2010年福建省高中学生学业基础会考化学实验操作考查试题(修订稿)
2010年福建省三明市高三化学普通高中毕业班质量检查测试 鲁科版 新课标

2010年三明市普通高中毕业班质量检查理科综合能力测试化学部分可能用到的相对原子质量: H l C 12 0 16 S 32 Cu 64第Ⅰ卷一、选择题(每小题6分。
每小题只有一个..选项符合题意) 6.下列叙述中,不正确...的是 A .天然药物无毒副作用,适合任何人群服用 B .置换反应都属于氧化还原反应 C .氡(22286Rn )原子核中含有136个中子D .AgI 胶体的分散质粒子直径在1nm ~1OOnm 之间 7.下列说法中,正确的是A .聚氯乙烯塑料能用于包装熟食B .乙酸乙酯与CH 3CH 2COOH 互为同分异构体C .乙醇和乙酸发生酯化反应不属于取代反应D .淀粉是人类重要的营养物质,在人体内可以水解成葡萄糖 8.下列叙述正确的是A .可以把氯化钠归类为钠盐、离子化合物、非电解质B .常温下W +K c(H )=0.1 mol .L -1的溶液中,233--++Na 、K 、SiO 、NO 一定能大量共存 C .氢氧化铁加到氢碘酸中,反应为332Fe(OH)+3HI=FeI +3H O D .FeO 、Fe 、CuO 、C 四种黑色固体不能用一种试剂区别 9.下列叙述正确的是A .欲配制质量分数为10%的4CuSO 溶液,可将10g 5⋅42CuSO H O 溶解在90g 蒸馏水中B .中和滴定时,滴定前滴定管必须洗净并烘干C .可用右图装置干燥、储存、吸收多余HCI 气体D .给试管中的液体加热时,可加入碎瓷片防止暴沸 10.A N 表示阿佛伽德罗常数,下列说法正确的是A .200 mL0.1mol ·L -1243Fe (SO )溶液中,含3+Fe 和24-SO 离子总数为0.1A NB .0.1mol Fe 与0.1mol 2Cl 充分反应,转移的电子数为0.3A NC .2.24L 的氮气和氧气混合气体中,含原子总数为0.2A ND .6.4g 的2S 和8S 混合物中,含硫原子总数为0.2A N 11.25时,部分弱酸的电离平衡常数如下表:下列有关说法正确的是A .等物质的量浓度溶液的pH 关系为pH (NaCN )>pH (Na2CO3)>pH (CH3COONaB .a mol ·L -1HCN 溶液与b mol ·L -1NaOH 溶液等体积混合后,所得溶液中C (Na +)>c (CN -),则a 一定小于bC .往冰醋酸中逐滴加水,溶液的导电性先增大后减小D .3NaHCO 和23Na CO 的混合液中:2()()()()c c c c c --=33++-(Na )+H OH +HCO +CO 12.镁——H 2O 2酸性电池采用海水作电解质(加入一定量酸),下列说法正确的是A .电池总反应为Mg+H 2O 2+2H +=Mg 2++ 2H 2O B .负极反应为H 2O 2+2e -+ 2H += 2H 2O C .电池工作时,正极周围海水的pH 减少 D .电池工作时,溶液中的H +向负极移动第Ⅱ卷必考部分23.(15分)X 、Y 、Z 、M 是由短周期元素组成的化合物;X 、Y 、Z 均含有钠元素,且Y 、Z 均含有三种元素;Z 的溶液显碱性。
2010 福建卷

2010 福建卷6.下列关于有机物的正确说法是A .聚乙烯可发生加成反应B .石油干馏可得到汽油、,煤油等C .淀粉、蛋白质完全水解的产物互为同分异构体D .乙酸乙酯、油脂与NaOH 溶液反应均有醇生成。
7.A N 表示阿伏伽德罗常数,下列判断正确的是A .在18182g O 中含有A N 个氧原子B .标准状况下,22.4L 空气含有A N 个单质分子C .1 mol 参加反应转移电子数一定为2A ND .含A N 个Na +的2Na O 溶解于1L 水中,Na +的物质的量浓度为1mol L -8.下列有关化学研究的正确说法是A .同时改变两个变量来研究反映速率的变化,能更快得出有关规律B .对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同C .依据丁大尔现象可将分散系分为溶液、胶体与浊液D .从HF 、HCl 、r HB 、HI 酸性递增的事实,推出F 、Cl 、Br 、I 的非金属递增的规律 9.下列各组物质中,满足下图物质一步转化关系的选项是10.下列关于电解质溶液的正确判断是A .在pH = 12的溶液中,K +、CL -、3HCO -、Na +可以常量共存 B .在pH = 0的溶液中,Na +、3NO -、23SO -、K +可以常量共存C .由0.1 mol ·1L -一元碱BOH 溶液的pH =10,可推知BOH 溶液存在BOH =B OH +-+ D .由0.1 mol ·1L -一元碱HA 溶液的pH =3, 可推知NaA 溶液存在A - + H 2O ⇋HA + OH -11.铅蓄电池的工作原理为:22442222Pb PbO H SO PbSO H O ++=+研读 右图,下列判断不正确的是A .K 闭合时,d 电极反应式:24224224PbSO H O e PbO H SO -+-+-=++ B .当电路中转移0.2mol 电子时,I 中消耗的24H SO 为0.2 molC .K 闭合时,II 中24SO -向c 电极迁移D .K 闭合一段时间后,II 可单独作为原电池,d 电极为正极12.化合物Bilirubin 在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如右图所示,计算反应4~8min 间的平均反应速率和推测反应16min 时反应物的浓度,结果应是A .μ2.5mol ·L -1·min -1和μ2.0mol ·L-1B .μ2.5mol ·L -1·min -1和μ2.5mol ·L -1C .μ3.0mol ·L -1·min -1和μ3.0mol ·L -1D .μ5.0mol ·L -1·min -1和μ3.0mol ·L -123.(15分)J 、L 、M 、R 、T 是原子序数依次增大的短周期主族元素,J 、R 在周期表中的相对位置如右表;J 元素最低负化合价的绝对值与其原子最外层电子数相等;M 是地壳中含量最多的金属元素。
2010年福州市质检化学

2010年福州市初中毕业班质量检查考试化学试卷参考答案及评分标准一、选择题(本题包含10小题,每小题3分,共30分)(每小题只有一个正确答案)二、填空与简答(本题5小题,共31分)11. (6分)(1)吸附(或除去水中的异味和色素)混合物(2)过滤(静置)(3)煮沸(蒸馏)(其它合理答案也给分)(4)+4 (5)C (每空各1分)12.(5分)(1)3,12,24(或24.305);(2)金属 Mg2+(每空各1分)13.(8分)(1)t2℃时,X和Y的溶解度相等(其他合理答案也得分)(2)有固体物质析出(3)加溶质X(或蒸发溶剂或降温)(4)100g (每空各2分)14.(5分)(1)①H2 +SiHCl3 Si + 3HCl (3分)(2)爆炸(1分)(3)HCl (1分)15.(7分)(1)NaOH+HCl=NaCl+H2O(3分)(2)氢氧化钠溶液(1分)(3)HCl、NaCl (各1分)(4)红(1分)三、实验与探究(本大题含2小题,共27分)16.(11分)(1)酒精灯集气瓶(每空1分)(2)2KMnO4 K2MnO4 + MnO2 + O2↑(3分)氧气不易溶于水氧气不与水反应(答“氧气不易溶于水”即可)(1分)(3)2H2O2MnO2====== 2H2O + O2↑(3分)B(1分) CO2 (H2)(合理答案均可)(1分)17.(16分)【猜想与分析】Ca(OH)2(2分)Ca(OH)2+CO2=CaCO3↓+H2O(3分)CaCO3和Ca(OH)2的混合物(2分)【设计实验】【交流与反思】(2) Ca(OH)2微溶于水,白色粉末可能是氢氧化钙。
(2分)【拓展与应用】(1)密闭保存(1分)(2)CaCO3+2HCl=CaCl2+H2O+CO2↑(或Ca(OH)2+2HCl=CaCl2+2H2O)(3分)复分解(1分)四、分析与计算(本大题含2小题,共12分)18.(2分) 3 104﹕112(或13﹕14)(各1分)19.(10分)(1)Cu—Zn (2分)(2) 设:32.5g的Cu—Zn合金中锌的质量为X。
福建省东山二中2010-2011学年高二学业基础会考化学试卷

东山二中高二年学业基础会考化学试卷(文科)(考试时间:90分钟;满分100分)说明:(1)本试卷分第I卷和第II卷两部分;第I卷为选择题,第II卷为非选择题(2)交卷时请把选择题填在第II卷上,交卷时只要交第II卷即可第Ⅰ卷(选择题44分)可能用到的相对原子质量:H—1 C-12 O—16 Na-23 N-14 Al-27 Cl—35.5一、选择题(本大题共有22小题,每小题2分,共44分,每小题只有一个正确答案)1、下列气体排入大气,不会造成空气污染的是()A。
NO B. SO2 C.NO2 D. N22、标准状况下,下列物质中体积最大的是()A. 48g O2B。
71gCl2C。
28个N2D。
100g H2O3、能正确表示下列化学反应的离子方程式的是()A.氢氧化钡溶液与硫酸的反应OH+H+=H2OB.澄清的石灰水与稀盐酸反应Ca(OH)2 + 2H+ = Ca2+ + 2H2O C.铜片插入硝酸银溶液中Cu + Ag+ = Cu2+ + AgD.碳酸钙溶于稀盐酸中CaCO3+2H+=Ca2++H2O+CO24、为了出去FeSO4溶液中少量的CuSO4,可向此溶液中()A。
通入SO2 B。
加入Zn C。
加入Fe D. 加入Cu5、通常情况下不能用浓硫酸干燥的气体是()A。
氢气 B. 氧气C。
氨气 D. 甲烷6、下列各类物质中,一定含有氢氧两种元素的是()A。
酸B。
碱 C. 有机物D。
氧化物7、某金属0.1mol跟足量稀盐酸反应,制的标准状况下氢气3。
36L,溶液中该金属离子的化合价为()A. +1 B。
+2 C。
+3 D。
+48、在无色透明的碱性溶液中,能大量共存的离子是( )A. Mg2+、Cl-、NO3—B. Ba2+、Na+、SO42—C. Fe3+、Cl—、SO42-D. K+、Cl—、Br—9、下列物质中既含共价键又含离子键的是()A 。
CO2 B. NaOH C。
CH4D。
CaCl210、在实际生活中,下列说法正确的是()A. 糖尿病是食用食糖过量造成的B. 日常生活中常用无水乙醇杀菌消毒C。
福建省普通高中学业水平合格性考试化学实验题汇编(含答案)
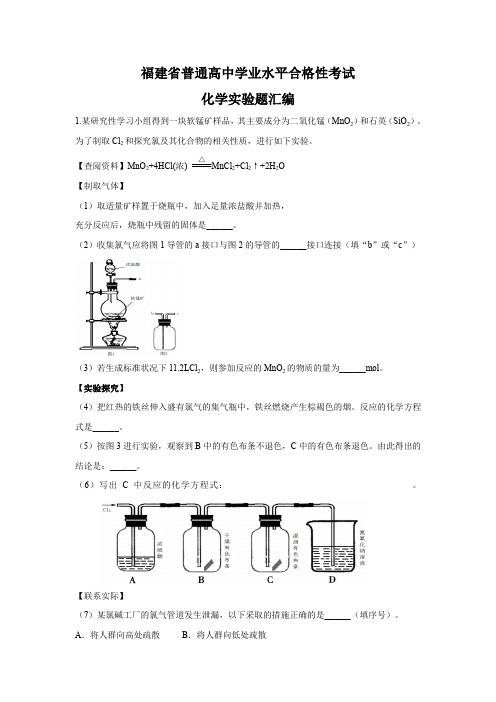
福建省普通高中学业水平合格性考试化学实验题汇编1.某研究性学习小组得到一块软锰矿样品,其主要成分为二氧化锰(MnO2)和石英(SiO2)。
为了制取Cl2和探究氯及其化合物的相关性质,进行如下实验。
【查阅资料】MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O【制取气体】(1)取适量矿样置于烧瓶中,加入足量浓盐酸并加热,充分反应后,烧瓶中残留的固体是______。
(2)收集氯气应将图1导管的a接口与图2的导管的______接口连接(填“b”或“c”)(3)若生成标准状况下11.2LCl2,则参加反应的MnO2的物质的量为______mol。
【实验探究】(4)把红热的铁丝伸入盛有氯气的集气瓶中,铁丝燃烧产生棕褐色的烟。
反应的化学方程式是______。
(5)按图3进行实验,观察到B中的有色布条不退色,C中的有色布条退色。
由此得出的结论是:______。
(6)写出C中反应的化学方程式:。
【联系实际】(7)某氯碱工厂的氯气管道发生泄漏,以下采取的措施正确的是______(填序号)。
A.将人群向高处疏散B.将人群向低处疏散C.关闭氯气管道,用碱液浸泡过的棉布覆盖泄漏部位D.关闭氯气管道,用饱和NaCl溶液浸泡过的棉布覆盖泄漏部位答案:(1)SiO2(或石英)(2)b (3)0.5 (3)2Fe+3Cl2点燃2FeCl3(5)干燥的氯气无漂白性,次氯酸有漂白性。
(6)Cl 2+ H2O HCl+ HClO (7)AC2. 某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。
A中发生反应的化学方程式:【实验探究】(1)A中的反应______(填“是”或“不是”)氧化还原反应。
(2)A装置还可用于制取气体______(只填一种)(3)若有10.7gNH4Cl固体,最多可制取NH3(标准状况)的体积是______L (NH4C1的摩尔质量为53.5g·mol—1)。
(4)实验室收集氨气的方法是______(5)C、D装置中颜色会发生变化的是______(填“C”或“D”)(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1-2滴浓盐酸,可观察到的现象是______(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是______(填“F”或“G”)。
福建省学业基础会考化学试题分类汇编---简答题部分

高中学业基础考试(化学科)分类试题(简答题)简要回答下列问题。
(1)医疗上,“胃得乐”(主要成份MgCO3)常用作治疗胃酸(含盐酸)过多的药剂,其理由是。
(2) CCTV“科技博览”栏目报道,我国科学家首创以CO2为原料制备可降解塑料——聚二氧化碳。
研制生产可降解塑料的主要目的是。
(3)据报道,全世界每年因金属腐蚀造成的直接经济损失约达7000亿美元,请你提出一种防止钢铁锈蚀的合理措施。
(1)“胃得乐”中的MgCO3能与胃中的盐酸反应(2)减少白色污染(3)电镀(涂油、喷漆、改变金属内部结构等)(1)化学工业生产中污水、废水未经处理不可直接排出工厂的原因是。
(2)蒸馒头时,经常往蒸笼中放入小苏打,使得馒头膨松,食用起来香甜可口,请写出其原因:。
(1)污水、废水会污染周围环境(2)碳酸氢钠受热分解产生二氧化碳气体,使得馒头疏松,香甜可口(1)铵态氮肥不能跟碱性肥料混合施用的原因是。
(2)面粉中加入小苏打(NaHCO3)焙制出的糕点,食用起来膨松可口。
试说明其原因:。
(3)我国是一个严重缺水的国家,保护水资源已迫在眉睫。
请你提出一种切实可行的做法。
(1)铵盐能与碱性肥料反应产生氨气,降低肥效(其他合理答案均给分)(2)小苏打(NaHCO3)不稳定,受热易分解产生二氧化碳气体(其他合理答案均给分)(3)①节约用水,从点滴做起;②减少对水资源的污染(如不往水里倒垃圾,不任意排放污水等);③致力于污水的治理;(以上任选其一或其他合理答案均给分)(1)大量废弃电池所引起的环境问题已经受到人们的关注。
废弃电池必须回收处理的原因是:。
(2)常温下,浓硫酸可以用铝质容器储存的原因是:。
(3)墨鱼骨粉(主要成分CaCO3)可作为治疗胃酸(含盐酸)过多的药剂。
其理由是:(1) 防止(重金属离子)污染环境(其他合理答案也给分)(2)常温下浓硫酸可使铝钝化(其他合理答案也给分)(3)CaCO3可与盐酸反应,减少过多的胃酸(其他合理答案或写化学方程式均给分)(2011-1福建会考)(1)自来水生产时,用适量的氯气来杀菌消毒,市场上有些不法商贩用自来水冒充纯净水出售,请你用化学方法将其辨别。
2010年高考试题——理综化学部分(福建卷)解析版

2010年普通高等学校招生全国统一考试(福建卷)理科综合能力测试化学部分真题解析6.下列关于有机物的正确说法是A .聚乙烯可发生加成反应B .石油干馏可得到汽油、,煤油等C .淀粉、蛋白质完全水解的产物互为同分异构体D .乙酸乙酯、油脂与NaOH 溶液反应均有醇生成。
【解析】答案:D本题考查有机化学方面有关的知识点A .乙烯加聚反应生成聚乙烯后,双键变单键不能发生加成反应B .石油分馏可得汽油和煤油属于物理变化过程,干馏是指隔绝空气加强热,属于化学变化C .淀粉属于糖类,完全水解生成葡萄糖;蛋白质完全水解生成氨基酸;两者的产物不可能是同分异构体D .乙酸乙酯和油脂都属于酯类,在氢氧化钠溶液反应后均生成醇,前者生成乙醇,后者生成甘油7.A N 表示阿伏伽德罗常数,下列判断正确的是A .在18182g O 中含有A N 个氧原子B .标准状况下,22.4L 空气含有A N 个单质分子C .1 mol 参加反应转移电子数一定为2A ND .含A N 个Na +的2Na O 溶解于1L 水中,Na +的物质的量浓度为1mol L -【解析】答案:A本题考查阿伏伽德罗常数的计算和判断A .18g 182O 正好是0.5 mol ,一个氧分子正好含有两个氧原子,所以氧原子的物质的量为1 mol ,即为1A NB .空气是混合物C .在氯气与水的反应中,1 mol 2Cl 就只转移1A N 的电子D .所得溶液中含A N 个+Na 可得氢氧化钠的物质的量为1 mol ,但这时候溶液不是1L ,所以物质的量浓度不是1 mol ·1-L8.下列有关化学研究的正确说法是A .同时改变两个变量来研究反映速率的变化,能更快得出有关规律B .对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同C .依据丁大尔现象可将分散系分为溶液、胶体与浊液D .从HF 、HCl 、r HB 、HI 酸性递增的事实,推出F 、Cl 、Br 、I 的非金属递增的规律【解析】答案:B本题侧重考查反应速率、盖斯定律、分散系、元素周期律重要的基本概念,规律。
2010年高考福建卷化学试题解析

2010年普通高等学校招生全国统一考试(福建卷)理科综合能力测试化学部分真题解析6.下列关于有机物的正确说法是A .聚乙烯可发生加成反应B .石油干馏可得到汽油、,煤油等C .淀粉、蛋白质完全水解的产物互为同分异构体D .乙酸乙酯、油脂与NaOH 溶液反应均有醇生成。
【解析】答案:D本题考查有机化学方面有关的知识点A .乙烯加聚反应生成聚乙烯后,双键变单键不能发生加成反应B .石油分馏可得汽油和煤油属于物理变化过程,干馏是指隔绝空气加强热,属于化学变化C .淀粉属于糖类,完全水解生成葡萄糖;蛋白质完全水解生成氨基酸;两者的产物不可能是同分异构体D .乙酸乙酯和油脂都属于酯类,在氢氧化钠溶液反应后均生成醇,前者生成乙醇,后者生成甘油7.A N 表示阿伏伽德罗常数,下列判断正确的是A .在18182g O 中含有A N 个氧原子B .标准状况下,22.4L 空气含有A N 个单质分子C .1 mol 参加反应转移电子数一定为2A ND .含A N 个Na +的2Na O 溶解于1L 水中,Na +的物质的量浓度为1mol L - 【解析】答案:A本题考查阿伏伽德罗常数的计算和判断A .18g 182O 正好是0.5 mol ,一个氧分子正好含有两个氧原子,所以氧原子的物质的量为1 mol ,即为1A NB .空气是混合物C .在氯气与水的反应中,1 mol 2Cl 就只转移1A N 的电子D .所得溶液中含A N 个+Na 可得氢氧化钠的物质的量为1 mol ,但这时候溶液不是1L ,所以物质的量浓度不是1 mol ·1-L8.下列有关化学研究的正确说法是A .同时改变两个变量来研究反映速率的变化,能更快得出有关规律B .对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同C .依据丁大尔现象可将分散系分为溶液、胶体与浊液D .从HF 、HCl 、r HB 、HI 酸性递增的事实,推出F 、Cl 、Br 、I 的非金属递增的规律【解析】答案:B本题侧重考查反应速率、盖斯定律、分散系、元素周期律重要的基本概念,规律。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2)现象:两试管均有气体产生,加NaHCO3
溶液的试管内反应较剧烈。
反应的化学方程式:
Na2CO3+2HCl=2NaCl+H2O+CO2↑;
班级座号姓名会考号.
第3题碳酸钠和碳酸氢钠的性质比较
实验用品:玻璃棒2支、pH试纸及比色卡、表面皿(或玻璃片)、试管两支、胶头滴管、1mol·L-1Na2CO3溶液、1mol·L-1NaHCO3溶液、1mol·L-1HCl溶液
实验步骤
实验内容与操作步骤
分值
得分
用试纸测溶液的pH
取一小片试纸于表面皿上,用玻璃棒蘸取1mol·L-1Na2CO3溶液点在试纸中部
(2)滴管不接触试管内壁。
3
3
(1)BaCO3+2HNO3=
Ba(NO3)2+H2O+CO2↑;
碳酸钠溶液。
(2)硫酸钠溶液。
3
4
(1)白色;氯化钠溶液。
(2)硝酸钠溶液。
2
实验习惯
遵守规则,整齐洁净。
1
考评总分
考评成绩(合格或不合格)
考点(学校):考评员(签名)20年月日
福建省高中学生学业基础会考化学实验操作考查试题
1mol·L-1NaHCO3溶液的pH。
物质的量浓度相同时,碳酸钠溶液的pH比碳酸氢钠溶液的pH。
(2)现象:,
反应的化学方程式:,
。
4
实验习惯
遵守规则、洗涤干净、整理物品、清理卫生。
1
考评总分
考评员
(签名)
考评成绩
(合格或不合格)
考点(学校):考查日期:年月日
福建省高中学生学业基础会考化学实验操作考查
1
盐酸的量
取和稀释
(1)用量筒量取所需的浓盐酸。
(2)把浓盐酸加入盛有少量蒸馏水(约20mL)的烧杯中稀释并冷却至室温。。
2
移液
将稀释的盐酸用玻璃棒转移到容量瓶里。
1
洗涤
每次用约15mL蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将洗涤液注入容量瓶里。
2
定容
继续往容量瓶中加水,直到瓶中的液面接近刻度线1~2㎝处,改用胶头滴管滴加蒸馏水至溶液的凹液面正好与刻度线相切。
福建省高中学生学业基础会考化学实验操作考查试题
班级座号姓名会考号.
第2题鉴别硫酸钠、氯化钠、碳酸钠、硝酸钠四种溶液
实验用品:滴管、试管6支、硫酸钠溶液、氯化钠溶液、碳酸钠溶液、
硝酸钠溶液、氯化钡溶液、稀硝酸
实验步骤
实验内容与操作步骤
分值
得分
1
取编号为A、B、C、D的四支试管,分别取待鉴别的少量溶液于试管中。
座号
1
2
3
4
5
6
7
8
考
生
姓
名
实验步骤
实验操作评分点
分
值
得分
得分
得分
得分
得分
得分
得分
得分
计算
1.19g·cm-3·V×37.5% =
0.5mol·L-1×0.1L×36.5g·mol-1
V=4.1mL
1
量取
稀释
(1)量筒读数正确。
(2)用玻璃棒引流盐酸并搅拌。
2
移液
用玻璃棒引流,溶液不流出瓶外。
1
洗涤
1
观察试纸颜色的变化,跟比色卡对照,测出pH。
1
采用同样的方法测出1mol·L-1NaHCO3溶液的pH。
1
液体药品
的取用
在2支试管里分别加入2~3mL的盐酸溶液
1
与酸的反应
再分别向上述2支试管加入约1mL1mol·L-1Na2CO3溶液和约1mL1mol·L-1NaHCO3溶液
1
观察现象与解释
(1)1mol·L-1Na2CO3溶液的pH,
(1)用蒸馏水洗涤烧杯内壁和玻璃棒2~3次。
(2)洗涤液用玻璃棒引流注入容量瓶里,不流出瓶外。
2
定容
(1)容量瓶内液面距离刻度线2~3cm时,改用胶头滴管滴加蒸馏水。
(2)凹液面最低处与刻度线相切。
2
摇匀
倒转和摇动方法正确。
1
实验习惯
遵守规则,整齐洁净。
1
考评总分
考评成绩(合格或不合格)
考点(学校):考评员(签名)20年月日
班级
第2题
鉴别硫酸钠、氯化钠、碳酸钠、硝酸钠四种溶液
座号
1
2
3
4
5
6
7
8
考
生
姓
名
实验步骤
实验操作评分点
分值
得分
得分
得分
得分
得分
得分
得分
得分
1
(1)取下瓶盖倒立在桌上。
(2)标签向手心,倒出溶液后及时塞好,放回原处。
1
2
(1)产生白色沉淀;
Na2CO3+BaCl2=BaCO3↓+2NaCl;
Na2SO4+BaCl2=BaSO4↓+2NaCl。
(1)C试管产生色沉淀,原溶液为。
(2)D试管无现象,原溶液为。
2
实验习惯
遵守规则、洗涤干净、整理物品、清理卫生。
1
考评总分
考评员
(签名)
考评成绩
(合格或不合格)
考点(学校):考查日期:年月日
福建省高中学生学业基础会考化学实验操作考查
(第2题)评分标准及考查成绩记录表(考评员使用)
题号
实验操作考查试题名称
2
摇匀
把容量瓶塞盖紧,将溶液转动摇匀。
1
实验习惯
遵守规则、洗涤干净、整理物品、清理卫生。
1
考评总分
考评员
(签名)
考评成绩
(合格或不合格)
考点(学校):考查日期:年月日
福建省高中学生学业基础会考化学实验操作考查
(第1题)评分标准及考查成绩记录表(考评员使用)
题号
实验操作考查试题名称
班级
第1题
配制100mL0.5mol·L-1盐酸
福建省高中学生学业基础会考化学实验操作考查试题
班级座号姓名会考号.
第1题配制100mL0.5mol·L-1盐酸
实验用品:100mL容量瓶、烧杯、10mL量筒、玻璃棒、胶头滴管、浓盐酸
(密度1.19g·cm-1,质量分数37.5%)、蒸馏水
实验步骤
实验内容与操作步骤
分值
得分
计算
计算需要量取浓盐酸的体积为mL。
(1)取下瓶盖倒立在桌上,标签向手心,瓶口紧挨试管口,倒出液体后及时塞好,放回原处。
(2)溶液约取2~3mL。
1
与酸的反应
向两试管分别滴加Na2CO3溶液和NaHCO3溶液各约1ml,滴管不可伸入试管内。
1
观察现象与解释
(1)1mol·L-1Na2CO3溶液的pH约10~11
1mol·L-1NaHCO3溶液的pH约8~9
(第3题)评分标准及考查成绩记录表(考评员使用)
题号
实验操作考查试题名称
班级
第3题
碳酸钠和碳酸氢钠的性质比较
座号
1
2
3
4
5
6
7
8
考
生
姓
名
实验步骤
实验操作评分点
分值
得分
得分
得分
得分
得分
得分
得分
得分
用试纸测溶液的pH
必须将试纸置于表面皿上,用玻璃棒蘸取待测液
1
跟比色卡对照1第二种试同上操作1液体药品
的取用
1
2
向四支试管中分别滴加氯化钡溶液。两支试管产生色沉淀,其反应的化学方程式为:
。
3
3
向上述有沉淀生成的试管中再滴入稀硝酸,振荡。
(1)A试管沉淀消失,反应的化学方程式为:
,
原溶液是。
(2)B试管沉淀不消失,原溶液是。
3
4
另取加氯化钡溶液无沉淀生成的原溶液少量,倒入新编C、D两试管中,再分别滴加硝酸银溶液:
