质量守恒定律实验报告
质量守恒定理实验报告

一、实验目的通过本次实验,验证质量守恒定律,即在一个封闭系统中,化学反应前后物质的总质量保持不变。
二、实验原理质量守恒定律是化学中的一个基本定律,它表明在任何化学反应中,反应物的总质量等于生成物的总质量。
在实验中,通过测量反应前后的质量,可以验证这一定律。
三、实验器材1. 烧杯(100mL)2个2. 天平(精确到0.01g)3. 铁钉4. 稀硫酸5. 滴管6. 搅拌棒7. 集气瓶8. 橡皮塞9. 铁丝网10. 水槽四、实验步骤1. 准备实验器材,将稀硫酸倒入烧杯中,铁钉放入另一个烧杯中。
2. 将烧杯放在天平上,调整天平至平衡状态,记录初始质量。
3. 使用滴管将稀硫酸滴入铁钉烧杯中,观察铁钉与稀硫酸的反应,铁钉逐渐溶解,产生气泡。
4. 待反应完成后,将烧杯放在天平上,记录反应后的质量。
5. 将集气瓶倒置,用橡皮塞密封瓶口,将铁丝网放在瓶底,将反应后的溶液倒入集气瓶中。
6. 观察铁钉溶解后,铁离子与硫酸根离子结合生成硫酸亚铁,同时产生氢气。
7. 将集气瓶倒置,使氢气充满瓶内,将瓶口用橡皮塞密封。
8. 将集气瓶放在天平上,记录氢气的质量。
9. 将反应后的溶液倒入水槽中,观察是否有沉淀物生成。
10. 将反应后的溶液和沉淀物放入另一个烧杯中,放在天平上,记录反应后的质量。
五、实验数据1. 初始质量:铁钉烧杯 + 稀硫酸 = 100.00g2. 反应后质量:铁钉烧杯 + 稀硫酸 = 98.65g3. 氢气质量:0.35g4. 反应后溶液和沉淀物质量:98.65g六、实验结果与分析根据实验数据,反应前后的质量分别为100.00g和98.65g,氢气质量为0.35g。
反应后的溶液和沉淀物质量为98.65g。
通过计算,反应前后质量差为1.35g,氢气质量为0.35g,两者相差1g,误差在允许范围内。
实验结果表明,在本次实验中,化学反应前后物质的总质量保持不变,验证了质量守恒定律。
七、实验结论本次实验通过实际操作,验证了质量守恒定律。
人教版化学九年级上册课本实验:质量守恒定律的验证实验

质量守恒定律的验证实验课本实验再现装置图(1)在红磷燃烧的实验中:①小气球可防止红磷燃烧产生的热量使瓶拓展训练1.用下列装置来验证质量守恒定律(托盘天平未画出),能达到目的的是( )A. B.C. D.2.如图1是利用红磷燃烧验证质量守恒定律的实验装置,图2是利用压强传感器测量的瓶中的气压变化的数据。下列说法不正确的是( )A.BC段气压增大的主要原因是燃烧放热B.CD段气压减小的主要原因是集气瓶内氧气不断被消耗C.该实验中气球的作用是平衡气压D.最终反应后的气压等于反应前的气压3.用下列装置进行证明质量守恒定律的实验,反应前后称量天平不平衡的是( )A. B.C. D.4.初三某化学兴趣小组同学。
依据教材实验对化学反应前后质量变化进行了探究。
【查阅资料】碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳气体。
【实验装置设计】甲、乙同学分别设计如图装置:【讨论与探究】请根据甲组和乙组设计的“质量守恒定律”的实验装置进行探究。
(1)甲组实验结束后可观察到天平_________(是或否)平衡;此反应______(填“遵守”或“不遵守”)质量守恒定律。
(2)乙组过氧化氢溶液分解反应前后各物质质量总和的测定,得出参加化学反应的各物质的质量总和____(填“大于”、“等于”或“小于”)反应后生成的各物质的质量总和。
该反应中二氧化锰起______作用。
【实验结论】(3)通过甲、乙实验探究,你得到的结论是:__________。
【实验分析】(4)化学反应的过程是_______________________重新组合的过程,即在一切化学反应中,反应前后原子的__________没有改变,原子的_______没有增减,原子的__________也没有变化,所以化学反应遵守质量守恒定律。
【反思与交流】(5)通过甲、乙小组实验的探究,你得到的启示是:_____________。
5.某兴趣小组的同学设计了如图甲、乙、丙所示的三个实验(天平略)来验证质量守恒定律。
质量守恒定律实验报告单
现象
结论
1、取一块白磷,放入盛水的培养皿中,在水下用小刀切下一粒绿豆大小的白磷,用滤纸吸干表面的水,放入锥形瓶中。(为防止白磷燃烧时,灼裂锥形瓶,可以瓶下事先放入少量的细砂。)将盛白磷的锥形瓶、绑有小气球的玻璃管一起放在天平的左盘中,在右盘添加砝码,并移动游码,使天平平衡。
2、硫酸铜与氢氧化钠反应
大庄中学九年级化学探究实验报告
班级
小组
姓名
合作者
时间
实验名称:质量守恒定律
实验目的:__________________________________________________________
实验用品:__________________________________________________________
(3)将反应后烧杯和内容物放到天平上再次称量,读出读数,记录。
质量守恒定律的内容是:
。
(1)在烧杯中放入约20毫升的硫酸铜溶液,在小试管中放入氢氧化钠溶液
(2)称量烧杯内物质的总质量
(3)倾倒烧杯使二者反应,观察现象
(约30 mL稀硫酸铜溶液,将几根打磨光亮的铁钉和盛硫酸铜溶液的烧杯一起放在天平上称量,读出读数,记录。
(2)将铁钉浸泡在硫酸铜溶液中,观察现象
高中化学实验质量守恒定律

1.现当代德育思想——关怀理论在当代价值观多元社会,如果试图在公立学校中进行道德教育,那么,一种合理的道德教育理论必须要有说服力地回答两个主要问题:一是“教谁的道德”,“何人的价值”,即道德教育的合法性问题;二是帮助人们有效地面对价值观多元社会中的道德境遇,即道德教育的合理性问题[33]。
关怀伦理模式以关怀伦理学作为理论基础。
关怀伦理学兴起于二十世纪70年代末80年代初的美国。
卡罗尔·吉利根(Caro1Ginigan)提出在女性的道德思维中存在着“关怀”的道德取向,进而建构了关怀伦理学。
此后,尼尔·诺丁斯(NelNeddings)从伦理学层面对关怀伦理学进一步系统化和理论化,并将这一理论应用到学校的道德教育实践中,形成了道德教育的关怀模式,在西方社会产生了广泛影响。
关怀教育思想的重要理论基础是关怀伦理学和多元智力理论。
诺丁斯认为,每个人在各个时期都需要得到人们的理解、接纳、尊重和认同,因此关怀他人和被他人关怀都是人的基本需要,我们应该建立、维持和增强关怀关系。
同时,诺丁斯还认为道德原则并不足以产生道德动机,她援引一些调查证明人们的道德行为大多是处于同情和关怀,是一种直觉的反应,因此主张道德教育首先应培养道德情感[34]。
在讨论专门的道德教育时,诺丁斯反对把道德等同于道德判断和道德知识,反对用教授数学推理的方式来进行道德教育。
她强调道德动机的发动,强调从情感上对他人的需要做出反应,认为“真正的道德教育需要形成共同的意义感,而不仅仅是信息的传递”[35]。
诺丁斯从关怀理论的角度提出道德教育应当特别强调的四种主要成分或教育要素:榜样(modeling)、对话(dialogue)、实践(practice)和认可(confirmation)。
第一,榜样在关怀理论中,榜样的地位至关重要。
首先,教师必须以身作则地和学生建立关怀关系,在这种关系中通过自己的行动向学生展示如何去关怀。
另外,能力的发展离不开一定的经验。
质量守恒定律的探究实验报告
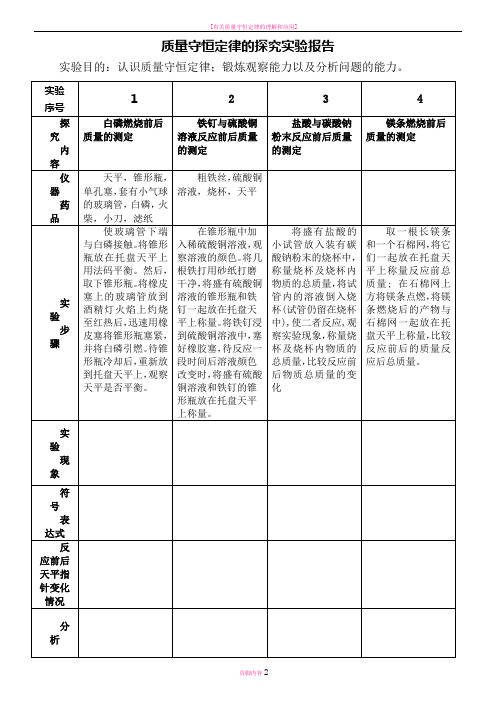
取一根长镁条和一个石棉网,将它们一起放在托盘天平上称量反应前总质量; 在石棉网上方将镁条点燃,将镁条燃烧后的产物与石棉网一起放在托盘天平上称量,比较反应前后的质量反应后总质量。
质量守恒定律的探究实验报告
实验目的:认识质量守恒定律;锻炼观察能力以及分析问题的能力。
实验
序号1234 Nhomakorabea探究
内容
白磷燃烧前后质量的测定
铁钉与硫酸铜溶液反应前后质量的测定
盐酸与碳酸钠粉末反应前后质量的测定
镁条燃烧前后质量的测定
仪器
药品
天平,锥形瓶,单孔塞,套有小气球的玻璃管,白磷,火柴,小刀,滤纸
粗铁丝,硫酸铜溶液,烧杯,天平
实验
步骤
使玻璃管下端与白磷接触。将锥形瓶放在托盘天平上用法码平衡。然后,取下锥形瓶。将橡皮塞上的玻璃管放到酒精灯火焰上灼烧至红热后,迅速用橡皮塞将锥形瓶塞紧,并将白磷引燃。待锥形瓶冷却后,重新放到托盘天平上,观察天平是否平衡。
在锥形瓶中加入稀硫酸铜溶液,观察溶液的颜色。将几根铁打用砂纸打磨干净,将盛有硫酸铜溶液的锥形瓶和铁钉一起放在托盘天平上称量。将铁钉浸到硫酸铜溶液中,塞好橡胶塞,待反应一段时间后溶液颜色改变时,将盛有硫酸铜溶液和铁钉的锥形瓶放在托盘天平上称量。
实验
现象
符号
表达式
反应前后天平指针变化情况
分析
结论
质量守恒定律实验报告

学校-----------班级姓名
实验目的:
1、认识质量守恒定律
2、锻炼动手能力、观察能力以及分析和解决问题的能力
3、认识定量研究对化学科学发展的重大作用
4、培养实事求是的科学态度和合作精神
实验用品:
托盘天平、锥形瓶、导气管、气球、单孔橡皮塞、试管、烧杯、石棉网、坩埚钳、酒精灯
细沙、红磷、铁钉、硫酸铜、碳酸钠粉末、稀盐酸、镁条
实验步骤:
实验方案
方案一
方案二
实验步骤
1、在底部பைடு நூலகம்有细沙的锥形瓶中,放入一小堆干燥的红磷。
2、在锥形瓶口的橡胶塞上安装一根玻璃管,在其上端系牢一个小气球,并使玻璃管下端能与红磷接触。将锥形瓶和玻璃管放在托盘天平上用砝码平衡,记录所称量的质量m1。然后,取下锥形瓶。将胶塞上的玻璃管放到酒精灯火焰上灼烧至红热后,迅速用橡胶塞将锥形瓶塞紧,并将红磷引燃。
反应前总质量(m1)
m1=g
m1= g
反应后总质量(m2)
m2=g
m2= g
老师评价:
3、待锥形瓶冷却后,重新放到托盘天平上,记录所称量的质量m2
1、在100mL锥形瓶中加入20mL稀硫酸铜溶液,塞好橡胶塞,观察溶液的颜色。
2、将几根铁打用砂纸打磨干净,将盛有硫酸铜溶液的锥形瓶和铁钉一起放在托盘天平上称量,记录所称的质量m1。
3、将铁钉浸到硫酸铜溶液中,塞好橡胶塞,观察现象。
4、待反应一段时间后溶液颜色改变时,将盛有硫酸铜溶液和铁钉的锥形瓶放在托盘天平上称量,记录所称的质量m2。
初中化学质量守恒定律

3.反应后称量五氧化二磷与 锥形瓶的总质量(称量得总 质量仍为178g)。
实验结论: 实验证明,在化学反应前后,物 质的总质量是不变的。
实验一 氧化汞(HgO)1.083g 汞(Hg)1.003g
实验二 金属镁(Mg)0.486g
氧化镁(MgO)0.806g
某同学记录实验数据如上表,他认为实验一中 生成物的质量减少了,实验二中生成物的质量 增加了,这两个反应都不符合质量守恒定律。 这位同学的说法对吗? 答:不对,因为氧化汞受热分解成汞和 氧气;镁条在氧气中燃烧生成固体氧化 镁。但在数据表中两个实验都没有记录 氧气的质量,所以导致某同学认为这两 个反应都不符合质量守恒定律。
探究内容:白磷在空气中燃烧, 生成五氧化二磷。 实验目的:探究化学反应前后 物质的总质量有无变化。
托盘天平
锥形瓶ቤተ መጻሕፍቲ ባይዱ
白磷固体
玻璃棒
酒精灯
1.在锥形瓶中放入白磷固体,称 量反应前反应物(白磷固体)和 反应容器(锥形瓶)的总质(称 量得总质量为:178g)。
2.加热玻璃棒底部,再把玻璃棒插 入锥形瓶中,使玻璃棒与白磷固 体接触,并引起燃烧。
质量守恒定律实验

质量守恒定律实验
为什么物质在发生化学反应前后,各物质的质量总和相等?这是因为化学反应的过程,就是参加反应的各物质(反应物)的原子,重新组合而生成其它物质(生成物)的过程。
一、目的:加深理解质量守恒定律。
二、实验原理:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这个规律叫做质量守恒定律。
三、仪器药品
仪器:托盘天平、砝码、烧杯、小试管、锥形瓶。
药品:氢氧化钠溶液、硫酸铜溶液、小苏打粉末、盐酸。
四、实验中化学反应式:NaOH+HCI=NaCI+H
2O HCI+NaHCO
3
=NaCI+CO
2
+H
2
O
2NaOH+CuSO4=Na
2SO4+Cu(OH)
2
四、疑点难点:
为什么物质在发生化学反应前后,各物质的质量总和相等?这是因为化学反应的过程,就是参加反应的各物质(反应物)的原子,重新组合而生成其它物质(生成物)的过程。
即:在一切化学反应中,反应前后的原子的种类没有改变,原子的数目没有增减,原子的质量也没有变化。
所以,化学反应前后各物质的质量总和必然相等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
质量守恒定律的探究实验报告
姓名合作者月日
实验目的:
1、认识质量守恒定律
2、锻炼动手能力、观察能力以及分析和解决问题的能力
3、认识定量研究对化学科学发展的重大作用
4、培养实事求是的科学态度和合作精神
实验用品:
托盘天平、烧杯、小试管,
硫酸铜溶液、铁钉、氢氧化钠溶液、砂纸
实验步骤:
方案一硫酸铜+铁→硫酸亚铁+铜
1.用砂纸把铁钉打磨干净放入一只试管中,在另一只试管中加入1/2的硫酸铜溶液。
2.把两只试管同时放在烧杯里用天平称量总质量,并把数据记入下表。
3.取下烧杯,把盛有硫酸铜试管溶液倒入放有铁钉的试管中,稍等片刻,你观察到的现象是。
方案二硫酸铜+氢氧化钠→氢氧化铜+硫酸钠
1.在小试管中加入约6ml硫酸铜溶液,再另一个小试管中加大约6ml氢氧化钠溶液。
2.把两小试管小心放入100ml烧杯中。
3.用天平称量烧杯的总质量,把数据记入下表。
4把一只试管内的液体倒入到另一只试管里,你看到的现象是
你发现的规律是:参加反应的各物质质量之和反应后生成的各物质质量之和。
质量守恒定律的内容是。
