八年级科学氧气PPT教学课件 (2)
合集下载
《氧气》说课 ppt课件

8
三、教法分析
1、探究式实验教学法 该教学法的教学模式是:设疑 —学生实验—观察 —思考—总结—应用。 根据目标设疑,引导学生动手实验,让学生通过观察实验现象,体验实验的 过程,积极的思考和分析。教给学生通过实验、观察、探究得出科学结论的 学习方法。 2、互动式教学法 在学生的实验过程中有教师的指导、答疑。师生之间不停地进行“信息” 交流,有助于学生注意力的集中和学习积极性的提高。
17
1、[实验2-2]:学生演示实验: 氧气能使带火星的小木条复燃
为了帮助学生掌握这部分知识,我主要采用如下几种探 究实验的模式进行教学。
【提问】带火星的木 条在空气中会逐渐熄灭,将它放在氧 气中会怎么样呢?
【提供】实验仪器让学生上前做实验,同学们观察, 相互 讨论。 【注意】发现问题要思考、要讨论。 【结论】氧气能支持燃烧
13
14
让学生通过观看氧气物理性质的动画,从而加深学生的感性认识。通过
思考、分析、讨论,由学生代表归纳氧气的物理性质:
a 通常状况下,氧气是无色无味的气体
b 密度比空气略大
c 不易溶于水
d 氧气 加压降温 液态氧 再加压降温 固态氧
(无色)
(淡蓝色)
(淡蓝色雪花状)
15
工业上使用的氧气一般是加压 贮存在蓝色钢瓶中。
二、化学性质:
31
三、化合反应和氧化反应
氧化反应: 物质与氧发生的反应。 化合反应: 由两种或两种以上物质生
成 一种物质的反应。 缓慢氧化
32
小结:
六、课堂总结:通过本课的学习,你学到了 什么?有何体会?
33
1、 学生已具备认知基础:学生初中生物课就认识了氧气,知道了氧气的存在和氧 气能供给呼吸。经过课题1空气的学习,学生对氧气的存在有了进一步认识,从心 理上和知识背景上都具备了学习本课题的条件。但是学生对氧气的物理性质和化学 性质缺乏系统了解。 2 、学生已具备的技能基础:通过第一单元的学习,学生已经了解了常用化学仪器 的主要用途和使用时的注意事项,初步学会了药品的取用,但基本的实验操作不够 规范。在本课题中,有较多的实验,这可以激发学生的学习兴趣,同时也可以使学 生学习仪器的规范操作。
三、教法分析
1、探究式实验教学法 该教学法的教学模式是:设疑 —学生实验—观察 —思考—总结—应用。 根据目标设疑,引导学生动手实验,让学生通过观察实验现象,体验实验的 过程,积极的思考和分析。教给学生通过实验、观察、探究得出科学结论的 学习方法。 2、互动式教学法 在学生的实验过程中有教师的指导、答疑。师生之间不停地进行“信息” 交流,有助于学生注意力的集中和学习积极性的提高。
17
1、[实验2-2]:学生演示实验: 氧气能使带火星的小木条复燃
为了帮助学生掌握这部分知识,我主要采用如下几种探 究实验的模式进行教学。
【提问】带火星的木 条在空气中会逐渐熄灭,将它放在氧 气中会怎么样呢?
【提供】实验仪器让学生上前做实验,同学们观察, 相互 讨论。 【注意】发现问题要思考、要讨论。 【结论】氧气能支持燃烧
13
14
让学生通过观看氧气物理性质的动画,从而加深学生的感性认识。通过
思考、分析、讨论,由学生代表归纳氧气的物理性质:
a 通常状况下,氧气是无色无味的气体
b 密度比空气略大
c 不易溶于水
d 氧气 加压降温 液态氧 再加压降温 固态氧
(无色)
(淡蓝色)
(淡蓝色雪花状)
15
工业上使用的氧气一般是加压 贮存在蓝色钢瓶中。
二、化学性质:
31
三、化合反应和氧化反应
氧化反应: 物质与氧发生的反应。 化合反应: 由两种或两种以上物质生
成 一种物质的反应。 缓慢氧化
32
小结:
六、课堂总结:通过本课的学习,你学到了 什么?有何体会?
33
1、 学生已具备认知基础:学生初中生物课就认识了氧气,知道了氧气的存在和氧 气能供给呼吸。经过课题1空气的学习,学生对氧气的存在有了进一步认识,从心 理上和知识背景上都具备了学习本课题的条件。但是学生对氧气的物理性质和化学 性质缺乏系统了解。 2 、学生已具备的技能基础:通过第一单元的学习,学生已经了解了常用化学仪器 的主要用途和使用时的注意事项,初步学会了药品的取用,但基本的实验操作不够 规范。在本课题中,有较多的实验,这可以激发学生的学习兴趣,同时也可以使学 生学习仪器的规范操作。
人教版八年级第2章第2节氧气性质(共39张ppt)

第二章 第2节
氧气的性质
1
课时目标 1.通过观察氧气与蜡烛的实验并总结,能
说出氧气的部分化学性质。 2.通过观察氧气与木炭的实验并总结,能
说出氧气与木炭反应的现象、文字表达式。
2
1.氧气的物理性质:
观察面前空气中的氧气,你知道氧气 的哪些物理性质?
在通常状况下氧气是 无 色、 无 味 的 气 体,氧气密度比空气的 大 (填
PLAY
Hale Waihona Puke 铁丝在氧气中燃烧1.铁丝的形状?
螺旋状
2.集气瓶中事先放有什么? 少量水 3.什么时候将铁丝伸入氧气中?
火柴即将燃尽时 4.产物是什么?颜色?状态?
四氧化三铁 黑色固体
5.现象?
铁丝在氧气中燃烧
实验步骤 实验现象 实验结论
点燃火柴,待 火柴即将燃尽 时把铁丝连同 火柴一起伸入 氧气中。
剧烈燃烧, 铁丝在氧气中
蜡烛
产生黄色火焰 比在空气中燃
烧 更剧烈 ,
将燃着的蜡烛 伸入氧气中
在氧气中燃烧 产生更明亮的 生成
水
和
火焰
二氧化碳 。
9
蜡烛燃烧文字表达式:
蜡烛 + 氧气 点燃 水 + 二氧化碳
10
导学案:
独立完成导学案10页:2.(1)蜡烛与氧气反应
蜡烛 + 氧气 点燃 水 + 二氧化碳
11
木炭在空气、氧气中燃烧
火星四射 , 放热 ,生成 黑色固体 。
可以燃烧 ,生 成四氧化三铁 .
铁丝燃烧反应的文字表达式?
26
(3)铁丝燃烧
铁丝 颜色状态
银白色固体
空气中 产生 红 光
反应现象
剧烈燃烧, 火星四射 ,
氧气的性质
1
课时目标 1.通过观察氧气与蜡烛的实验并总结,能
说出氧气的部分化学性质。 2.通过观察氧气与木炭的实验并总结,能
说出氧气与木炭反应的现象、文字表达式。
2
1.氧气的物理性质:
观察面前空气中的氧气,你知道氧气 的哪些物理性质?
在通常状况下氧气是 无 色、 无 味 的 气 体,氧气密度比空气的 大 (填
PLAY
Hale Waihona Puke 铁丝在氧气中燃烧1.铁丝的形状?
螺旋状
2.集气瓶中事先放有什么? 少量水 3.什么时候将铁丝伸入氧气中?
火柴即将燃尽时 4.产物是什么?颜色?状态?
四氧化三铁 黑色固体
5.现象?
铁丝在氧气中燃烧
实验步骤 实验现象 实验结论
点燃火柴,待 火柴即将燃尽 时把铁丝连同 火柴一起伸入 氧气中。
剧烈燃烧, 铁丝在氧气中
蜡烛
产生黄色火焰 比在空气中燃
烧 更剧烈 ,
将燃着的蜡烛 伸入氧气中
在氧气中燃烧 产生更明亮的 生成
水
和
火焰
二氧化碳 。
9
蜡烛燃烧文字表达式:
蜡烛 + 氧气 点燃 水 + 二氧化碳
10
导学案:
独立完成导学案10页:2.(1)蜡烛与氧气反应
蜡烛 + 氧气 点燃 水 + 二氧化碳
11
木炭在空气、氧气中燃烧
火星四射 , 放热 ,生成 黑色固体 。
可以燃烧 ,生 成四氧化三铁 .
铁丝燃烧反应的文字表达式?
26
(3)铁丝燃烧
铁丝 颜色状态
银白色固体
空气中 产生 红 光
反应现象
剧烈燃烧, 火星四射 ,
八年级化学第四单元第二节《氧气》第2课时氧气的性质PPT课件

文字表达式:
碳 +氧气 点→燃二氧化碳
C O2
CO2
实验二:铁丝(铁)与氧气反应
实验现象: 铁丝在氧气中剧烈燃烧,火星四射, 放出大量的热,生成黑色固体
文字表达式:
铁+ 氧气 点→燃 四氧化三铁
Fe O2
Fe3O4
思考:铁丝在氧气中燃烧应注意的问题
1、集气瓶底为什么要装少量水或铺一层细沙?
防止生成的高温熔化物溅落炸裂瓶底。
2、铁丝为什么要绕成螺旋状?
增大铁丝的受热面积
3、实验前用砂纸打磨铁丝,原因是什么? 除去铁丝表面的锈
4、为什么铁丝下端火柴快燃尽时才把铁丝伸入集气瓶中?
防止火柴燃烧消耗较多的氧气 5、铁丝下端系一根火柴,火柴的作用是什么?引燃铁丝
实验三:蜡烛(石蜡)与氧气反应
实验现象: 空气中:产生黄色火焰,放出热量 氧气中:比在空气中燃烧更旺,发出白光, 放出热量,瓶壁上有水雾;产生能使澄清石 灰水变浑浊的气体。
思考:课本P89页 木炭、铁丝、蜡烛在空气中反应与在氧 气中反应剧烈程度明显不同,原因是什么?
物质跟氧气发生化学反应时,单位体积的空间 里氧分子的数目越多,与反应微粒碰撞几率越 大,反应就越剧烈。 (氧气的浓度越大,反应越剧烈)
2022/7/18
课堂检查: 1、关于氧气化学性质描述错误的是( A ) A.具有可燃性 B.化学性质比较活泼 C.具有氧化性 D.具有助燃性,可以支持燃烧 2、下列物质中属于氧化物的是( B)
颜色
气味
状态 密度
溶解性
无色
(通常)
无味 气体 1.429g/L 不易溶
(通常) 比空气大 于水
存在三态 变化
氧气
加压 降温
浙教版八年级科学下册《空气与氧气》PPT课件

B.铁丝在氧气中燃烧
C.红磷在氧气中燃烧
D.硫在空气中燃烧
五、课堂练习
香烟中对人体危害最大的是烟碱(尼古丁)、焦
油和氰化物。尼古丁C10H14N2分子的结构式如图
所示。求:
1)组成尼古丁的各元素的原子个数比;2)组成尼古丁
的各元素的质量比;
C:12 H:1 N:14
3)尼古丁中碳元素的质量分数。
(1)5:7:1 (3)74.1%
第3章 空气与生命 第1节 空气与氧气
一、复习导入
空气的组成成分和其体积分数?
氧气
答:氮气78%,氧气21%,稀有气体0.93%,二氧化碳0.04%, 水蒸气和其他杂质0.03%。
一、氧气的性质
氧气的性质可以分为物理性质和化学性质。
物理性质:就是不需要化学变化所表现出来 的性质;比如颜色,气味,状态,密度等
①发出淡蓝色火焰
②放热
③产生有刺激性气 味的气体
二、实验活动
3.铁丝在氧气和空气中燃烧
氧气
①火星四射 ②放热 ③产生黑色的固体
空气
不燃烧没 有现象
结论 铁 + 氧气 点燃 四氧化三铁
三、实验总结
1.能在空气燃烧的物质 ——碳、硫、磷、镁、天然气说等明氧气具有很
在氧气中燃烧时,比在空气燃烧强时的更助加的燃剧性烈 2.一些不能在空气中燃烧的物质
——铁、铜等能在氧气中燃烧
却可以在氧气中燃, 溶解性,密度
化学性质
碳,硫,铁 ——现象
五、课堂练习
1、空气中氮气与氧气的体积比约为(C ) A.1:4 B.5:4 C.4:1 D.5:1
2.下列物质燃烧时,能产生大量白烟的物质是(C )
A.木炭在空气中燃烧
初中化学《氧气的性质》课件ppt (2)
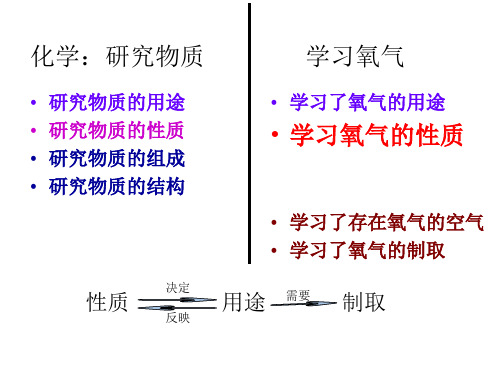
化学:研究物质
学习氧气
• 研究物质的用途 • 研究物质的性质 • 研究物质的组成 • 研究物质的结构
决定
性质 反映
• 学习了氧气的用途
• 学习氧气的性质
• 学习了存在氧气的空气 • 学习了氧气的制取
用途 需要 制取
第三节 氧气的性质
展示一瓶氧气
说一说氧气有哪些性质? 把这些性质分类?
液态氧气呈淡蓝色
鱼缸养鱼时要经常换水?
氧气的密度比空气的密度略大
氧气的密度为1.429g/L 空气的密度为1.293g/L
木炭在空气、氧气中燃烧
问1:木碳燃烧是物理变化还是化学变化? 问2:如何确定木碳燃烧是化学变化呢? 问3:新物质是什么呢?如何检验有新物质?
木炭在空气、氧气中燃烧
实验现象的叙述:
实验前 反应物的描述
铁在氧气中燃烧
实验现象叙述: 银白色的铁丝在氧气中燃
烧剧烈,火星四射,放热, 生成一种黑色固体。
• 木炭在氧气中燃烧比空气中燃烧的剧烈,铁 丝在空气中加热不燃烧,在氧气中能燃烧,这 说明什么呢?
• 碳+氧气 点燃 二氧化碳 • 铁+氧气 点燃 四氧化三铁 • 红磷+氧气 点燃 五氧化二磷 • 石蜡+氧气 点燃 二氧化碳+水
说说这几个文字表达式有验后 生成物的描述
现象:黑色木炭在空气中燃烧有红热现象,在氧气 中燃烧发白光,放热,生成一种使石灰水变浑浊的气体。
铁丝在氧气中燃烧
问1:铁在氧气中燃烧是化学变化吗?判断的依据是什么? 问2:做这个实验时为什么瓶底放少量的水呢? 问3:做这个实验时为什么将铁丝绕成螺旋状呢? 问4;为什么要等火柴快要燃尽时再深入氧气瓶中呢?
学习氧气
• 研究物质的用途 • 研究物质的性质 • 研究物质的组成 • 研究物质的结构
决定
性质 反映
• 学习了氧气的用途
• 学习氧气的性质
• 学习了存在氧气的空气 • 学习了氧气的制取
用途 需要 制取
第三节 氧气的性质
展示一瓶氧气
说一说氧气有哪些性质? 把这些性质分类?
液态氧气呈淡蓝色
鱼缸养鱼时要经常换水?
氧气的密度比空气的密度略大
氧气的密度为1.429g/L 空气的密度为1.293g/L
木炭在空气、氧气中燃烧
问1:木碳燃烧是物理变化还是化学变化? 问2:如何确定木碳燃烧是化学变化呢? 问3:新物质是什么呢?如何检验有新物质?
木炭在空气、氧气中燃烧
实验现象的叙述:
实验前 反应物的描述
铁在氧气中燃烧
实验现象叙述: 银白色的铁丝在氧气中燃
烧剧烈,火星四射,放热, 生成一种黑色固体。
• 木炭在氧气中燃烧比空气中燃烧的剧烈,铁 丝在空气中加热不燃烧,在氧气中能燃烧,这 说明什么呢?
• 碳+氧气 点燃 二氧化碳 • 铁+氧气 点燃 四氧化三铁 • 红磷+氧气 点燃 五氧化二磷 • 石蜡+氧气 点燃 二氧化碳+水
说说这几个文字表达式有验后 生成物的描述
现象:黑色木炭在空气中燃烧有红热现象,在氧气 中燃烧发白光,放热,生成一种使石灰水变浑浊的气体。
铁丝在氧气中燃烧
问1:铁在氧气中燃烧是化学变化吗?判断的依据是什么? 问2:做这个实验时为什么瓶底放少量的水呢? 问3:做这个实验时为什么将铁丝绕成螺旋状呢? 问4;为什么要等火柴快要燃尽时再深入氧气瓶中呢?
《物质构成的表示式》维持生命之气―氧气PPT教学课件(第2课时)

3.4 物质组成的表示式
[方法点拨]元素符号周围数字表示的含义不同,要认真分析总结。元
素符号、离子符号、化学式前的数字表示微粒的个数;化合价标在元素 符号的正上方(先正负,后数字),离子所带的电荷数写在元素符号的右 上角(先数字,后正负),并注意两者书写的顺序不同;化学式中元素符 号右下角的数字表示一个分子中所含原子的个数。
3.4 物质组成的表示式
探究点二 化合价的应用
[情景展示1]
步骤 写出组成化合物的元素,正价元素
居左,负价元素居右。
标出有关元素的化合价。
根据化合物中各种元素化合价代数 和等于零的原则,确定各有关原子
的数目。 写出化学式。
写出水的化学式 HO H O +1 -2
∵2×(+1)+1×(-2)=0, ∴2 个氢原子,1 个氧原子。
[核心应用] 核心三 化学符号周围数字的含义
例 4 [2017·青岛]下列化学用语书写正确的是( C ) A.两个氢分子:2H B.2 个硫酸根离子:2SO4-2 C.水中氧元素的化合价为-2:H2-O2 D.两个氮原子:N2
[解析] 两个氢分子:2H2;2 个硫酸根离子:2SO42-;两个氮原子:2N。
3.4 物质组成的表示式
2.计算化合物中各元素的质量比 元素质量比=(相对原子质量×原子个数)之比。 例如:H2SO4中氢元素、硫元素、氧元素的质量比为 (1×2)∶32∶(16×4)=1∶16∶32。 [点拨] 解题时,要先确定好元素比的顺序,其次要确定化合物中 各元素原子的个数,最后计算结果应是最简整数比。
[课堂速记]
3.4 物质组成的表示式
[核心应用] 核心二 化合价与化学式 例2 根据化合价写出下列物质的化学式。 (1)氧化钠:______N_a2_O____________。 (2)碳酸钾:____K_2_CO__3 ____________。 (3)硫酸铵:____(_N_H_4)_2S_O_4__________。 (4)氢氧化钙:__C_a_(O_H_)_2 _____________。
第三节氧气PPT课件(初中科学)

本实验中二氧化锰是加快过氧 化氢的分解速度。
• 1、实验室用分解过氧化氢(H2O2、双氧水) 制取氧气,二氧化锰是催化剂。也可用分解氯
酸钾(KClO3)、高锰酸钾(KMnO4)。
• 2、催化剂可改变反应的速度但自身的质量和化
学性质不变。二氧化锰在这个反应中的作用是
加快过氧化氢的分解。 二氧化锰
• 3、反应原理:过氧化氢
2、用双手捂住烧瓶的外壁
3、视察:若水中出现气泡, 水进入导管形成一段水柱,则 气密性好。
向锥形瓶中加入二氧化锰粉末
❖2、塞好带有分液漏斗(或长颈漏 斗)和导管的双孔橡皮塞。
❖3、向分液漏斗(或长颈漏斗) 中加入过氧化氢溶液。
收集气体的方法
1、排水法----适用于收集难溶或 不易溶于水的气体。
收集装置
收 集 装置示意图 方法 排水法
向上排 空气法
怎样判
原 因 断氧气
已集满
氧气不 集气瓶口
易溶于 有气泡冒
水
出时
氧气密 将带火星 度比空 的木条放 气略大 在集气瓶
口
过氧化氢溶液
实验中的反应物是什么?
H2O
MnO
2
2
H2O2+MnO2
MnO2(催化剂)
二氧化锰
移出导管
过氧化氢分解制氧气的装置
产生装置
收集装置
实验中的反应物生成物是什么?
过氧化氢溶液 反应物是过__氧__化__氢_
二氧化锰
生成物是氧气和水
二氧化锰加快了过氧化氢分解的速率
实验室 制取氧 气的原 理
过氧化氢 二氧化锰 水 + 氧气
MnO2
H2O2
H2O + O2
催化剂:
改变(加快和减慢)化学反应速 率,而自身的化学性质和质量并不改 变的物质。
• 1、实验室用分解过氧化氢(H2O2、双氧水) 制取氧气,二氧化锰是催化剂。也可用分解氯
酸钾(KClO3)、高锰酸钾(KMnO4)。
• 2、催化剂可改变反应的速度但自身的质量和化
学性质不变。二氧化锰在这个反应中的作用是
加快过氧化氢的分解。 二氧化锰
• 3、反应原理:过氧化氢
2、用双手捂住烧瓶的外壁
3、视察:若水中出现气泡, 水进入导管形成一段水柱,则 气密性好。
向锥形瓶中加入二氧化锰粉末
❖2、塞好带有分液漏斗(或长颈漏 斗)和导管的双孔橡皮塞。
❖3、向分液漏斗(或长颈漏斗) 中加入过氧化氢溶液。
收集气体的方法
1、排水法----适用于收集难溶或 不易溶于水的气体。
收集装置
收 集 装置示意图 方法 排水法
向上排 空气法
怎样判
原 因 断氧气
已集满
氧气不 集气瓶口
易溶于 有气泡冒
水
出时
氧气密 将带火星 度比空 的木条放 气略大 在集气瓶
口
过氧化氢溶液
实验中的反应物是什么?
H2O
MnO
2
2
H2O2+MnO2
MnO2(催化剂)
二氧化锰
移出导管
过氧化氢分解制氧气的装置
产生装置
收集装置
实验中的反应物生成物是什么?
过氧化氢溶液 反应物是过__氧__化__氢_
二氧化锰
生成物是氧气和水
二氧化锰加快了过氧化氢分解的速率
实验室 制取氧 气的原 理
过氧化氢 二氧化锰 水 + 氧气
MnO2
H2O2
H2O + O2
催化剂:
改变(加快和减慢)化学反应速 率,而自身的化学性质和质量并不改 变的物质。
浙教版科学八年级下册-3.1-空气和氧气-课件2(15张PPT)

二氧化硫
点燃
磷 + 氧气
五氧化二磷
点燃
铁 + 氧气
四氧化三铁
由两种或两种以上物质生成另一种物
质的反应,叫做化合反应。
特点:A+B=AB(“多变一”)
讨论:石蜡与氧气的反应是化合反应吗?
点燃
石蜡+氧气
二氧化碳+水
两种产物
不是化合反应
判断下列反应是否为化合反应
镁 + 氧气 点燃 氧化镁 ✓
二氧化碳 + 水
结论 碳 + 氧气 点燃 二氧化碳
2.硫在氧气中燃烧(硫跟氧气反应)
①发出明亮的蓝紫色火焰
现象
(空气中为淡蓝色火焰) ②放热
③产生有刺激性气味的气体
结论 硫 + 氧气 点燃 二氧 Nhomakorabea硫3.铁丝在氧气中燃烧(铁跟氧气反应)
现象
①火星四射 ②放热
③产生黑色的固体
结论 铁 + 氧气 点燃 四氧化三铁
4.蜡烛在氧气中燃烧(石蜡跟氧气反应)
①发出白光
现象
②放热 ③产生使澄清石灰水变浑的气体
④集气瓶内壁有小水滴
结论 石蜡+氧气 点燃 二氧化碳+水
思考: 1.铁丝在氧气中燃烧实验中,为什么集气瓶底 预先装有少量水或铺上一层细砂?
防止生成的熔化物溅落而炸裂瓶底
2.硫在空气和氧气中燃烧现象不同;铁丝在空 气中不能燃烧,而在纯氧中可以燃烧。你认为 其中的原因是什么?
氧气的浓度不同。 同种物质,反应条件不同,实验现象不同。
氧气的化学性质
1.能在空气燃烧的物质 ——碳、硫、磷、镁能在氧气中燃烧 ——蜡烛、酒精、天然气(主要成分 是甲烷)能在氧气中燃烧 2.一些不能在空气中燃烧的物质 ——铁、铜等能在氧气中燃烧
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
灯色
大红 深红 金黄 蓝 绿 紫
气
体
氖 氖 氦 体积分数:氩80% 氖20 % 体积分数:氩80% 氖20 % 体积分数:氩5% 氖50 %
玻璃管的 颜色
无 淡红
淡红 淡蓝 淡黄
无 返回
你猜我猜大家猜`1
空气里有什么呢? 二氧化碳 水蒸汽 氧气
氮气
探究之4 如何设计实验来测定空气所含O2体积比?
测定空气中氧气的含量
1、实验方案设计:
红磷在密闭容器内充分燃烧,消耗了空气中的氧气,
生成五氧化二磷固体,容器内压强减小,大气压将烧杯
中的水压入集气瓶中,水的体积正好填补消耗掉氧气的
体积,从而确定空气中氧气的体积分数。
2、实验装置:
C止水夹
燃烧匙 B
奇妙奇妙真奇妙, 看不见来摸不着, 无孔不入变化多, 动物植物都需要。
第二章 空 气 与 生 命
第一节
可怕的想象
如果我们生活的地球上没有空气,那我们 的地球会是什么样子?
受到流星的袭击 温差很大 没有天气的变化 没有生命 ….…
空气是一种重要的天然资源
一、空气的成分
历史上对空气的认识: 1、很长一段时间内认为空气是一种单质 2、科学家拉瓦锡研究出空气由氮气和氧气组成
空 氧气
气 (21%)
的
பைடு நூலகம்
二氧化碳
(0.03%)
组
成
氮气
(78%)
成 分 稀有气体
(0.94%)
其他气体
空
光合作用的原料;制冷剂; 气
是
灭火; 工业原料等
一
助燃; 供呼吸等
种
重
用于飞艇、闪光灯、液 要 氦冷冻机、霓虹灯等 的
供给植物生长所需的氮;
天
冷冻剂; 制化肥、炸药; 然
食品充氮防腐等
资
源
霓虹灯的颜色
D导管
集气瓶 A
3、实验结论:
E 烧杯
测定空气中氧气的含量
1、按图把装置连接,先在集气瓶内加入少量水, 再把剩余的容积用记号划成5等份。
2、点燃燃烧匙内的红磷,立即塞紧瓶塞,观 察现象: 产生大量的白烟。
3、火焰熄灭后,振荡集气瓶,打开导管上的夹子, 出现什么现象? 水从烧杯倒吸入集气瓶内. 。
瓶内水位变化 水的体积约占瓶容积的1/5 ; 消耗的气体跟余下的气体 的体积比为 1:4 。
拉瓦锡(1743—1794)
想一想
生活中有哪些事实能 说明空气中含有
CO2
探究之1
如何设计实验来证明空气中有CO2?
方法: 澄清的石灰水 通入CO2气体
浑浊
想一想
生活中有什么事实能 说明空气中含有
H2O
探究之2
如何设计实验来证明空气中有水分?
方法1、用白色的硫酸铜粉末放置于空 气中,过一段时间后,观察其颜色变化:
的
氮气
组
(78%)
灭火; 工业原料等
种
供给植物生长所需的氮; 重
冷冻剂;制化肥、炸药; 要
成 稀有气体
食品充氮防腐等
的
成 分
(0.94%)
稀有气体用于飞艇、闪光
其他气体和杂质
灯、液氦冷冻机、霓虹灯 等
天 然 资
(0.03%)
源
假 1.神舟六号飞船中,航天员所需的氧气是由
飞船自行携带的,用完就没的.
二氧 化碳
1、植物光合作用的原料 2、工业原料:制纯碱、尿素、汽水
3、致冷剂、人工降雨 4、灭火
稀有 气体
1、霓虹灯内充气 2、激光技术,制造低温环境(氦气)用于医疗麻醉。
小 结:
一、空气里有什么? 二、空气的应用
空
氧气 空 (21%)
助燃; 供呼吸等
气 是
气
二氧化碳
光合作用的原料;制冷剂; 一
(0.03%)
其他气体 和杂质 0.03%
氮气78%
通过阅读完成下表:
气体
用
途
1、构成人体蛋白质的主要元素 2、制化肥、炸药
氮气 3、充入灯光,延长灯光寿命;充入食品 保装袋防腐,保鲜。4、用作致冷剂,医疗上常用液氮
冷冻麻醉或冷藏人 体细胞
氧气
1、可帮助病人呼吸 2、燃烧在氧气中燃烧后产生的高温火焰可用来切割或 焊接金属
实验说明:
。
一、空气的组成(体积分数)
氧气(O2)
氮气一(百N2份) 体78%积的空气
21%
稀有 气体 0.94%
二氧化碳 0.03%
其他气体杂质 0.03%
空气的成分
成分 氮气
体积分 模型表示空气中各成份的体积分数 数
其他成分1%
78%
氧气
21%
稀有气体 0.94%
氧气 21%
二氧化碳 0.03%
假 2.空气中水蒸气是成云致雨的原料,当它的含量达
到一定时,就会下雨或下雪.
真 3.大豆的根上,会有很多的小颗粒,科学家研究发现:
它能吸收空气中的氮气,并转化为养分.从而种植大 豆省肥料.
假 4.人工降雨所用的“干冰”,即固态二氧化碳,它
是利用熔化吸收热量来降低温度,使空气中的水蒸 气液化成雨滴,从而降雨.
白色的 硫酸铜
遇水后
蓝色的 硫酸铜晶体
探究之2
如何设计实验来证明空气中有水分?
方法2、用蓝色的氯化钴试纸放置于空 气中,过一段时间后,观察其颜色变化:
蓝色的 氯化钴试纸
遇水后
红色的 氯化钴试纸
想一想
哪些事实可说明 空气中有氧气?
O2
探究之3
如何设计实验来证明空气中有O2?
方法:利用氧气的助燃性
