化学初中化学化学计算题练习题及解析
(化学)初中化学化学计算题解题技巧讲解及练习题(含答案)

(化学)初中化学化学计算题解题技巧讲解及练习题(含答案)一、中考化学计算题1.现将100 g溶质质量分数为9.8%的稀硫酸与一定质量的氯化钡溶液恰好完全反应后,过滤得到284.7 g滤液。
计算:(1)生成硫酸钡沉淀的质量。
(2)氯化钡溶液中溶质的质量分数。
【答案】(1)生成硫酸钡沉淀的质量为23.3 g。
(2)氯化钡溶液中溶质的质量分数为10%。
【解析】试题分析:解:设生成硫酸钡沉淀的质量为x,反应的氯化钡的质量为y。
H2SO4质量为:10 0g×9.8%=9.8 gBaCl2 + H2SO4 = BaSO4↓ + 2HCl208 98 233y9.8 g x233/98 =x/9.8x=23.3 g208/98 =y/9.8y=20.8 g(2)氯化钡溶液的质量为:284.7 g+23.3 g-100 g=208 g氯化钡溶液的溶质质量分数为:20.8 g/208 g×100%=10%考点:根据化学方程式的计算溶质的质量分数2.向13.6g碳酸钠和氯化钠的固体混合物滴加稀盐酸,所加稀盐酸质量与生成气体质量的关系如图所示。
计算:(1)固体混合物中碳酸钠的质量。
(2)该稀盐酸中溶质的质量分数。
(3)恰好完全反应时所得的溶液中溶质的质量分数。
(计算结果精确至0.1%)【答案】(1)10.6克(2)10%(3)17.9%【解析】试题分析:设固体混合物中Na2CO3的质量为x,稀盐酸中溶质的质量为y,反应生成NaCl 的质量为z。
Na2CO3+ 2HCl ="=" 2NaCl + H2O + CO2↑106 2×36.5 2×58.5 44x y z 4.4g得x=10.6克稀盐酸中溶质的质量分数为:恰好完全反应时所得的溶液溶质质量分数为:考点:根据化学方程式的计算 物质的质量分数3.将含有杂质(不溶于水)的氯化钡样品12.5g 放入39.6g 水中充分搅拌,完全溶解后过滤。
初中化学化学计算题解题技巧及经典题型及练习题(含答案)及解析

Mg+ 24 2.4g
H2SO4 == 98 x
MgSO4 + H2 120 y
24 = 98 x=9.8g 2.4g x
24 = 120 y=12g 2.4g y
(2)由图可知加入的氢氧化钠的质量为 80g 时才开始形成沉淀; 设参加反应的氢氧化钠的质量为 z;
2NaOH+ 80 z
MgSO4 == 120 12g
(1)利用化学方程式: Mg+H2SO4 ==MgSO4 +H2 ,根据反应的质量比即可计算出参
加反应的硫酸的质量; (2)镁与稀硫酸反应后的溶液中滴加氢氧化钠溶液,一段时间后才产生白色沉淀,说明与 镁反应的稀硫酸是过量的,氢氧化钠先与稀硫酸反应,再与硫酸镁反应生成氢氧化镁沉 淀。由图可知加入的氢氧化钠的质量为 80g 时才开始形成沉淀;根据硫酸镁与氢氧化钠反 应的质量比即可计算出消耗的氢氧化钠的质量; (3)氢氧化钡既能与稀硫酸反应,也能与硫酸镁反应,利用化学方程式,根据硫酸和硫酸 镁的质量即可计算出产生的沉淀的质量。 【详解】 解:(1)设与 2.4g 镁反应的 H2SO4 的质量为 x,生成硫酸镁的质量为 y;
7.为测定 21.2g 某变质氢氧化钠固体中碳酸钠的含量,将其配置成 500mL 溶液,分别取出 50mL 用两种方法进行测定。已知:Na2CO3+BaCl2=BaCO3↓+2NaCl
加入的试剂
测得数据
方法 1 方法 2
足量 BaCl2 溶液 足量稀硫酸
BaCO3 沉淀 1.97g CO2 气体 0.44g
(1)恰好完全反应时,生成沉淀的质量是_____g。 (2)请按上述实验中发生反应的先后顺序写出有关反应的化学方程式:_____;_____。 (3)该工业盐酸中 HCl 的质量分数是多少_____(写出计算过程)? 【答案】2.14g NaOH+HCl═ NaCl+H2O FeCl3+3NaOH═ Fe(OH)3↓+3NaCl 29.2% 【解析】 【详解】 (1)由图可知,完全反应后生成沉淀的质量为 2.14g。 (2)酸首先要和氢氧化钠反应,当酸反应完后,氯化铁才和氢氧化钠反应,故有关反应的 化学方程式为:NaOH+HCl═ NaCl+H2O;FeCl3+3NaOH═ Fe(OH)3↓+3NaCl。 (3)由图可知,与氯化铁反应的氢氧化钠溶液的质量为 172g﹣160g=12g; 设消耗的氢氧化钠的质量为 x。
初中化学化学计算题及其解题技巧及练习题(含答案)及解析
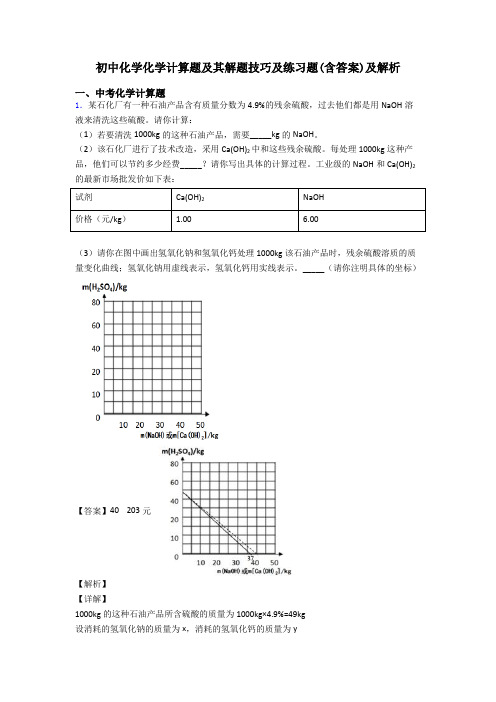
初中化学化学计算题及其解题技巧及练习题(含答案)及解析一、中考化学计算题1.某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸。
请你计算:(1)若要清洗1000kg的这种石油产品,需要_____kg的NaOH。
(2)该石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。
每处理1000kg这种产品,他们可以节约多少经费_____?请你写出具体的计算过程。
工业级的NaOH和Ca(OH)2的最新市场批发价如下表:试剂Ca(OH)2NaOH价格(元/kg) 1.00 6.00(3)请你在图中画出氢氧化钠和氢氧化钙处理1000kg该石油产品时,残余硫酸溶质的质量变化曲线;氢氧化钠用虚线表示,氢氧化钙用实线表示。
_____(请你注明具体的坐标)【答案】40 203元【解析】【详解】1000kg的这种石油产品所含硫酸的质量为1000kg×4.9%=49kg设消耗的氢氧化钠的质量为x,消耗的氢氧化钙的质量为y根据2NaOH+H2SO4=Na2SO4+2H2O和Ca(OH)2+H2SO4=CaSO4+2H2O可得关系式为242 2NaOH H SO Ca(OH)809874x49kg y::809874==x49kg yx=40kgy=37kg每处理1000kg这种产品,他们可以节约经费为6.00元/kg×40kg-1.00元/kg×37kg=203元图中画出用氢氧化钠和氢氧化钙处理1000kg该石油产品时,残余硫酸溶质的质量变化曲线;氢氧化钠用虚线“…”表示,氢氧化钙用实线“一”表示,答:(1)若要清洗1000kg的这种石油产品,需要 40kg的NaOH。
(2)该石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。
每处理1000kg这种产品,他们可以节约203元经费。
(3)残余硫酸溶质的质量变化曲线;氢氧化钠用虚线“…”表示,氢氧化钙用实线“一”表示,2.现有一份氧元素质量分数为 89.5%的过氧化氢溶液,加入 MnO2充分反应后,得到液体的质量为 90g(不考虑操作过程中液体的损失),则生成氧气的质量为________________g(精确到小数点后 1 位)。
【化学】 初中化学化学计算题试题(有答案和解析)及解析

(1)根据质量守恒定律可得,产生氢气的质量为:93.7g+20g-113.5g=0.2g;
(2)解:设参加反应的锌的质量为 x,生成氯化锌的质量为 y
Zn+H2SO4=ZnSO4+H2
65
161 2
x
y 0.2g
65 161 2 x y 0.2g
x=6.5g y=16.1g
反应后烧杯里溶液中溶质的质量分数:
(4)设产生硫化氢的质量为 z
z=17kg 故填:17。
6.将 20 g 黄铜(铜和锌的合金)与 93.7 g 稀硫酸放入烧杯中恰好完全反应,反应后烧杯中物
质的质量为 113.5g,求:
(1)产生氢气的质量___。
(2)反应后烧杯里溶液中溶质的质量分数___。
【答案】0.2g 16.1%
【解析】
【详解】
(3)据质量守恒定律可以知道,反应前后减少的质量即为生成的二氧化碳的质量,所以可
以求出图中纵坐标上 a 点数值为:100g+30﹣127.8g=2.2g;
(4)草木灰样品中碳酸钾的质量为 x
K2CO3+H2SO4═ K2SO4+CO2↑+H2O
【答案】40
17
【解析】 【详解】 (1)设需要氢氧化钠的质量为 x
x=40kg 故填:40; (2)设需要用 Ca(OH)2 的质量为 y
y=37kg 氢氧化钠需要的费用为: 6 元/kg×40kg=240 元; 氢氧化钙需要的费用为: 1 元/kg×37kg=37 元 可以节约的费用为:240 元-37 元=203 元; 答:可以节约的费用为 203 元; (3)最开始硫酸的量为 1000kg×4.9%=49kg,消耗氢氧化钙的质量为 37kg,氢氧化钠的质 量为 40kg,故填:
中考化学化工计算题题(含答案)
中考化学化工计算题题(含答案)一、初中化学计算题1.一氧化碳还原氧化铜生成的红色固体可能是铜,也可能是氧化亚铜(Cu2O),还可能是铜和氧化亚铜(Cu2O)的混合物;氧化亚铜(Cu2O)是不溶于水的红色固体,氧化亚铜(Cu2O)能与稀硫酸反应的化学方程式为Cu2O +H2SO4=CuSO4+Cu+H2O,为进一步确定该红色固体成分,某同学取20.4g该红色固体,加入到足量的稀硫酸中使其充分反应,经过滤、洗涤、干燥后,称量剩余红色固体的质量为12.4g。
求红色固体中各成分的质量是多少__________?2.草木灰的主要成分是碳酸钾。
某化学兴趣小组取100g草木灰于烧杯中,不断滴入稀盐酸溶液,当滴入40g稀盐酸时,不再有气泡产生,此时烧杯中的残余混合物质量为K CO+2HC1=2KC1+H O+CO (假设137.8g。
碳酸钾与盐酸反应的化学方程式为2322草木灰的其他成分不与酸反应)。
请计算草木灰样品中碳酸钾的质量(要求写出计算过程)。
3.现有一瓶敞口放置在空气中的氢氧化钠样品,为了探究样品变质的情况,某兴趣小组进行了如图1所示实验,加入稀盐酸的质量与产生气体质量的关系如图2所示。
请结合图1、2中的实验数据,完成以下计算:(1)完全反应时产生气体的质量是______g。
(2)图2中b的数值是______。
(3)恰好完全反应时所得溶液的溶质质量分数______(写出计算过程,计算结果精确到0.01%)。
4.现有一瓶敞口放置在空气中的氢氧化钠样品,为了探究样品变质的情况,某兴趣小组进行了如图所示实验,加入稀硫酸的质量与产生气体质量的关系如图所示。
请结合图中的实验数据,计算:(1)烧杯中加入稀硫酸的质量是多少?(2)变质后的样品中氢氧化钠的质量分数。
(写出计算过程,结果保留1位小数)5.软磁铁氧体是用量很大的一种磁性材料,也是电子信息和家电工业等的重要基础功能性材料。
Mn3O4是生产软磁铁氧体材料的主要原料,实验室以SO2气体制备少量高纯Mn3O4的操作步骤如下:(资料)①亚硫酸(H2SO3)在Mn2+催化作用下被O2氧化为硫酸,硫酸与MnO2在常温下不易发生反应。
中考化学培优专题复习计算题练习题附详细答案

一、中考初中化学计算题1.某纯碱样品中含有少量氯化钠。
为测定样品中碳酸钠的质量分数,现称取该样品11g ,加入到盛有50g 稀盐酸的烧杯中,恰好完全反应,最后称得烧杯中溶液的质量为56.6g 。
计算:(1)完全反应后生成CO 2的质量_______;(2)纯碱样品中碳酸钠的质量分数_________(结果精确到0.1%) 【答案】4.4g 96.4% 【解析】 【分析】 【详解】(1)根据质量守恒定律,完全反应后生成二氧化碳的质量=11g+50g-56.6g=4.4g (2)设参加反应的碳酸钠的质量为x2322Na CO 2HCl 2Na +=++106444.4C CO Ogl H x106x=444.4gx=10.6g纯碱样品中碳酸钠的质量分数=10.6g11g×100%≈96.4% 答:(1)完全反应后生成CO 2的质量为4.4g ;(2)纯碱样品中碳酸钠的质量分数约为96.4%.2.在我国青海湖地区有一种说法,冬天捞碱,夏天晒盐。
这里的碱是指Na 2CO 3,盐是指NaCl 。
人们从盐湖中捞得的碱会含有少量的NaCl 。
某研究性学习小组称取含NaCl 的Na 2CO 3固体25.0g ,将其配制成溶液,再向其中逐滴加入足量的溶质质量分数为7.3%的稀盐酸,使气体完全放出,共收集到8.8gCO 2气体。
试计算:(1)原固体中Na 2CO 3的质量分数________。
(2)反应中消耗盐酸的总质量______。
【答案】(1)84.8%.(2)200g . 【解析】解:(1)设碳酸钠的质量为x ,盐酸溶液中溶质的质量为y Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑ 106 73 44 x y 8.8gx=21.2g ,y=14.6g所以原固体中碳酸钠的质量分数为 ×100% =84.8%(2)反应中消耗盐酸的总质量为: =200g答:(1)原固体中Na2CO3的质量分数为84.8%;(2)反应中消耗盐酸总质量为200g。
初中化学计算题大全(含答案及解析)

2024年中考化学《必考经典》计算题大全(含答案及解析)1.实验室欲测定一瓶标签破损的稀硫酸中溶质的质量分数,现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化情况如图所示。
分析并计算:(1)a点溶液中含有的离子是_____。
(2)当pH=7时,消耗氢氧化钠溶液中NaOH质量为_____g。
(3)计算稀H2SO4中溶质的质量分数。
_____(4)计算恰好完全反应时所得溶液的溶质质量分数。
_____【答案】Na+、H+、SO42- 0.8 稀H2SO4的溶质质量分数是9.8%;恰好完全反应时所得溶液的溶质质量分数是5.5%。
【解析】【详解】(1)由图示可知,在a点时溶液的pH小于7,说明加入的NaOH完全反应,有剩余的硫酸,所以,溶液中含有的离子为:Na+、H+、SO42-;(2)由图示可知,在溶液的pH等于7,消耗的NaOH溶液的质量为16g,溶质的质量为:16g×5%=0.8g;(3)10g稀硫酸样品含有H2SO4的质量为x,生成的硫酸钠的质量为y2NaOH+H SO=Na SO+2H O2424280981420.8g x y解得:x=0.98g y=1.42g稀H2SO4的溶质质量分数为:×100%=9.8%;(4)恰好完全反应时所得溶液的溶质质量分数:×100%≈5.5%。
2.某小组同学将530 g碳酸钠溶液加入到280 g石灰乳(水和氢氧化钙的混合物)中,使之恰好完全反应,所得溶液中溶质的质量分数为1%,计算加入的碳酸钠溶液中溶质的质量分数。
【答案】2%【解析】【详解】设原碳酸钠溶液中溶质的质量为xNa2CO3+ Ca(OH)2=CaCO3↓+ 2NaOH106 100 80X则解得x =10.6g所以加入的碳酸钠溶液中溶质的质量分数为答:加入的碳酸钠溶液中溶质的质量分数为2%。
3.取一定量的氯化钠与氢氧化钠的混合物,加一定量的水配成溶液,然后向其中滴加溶质质量分数为7.3%稀盐酸,直至恰好反应,共消耗稀盐酸50g。
化学计算题试题含答案
化学计算题试题含答案一、初中化学计算题1.鸡蛋壳的主要成分是碳酸钙(其他成分不溶于水也不与酸反应)。化学兴趣小组为了测定鸡蛋壳中碳酸钙的含量,做了如下实验,请回答下列问题:(1)鸡蛋壳发生反应的化学方程式为 ____________;(2)根据已知条件列出求解碳酸钙质量(x)的比例式 _____________;(3)该鸡蛋壳中碳酸钙的质量分数为 ____________;(4)最终所得溶液中溶质的质量分数为 _____________;(5)用 25%的盐酸配制上述稀盐酸需要加水的体积为 ___________。2.氧化亚铜(Cu2O)可用于生产船底防污漆,防止海生物对船舶设备的污损。
现将Cu2O 和Cu的固体混合物6.8g放入烧杯中,加入23.0g稀硫酸,恰好完全反应后,过滤,并用15.0g蒸馏水洗涤,得到滤液和4.8g干燥固体(已知:Cu2O+H2SO4=CuSO4+Cu+H2O)。
请计算:(1)Cu2O中铜元素的化合价为_____价。
(2)所得滤液中溶质的质量分数_____。
(3)若将上述23.0g稀硫酸,稀释为溶质的质量分数为4.9%的溶液,需要加入水的质量_____。
3.兴趣小组用氧化铜样品(含少量杂质铜)进行了如下实验:用一定量的稀盐酸溶解5g 样品,充分反应后过滤,得到100g滤液,向滤液加入NaOH溶液,所得实验数据如图:(1)从图可知,加入的NaOH溶液先跟滤液中的反应(填化学式)。
(2)求NaOH溶液的溶质质量分数(写出计算过程)(3)请画出滤液中氯化铜质量随NaOH溶液质量变化的图像(4)另取5g该样品,用足量的CO还原成纯铜,理论上可得到纯铜 g。
4.某课外活动小组为测定一包碳酸钠样品的质量分数,取来了一些样品,准确称取样品10g放于烧杯中(杂质既不溶于水,也不与稀盐酸反应),向其中加入足量的稀盐酸,根据实验测得的数据绘制出所加稀盐酸的质量和放出的CO2的质量关系图。
(1)10g样品可以产生多少克二氧化碳?(2)该样品中碳酸钠的质量分数是多少?(3)加入稀盐酸到恰好完全反应时,所得的溶液中溶质的质量分数是多少?(写出计算过程)5.某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取10g样品放入烧杯中,再取60g稀硫酸分六次加入烧杯中,充分反应,实验数据如下:第1次第2次第3次第4次第5次第6次加入稀硫酸的质量(g)101010101010剩余固体的质量(g)9.35m8.057.4 6.75 6.75的值为.(2)黄铜样品中锌的质量分数为.(写出计算步骤,下同)(3)所用稀硫酸的溶质质量分数为多少?6.“学化学,爱化学,用好化学”学习小组为测出鸡蛋壳(主要成分是碳酸钙)中碳酸钙的质量分数,某同学称取已洗净、晾干、研成粉末的鸡蛋壳10g置于烧杯中,将烧杯放在电子天平上,往烧杯中平均分5次加入50g的稀盐酸,测得实验数据如表:实验次数12345加入稀盐酸质量/g10.020.030.040.050.0剩余物质质量/g19.028.037.046.756.7(1)第_____ 次实验时鸡蛋壳已经完全反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
答:(1)反应完全时,生成氢氧化镁的质量为 5.8g ;
(2)样品中 MgCl2 的质量分数为19.0% ; (3)反应后所得溶液中 NaCl 的质量分数为17.4% 。
4.某氢氧化钠样品中混有氯化钠,为测定样品中氢氧化钠的质量分数,在 20℃时,称取 5g 样品,加入 27g 水完全溶解后,缓慢加入稀盐酸,至恰好完全反应时,用去 10%的稀盐 酸 36.5g。(该反应的化学方程式为:NaOH+HCl=NaCl+H2O) 试计算: (1)样品中氢氧化钠的质量分数。 (2)反应后所得溶液中溶质的质量分数。 (3)已知 20℃时,氯化钠的溶解度为 36 g,试通过简单计算确定反应后所得溶液是否为 20℃时该溶质的饱和溶液。 【答案】80% 10% 不是 【解析】 恰好完全反应时,消耗氯化氢的质量为:10%×36.5 g3.65g。设样品中氢氧化钠的质量为 x,反应后所得溶液中溶质的质量为 y NaOH + HCl = NaCl+ H2O 40 36.5 58.5 x 3.65g y 40/x=36.5/3.65g x=4g 58.5/y=36.5/3.65g y=5.85g 反应后所得溶液中溶质的质量分数=4g÷ 5g× 100%=80%。
2.某硫酸铜样品中含有不溶性杂质(杂质不溶于水,不含铜元素,不与其他物质发生反 应),兴趣小组同学欲测定硫酸铜的含量。进行了如下实验:①取样品 20g 加入 81.8g 足量 的水搅拌充分溶解后,向其中加入 56g 氢氧化钾溶液,充分反应后过滤,得到 8.9g 不溶于 水的物质和滤液 a;②再向上述滤液 a 中继续加入 56g 氢氧化钾溶液,充分反应后过滤, 又得到 4.9g 不溶于水的物质和只含一种溶质的滤液 b。请计算: (1)样品中硫酸铜的质量分数;______________ (2)最后所得滤液 b 中溶质的质量分数。________________ 【答案】80% 8.7% 【解析】 【详解】 (1)由题意可知硫酸铜和氢氧化钾反应生成氢氧化铜沉淀和硫酸钾,根据“又得到 4.9g 不 溶于水的物质和只含一种溶质的滤液 b”可知,20g 样品中的硫酸铜和氢氧化钾恰好完全反 应,需消耗氢氧化钾溶液质量为 56g+56g=112g,则 56g 的氢氧化钾反应消耗样品的质量为 10g,同时生成氢氧化铜沉淀质量为 4.9g,则 20g 样品中杂质的质量=8.9g-4.9g=4g,则 20g
5.化学反应在防治环境污染中扮演了重要角色。某工厂废气中的 SO2,可用以下方式处
理。方式一:2SO2+O2+2CaO═ 2CaSO4;方式二:2SO2+O2+4NaOH═ 2Na2SO4+2H2O 试计算:
(1)方式一反应的化学计量数之和为____;方式二反应前后硫元素的化合价变化为___。
(2)若用方式一处理 9.6tSO2,所得产品价值____元?(写出计算过程)(已知:CaSO4 的价格为 700 元/吨)
17.4g
溶液溶质质量分数=
×100%=8.7%,故填 8.7%。
200g
答:样品中硫酸铜的质量分数为 80%;最后所得滤液 b 中溶质的质量分数为 8.7%。
3.某粗盐中除 NaCl 以外还含有少量杂质 MgCl2,为了测定粗盐中 MgCl2 的质量分数。取固 体样品 50.0g 完全溶解于 150.0g 水中,并向其中逐渐加入一定浓度的 NaOH 溶液,实验过 程中生成沉淀的质量与加入 NaOH 溶液的质量的关系如图所示:
Na2SO4 + Mg(OH)2
80 = 120 z=8g z 12g
反应消耗的氢氧化钠溶液的质量= 8g 10% =80g
酸
【解析】
【分析】
【详解】
(1)根据质量守恒定律,反应前后溶液质量的减少就等于反应过程中所生成的气体的质量,
所以反应产生的 CO2 的质量为 200g+200g﹣395.6g=4.4g.故填:4.4 (2)根据质量守恒定律,反应物和生成物之间的量的关系,可以解决此题.
故填:78.8%
解:设所取样品中含有 Na2CO3 的质量为 x.
Na2CO3 +H2SO4═Na2SO4 +H2O+ CO2
106
44
x4Βιβλιοθήκη 4g106 = 44 解得: x=10.6g x 4.4g
则烧碱样品中
NaOH%=
50.0g-10.6g 50.0g
100%=78.8%
答:烧碱样品中 NaOH 的百分含量为 78.8%. (3)根据质量守恒定律,氢氧化钠转化成碳酸钠的过程中,钠元素的质量没变,故填:氢氧 化钠和碳酸钠都是每 46g 钠元素生成 142g 硫酸钠,消耗 98g 硫酸.
9.6t z
y
128 = 32 = 284 9.6t z y
y=21.3t z=2.4t
所得溶液的溶质质量分数为 21.3t 100% 34.4% 9.6t+50t+2.4t
答:所得溶液的溶质质量分数为 34.4%。
6.NaOH 潮解后极易与空气中的 CO2 反应生成 Na2CO3 而变质.为测定实验室一瓶放置已久 的烧碱中 NaOH 含量,某同学取适量的烧碱样品,溶于一定量的水得到 200g 溶液;再加入 200g 稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为 395.6g.请计算: (1)反应产生的 CO2 的质量为___g.
2SO2+O2+4NaOH═ 2Na2SO4+2H2O 前后硫元素的化合价变化为+4→+6。故填:7,+4→+6 (2)解:若用方式一处理 9.6tSO2,设生成的硫酸钙的质量为 x
2SO2 + O2 + 2CaO = 2CaSO4
128
272
9.6t
x
128 = 9.6t 272 x
x=20.4t
(3)若用方式二处理 9.6tSO2,刚好用去 50t 一定浓度的 NaOH 溶液,求所得溶液的溶质质量 分数____(最终结果精确到 0.1%)。(写出计算过程)
【答案】7 +4 +6 14280 34.4%
【解析】
【分析】
【详解】
(1)方式一 2SO2+O2+2CaO═ 2CaSO4 的化学计量数之和为 7;方式二
Mg+ 24 2.4g
H2SO4 == 98 x
MgSO4 + H2 120 y
24 = 98 x=9.8g 2.4g x
24 = 120 y=12g 2.4g y
(2)由图可知加入的氢氧化钠的质量为 80g 时才开始形成沉淀; 设参加反应的氢氧化钠的质量为 z;
2NaOH+ 80 z
MgSO4 == 120 12g
所得产品价值 700 元/t×20.4t=14280 元
答:若用方式一处理 9.6tSO2,所得产品价值 14280 元。 (3)解:若用方式二处理 9.6tSO2,设生成的硫酸钠的质量为 y,消耗的氧气质量为 z
2SO2 + O2 + 4NaOH = 2Na2SO4 + 2H2O
128 32
284
16g 样品中硫酸铜的质量=20g-4g=16g,样品中硫酸铜的质量分数= 20g ×100%=80%,故填
80%;
(2)设反应共生成硫酸钾的质量为 x,
160 = 174 16g x
解得 x=17.4g,反应所得滤液 b 的质量=20g+81.8g+56g+56g-8.9g-4.9g=200g,则所得硫酸钾
7.把 2.4g 镁加入到一定质量的硫酸中,反应完毕后,向溶液中滴加质量分数为 10%的 NaOH 溶液,一段时间后有白色沉淀生成。加入 NaOH 溶液与生成沉淀质量的关系如图。
(1)计算与 2.4g 镁反应的 H2SO4 的质量是多少?________(请在答题卡上写出计算过 程) (2)加入 NaOH 溶液____g 时,开始生成沉淀;图中 a 的数值为____。 (3)利用上述计算结果,若将 NaOH 溶液改用 Ba(OH)2 溶液并逐滴加入上述镁与硫酸反 应后的溶液中至不再产生沉淀为止,过滤、洗涤、烘干,得到沉淀的质量为____g。 【答案】9.8g 80 160 52.4 【解析】 【分析】
(2)若所取烧碱样品为 50.0g,则样品中 NaOH 的质量分数是_____?
(3)用同浓度的硫酸,与一瓶未变质、部分变质、或全部变质(杂质都是 Na2CO3)的烧碱样品 反应,需要硫酸的质量都相等.其原因是:__(从钠元素质量守恒的角度解释).
【答案】4.4 78.8% 氢氧化钠和碳酸钠都是每 46g 钠元素生成 142g 硫酸钠,消耗 98g 硫
化学初中化学化学计算题练习题及解析
一、中考化学计算题
1.向盛有氢氧化钠溶液的试管中加入一定量白色的硫酸铜固体粉末,恰好完全反应,过 滤,得到溶质质量分数为 14.2%的无色溶液 10g。请计算: (1)所得溶液中溶质的质量是_____________; (2)实验前试管中氢氧化钠溶液的溶质质量分数。(计算结果保留到 0.1%)__________ 【答案】1.42g 8.5% 【解析】 【分析】 【详解】 (1)10 g×14.2%=1.42g (2) 解:设实验前氢氧化钠溶液中的溶质质量为 X,生成 Cu(OH)2 的质量为 Y,白色的硫酸 铜固体粉末的质量为 W。 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓ 2×40 160 142 98 X W 1.42g Y 2×40 : 142=X :1.42g 解得 X=0.8g 180 :142= W :1.42g 解得 W=1.6g 142 :98 = 1.42g :Y 解得 Y="0.98g." 氢氧化钠溶液的质量为:10 g+0.98g- 1.6g=9.38g 实验前试管中氢氧化钠溶液的溶质质量分数为:0.8g÷9.38g=8.5%
