平衡常数、电离常数、水解常数、离子积常数、溶度积常数相关计算
高考化学二轮复习电解质溶液微 溶液中的“四大”常数课件

动,平衡常数减小
3.有机化学中常见的氧化、还原反应
3)Ksp(CaF2)=5.29×10-9,除铁后所得100 mL溶液中c(Ca2+)=0.01 mol·L-1,加
不变,c(H )不变,则c(HY)与原 HY 溶液的相同,C 项错误。HX 是强 两DC..汽氯个车仿晶尾的胞气化结中学构含名示有称意的是图氮四可氧氯知化化,+物碳Li1是-x汽Fe油PO不4完相全比燃于烧LiF造eP成O的4缺失一个面-心的Li+以及一 c(Y ) 个氮原子能形成三个共价键,属于原子(共价晶体),平均1个氮原子属于本身的
度先增大后减小,D 项错误。
14
3.常温下,分别向等体积、浓度均为 0.1 mol·L-1 的 HX 溶液和 HY 溶液 中加水进行稀释,两溶液的 pH 随 lgVV0(设稀释前酸溶液的体积为 V0,稀释 后酸溶液的总体积为 V)的变化曲线如图所示。下列说法错误的是( )
A.当两溶液的 lgVV0相等时,两种溶液中 c(X-)=c(Y-)+c(HY) B.HY 的电离平衡常数约为 1.1×10-3
)=10×0.02
mol×96
2
g·mol-1=19.2
g,则M的摩尔
a1 a2
2
2
(1)某粒子一般不与其他元素的原子反应,这种粒子的符号是_____。
积常数分别为 K 、K′ 、K″ 。 mol,m(Co)=59× g;在1 000 ℃时,固体质量不再变化,说明Co(OH)2完全
a.Be—H中氢原子带负电,H—O中氢原子sp带正电,符合双氢sp键定义;b.O—Hs和p
√C.将 pH=2 的两种溶液等体积混合后,cc((HYY-))比原 HY 溶液的大
D.当 lgVV0=4 时,若两溶液同时升高温度,则cc((YX--))增大
微专题 四大平衡常数的计算与应用(原卷版)--2025年高考化学微专题
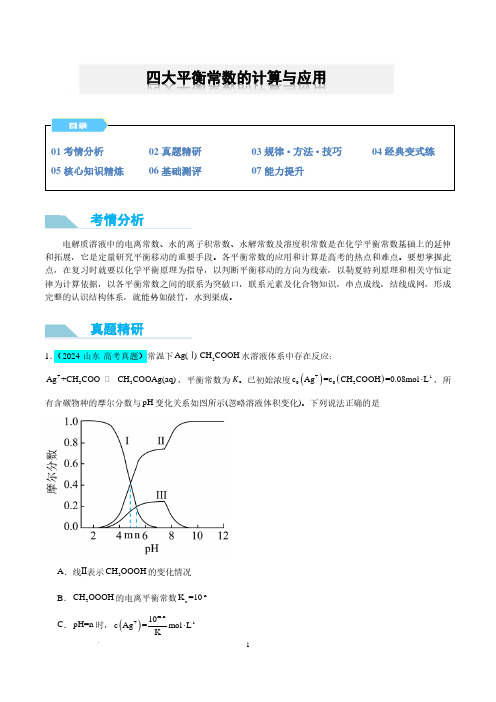
四大平衡常数的计算与应用考情分析真题精研D .pH=10时,()()+-13c Ag+c CH COOAg =0.08mol L⋅2.(2024·安徽·高考真题)环境保护工程师研究利用2Na S 、FeS 和2H S 处理水样中的2+Cd 。
已知25℃时,2H S 饱和溶液浓度约为-10.1mol L ⋅,()-6.97a12K H S =10,()-12.90a22K H S =10,-17.20sp K (FeS)=10,-26.10sp K (CdS)=10。
下列说法错误的是A .2Na S 溶液中:()()()()()+--2-c H+c Na =c OH +c HS +2c S +B .-120.01mol L Na S ⋅溶液中:()()()()+2---c Na >c S >c OH >c HSC .向()2+-1c Cd=0.01mol L⋅的溶液中加入FeS ,可使()2+-8-1c Cd <10mol L ⋅D .向()2+-1c Cd=0.01mol L⋅的溶液中通入2H S 气体至饱和,所得溶液中:()()+2+c H >c Cd注意:(1)四大平衡的基本特征相同,包括逆、动、等、定、变,其研究对象均为可逆变化过程。
(2)溶解平衡有放热反应、吸热反应,升高温度后K sp 可能变大或变小;而电离平衡、水解平衡均为吸热过程,升高温度K a (或K b )、K h 均变大。
规律·方法·技巧A .pH=6.5时,溶液中()()2-2+3c CO <c PbB .()()2+3δPb=δPbCO 时,()2+c Pb <1.010×()-1M lg c /mol L ⋅(M 代表+Ag 、-Cl 或2-4CrO )随加入NaCl 溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。
下列叙述正确的是经典变式练核心知识精炼(1)A、C、B三点均为中性增大(2)D点为酸性溶液,E点为碱性溶液(1)a、c点在曲线上,a→c Na2SO4固体,但K sp不变基础测评1.(2024·陕西商洛·模拟预测)室温下,用-10.1mol L ⋅的二甲胺()32CH NH 溶液(二甲胺在水中的电离与一水合氨相似)滴定-110.00mL0.1mol L ⋅盐酸溶液。
化学复习:有关水溶液中平衡常数关系计算

因而该比值减小。
5.高铁酸钾(K2FeO4)是一种优良的水处理剂。25 ℃时, 其水溶液中加酸或碱改变溶液的pH时,含铁粒子的物 质的量分数δ(X)随pH的变化如图,已知δ(X)=nnFXe 。 (1)由B点数据可知,FeO4的第一步电离常数Ka1= __4_.0_×__1_0_-_4_。
B 点 pH=4,δ(HFeO- 4 )=0.8,则 δ(H2FeO4)=0.2,由于溶液体积相同,则ccHH2FFeeOO- 44 =00..82=4.0,则 H2FeO4 的第一步电离常数 Ka1=cHcFHeO2F- 4 e·Oc4H+=4.0×10-4。
化热精点讲学复习:有关水溶液中平衡常数关系计算
1.水解常数与电离常数、水的离子积之间的关系 常温下,H2S的电离常数为Ka1、Ka2,推导Na2S溶液中S2-水解常数Kh1、Kh2与Ka1、 Ka2的关系。 答案 (1)S2-+H2O HS-+OH-
Kh1=cHSc-S·c2-O H-=cHSc-S·c2-H·+ cH·c+O H-=KKaw2。 (2)HS-+H2O H2S+OH- Kh2=cH2cSH·cS-OH-=cH2cSH·cS-O·Hc-H·+cH+=KKaw1。
2.水解常数与溶度积、水的离子积之间的关系 常温下推导Cu2+的水解常数与溶度积、水的离子积之间的关系。
答案 Cu2++2H2O Cu(OH)2+2H+ Kh=cc2CHu2++=cc2CHu2++··cc22OOHH--=Ksp[CKu2wOH2]。
3.平衡常数与电离常数、溶度积之间的关系 (1)以反应CuS(s)+2Ag+(aq) Cu2+(aq)+Ag2S(s)为例,推导沉淀转化的平衡常数K。 答案 K=cc2CAug2++=cc2CAug2++··ccSS22--=KKssppACgu2SS。
2020高考化学冲刺核心素养专题 四大平衡常数(Ka、Kh、Kw、Ksp)的综合应用含解析
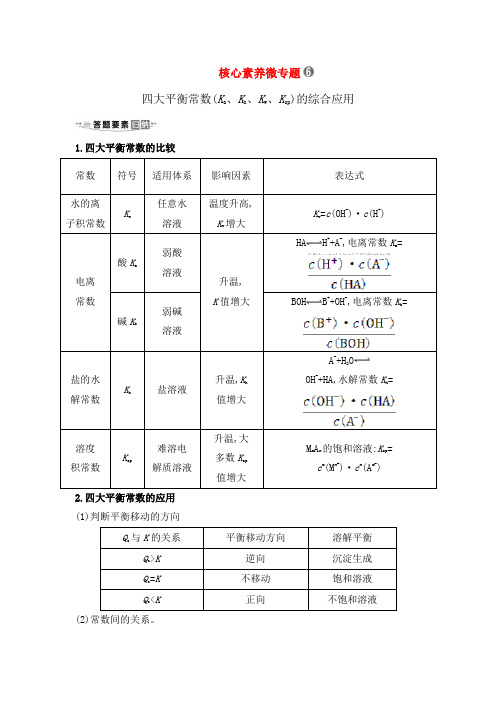
核心素养微专题四大平衡常数(K a、K h、K w、K sp)的综合应用1.四大平衡常数的比较常数符号适用体系影响因素表达式水的离子积常数Kw任意水溶液温度升高,Kw增大Kw=c(OH-)·c(H+)电离常数酸K a弱酸溶液升温,K值增大HA H++A-,电离常数K a= 碱K b弱碱溶液BOH B++OH-,电离常数K b=盐的水解常数Kh盐溶液升温,K h值增大A-+H2OOH-+HA,水解常数K h=溶度积常数Ksp难溶电解质溶液升温,大多数K sp值增大M m A n的饱和溶液:K sp=c m(M n+)·c n(A m-)2.四大平衡常数的应用(1)判断平衡移动的方向Qc与K的关系平衡移动方向溶解平衡Qc>K逆向沉淀生成Qc=K不移动饱和溶液Qc<K正向不饱和溶液(2)常数间的关系。
①K h=②K h=(3)判断离子浓度比值的大小变化。
如将NH3·H2O溶液加水稀释,c(OH-)减小,由于电离平衡常数为,此值不变,故的值增大。
(4)利用四大平衡常数进行有关计算。
【典例】(2019·武汉模拟)(1)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
①滴定醋酸的曲线是________(填“Ⅰ”或“Ⅱ”)。
②V1和V2的关系:V1________V2(填“>”“=”或“<”)。
(2)25 ℃时,a mol·L-1的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的电离常数为________。
(用含a的代数式表示)。
【审题流程】明确意义作判断,紧扣关系解计算【解析】(1)①醋酸为弱酸,盐酸为强酸,等浓度时醋酸的pH大,曲线Ⅱ为滴定盐酸曲线,曲线Ⅰ为滴定醋酸曲线,答案填Ⅰ;②醋酸和氢氧化钠恰好完全反应时,得到的醋酸钠溶液显碱性,要使溶液pH=7,需要醋酸稍过量,而盐酸和氢氧化钠恰好完全反应,得到的氯化钠溶液显中性,所以。
2020高考化学冲刺核心素养微专题: 6 四大平衡常数(Ka、Kh、Kw、Ksp)的综合应用
温馨提示:此套题为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,答案解析附后。
关闭Word文档返回原板块。
核心素养微专题四大平衡常数(K a、K h、K w、K sp)的综合应用1.四大平衡常数的比较常数符号适用体系影响因素表达式水的离子积常数K w任意水溶液温度升高,K w增大K w=c(OH-)·c(H+)电离常数酸K a弱酸溶液升温,K值增大HA H++A-,电离常数K a=碱K b弱碱溶液BOH B++OH-,电离常数K b=盐的水解常数K h盐溶液升温,K h值增大A-+H2OOH-+HA,水解常数K h=溶度积常数K sp难溶电解质溶液升温,大多数K spM m A n的饱和溶液:K sp=c m(M n+)·值增大c n(A m-)2.四大平衡常数的应用(1)判断平衡移动的方向Q c与K的关系平衡移动方向溶解平衡Q c>K逆向沉淀生成Q c=K不移动饱和溶液Q c<K正向不饱和溶液(2)常数间的关系。
①K h=②K h=(3)判断离子浓度比值的大小变化。
如将NH3·H2O溶液加水稀释,c(OH-)减小,由于电离平衡常数为,此值不变,故的值增大。
(4)利用四大平衡常数进行有关计算。
【典例】(2019·武汉模拟)(1)用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
①滴定醋酸的曲线是________(填“Ⅰ”或“Ⅱ”)。
②V1和V2的关系:V1________V2(填“>”“=”或“<”)。
(2)25 ℃时,a mol·L-1的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的电离常数为________。
(用含a的代数式表示)。
四大平衡常数

物料守恒
Kb=10-6/5.5=1.8×10-5
3、混合溶液中求电离平衡常数 特别提醒:电离平衡常数公式在混合溶液中同样适用。 【例题3 】在25℃下,将a mol/L的氨水与0.01mol/L的 盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)用 含a的代数式表示NH3· H2O的电离常数Kb。
3、四大常数只受温度影响,催化剂、压强变化、浓
度变化、溶液混合等不能影响四大常数。
二、利用平衡常数解决平衡移动问题
1、常见气体反应 N2(g)+3H2(g) 2NH3(g)
将容器压缩一半体积,用平衡常数判断平衡移动。
压缩一半
利用浓度商Qc和平衡常数判断平衡移动
N2(g)+3H2(g) 压缩前 压缩后 2NH3(g)
1、化学平衡常数 N2(g)+3H2(g) 2NH3(g)
平衡常数K=
2、电离平衡常数 CH3COOH 电离平衡常数K=
c2 (NH3) c(N2) c3(H2)
CH3COO-+H+
c(CH3COO-) c (H+) c (CH3COOH)
3、水解常数
CH3COO-+H2O CH3COOH+OH-
【例题2 】25℃下5.5mol/L的氨水的PH=11,求该温度 下NH3· H2O的电离常数Kb? 电离平衡常数Kb=
c(OH-) c (NH4+) c (NH3· H2O)
c(OH-)=10-3 mol/L c(NH4+) =10-3 -10-11≈ 10-3 mol/L c(NH3· H2 O)=5.5-10-3 ≈5.5 mol/L
c(CH3COOH) c (OH-) 水解常数Kh= c (CH3COO-)
水解常数参见选修四P58《科学视野》
平衡常数、电离常数、水解常数、离子积常数、溶度积常数相关计算
平衡常数、电离常数、水解常数、离子积常数、溶度积常数相关计算班级:姓名:⒈将足量BaCO3(K sp=8.1×10-9)分别加入①30mL水②10mL0.2mol/LNa2CO3溶液③50mL0.01mol/L氯化钡溶液④100mL0.01mol/L盐酸中溶解至溶液饱和。
请确定各溶液中Ba2+的浓度由大到小的顺序为()A.①②③④B.③④①②C.④③①②D.②①④③⒉已知在25℃时,H2S的电离常数K a1=5.7×10-8、K a1=1.2×10-15,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36。
常温时下列说法正确的是()(多选)A.除去工业废水中的Cu2+可以选用FeS作沉淀剂B.将足量CuSO4溶解在0.1mol/L氢硫酸中,溶液中Cu2+的最大浓度为1.3×10-35mol/LC.因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生D.FeS+2H+Fe2++H2S的平衡常数K=9.21×104E.向H2S的饱和溶液中通入少量SO2气体,溶液的酸性增强⒊25℃时,pH=9的CH3COONa溶液和pH=9的C溶液中由水电离产生的OH—的物质的量浓度之比为。
⒋已知常温下K a(HClO2)=1.1×10-2,则反应HClO2+OH-ClO2-+H2O在常温下的平衡常数K= 。
⒌常温下,K a1(H2CO3)=4.0×10-7,K a2(H2CO3)=5.0×10-11,则0.50mol/L的Na2CO3溶液的pH= 。
⒍H3AsO3又叫路易斯酸,是一种弱酸,发生酸式电离是通过和水中的氢氧根离子结合实现的,则第一步电离方程式为;若常温时H3AsO3的第一步电离常数K a1=1.0×10-9,则常温下,0.1mol/L的溶液的pH为。
水溶液中四大平衡常数的计算及应用
根据
Ka
=
c(
HB - c(
) ·c( H2 B)
H
+
)
,知
c( H2 B)
=
0. 1 × 10 1 × 10 -
- 2
3
mol·L - 1 = 1 × 10 - 2 mol·L - 1 .
答 案: ( 1 ) 1 × 10 -13
( 2)
2b × 10 - 6. 5 a - 2b
( a - 2b) × 10 - 6. 5 2b
解析 由 AgCl 的 Ksp = c( Ag + ) ·c( Cl - ) ,当溶液中
Cl - 恰好完全沉淀( 浓度等于 1. 0 × 10 -5 mol·L -1 ) 时,溶液中
c( Ag + )
=
2. 0 1. 0
× 10 -10 × 10 -5
mol · L -1 = 2. 0 × 10 -5 mol · L -1; 由
c( OH - )
= 10 - 6. 5 ,c( CH3 COO - )
=2
×
b
×
1 2
mol·L -1 ,
Ka
=
b
× 10 - 6. 5 a -b
=
2b × 10 - 6. 5 a - 2b
2
Kh
=
2
b
10 - 13 × 10 -
6.
5
=
(
a
- 2b) × 10 2b
- 6. 5
a - 2b
(
3)
— 90 —
c( H + ) ( 2) 0. 6162
二、溶度积( Ksp) 的计算与应用
四大平衡常数
四大平衡常数的相互关系及运算电解质溶液中的电离常数、水的离子积常数、水解常数及溶度积常数是在化学平衡常数基础上的延深和拓展,它是定量研究平衡移动的重要手段。
在复习时就要以化学平衡原理为指导,以判断平衡移动的方向为线索,以勒夏特列原理和相关守恒定律为计算依据,以各平衡常数之间的联系为突破口,联系元素及化合物知识,串点成线,结线成网,形成完整的认识结构体系.1.四大平衡常数的比较常数符号适用体系影响因素表达式水的离子积常数K W任意水溶液温度升高,K W增大K W=c(OH-)·c(H+)电离常数酸K a弱酸溶液升温,K值增大HA H++A-,电离常数K a=c(H+)·c(A-)c(HA)碱K b弱碱溶液BOH B++OH-,电离常数K b=c(B+)·c(OH-)c(BOH)盐的水解常数K h盐溶液升温,K h值增大A-+H2O OH-+HA,水解常数K h=c(OH-)·c(HA)c(A-)溶度积常数K sp 难溶电解质溶液升温,大多数K sp值增大M m A n的饱和溶液:K sp=c m(M n+)·c n(A m-)2.四大平衡常数间的关系(1)CH3COONa、CH3COOH溶液中,K a、K h、K W的关系是K W=K a·K h。
(2)NH4Cl、NH3·H2O溶液中,K b、K h、K W的关系是K W=K b·K h。
(3)M(OH)n悬浊液中K sp、K W、pH间的关系是K sp=c(M n+)·c n(OH-)=c(OH-)n·cn(OH-)=c n+1(OH-)n=1n⎝⎛⎭⎫K W10-pHn+1。
3.四大平衡常数的应用(1)判断平衡移动方向Q c与K的关系平衡移动方向溶解平衡Q c>K逆向沉淀生成Q c=K不移动饱和溶液Q c<K正向不饱和溶液(2)判断离子浓度比值的大小变化如将NH3·H2O溶液加水稀释,c(OH-)减小,由于电离常数为c(NH+4)·c(OH-)c(NH3·H2O),此值不变,故c(NH+4)c(NH3·H2O)的值增大。
高考专题讲座5 水溶液中的四大常数及其应用
专项突破 电解质溶液中的四大平衡常数[K a (K b )、K w 、K h 、K sp ]及其应用电解质溶液中的四大平衡常数是指弱电解质的电离平衡常数,水的离子积常数,水解平衡常数及难溶电解质的溶度积常数,这部分内容为新课标中的新增知识,在高考题中频繁现身,已成为新高考的热点内容。
一.“四大平衡常数”比较表达式电离常数(K a 或K b )(1)弱酸HA 的K a =c (H +)·c (A -)c (HA )(2)弱碱BOH 的K b =c (B +)·c (OH -)c (BOH )水的离子积(K w )K w =c (OH -)·c (H +) 溶度积(K sp )M m A n 的饱和溶液的 K sp =c m (M n +)·c n (A m -) 水解常数(K h )以NH +4+H 2ONH 3·H 2O +H +为例K h =c (H +)·c (NH 3·H 2O )c (NH +4)(1)K a (或K b )与K w 、K h 的关系①一元弱酸的K a 与弱酸根离子的K h 关系K a =K wK h例如:推导含HClO 、NaClO 的溶液中Ka 、K h 与Kw 的关系解析:由HClOH ++ClO -得K a =c (H +)·c (ClO -)c (HClO ),由ClO -+H 2OHClO +OH -得K h =c (HClO )·c (OH -)c (ClO -),K a ·K h =c (H +)·c (ClO -)c (HClO )·c (HClO )·c (OH -)c (ClO -)。
=c (H +)·c (OH -)=K w同理,一元弱碱的K b 与弱碱离子的K h 关系K b =K wK h②二元弱酸的K a1、K a2与相应酸根的水解常数K h1、K h2的关系 K a1=K w K h2,K a2=K wK h1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
平衡常数、电离常数、水解常数、离子积常数、溶度积常数相关计算班级:姓名:⒈将足量BaCO3(K sp=8.1×10-9)分别加入①30mL水②10mL0.2mol/LNa2CO3溶液③50mL0.01mol/L氯化钡溶液④100mL0.01mol/L盐酸中溶解至溶液饱和。
请确定各溶液中Ba2+的浓度由大到小的顺序为()A.①②③④B.③④①②C.④③①②D.②①④③⒉已知在25℃时,H2S的电离常数K a1=5.7×10-8、K a1=1.2×10-15,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36。
常温时下列说法正确的是()(多选)A.除去工业废水中的Cu2+可以选用FeS作沉淀剂B.将足量CuSO4溶解在0.1mol/L氢硫酸中,溶液中Cu2+的最大浓度为1.3×10-35mol/LC.因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生D.FeS+2H+Fe2++H2S的平衡常数K=9.21×104E.向H2S的饱和溶液中通入少量SO2气体,溶液的酸性增强⒊25℃时,pH=9的CH3COONa溶液和pH=9的C溶液中由水电离产生的OH—的物质的量浓度之比为。
⒋已知常温下K a(HClO2)=1.1×10-2,则反应HClO2+OH-ClO2-+H2O在常温下的平衡常数K= 。
⒌常温下,K a1(H2CO3)=4.0×10-7,K a2(H2CO3)=5.0×10-11,则0.50mol/L的Na2CO3溶液的pH= 。
⒍H3AsO3又叫路易斯酸,是一种弱酸,发生酸式电离是通过和水中的氢氧根离子结合实现的,则第一步电离方程式为;若常温时H3AsO3的第一步电离常数K a1=1.0×10-9,则常温下,0.1mol/L的溶液的pH为。
⒎已知常温下:K sp[Cu(OH)2]=2.2×10-20。
常温下,在一定量的氯化铜溶液中逐滴加入氨水至过量,可观察到先产生蓝色沉淀,后蓝色沉淀溶解转化成蓝色溶液。
①当pH=8时,c(Cu2+)= mol•L-1,表明已完全沉淀(一般地,残留在溶液中的离子浓度小于1×10-5mol•L-1时即可认为沉淀完全)。
②常温下,发生反应:Cu2+(aq)+4NH3(aq)[Cu(NH3)4]2+(aq) K1=2.0×1013。
该反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:Cu2+浓度/ NH3(aq)浓度[Cu(NH3)4]2+浓mol•L-1/ mol•L-1度/ mol•L-1平衡1a b c平衡2d e f用等式表示a、b、c、d、e、f之间的关系:。
若向蓝色溶液中滴加少量盐酸,则Cu2+的平衡转化率降低,原因是。
③蓝色沉淀溶解过程中存在平衡:Cu(OH)2(s)+4NH3(aq)[Cu(NH3)4]2+(aq)+2OH-(aq),则常温下,其平衡常数K2= 。
⒏向Na2SO4溶液中加入CaCO3有大量CaSO4生成,是因为。
(请用必要的文字加以说明)。
该转化过程中发生的反应的平衡常数K= 。
已知K sp(CaCO3)=2.7×10-9,K sp(CaSO4)=9.0×10-6。
⒐已知25℃时,K sp(CuOH)=2.0×10-15,K sp(CuCl)=1.0×10-6,则CuCl(s)+H2O(l) CuOH(s)+Cl-(aq)+H+(aq)的平衡常数K= (填数值)。
⒑向物质的量浓度均为0.1mol/L的FeCl2和MnCl2混合溶液中,滴加Na2S溶液,后沉淀的是(填离子符号);当MnS开始沉淀时,溶液中c(Mn2+)/c(Fe2+)为。
已知K sp(MnS)= 4.64×10-14,K sp(FeS)= 2.32×10-19。
⒒常温下,向0.5mol/LNa2SO3和0.05mol/LNa2SO4的混合溶液中加入等体积0.5mol/L的BaCl2溶液,充分反应后溶液中c(Ba2+)= 。
已知:K sp(BaSO4)=1.1×10-10、K sp(BaSO3)=5.5×10-7。
⒓已知25℃时,K sp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+Fe3++3H2O的平衡常数K= 。
⒔一般地,残留在溶液中的离子浓度小于1×10-5mol•L-1时即可认为沉淀完全;当一个反应的平衡常数大于105时即可认为该反应不可逆。
已知25℃时,K sp(FeS)=6.3×10-18、K sp(CuS)=1.3×10-36,H2S的电离常数K a1=5.7×10-8,K a2=1.2×10-15。
试通过计算判断FeS、CuS是否可溶于0.1 mol•L-1稀硫酸并制得H2S气体。
⒕25℃时,H2CO3、NH3•H2O在水中的电离平衡常数如下表:H2CO3NH3•H2O电K a1=4.0×10-7K b=2.离常数K a2=5.0×10-110×10-5①判断0.1mol•L-1的(NH4)2CO3溶液呈性(填“酸”、“中”或“碱”),该溶液中c(CO32-)、c(HCO3-)、c(NH4+)的浓度由大到小的顺序为。
②0.5 mol•L-1的Na2CO3溶液的pH= (忽略CO32-第二步水解和H2O的电离)。
③25℃时,Mg(OH)2的K sp=2.0×10-11,要使0.002 mol•L-1的MgSO4溶液中生成Mg(OH)2沉淀,应调整溶液pH不低于。
⒖硫酸钙在高温下被CO还原,发生的反应有:Ⅰ.CaSO4(s)+4CO(g)CaS(s)+4CO2(g) △H1平衡常数K1Ⅱ.CaSO4(s)+CO(g)CaO(s)+SO2(g)+CO2(g) △H2平衡常数K2Ⅲ.3CaSO4(s)+CaS(s)4CaO(s)+4SO2(g) △H3=+1049.2kJ•mol-1平衡常数K3⑴△H3= (用△H1、△H2表示);K3= (用K1、K2表示)。
⑵上述反应对应的平衡常数的对数值(lgK)与温度(T)的关系如图所示:①△H1 0(填“>”或“<”)。
②若只发生反应Ⅰ,A点c(CO)/c(CO2)= (填数值)。
③若只发生反应Ⅱ和Ⅲ,B点c(CO)、c(CO2)及c(SO2)之间的关系是。
⒗已知25℃时,K a1(H2C2O4)=6.0×10-2,K a2(H2C2O4)=6.4×10-5,K sp(CaC2O4)=4.0×10-9。
则反应Ca2+(aq)+H2C2O4(aq)CaC2O4(s)+2H+(aq)在25℃时的平衡常数K= 。
⒘已知常温下CH3COOH和NH3•H2O的电离平衡常数分别为K a、K b,则CH3COONH4在水溶液中的水解平衡常数K h= 。
⒙联氨(又称肼,无色液体)为二元弱碱,在水中的电离方式与氨相似。
常温下,联氨第一步电离反应的平衡常数值为(已知:N2H4+H+N2H5+的K=8.7×107)。
19.25℃时,K SP[Fe(OH)3]=4.0×10-38。
Fe3+发生水解反应Fe3++3H2O⇌Fe (OH)3+3H+,该反应的平衡常数为。
20.已知下列不同弱电解的电离常数:Ka(HCN)=4.93×10-10、Ka(CH3COOH)=1.8×10-5、Ka(HF)= 4.6×10-4、Ka(HClO)=7.5×10-8 Ka(NH3.H2O)=1.8×10-5(1)在常温条件下,等浓度的一元弱酸的钠盐:NaCN、CH3COONa、NaClO与NaF 四种溶液中PH由大到小的排列顺序为21.已知0.05mol/LBa(OH)2溶液的PH为11,且该温度下,H2CO3的Ka1=4×10-7,Ka2=4×10-11,则0.1mol/LNa2CO3溶液的PH近似值为:用对数表示。
平衡常数、电离常数、水解常数、离子积常数、溶度积常数相关计算【答案】⒈B ⒉AD ⒊104∶1 ⒋1.1×1012⒌12 ⒍H3AsO3+H2O[As(OH)4]-+H+ 5⒎①2.2×10-8②c/ab4=f/de4 NH3与H+反应生成NH4+,NH3浓度降低③4.4×10-7⒏溶液中SO42-浓度大,有利于反应CaCO3+SO42-CaSO4+CO32-向生成CaSO4的方向移动 3.0×10-4⒐5.0×10-6⒑Mn2+ 2×105⒒2.2×10-5mol/L ⒓2.79×103⒔提示:MS+2H+M2++H2S的平衡常数K=K sp/(K a1·K a2)⒕①碱 c(NH4+)>c(CO32-)>c(HCO3-) ②12 ③10⒖⑴4△H2-△H1 K24/K1⑵①< ②10-4③c(CO2)=c(CO)·c3(SO2)⒗960 ⒘K w/(K a•K b)⒙8.7×10-719.20.PH由大到小顺序为NaCN> NaClO> CH3COONa> NaF.21.10+lg5。
