fam荧光基团激发波长
三种荧光定量PCR检测方式比较

三种荧光定量PCR检测方式比较:以参照物为标准,对PCR终产物进行分析或对PCR进程进行监测,从而达到评估样本中靶基因的拷贝数,称为定量PCR。
定量PCR的可行性定量一样是在PCR扩增的指数期进行的。
常见检测方式可分为以下几类:(1) SYBR Green I 检测模式SYBR Green I 是一种能与双链 DNA 结合发光的荧光染料。
其与双链 DNA 结合后,荧光大大增强。
因此,SYBR Green I 的荧光信号强度与双链 DNA 的数量相关,能够依照荧光信号检测出 PCR 体系存在的双链 DNA 数量。
SYBR Green I 的最大吸收波长约为 497nm,发射波长最大约为 520nm。
PCR 扩增程序一样为 94℃~55℃~72℃三步法,40 个循环。
SYBR Green I 的缺点:由于 SYBR Green I 没有特异性,不能识别特定的双链,只若是双链就会结合发光,对 PCR 反映中的非特异性扩增或也会产生荧光,通常本底较高,因此在临床上利用可能会有假阳性发生。
SYBR Green I 的优势:SYBR Green I 的优势是因为其缺点产生,由于它能所有的双链相结合,因此对不同模板不需专门定制不同的特异性探针,通用性较好,而且价钱相对较低。
这对科研是很有利的,因此国内外在科研中利用比较普遍。
(2) 水解探针模式(man探针)TaqMan 探针是一种探针,荧光基团连接在探针的5’结尾,而淬灭剂那么在3’结尾。
当探针与靶序列配对时,荧光基团发射的荧光因与3’端的淬灭剂接近而被淬灭。
在进行延伸反映时,聚合酶的5’外切酶活性将探针切断,使得荧光基团与淬灭剂分离,发射荧光。
一分子的产物生成绩伴随着一分子的荧光信号的产生。
随着扩增循环数的增加,释放出来的荧光基团不断积存。
因此 Taqman 探针检测的是积存荧光。
PCR 扩增程序一般是:94℃~60 ℃ 40 个循环。
经常使用的荧光基团是 FAM,TET,VIC,HEX。
荧光探针和荧光染料

荧光探针和荧光染料来源:互联网 作者:未知 发布时间:2006-10-18实时荧光PCR 定量包括探针类和非探针类两种,探针类是利用与靶序列特异杂交的探针来指示扩增产物的增加,非探针类则是不利用杂交原理,而利用其他的一些理化特征指示扩增产物的增加。
前者由于增加了探针的识别步骤,特异性更高,但后者则简便易行。
1.TaqMan 探针TaqMan 探针是一种寡核苷酸探针,荧光基团连接在探针的5’末端, 而淬灭剂则在3’末端。
当探针与靶序列配对时,荧光基团发射的荧光因与3’端的淬灭剂接近而被淬灭。
在进行延伸反应时,聚合酶的5’外切酶活性将探针切断, 使得荧光基团与淬灭剂分离,发射荧光。
一分子的产物生成就伴随着一分子的荧光信号的产生。
随着扩增循环数的增加,释放出来的荧光基团不断积累。
因此Taqman 探针检测的是积累荧光。
常用的荧光基团是FAM ,TET ,VIC ,HEX 。
2.分子信标(molecular beacon)分子信标是一种呈发夹结构的茎环双标记寡核苷酸探针,两端的核酸序列互补配对,因此标记在一端的荧光基团与标记在另一端的淬灭基团紧紧靠近。
荧光基团被激发后产生的光子被淬灭剂淬灭,由荧光基团产生的能量以红外而不是可见光形式释放出来。
分子信标的茎环结构中,环一般为15-30 个核苷酸长,并与目标序列互补;茎一般5-7 个核苷酸长,并相互配对形成茎的结构。
荧光基团标记在探针的一端,而淬灭剂则标记在另一端。
在复性温度下,因为模板不存在时形成茎环结构,当加热变性会互补配对的茎环双链解开,如果有模板存在环序列将与模板配对。
与模板配对后,分子信标将成链状而非发夹状,使得荧光基团与淬灭剂分开。
当荧光基团被激发时,因淬灭作用被解除,发出激发光子。
由于是酶切作用的存在,分子信标也是积累荧光。
常用的荧光基团:FAM ,Texas Red 。
3.SYBR Green ISYBR Green I 是一种能与双链DNA 结合发光的荧光染料。
实时荧光定量PCR简介及其在食品监测领域中的应用要点

实时荧光定量PCR简介及其在食品检测领域中应用摘要:实时荧光定量PCR 是在定性PCR 技术基础上发展起来的核酸定量技术;该技术不仅实现对DNA 模板定量,且具有灵敏度高、特异性强、无污染性、及实时性和准确性等特点。
该文主要介绍实时荧光定量PCR 原理和在食品检测中应用,及其在食品领域发展前景。
关键字:荧光定量PCR;致病菌检测;转基因食品检测Abstract:Real–time fluorogenic quantitative polymerase Chain Reaction is a quantitative nucleic acids technology based on quanlity PCR,with characteristics of high sensitivity and specificity,pollution–free,instantaneity and accuracy as well as realization for quantitation of DNA template. its principle and application in food detection have been introduced in this article,and its prospect in food field predicted.Key word:real–time quantitative PCR;pathogen detection;genetically modified food detection一、实时荧光定量PCR技术原理实时定量荧光PCR技术是从传统PCR技术发展而来,其基本原理是相同的,主要不同之处是其定量的体系。
PCR反应过程产生DNA拷贝数,随反应循环数增加,以呈指数方式增加逐渐转入平台期。
在传统PCR中,用终点法对PCR产物定量有不足之处;而在实时荧光定量PCR反应中,引入了一种荧光化学物质,加入的荧光物质具有特定的波长,随着PCR反应的进行,PCR 反应产物不断累计,荧光信号强度也等比例增加。
以香豆素基团为荧光基团

以香豆素基团为荧光基团香豆素基团是一种常见的荧光基团,也被称为香豆酿基团。
它的化学结构是2-苯基苯并噻吩-2-甲酸酯,分子式为C13H8O2S。
香豆素基团具有较高的荧光效率和荧光稳定性,广泛应用于生物医药、分析化学和材料科学等领域。
香豆素基团的荧光产生机制是通过吸收光能激发电子,然后电子经过激发态和振动激发态的转变,最终从振动激发态跃迁回基态时释放出荧光。
香豆素基团的荧光波长通常在400-500纳米范围内,是蓝色和绿色光区域的发射光。
由于香豆素基团的荧光特性突出,它成为了许多领域中的重要工具。
在生物医药领域,香豆素基团被广泛应用于细胞成像、药物运输和疾病诊断等方面。
例如,科学家们通过将香豆素基团标记在分子探针上,可以实现对癌细胞、微生物和蛋白质等生物样品的高质量成像。
此外,香豆素基团还被用作荧光探针来研究生物分子的相互作用和代谢过程。
在分析化学领域,香豆素基团也发挥着重要的作用。
由于其很强的荧光信号和灵敏的荧光性质,香豆素基团常被用作分析试剂和荧光标记物。
利用香豆素基团的荧光特性,科学家们能够研究和测量生物样品中的化学物质,如氨基酸、蛋白质和核酸等。
此外,香豆素基团还被用于环境分析和食品安全等领域,具有重要的应用前景。
此外,由于香豆素基团具有较高的荧光稳定性和光化学稳定性,它也被广泛应用于材料科学领域。
科学家们利用香豆素基团的荧光性质,设计和制备了一系列具有特殊功能的荧光材料。
这些荧光材料在光电子器件、荧光显示器件、发光标记和荧光传感器等方面具有广泛的应用潜力。
总之,香豆素基团作为一种重要的荧光基团,在生物医药、分析化学和材料科学等领域发挥了重要作用。
它的荧光效率高、荧光稳定性好,广泛应用于生物成像、分子分析和材料制备等方面。
随着科学技术的不断发展,相信香豆素基团在未来将会有更广泛的应用前景。
fam分子量

fam分子量
FAM分子量是一个基础的化学概念,它是指荧光染料Fluorescein amidite的分子量。
FAM是一种广泛应用于分子生物学和生物医学研究中的荧光染料,它能够被用于标记DNA、RNA等生物大分子,进而在荧光显微镜下观察这些分子的运动、位置和构象等重要信息。
FAM的分子量是338.32 g/mol,它的化学结构式为C21H16O7N2。
FAM的化学结构是由一个荧光基团和一个硅烷羟基(Si-OH)团组成的。
硅烷羟基团能够和生物大分子中的羟基或氨基反应,从而将FAM标记在这些生物大分子上,并在荧光显微镜下发出明亮的绿色荧光。
这种荧光染料还可以通过引入其他化学基团来改变其荧光特性,如Kodak公司生产的JOE分子中引入了两个丙酰胺基团,使得其在荧光显微镜下表现为黄绿色荧光。
FAM分子量在分子生物学和生物医学研究中具有广泛的应用价值。
它可以被用于研究基因表达、蛋白质合成和细胞信号转导等过程中生物大分子的活动状态。
FAM标记的生物大分子可以通过荧光显微镜和相关技术手段进行监测和分析,为研究生命过程提供了重要的工具和手段。
总之,FAM分子量是分子生物学和生物医学研究中不可或缺的基础知识之一。
对于从事这个领域的科学家来说,理解FAM的结构和性质对于设计和实施相关研究具有重要的意义。
三种荧光定量PCR检测方法比较

三种荧光定量PCR检测方法比较定量pcr:以参照物为标准,对PCR终产物进行分析或对PCR过程进行监测,从而达到评估样本中靶基因的拷贝数,称为定量PCR。
定量PCR的可行性定量一般是在PCR扩增的指数期进行的。
常见荧光定量PCR检测方法可分为以下几类:<1> SYBR Green I 检测模式SYBR Green I 是一种能与双链DNA 结合发光的荧光染料。
其与双链DNA 结合后, 荧光大大增强。
因此, SYBR Green I 的荧光信号强度与双链DNA 的数量相关,可以根据荧光信号检测出PCR 体系存在的双链DNA 数量。
SYBR Green I 的最大吸收波长约为497nm,发射波长最大约为520nm。
PCR 扩增程序一般为94℃~55℃~72℃三步法,40 个循环。
SYBR Green I 的缺点:由于SYBR Green I 没有特异性,不能识别特定的双链,只要是双链就会结合发光,对PCR 反应中的非特异性扩增或引物二聚体也会产生荧光,通常本底较高,所以在临床上使用可能会有假阳性发生。
SYBR Green I 的优点:SYBR Green I 的优点是因为其缺点产生,由于它能所有的双链DNA相结合,所以对不同模板不需特别定制不同的特异性探针,通用性较好,并且价格相对较低。
这对科研是很有利的,因此国内外在科研中使用比较普遍。
<2> 水解探针模式<taq man探针>TaqMan 探针是一种寡核苷酸探针,荧光基团连接在探针的5’末端, 而淬灭剂则在3’末端。
当探针与靶序列配对时,荧光基团发射的荧光因与3’端的淬灭剂接近而被淬灭。
在进行延伸反应时,聚合酶的5’外切酶活性将探针切断,使得荧光基团与淬灭剂分离,发射荧光。
一分子的产物生成就伴随着一分子的荧光信号的产生。
随着扩增循环数的增加,释放出来的荧光基团不断积累。
因此Taqman 探针检测的是积累荧光。
PCR 扩增程序通常是:94℃~60 ℃40 个循环。
荧光定量PCR全攻略

荧光定量PCR完全攻略1、什么是定量PCR?以参照物为标准,对PCR终产物进行分析或对PCR过程进行监测,从而达到评估样本中靶基因的拷贝数,称为定量PCR。
定量PCR的可行性定量一般是在PCR扩增的指数期进行的。
2、定量PCR定量的理论依据是什么?特定的待扩增基因片段起始含量越大,则指数扩增过程越短,当扩增速率趋于稳定后,则无论原来样品中起始模板含量多少,最终扩增片段的含量通常是一样的。
理想的扩增结果:Y=X×2n其中Y代表扩增产物量,X代表PCR反应体中的原始模板数n为扩增次数;理论上PCR扩增效率为100%,PCR产物随着循环的进行成指数增长,但实际上:DNA的每一次复制都不完全,即每一次扩增中,模板不是呈2的倍增长;实际应为:Y= X(1+E)n,其中E 代表扩增效率:E = 参与复制的模板/总模板,通常E≤1,E在整个PCR扩增过程中不是固定不变的。
通常X 在1~105拷贝、循环次数n≤30时,E 相对稳定,原始模板以相对固定的指数形式增加,适合定量分析,这也就是所谓的指数期;随着循环次数n的增加(>30次),E值逐渐减少,Y 呈非固定的指数形式增加,最后进入平台期。
3、荧光定量PCR定量的理论模式又是什么?PCR是对原始待测模板核酸的一个扩增过程,任何干扰PCR指数扩增的因素都会影响扩增产物的量,使得PCR扩增终产物的数量与原始模板数量之间没有一个固定的比例关系,通过检测扩增终产物很难对原始模板进行准确定量。
近年来研究人员通过大量的实践,研究了相对准确的定量PCR方法,即荧光定量PCR。
PCR扩增通式:① T n=T0(1+E)n② T n=Tn-1(1+E)n 注:[0<E< 1]其中E表示扩增效率,n为循环数,T n表示在n个周期后PCR产物的数量,Tn-1表示在n-1个周期后PCR产物的数量,T0为原始模板数量。
设定PCR到达指数扩增期时,产生一定的荧光(荧光依赖于某一循环扩增产物的总量,即特定的拷贝数K,为常数,大约在1010左右)高于背景为仪器所识别,此时的循环数为CP(crossing point),也就是K= T0(1+E)CP,取对数即: lg K=lg T0+CP*lg(1+E)CP=- 1/lg(1+E)*lg T0 +lgk/lg(1+E)由于对一特定的PCR而言,E与K均为常数,故上式为循环数(CP)对原始模板拷贝数的对数(lg T0)一次方程,其标准形式y=kx+b,该直线的斜率为- 1/lg(1+E),在横坐标上的截距为lgk/lg(1+E),也是荧光定量PCR所谓的标准曲线。
荧光定量PCR中探针的荧光修饰基团
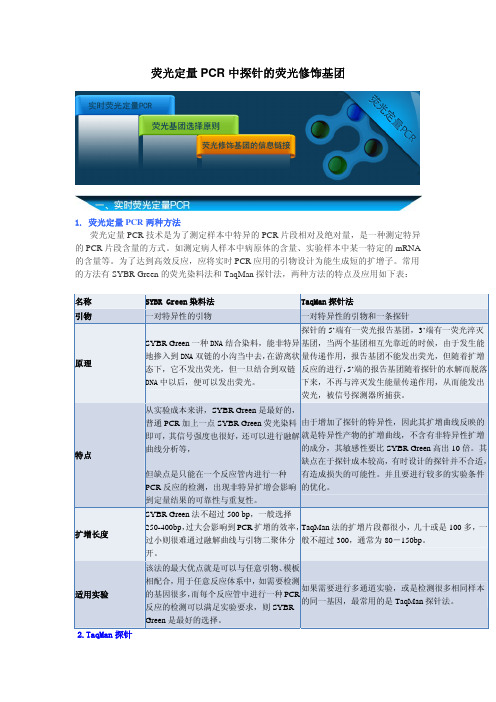
荧光定量PCR中探针的荧光修饰基团1. 荧光定量PCR两种方法荧光定量PCR技术是为了测定样本中特异的PCR片段相对及绝对量,是一种测定特异的PCR片段含量的方式。
如测定病人样本中病原体的含量、实验样本中某一特定的mRNA 的含量等。
为了达到高效反应,应将实时PCR应用的引物设计为能生成短的扩增子。
常用的方法有SYBR Green的荧光染料法和TaqMan探针法,两种方法的特点及应用如下表:名称SYBR Green染料法TaqMan探针法引物一对特异性的引物一对特异性的引物和一条探针原理SYBR Green一种DNA结合染料,能非特异地掺入到DNA双链的小沟当中去,在游离状态下,它不发出荧光,但一旦结合到双链DNA中以后,便可以发出荧光。
探针的5’端有一荧光报告基团,3’端有一荧光淬灭基团,当两个基团相互先靠近的时候,由于发生能量传递作用,报告基团不能发出荧光,但随着扩增反应的进行,5’端的报告基团随着探针的水解而脱落下来,不再与淬灭发生能量传递作用,从而能发出荧光,被信号探测器所捕获。
特点从实验成本来讲,SYBR Green是最好的,普通PCR加上一点SYBR Green荧光染料即可,其信号强度也很好,还可以进行融解曲线分析等,但缺点是只能在一个反应管内进行一种PCR反应的检测,出现非特异扩增会影响到定量结果的可靠性与重复性。
由于增加了探针的特异性,因此其扩增曲线反映的就是特异性产物的扩增曲线,不含有非特异性扩增的成分,其敏感性要比SYBR Green高出10倍。
其缺点在于探针成本较高,有时设计的探针并不合适,有造成损失的可能性。
并且要进行较多的实验条件的优化。
扩增长度SYBR Green法不超过500 bp,一般选择250-400bp,过大会影响到PCR扩增的效率,过小则很难通过融解曲线与引物二聚体分开。
TaqMan法的扩增片段都很小,几十或是100多,一般不超过300,通常为80-150bp。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
fam荧光基团激发波长
FAM(6-羧基荧光素)是一种常用于分子生物学和生物化学研究的荧光染料。
当被蓝光或紫外光激发时,它的激发最大值为494 nm,发射最大值为519 nm。
这意味着FAM在494 nm左右波长的光下最有效地被激发或“激活”,并且在被激发时会发射519 nm左右波长的光。
FAM的发射最大值通常被用作涉及其他荧光染料或蛋白质的实验的参考,因为它提供了一个方便和众所周知的比较点。
FAM是标记DNA或蛋白质的常用选择,因为它相对稳定,荧光强度高,并且可以使用各种技术轻松检测。
