电位滴定法测氯化银的Ksp 备注版
电位法测定氯和碘

实验5 电位滴定法测定氯、碘离子浓度及AgI和AgCl的K sp一、实验目的1.掌握电位滴定法测量离子浓度的一般原理;2.学会用电位滴定法测定难溶盐的溶度积常数。
二、方法原理当银丝电极插入含有Ag+的溶液时,其电极反应的能斯特响应可表示为:如果与一参比电极组成电池可表示为:进一步简化为:式中包括和r(Ag+)常数项。
银电极不仅可指示溶液中Ag+的浓度变化,而且也能指示与Ag+反应的阴离子的浓度变化。
例如,卤素离子。
本实验利用卤素阴离子(I-、Cl-)与银离子生成沉淀的溶度积K sp非常小,在化学计量点附近发生电位突跃,从而通过测量电池电动势的变化来确定滴定终点。
在终点时:其中X-为Cl-、I-,代入终点时的滴定电池方程:用该式即可计算出被滴定物质难溶盐的K sp。
而式中K′和S值可利用第二终点之后过量的[Ag+]与E(电池)关系作图求得,由直线的截距确定K′,斜率确定S。
通常的电位滴定使用甘汞或AgCl/Ag参比电极,由于它们的盐桥中含有氯离子会渗漏于溶液中,不适合在这个实验中使用,故可选用甘汞双液接硝酸盐盐桥,或硫酸亚汞电极。
三、仪器设备与试剂材料1.pH/mV计,电磁搅拌器。
2.银电极,双液接饱和甘汞电极。
3.硝酸银标准溶液,0.100mol∙L-1:溶解8.5g AgNO3于500mL去离子水中,将溶液转入棕色试剂瓶中置暗处保存。
准确称取1.461g基准NaCl,置于小烧杯中,用去离子水溶解后转入250mL容量瓶中,加水稀释至刻度,摇匀。
准确移取25.00mL NaCl标准溶液于锥形瓶中,加25mL水,加1mL15% K2CrO4,在不断摇动下,用AgNO3溶液滴定至呈现砖红色即为终点。
根据NaCl标准溶液浓度和滴定中所消耗的AgNO3体积(mL),计算AgNO3的浓度。
4.Ba(NO3)2(固体)。
5.硝酸,6mol∙L-1。
6.试样溶液(其中含Cl-和I-分别都为0.05mol∙L-1左右)。
电池电动势法测定氯化银的溶度积ppt课件

AgNO3 溶液
0.1000mol/L
本实验所有试剂均为分析纯,溶液用重蒸馏水配置。
5
四、实验步骤
1、电极制备 Ag-AgCl电极的制备方法见实验二十。 将表面经过清洁处理的自制铂丝电极作阴极,
把经金相沙纸打磨光洁的银丝电极作阳极,再镀 银溶液中进行镀银。电流控制在5mA左右,40分 钟后即可在铂丝点击上镀上白色紧密的镀层。将 镀好的银电极用蒸馏水仔细冲洗,然后以此银电 极为阳极。另选一铂丝或铂片电极为阴极,对 0.1mol.L-1盐酸溶液进行电镀,电流仍控制在5mA 左右,通过20分钟后就可在银电极表面形成AgAgCl 镀层(呈紫褐色)。此Ag-AgCl电极不用时 应置于含有少量AgCl沉淀的稀盐酸溶液中,并放 于暗处保存。
lg aAg
3
电池的电动势为两电极电势之差。
左
Ag / AgCl
2.303RT F
lg
K SP
2.303RT F
lg
aAg
右
Ag / AgCl
2.303RT F
lg
aCI
E
右
左
2.303RT F
lg
K SP
2.303RT F
lg
aAg
实验九 电池电动势法测定 氯化银的溶度积
1
一、目的要求 1、学会用电池电动势法测定氯化银 的溶度积。 2、加深对液接电势概念的理解即学 会消除液接电势的方法。
2
二、实验原理
电池电动势法是测定难溶盐溶度积的常用方 法之一。测定氯化银的溶度积,设计电池如下:
Ag(S)-AgCl(S)|KCl(α1)‖AgNO3(α1)|AgCl(S) -Ag(S)
电位滴定法测定氯离子浓度及AgCl的Ksp(PPS)
E K S ln[ Ag
]
3.终点确定方法(作图法):
三、实验内容
① 2 0 .0 0 m L 水 样 溶 液 ( 100m L烧 杯 )
② 5 0 .0 0 m L 蒸 馏 水 ( 100m L烧 杯 ) 5D 6M HN O 3 0 .5 g B a ( N O 3 ) 2
2 5 .0 0 m L H 2 O
E K RT nF ln a ( Ag
RT nF
RT nF
ln a ( Ag
)
) K
ln[ Ag
]
2.卤化银沉淀溶解平衡
Ag+来自+ X-
AgX
沉淀溶解平衡时:[Ag+]· [X-] =Ksp, 银离子与卤离子完全反应时:[Ag+]=[X-] 所以滴定终点时:[ Ag ] [ X ] 此时:
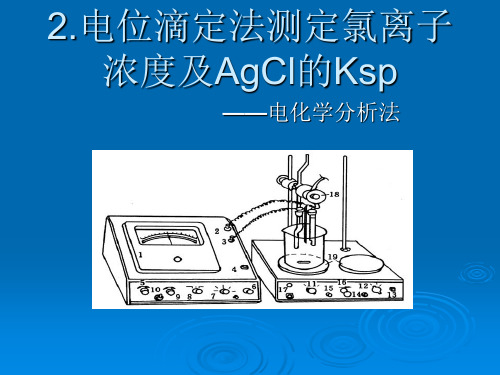
2.电位滴定法测定氯离子 浓度及AgCl的Ksp
——电化学分析法
一、实验目的
1.掌握电位滴定法测量离子浓度的一般原理; 2.学会用电位滴定法测定难溶盐的溶度积常数。
二、实验原理
1.原电池:
甘汞电极(参比电极)ㄧ待测溶液ㄧ银电极(指示电极)
银电极电极电势: 原电池电动势:
( Ag , Ag ) ( Ag , Ag )
五、思考题
1.与化学分析法中的容量法相比,电位滴定
法有何特点? 2. 如何计算滴定反应的理论电位值?
3D 6M HN O 3 0 .5 g B a ( N O 3 ) 2
搅拌 滴定 记 录 V、 E
搅拌 滴定
记 录 V、 E
9 实验九 电池电动势法测定氯化银的溶度积

一、目的要求
1、学会用电池电动势法测定氯化银 的溶度积。 2、加深对液接电势概念的理解即学 会消除液接电势的方法。
二、实验原理 电池电动势法是测定难溶盐溶度积的常用方 法之一。测定氯化银的溶度积,设计电池如下:
Ag(S)-AgCl(S)|KCl(α1)‖AgNO3(α1)|AgCl(S) -Ag(S)
四、实验步骤
1、电极制备 Ag-AgCl电极的制备方法见实验二十。 将表面经过清洁处理的自制铂丝电极作阴极, 把经金相沙纸打磨光洁的银丝电极作阳极,再镀 银溶液中进行镀银。电流控制在5mA左右,40分 钟后即可在铂丝点击上镀上白色紧密的镀层。将 镀好的银电极用蒸馏水仔细冲洗,然后以此银电 极为阳极。另选一铂丝或铂片电极为阴极,对 0.1mol.L-1盐酸溶液进行电镀,ቤተ መጻሕፍቲ ባይዱ流仍控制在5mA 左右,通过20分钟后就可在银电极表面形成AgAgCl 镀层(呈紫褐色)。此Ag-AgCl电极不用时 应置于含有少量AgCl沉淀的稀盐酸溶液中,并放 于暗处保存。
电池的电动势为两电极电势之差。
左 Ag / AgCl
2.303 RT 2.303 RT lg K SP lg aAg F F
右 Ag / AgCl
2.303 RT lg aCI F
2.303 RT 2.303 RT E 右 左 lg K SP lg aAg aCI F F
整理后得
lg K SP EF lg aAg aCI 2.303 RT
若已知银离子和氯离子的活度,测定了电池的电动势值就 能求出氯化银的溶度积。
三、仪器试剂
UJ-25型电势差计及附件 1套 超级恒温槽 1台 粗试管 2只 烧杯 3只 Ag-AgCl电极 2支 饱和硝酸钾盐桥 1支 KCl 溶液 0.1000mol/L AgNO3 溶液 0.1000mol/L 本实验所有试剂均为分析纯,溶液用重蒸馏水配置。
电导法测定氯化银溶度积及溶解度的测定

实验三 电导法测定难溶盐的溶度积和溶解度的测定作者:李俊杰摘要:以测量待测溶液的电导为基础的分析方法。
电导是电阻的倒数, 测电导实质就是测电阻。
电导分析也可以说是通过测量两电极间溶液的电阻来确定离子含量的方法。
电导分析法, 可分为直接电导法和电导滴定法两类。
直接电导法简称电导法, 它是通过测量溶液的电导值, 并根据电导与溶液中待测离子的浓度之间的定量关系来确定待测离子的含量。
电导滴定法是以测量滴定过程中电导值的突跃变化来确定滴定分析终点关键词:电导率、溶度积、溶解度。
前言:电导率是物质传送电流的能力,是电阻率的倒数。
在液体中常以电阻的倒数——电导来衡量其导电能力的大小。
水的电导是衡量水质的一个很重要的指标。
它能反映出水中存在的电解质的程度。
根据水溶液中电解质的浓度不同,则溶液导电的程度也不同。
通过测定溶液的导电度来分析电解质在溶解中的溶解度。
这就是电导仪的基本分析方法。
溶液的电导率与离子的种类有关。
同样浓度电解质,它们的电导率也不一样。
通常是强酸的电导率最大,强碱和它与强酸生成的盐类次之,而弱酸和弱碱的电导率最小。
因此,通过对水的电导的测定,对水质的概况就有了初步的了解。
一、实验目的1、掌握电导法测定难溶盐溶解度和溶度积的原理和方法。
2、加深对溶液电导概念的理解及电导测定应用的了解。
3、测定在AgCl 在25℃的溶度积和溶解度。
二、基本原理1.电导法测定难溶盐溶解度的原理难溶盐的溶解度很小,其饱和溶液可近似为无限稀,饱和溶液的摩尔电导率m Λ与难溶盐的无限稀释溶液中的摩尔电导率m ∞Λ是近似相等的,即 m Λ≈m ∞Λ在一定温度下,电解质溶液的浓度c 、摩尔电导率m Λ与电导率κ的关系为m c κΛ=(Ⅰ)难溶盐在水中的溶解度极微,其饱和溶液的电导率κ溶液实际上是盐的正、负离子和溶剂(H 2O )解离的正、负离子(H +和OH -)的电导率之和,在无限稀释条件下有κ溶液=κ盐+κ水 (Ⅱ) 因此,测定κ溶液后,还必须同时测出配制溶液所用水的电导率κ水 ,才能求得κ盐。
电位滴定分析法概述

AgCl( s ) e Ag Cl
EDTA --电极)
*
膜电极——具有选择透过性
(1)测pH的玻璃电极
Ag | AgCl , HCl (0.1 M ) | 玻璃 | H ( xM ) KCl (盐), Hg2Cl2 | Hg 例:
盐桥相连 H ( xM ) KCl (盐), Hg 2Cl2 | Hg 参比电极(甘汞电极) 允许KCl通过 Ag | AgCl , HCl (0.1M ) | 玻璃--------玻璃电极
一类自动滴定仪是将试样滴定到预 先拔好的电位,指示电极和参比电极之 间在等当点时的电位差是预先确定的, 实现调整仪器使在该电位时关闭滴定管。 另一类由马尔姆斯塔特和费特所发 展的自动滴定仪,是以电子微分法为基 础的。
其他离子的浓度测定
任何指示电极的电位显然是随对之敏感的离子活度而 不是随离子浓度而定.若用直接电位法测定离子的浓度, 则试样和标准溶液总的离子强度必须相似.
例如,用钙离子选择性电极来测定钙离子
0.059 lg Ca2 2 0.059 2 Ek lg 2 Ca Ca 2 0.059 0.059 2 Ek lg Ca lg 2 Ca 2 2 Ek
电位法测定 pH
例如:用盐桥将适当的参比电极同浸在测试溶液中的氢电 | H2 , Pt
E E参比 0.059 pH E j
令 E参比 E j 等于常数 k ,则原式变为
E k 0.059 pH
或
Ek pH 0.059
在电位滴定法中,终点是由当加入滴定剂造成相 当大的电位变化时 ,确定滴定剂加入的体积来检 出的.此法能用于滴定目的的所有反应:酸碱反应, 氧化还原反应,沉淀反应以及络合物形成反应。
留铅灰吹—电位滴定法测试铅精矿中高含量的银

留铅灰吹—电位滴定法测试铅精矿中高含量的银
电位滴定法是一种常用的分析方法,特别适用于测定金属离子的含量。
在分析铅精矿
中的高含量银时,电位滴定法也是一种比较可靠的方法。
首先需要进行样品的制备工作。
将铅精矿粉碎成细粉,取样3克,并加入50 ml 10% HCl 溶液,加热至沸腾并持续加热30 min。
之后过滤将溶液转移到 200 ml 的容量瓶中,加满水,摇匀均匀混合。
测试时需要用到电位滴定仪和相关的试剂,包括:银硝酸标准溶液、甲酸钠标准溶液、平衡KCl溶液、KBr指示剂等。
取25ml 上述制备好的溶液, 加入 10ml 甲酸钠标准溶液, 加 5% KBr 指示剂 1 滴,然后用银硝酸标准溶液滴定至终点。
银离子与制备的甲酸钠溶液中的钠离子反应生成沉淀,直到反应完全发生并消耗完甲酸钠,在终点处发生变化,指示剂从紫色转变为黄色。
可以根据标准曲线来计算出样品中的银含量的浓度。
在实验中如果溶液浓度较高,需要进行稀释来使其达到滴定的范围。
同时,样品中的
其他离子也可能会对分析造成干扰,需要对试剂进行正确的选择和反应条件进行优化。
此外,在实验中需要注意一些安全事项,如佩戴好安全实验室用品,避免试剂接触皮肤和眼睛。
综上,电位滴定法是比较可靠和精确的测定银含量的方法。
但是也需要针对不同的样
品条件和实验环境进行优化和改进。
氯化银溶度积常数的测定

氯化银溶度积常数的测定一、实验目的1.了解难溶电解质溶度积常数的测定方法及原理;2.学会电导率仪的使用;3.掌握电导法测定难溶电解质的溶度积常数。
二、实验原理氯化银是难溶电解质,其饱和溶液中存在沉淀–溶解平衡:AgCl Ag+ + Cl–若难溶电解质AgCl在纯水中的溶解度为c(AgCl),则其溶度积常数可表示为:K sp(AgCl) = [Ag+]·[Cl–] = [c(AgCl)]2不难看出,只需测出[Ag+]、[Cl–]、c(AgCl) 中的任何一个,即可求出AgCl的溶度积常数K sp(AgCl)。
由于AgCl的溶解度很小,其饱和溶液可看作无限稀释的溶液,离子间的影响可忽略不计。
这时,溶液的摩尔电导率Λm为极限摩尔电导率Λm∞,而极限摩尔电导率可通过查资料得知(表1为25℃时无限稀释溶液中离子的极限摩尔电导率)。
表1 无限稀释溶液中离子的极限摩尔电导率(25℃)由于摩尔电导率Λm与电导率k及溶液浓度c之间存在关系式:Λm= k/c,这样通过测AgCl饱和溶液的电导率求得c(AgCl),进而可计算出K sp(AgCl)。
需要注意的是:实验测得的AgCl饱和溶液的电导率包括水的电导率,计算时应扣除。
三、实验仪器及试剂烧杯、量筒、电导率仪、恒温水浴锅0.1 mol⋅L–1 AgNO3溶液、0.1 mol⋅L–1HCl溶液四、实验内容1.AgCl饱和溶液的制备0.1 mol⋅L–1 AgNO3溶液、0.1 mol⋅L–1 HCl溶液各取10 mL,在不断搅拌的情况下,将AgNO3溶液慢慢滴加到HCl溶液中,然后将盛有沉淀的烧杯置于沸水浴中加热,搅拌10 min,静置冷却20 min,去掉上清液,用近沸的蒸馏水洗涤沉淀至少5次,最后向沉淀中加40 mL蒸馏水,煮沸3~5 min,并不断搅拌,冷却至室温。
2.AgCl溶度积常数K sp(AgCl) 的测定1)用电导率仪测定蒸馏水的电导率。
2)用电导率仪测定制得的AgCl饱和溶液的电导率。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电位滴定法测定AgCl的K sp
一、实验目的
1.掌握电位滴定法测量离子浓度的一般原理;
2.学会用电位滴定法测定难溶盐的溶度积常数。
二、实验原理
当银丝电极插入含有Ag+的溶液时,其电极反应的能斯特响应可表示为:
(α代表活度,当溶液浓度很小时可用浓度代替。
)
如果与一参比电极组成电池可表示为:
(汞活泼性比银大开始时汞会把银离子置换出来所以汞是负极银是正极。
Ej表示液体接界电位,一般很小,可以忽略。
并且,盐桥是减弱液接电位的有效手段。
)
进一步简化为:
式中包括和r(Ag+)常数项。
银电极不仅可指示溶液中Ag+的浓度变化,而且也能指示与Ag+反应的阴离子的浓度变化。
例如,卤素离子。
本实验利用Cl-与银离子生成沉淀的溶度积K sp非常小,在化学计量点附近发生电位突跃,从而通过测量电池电动势的变化来确定滴定终点。
在终点时:
其中X-为Cl-、I-,代入终点时的滴定电池方程:
用该式即可计算出被滴定物质难溶盐的K sp。
通常的电位滴定使用甘汞或AgCl/Ag参比电极,由于它们的盐桥中含有氯离子会渗漏于溶液中,不适合在这个实验中使用,故可选用甘汞双液接硝酸盐盐桥,或硫酸亚汞电极。
注:当盐桥溶液不影响测定的时候选用单盐桥,否则必须选择双盐桥。
外盐桥的作用:(1)防止参比电极内盐桥的物质渗入的待测溶液中干扰测定
(2)防止待测溶液中有害物质进入内盐桥影响其电极电位
三、仪器和药品
仪器:pH/mV计,电磁搅拌器,银电极,双液接饱和甘汞电极,分析天平,容量瓶(250mL,1000mL),烧杯(150mL,250mL)
药品:AgNO3(分析纯,s),KNO3(分析纯,s),KCl(分析纯,s),K2CrO4(分析纯,s),Ba(NO3)2(分析纯,s)
四、实验内容
1.硝酸银标准溶液,0.100mol∙L-1
溶解17.00g AgNO3于1000mL去离子水中,将溶液转入棕色试剂瓶中置暗处保存。
准确称取1.8638g基准KCl,置于小烧杯中,用去离子水溶解后转入250mL容量瓶中,加水稀释至刻度,摇匀。
准确移取25.00mL KCl标准溶液于锥形瓶中,准确移取25.00mL去离子水(加几滴15% K2CrO4和几滴Ba(NO3)2,在不断摇动下,用AgNO3溶液滴定至呈现砖红色即为终点)。
根据KCl标准溶液浓度和滴定中所消耗的AgNO3体积(mL),计算AgNO3的浓度。
2.将银电极用蒸馏水冲洗干净,并浸泡在蒸馏水中。
烧杯及搅拌磁子都要用清洗干净。
3.根据滴定终点的电动势计算AgCl的K sp。
按图示安装仪器
电位滴定装置
1-银电极;2-双盐桥饱和甘汞电极;3-滴定管;4-滴定池(100mL烧杯);5-搅拌子;6-磁力搅拌器。
五、数据处理
1.按下表格式记录和处理数据:
滴入AgNO3
V/mL 电位
E/mV
△E
/mV
△V
/mL
△E/△V
/(mV/mL)
平均体
5.00 0.062
15.00 0.085 0.023 10 0.0023
20.00 0.107 0.022 5 0.0044 0.0021 0.00042
22.00 0.123
.......
2.作E~V,△E/△V~V,△2E/△V2~V滴定曲线。
3. 贴上E-V图,并标上滴定终点AgNO3的体积。
(做两条与曲线相切的直线,并且,直线与横轴的夹角为45°。
然后做一条垂直于横轴的直线,其交两条切线分别为A、B两点。
然后找到线段AB的中点,过中点做切线的平行线。
该平行线交E-V曲线于C点,则该点为滴定终点。
)
4.由实验数据计算AgNO3的浓度。
详细过程计算出AgCl的K sp。
(△2E/△V2~V曲线法确定滴定终点,曲线最高点与最低点之间的连线与横轴的交点即为滴定终点。
此方法在计算时无需作图,可直接通过内差法计算得到滴定终点的体积,比一阶微商法更准确、更简单。
在滴定终点前和终点之后找出一对△2E/△V2数值,使得这对△2E/△V2符号相反。
然后,内差求得滴定终点的体积。
根据KCl标准溶液浓度和滴定中所消耗的AgNO3体积(mL),计算AgNO3的浓度。
)
六、注意事项
1、电极使用时,电极上下端小孔的橡皮塞和橡皮帽应该拔去,以防止产生扩散电位影响测试结果。
2、电极不用时,取下盐桥套管,将电极保存在KCl溶液中,千万不能使电极干涸。
3、电极长期(半年)不用时,应把端部的橡胶帽套上,放在电极盒中保存。
4、必须保证甘汞电极下端毛细管的畅通,故在使用前应将电极下端之胶帽及电极上部的小胶皮塞拔下,让极少量的溶液从毛细管中渗出,使测定结果稳定可靠。
5、使用双液接甘汞电极时,外套管内盛饱和硝酸钾溶液(用优级纯试剂配制),外套管内溶液,每次使用前应更换新液。
硝酸钾外套管用橡皮筋与参比电极连接好。
6、双盐桥内饱和甘汞电极应装有一定高度的饱和氯化钾溶液,液体下方不能有气泡。
7、保持银棒表面清洁,必要时可用细砂皮擦亮银棒表面,再用蒸馏水洗净。
用完后,也用蒸馏水洗净擦干后保存。
(前6条为甘汞电极使用注意事项,第7条为银电极注意事项)
七、附录:双盐桥式甘汞电极:。
