2015版中国药典微生物限度解析
2015版中国药典微生物限度记录

培养基的配制
使用容器
配制培养基使用的容器应该是玻璃器皿或搪瓷器皿等。 禁用金属容器如:铁、铜、铝容器。
培养基制备方法
实验室指南
溶解培养基应当用水浴加热进行溶解。 测定pH值 矫正pH,配制培养基必须矫正pH,并进行验证。 培养基灭菌后冷却至室温( 25 ℃)进行 pH 测试。培 养基pH范围不得超过规定的正负0.2。 <高压灭菌前的pH值应比最终pH值高0.2左右>
2015版药典微生物检查法修订内容——结果判断 微生物计数法和控制菌检查法结果判断
不再规定复试,通过实验室调查、回顾、分析结果 的准确性。
限度标准以指数方式表示:
10的一次方cfu:可接受的最大限度为20;
10 的二次方 cfu ,可接受的最大限度为 200 ;以此类 推。
2015版药典通则非无菌产品微生物限度标准增订内容
4.微生物限度标准
5.控制菌检查:保留部分生化试验 6. 修订后,控制指标更合理,计数方法及标准合理、 准确,反映真实污染情况
2015版药典微生物检查法修订内容——环境要求
目前我国药品微生物检测对环境的要求与国际标准 分级不一致。 国际要求:只要洁净环境分为 A 级、 B 级、 C 级、 D 级。 A (百级)、 B (千级)、 C (万级)、 D (十万级)。 协调案要求:试验在经过设计的可避免外来微生物 污染供试品的环境下进行。 我国修订后药品微生物限度检查对检测环境的要求: 无菌环境下符合微生物技术检验要求,单向流空气 区域内进行。
(二)2015版药典微生物检查法修订内容——环境要求
1. 强调了“微生物实验的各项工作应在专属的区域 进行,以降低交叉污染、假阳性结果和假阴性结 果的风险”。 2.无菌检查 修订前 万级(C级)下局部百级(A)或隔离器 修订后 B+A级或建议D级背景下隔离器 3.微生物限度检查 修订前 万级(C)下局部百级(A) 修订后 不低于D级背景下的B级单向流空气区域内 进行。
2015版中国药典微生物限度
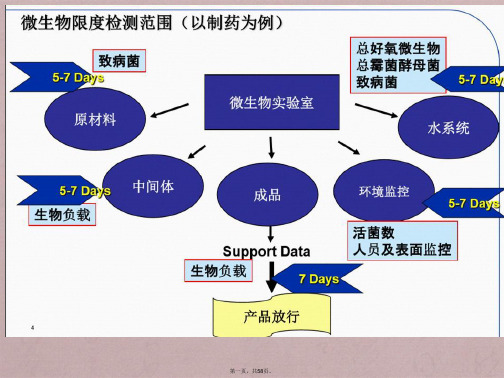
1.4.2供试品检查
• 供试液制备
– 根据供试品的理化特性与生物学特性,采取适宜 的方法制备供试液。供试液制备若需加温时,应 均匀加热,且温度不应超过 45℃。供试液从制 备至加入检验用培养基,不得超过 1小时。
– 常用的供试液制备方法如下。如果下列供试液 制备方法经确认均不适用,应建立其他适宜的方 法。
• 使用选择性培养基时,应进行培养基适用性检查 。若采用MPN 法,测定结果为需氧菌总数。
第二十七页,共58页。
第十页,共58页。
1.3.1菌液制备及使用
试验菌株
金黄色葡萄球菌 〔CMCC(B) 26 003)〕
铜绿假单胞菌 〔CMCC(B)10 104〕
枯草芽孢杆菌 〔CMCC(B) 63 501〕
白色念珠菌 〔CMCC(F) 98 001〕
试验菌液的制备 胰酪大豆胨琼脂培养基或胰酪大豆胨液体培 养基 【10版:营养肉汤或营养琼脂培养基】 30~35℃,18~24小时
第一页,共58页。
第二页,共58页。
1.非无菌产品微生物限度检查: ----微生物计数法
1.1 总则:环境、要求 1.2 计数方法:平皿法、薄膜过滤法、最可能数法(
MPN法)
1.3 计数培养基适用性检查和供试品计数方法适用性试 验:菌种及菌液制备、培养基适用性检查、计数 方法适用性试验。
1.4 供试品检查:检验量、供试品检查 1.5 结果判断 1.6 稀释液、冲洗液及培养基
致,判该培养基的适用性检查符合规定。
第十二页,共58页。
1.3.2计数培养基适用性检查【15版】
需氧菌总数 计数
霉菌和酵母 菌总数计数
金黄色葡萄球菌 胰酪大豆胨琼脂培养基或 30~35 ℃
2015版中国药典微生物限度解析

(MPN法) 1.3 计数培养基适用性检查和供试品计数方法适用
性试验:菌种及菌液制备、培养基适用性检查 、计数方法适用性试验。 1.4 供试品检查:检验量、供试品检查 1.5 结果判断 1.6 稀释液、冲洗液及培养基
1.1 总则:
• 微生物计数法系用于能在有氧条件下生长的嗜温 细菌和真菌的计数。
• 当本法用于检查非无菌制剂及其原、辅料等是否 符合规定的微生物限度标准时,应按规定进行检 验,包括样品的取样量和结果的判断等。除另有 规定外,本法不适用于活菌制剂的检查。
30~35 ℃ 不超过3天
20~25 ℃ 不超过5天
每一试验菌株平行制备2 管或2 个平皿;接种量50~100cfu ; 同时,用相应的对照培养基替代被检培养基进行上述试验。 结果判定:
若被检培养基上的菌落平均数不小于对照培养基上的菌落 平均数的70 %,且菌落形态大小与对照培养基上的菌 落一致,判该培养基的适用性检查符合规定。
1.3 计数培养基适用性检查和供试品计 数方法适用性试验
• 供试品微生物计数中所使用的培养基应进 行适用性检查。
• 供试品的微生物计数方法应进行方法适用 性试验【10版:方法验证】, 以确认所 采用的方法适合于该产品的微生物计数。
• 若检验程序或产品发生变化可能影响检验 结果时, 计数方法应重新进行适用性试 验。
1.3.3计数方法适用性试验
1. 供试液制备 2. 接种和稀释 3. 抗菌活性的去除与灭活 4. 供试品中微生物的回收
– 平皿法 – 薄膜过滤法 – 最可能数法(MPN 法)
5. 结果判断
1.4 供试品检查
• 1.4.1检验量
– 检验量即一次试验所用的供试品量(g、ml
2015版药典微生物限度检查法

(MPN 法),
度 30 ~ 度 30 ~
培养温度
35℃,培养 35 ℃ , 培 养
30~35℃,培
时间 18~24 时 间 不 超 过
养时间不超
小时
3 天,接种量
过 3 天,接种
不大于
量不大于
100cfu
100cfu
沙氏葡萄糖 胰酪大豆胨 沙 氏 葡 萄 胰 酪 大 豆 胨 沙 氏 葡 萄
琼脂培养基 琼 脂 培 养 糖 琼 脂 培 琼 脂 培 养 基 糖 琼 脂 培
过 3 天,接种
小时
不大于
量不大于
100cfu
100cfu
枯草芽孢杆菌 胰酪大豆胨 胰 酪 大 豆 胨
胰酪大豆胨
(Bacillus
琼脂培养基 琼脂培养基
琼脂培养基/
subtilis)
或胰酪大豆 和胰酪大豆
胰酪大豆胨
〔CMCC(B) 63 501〕 胨液体培养 胨 液 体 培 养
液体培养基
基,培养温 基,培养温
贴膏剂供试品 取供试品,去掉防粘层,将粘贴面朝上放置在无菌玻璃或塑 料器皿上,在粘贴面上覆盖一层适宜的无菌多孔材料(如无菌纱布),避免贴膏 剂粘贴在一起。将处理后的贴膏剂放入盛有适宜体积并含有表面活性剂(如聚山 梨脂 80 或卵磷脂)稀释液的容器中,振荡至少 30 分钟。必要时,用同一稀释液 将供试液进一步 10 倍系列稀释。
计数方法适用性试验 ⒈供试液制备 根据供试品的理化特性与生物学特性,采取适宜的方法制备供试液。供试液 制备若需加温时,应均匀加热,且温度不应超过 45℃。供试液从制备至加入检验 用培养基,不得超过 1 小时。 常用的供试液制备方法如下。如果下列供试液制备方法经确认均不适用,应 建立其他适宜的方法。 ⑴ 水溶性供试品 取供试品,用 pH7.0 无菌氯化钠-蛋白胨缓冲液,或 pH7.2 磷酸盐缓冲液,或胰酪大豆胨液体培养基溶解或稀释制成 1:10 供试液。 若需要,调节供试液 pH 值至 6~8。必要时,用同一稀释液将供试液进一步 10 倍系列稀释。水溶性液体制剂也可用混合的供试品原液作为供试液。 ⑵ 水不溶性非油脂类供试品 取供试品,用 pH7.0 无菌氯化钠-蛋白胨缓 冲液,或 pH7.2 磷酸盐缓冲液,或胰酪大豆胨液体培养基制备成 1:10 供试液。 分散力较差的供试品,可在稀释剂中加入表面活性剂如 0.1%的聚山梨酯 80,使 供试品分散均匀。若需要,调节供试液 pH 值至 6~8。必要时,用同一稀释液将 供试液进一步 10 倍系列稀释。 ⑶ 油脂类供试品 取供试品,加入无菌十四烷酸异丙酯使溶解,或与最少 量并能使供试品乳化的无菌聚山梨酯 80 或其他无抑菌性的无菌表面活性剂充分 混匀。表面活性剂的温度一般不超过 40℃(特殊情况下,最多不超过 45℃), 小心混合,若需要可在水浴中进行,然后加入预热的稀释液使成 1∶10 供试液, 保温,混合,并在最短时间内形成乳状液。必要时,用稀释液或含上述表面活性 剂的稀释液进一步 10 倍系列稀释。 ⑷需用特殊方法制备供试液的供试品 膜剂供试品 取供试品,剪碎,加 pH7.0 无菌氯化钠-蛋白胨缓冲液,或 pH7.2 磷酸盐缓冲液,或胰酪大豆胨液体培养基,浸泡,振摇,制成 1∶10 的供试液。 若需要,调节供试液 pH 值至 6~8。必要时,用同一稀释液将供试液进一步 10 倍系列稀释。 肠溶及结肠溶制剂供试品 取供试品,加入 pH6.8 无菌磷酸盐缓冲液(用于 肠溶制剂)或 pH7.6 无菌磷酸盐缓冲液(用于结肠溶制剂),置 45℃水浴中,振
中国药典2015年版-微生物限度检查解析

药品微生物检验的现状与发展
• 历史沿革 • 新中国第一部药典(1953年版)收载了无菌检查法 • 我国开展药品微生物限度检查始于1972年。 • 1978年颁发了第一个“药品卫生标准”。 • 1995年版中国药典首次收载了微生物限度检查法,2000年
版收载了微生物限度标准。 • 从第八届药典委员会(2005版中国药典)开始设立微生物
控制菌检查法修订解析
本检查法可采用替代的微生物检查法,包括自动检测方法, 但必须证明替代方法等效于药典规定的检查方法---新增内 容
在各控制菌项下:生化试验和“应进行分离、纯化及适宜的 鉴定试验”改为较少的生化试验或“采用其他适宜方法进 一步鉴定”---较大改变
检查项目
菌种的传代、保藏与管理
控制程序
原辅料、中药提取物和中 药饮片,
参考制剂的要求及生产工艺特点设置 控制军检查要求
《中国药典》2015年版-非无菌产品微生物检查法
• 格式变化 • 通用要求
检测环境 供试品前处理---抑菌性去除 微生物计数法使用范围---可采用替代检查方法 微生物计数定义变化--需氧菌总数(胰酪大豆胨琼脂), 霉菌和酵母菌总数(沙氏葡萄糖琼脂)
人员
• 相关的教育背景 • 应经过生物安全方面培训,保证安全 • 不断地继续培训,保证知识与技能不断地更新 • 熟悉、规范理解和执行 • 能力评估-通过质量控制、能力验证等 • 培训、考核等档案
专业委员会。
药品微生物检验的现状与发展
中国药典的标准修订:
• 2005版
• 将按剂型制定 限度修订为按 给药途径制定 限度
• 强调微生物检 验的“方法验 证”
• 无菌检查培养 时间与国外接 轨
• 2010版
• 质量标准体系 基本与国外接 轨
2015年版《中国药典》微生物限度检查法洁净环境及计数培养基修订分析探讨

2015年版《中国药典》微生物限度检查法洁净环境及计数培养基修订分析探讨2015年版《中国药典》将于2015年7月起开始实施:该版药典对微生物限度检查法检查时的洁净环境、培养基及检查方法进行了修订。
其中洁净环境要求由10000级背景下的100级单向流(2010年版)修订为受控背景下的不低于B 级环境(2015年版);计数培养基由营养琼脂/玫瑰红钠琼脂培养基(2010年版)修订为胰酪大豆琼脂培养基/沙氏葡萄糖琼脂培养基(2015年版)。
该文旨在分析2015年版中国药典与2010年版中国药典在非无菌产品微生物限度检查时洁净环境与计数培养基的异同点,为更规范执行2015年版中国药典提供参考。
标签:中国药典;2015年版;2010年版;洁净环境;培养基[Abstract] The Chinese Pharmacopoeia (2015 edition)will be implemented in July,2015 which have revised in some part,including clean environment and medium in microbial limit test. The clean environment was rectified from 10000 background plus 100 degree to control background plus A or B environment. The counting medium was changed from nutrient medium and rose bengal agar to trypticase soy agar (TSA)medium and sabouraud dextrose agar medium. In this part,we analyzed the differences of the clean environment and counting medium between 2010 and 2015 edition Chinese Pharmacopoeia for normative enforcement.[Key words] Chinese Pharmacopoeia;2010 edition;2015 edition;Clean environment;Medium微生物限度检查是用于检查非无菌制剂及其原料、辅料等是否符合规定的方法[1-2]。
中国药典2015版 四部 9202 非无菌产品微生物限度检查指导原则

为更好应用非无菌产品微生物限度检查:微生物计数法(通则1105)、非无菌产品微生物限度检查:控制菌检查法(通则1106)及非无菌药品微生物限度标准(通则110 7),特制定本指导原则。
非无菌药品中污染的某些微生物可能导致药物活性降低,甚至使药品丧失疗效,从而对患者健康造成潜在的危害。
因此,在药品生产、贮藏和流通各个环节中,药品生产企业应严格遵循GMP的指导原则,以降低产品受微生物污染程度。
非无菌产品微生物计数法、控制菌检查法及药品微生物限度标准可用于判断非无菌制剂及原料、辅料等是否符合药典的规定,也可用于指导制剂、原料、辅料等微生物质量标准的制定,及指导生产过程中间产品微生物质量的监控。
本指导原则将对微生物限度检查方法和标准中的特定内容及应用做进一步的说明。
1. 非无菌产品微生物限度检查过程中,如使用表面活性剂、灭活剂及中和剂,在确定其能否适用于所检样品及其用量时,除应证明该试剂对所检样品的处理有效外,还须确认该试剂不影响样品中可能污染的微生物的检出(即无毒性),因此无毒性确认试验的菌株不能仅局限于验证试验菌株,而应当包括产品中可能污染的微生物。
2. 供试液制备方法、抑菌成分的消除方法及需氧菌总数、霉菌和酵母菌总数计数方法应尽量选择微生物计数方法中操作简便、快速的方法,同时,所选用的方法应避免损伤供试品中污染的微生物。
对于抑菌作用较强的供试品,在供试品溶液性状允许的情况下,应尽量选用薄膜过滤法进行试验。
3. 对照培养基系指按培养基处方特别制备、质量优良的培养基,用于培养基适用性检查,以保证药品微生物检验用培养基的质量。
对照培养基由中国食品药品检定研究院研制及分发。
4. 进行微生物计数方法适用性试验时,若因没有适宜的方法消除供试品中的抑菌作用而导致微生物回收的失败,应采用能使微生物生长的更高稀释级供试液进行方法适用性试验。
此时更高稀释级供试液的确认要从低往高的稀释级进行,最高稀释级供试液的选择根据供试品应符合的微生物限度标准和菌数报告规则而确定,如供试品应符合的微生物限度标准是lg需氧菌总数不得过10 3 cfu,那么最高稀释级是1:10 3 。
2015年药典 通则1105 非无菌产品微生物限度检查

2015年药典通则1105 非无菌产品微生物限度检查环境中的微生物数量是非常重要的,因为它们可能会对产品的质量和安全性产生影响。
微生物计数法是一种用于检查非无菌制剂及其原、辅料等是否符合规定的微生物限度标准的方法。
这种方法适用于能在有氧条件下生长的嗜温细菌和真菌的计数。
但是,除非另有规定,它不适用于活菌制剂的检查。
在进行微生物计数试验之前,必须确保试验环境符合微生物限度检查的要求。
检验全过程必须严格遵守无菌操作,防止再污染,防止污染的措施不得影响供试品中微生物的检出。
单向流空气区域、工作台面及环境应定期进行监测。
如果供试品有抗菌活性,应尽可能去除或中和。
供试品检查时,如果使用了中和剂或灭活剂,应确认其有效性及对微生物无毒性。
如果在供试液制备时使用了表面活性剂,应确认其对微生物无毒性以及与所使用中和剂或灭活剂的相容性。
计数方法包括平皿法、薄膜过滤法和最可能数法(Most-Probable-Number Method,简称MPN法)。
MPN法用于微生物计数时精确度较差,但对于某些微生物污染量很小的供试品,MPN法可能是更适合的方法。
在选择计数方法时,应根据供试品理化特性和微生物限度标准等因素选择计数方法,检测的样品量应能保证所获得的试验结果能够判断供试品是否符合规定。
所选方法的适用性须经确认。
供试品微生物计数中所使用的培养基应进行适用性检查。
供试品的微生物计数方法应进行方法适用性试验,以确认所采用的方法适合于该产品的微生物计数。
如果检验程序或产品发生变化可能影响检验结果时,计数方法应重新进行适用性试验。
表1给出了试验菌液的制备和使用。
计数培养基适用性检查和计数方法适用性试验的试验菌株和试验菌液的制备也在表中给出。
在进行试验时,应按照表中的要求进行操作。
然后加入适量的pH7.0无菌氯化钠-蛋白胨缓冲液,或pH7.2磷酸盐缓冲液,或胰酪大豆胨液体培养基,用振荡器在恒温条件下搅拌,制成1:10供试液。
必要时,用同一稀释液将供试液进一步10倍系列稀释。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《中国药典》2015年版修订后将分为三个附录: – 1、非无菌产品微生物限度检查:微生物计数法 – 2、非无菌产品微生物限度检查:控制菌检查法 – 3、非无菌药品微生物限度标准
1.非无菌产品微生物限度检查: ----微生物计数法
1.1 总则:环境、要求 1.2 计数方法:平皿法、薄膜过滤法、最可能数法
1.4.2供试品检查
• 供试液制备
– 根据供试品的理化特性与生物学特性,采取适 宜的方法制备供试液。供试液制备若需加温 时,应均匀加热,且温度不应超过 45℃。供试 液从制备至加入检验用培养基,不得超过 1小 时。
– 常用的供试液制备方法如下。如果下列供试 液制备方法经确认均不适用,应建立其他适 宜的方法。
每一试验菌株平行制备2 管或2 个平皿;接种量不大于100cfu ; 同时,用相应的对照培养基替代被检培养基进行上述试验。 结果判定:
被检固体培养基上的菌落平均数与对照培养基上的菌落平 均数的比值应在0.5-2 范围内,且菌落形态大小应与对 照培养基上的菌落一致;被检液体培养基管与对照培 养基管比较,试验菌应生长良好。
• 本检查法可采用替代的微生物检查法,包括自动 检测方法,但必须证明替代方法等效于药典规定 的检查方法。
不适用于活菌制剂的检查
1.1 总则:
• 环境: – 微生物计数试验环境应符合微生物限度检查的要 求。(在不低于GMP 现行版要求的D 级洁净环境 、局部洁净度不低于B 级的单向流空气区域内进 行)【10版:在环境洁净度10000级下的局部洁净 度100级的单向流空气区域内】【 20版:不低于 D级背景下的生物安全柜或B级洁净区域内进行】 – 检验全过程必须严格遵守无菌操作,防止再污染 ,防止污染的措施不得影响供试品中微生物的检 出。 – 单向流空气区域、工作台面及环境应定期进行监 测。
• 使用选择性培养基时,应进行培养基适用性检查 。若采用MPN 法,测定结果为需氧菌总数。
1.5结果判断
• 各品种项下规定的微生物限度标准解释如下:
– 101cfu: 可接受的最大菌数为20; – 102cfu: 可接受的最大菌数为200; – 103cfu: 可接受的最大菌数为2000:依此类推。
菌数报告规则
– 需氧菌总数测定宜选取平均菌落数小于 300cfu 的稀释级、霉菌和酵母菌总数测定宜 选取平均菌落数小于100cfu 的稀释级,作为 菌数报告(取两位有效数字)的依据。取最 高的平均菌落数,计算1g、1ml 或10 cm² 供 试品中所含的微生物数。
– 如各稀释级的平皿均无菌落生长,或仅最低 稀释级的平板有菌落生长,但平均菌落数小 于1 时,以﹤1 乘以最低稀释倍数的值报告菌 数。
1.1 总则:
• 如供试品有抗菌活性,应尽可能去除或中和。供 试品检查时, 若使用了中和剂或灭活剂,应确认 其有效性及对微生物无毒性。
• 供试液制备时如果使用了表面活性剂,应确认其 对微生物无毒性以及与所使用中和剂或灭活剂的 相容性。
1.2计数方法:
• 平皿法 • 薄膜过滤法 • 最可能数法(Most-Probable-Number Method,
沙氏葡萄糖琼脂培养基或沙氏葡萄糖液体培 养基,20~25℃,2~3 天
黑曲霉 〔CMCC(F) 98 003〕
沙氏葡萄糖琼脂培养基或马铃薯葡萄糖琼脂
培养基 ,20~25℃,5~7天 ,或直接获得 丰富孢子
菌液制备后若在室温下放置,应在2 小时内使用;若保存在2 ~8℃,可在24小时内使用。稳定的黑曲霉孢子悬液可保存在2 ~8℃,在验证过的贮存期内使用。
• 按计数方法适用性试验确认的计数方法进行供试 品中需氧菌总数、霉菌和酵母菌总数的测定。
• 胰酪大豆胨琼脂培养基或胰酪大豆胨液体培养基 用于测定需氧菌总数;
• 沙氏葡萄糖琼脂培养基用于测定霉菌和酵母菌总 数。
• 阴性对照试验 – 以稀释剂代替供试液进行阴性对照试验,阴 性对照试验应无菌生长。如果阴性对照有菌 生长,应进行偏差调查。
– 培养和计数 培养条件和计数方法同平皿计数 法,每张滤膜上的菌落数应不超过100cfu。
• 菌数报告规则
– 以相当于 1g、1ml 或10cm2 供试品的菌落数 报告菌数;若滤膜上无菌落生长,以﹤1 报 告菌数(每张滤膜过滤1g、1ml 或10cm2 供 试品),或﹤1 乘以最低稀释倍数的值报告菌 数。
1.3.3计数方法适用性试验
1. 供试液制备 2. 接种和稀释 3. 抗菌活性的去除与灭活 4. 供试品中微生物的回收
– 平皿法 – 薄膜过滤法 – 最可能数法(MPN 法)
5. 结果判断
1.4 供试品检查
• 1.4.1检验量
– 检验量即一次试验所用的供试品量(g、ml
或cm²)。
– 除另有规定外,一般供试品的检验量为10g 或
1.3 计数培养基适用性检查和供试品计 数方法适用性试验
• 供试品微生物计数中所使用的培养基应进 行适用性检查。
• 供试品的微生物计数方法应进行方法适用 性试验, 以确认所采用的方法适合于该 产品的微生物计数。
• 若检验程序或产品发生变化可能影响检验 结果时, 计数方法应重新进行适用性试 验。
1.3 计数培养基适用性检查和供试品计 数方法适用性试验
10ml;膜剂为100cm²;贵重药品、微量包
装药品的检验量可以酌减。[20版增订了小剂 量,低含量、小批量]检验时,应从2 个以上最 小包装单位中抽取供试品,大蜜丸还不得少于 4 丸,膜剂还不得少于4 片。 – 一般应随机抽取供试品,取规定容器数,混 合,取规定量供试品进行检验。
1.4.2供试品检查
1.4.2供试品检查
• 供试液制备
– ⑶油脂类供试品
• 取供试品,加入无菌十四烷酸异丙酯使溶 解,或与最少量并能使供试品乳化的无菌 聚山梨酯 80或其他无抑菌性的无菌表面 活性剂充分混匀。表面活性剂的温度一般 不超过 40℃(特殊情况下,最多不超过 45℃),小心混合,若需要可在水浴中进 行,然后加入预热的稀释液使成 1∶10供 试液,保温,混合,并在最短时间内形成 乳状液。必要时,用稀释液或含上述表面 活性剂的稀释液进一步 10倍系列稀释。
• 需氧菌总数是指胰酪大豆胨琼脂培养基上生长的 总菌落数(包括真菌菌落数);
• 霉菌和酵母菌总数是指沙氏葡萄糖琼脂培养基上 生长的总菌落数(包括细菌菌落数)。
• 若因沙氏葡萄糖琼脂培养基上生长的细菌使霉菌 和酵母菌的计数结果不符合微生物限度要求,可 使用含抗生素(如氯霉素、庆大霉素)的沙氏葡 萄糖琼脂培养基或其他选择性培养基(如玫瑰红 钠琼脂培养基)进行霉菌和酵母菌总数测定。
(MPN法) 1.3 计数培养基适用性检查和供试品计数方法适用
性试验:菌种及菌液制备、培养基适用性检查 、计数方法适用性试验。 1.4 供试品检查:检验量、供试品检查 1.5 结果判断 1.6 稀释液、冲洗液及培养基
1.1 总则:
• 微生物计数法系用于能在有氧条件下生长的嗜温 细菌和真菌的计数。
• 当本法用于检查非无菌制剂及其原、辅料等是否 符合规定的微生物限度标准时,应按规定进行检 验,包括样品的取样量和结果的判断等。除另有 规定外,本法不适用于活菌制剂的检查方法适用性试验确认 的方法进行供试液制备。取相当于1g、1ml 或10 cm²供试品的供试液,若供试品所含的 菌数较多时,可取适宜稀释级的供试液,照 方法适用性试验确认的方法加至适量稀释液 中,立即过滤,冲洗,冲洗后取出滤膜,菌 面朝上贴于胰酪大豆胨琼脂培养基或沙氏葡 萄糖琼脂培养基上培养。
1.3.1菌液制备及使用
试验菌株
试验菌液的制备
金黄色葡萄球菌 〔CMCC(B) 26 003)〕
铜绿假单胞菌 〔CMCC(B)10 104〕
枯草芽孢杆菌 〔CMCC(B) 63 501〕
白色念珠菌 〔CMCC(F) 98 001〕
胰酪大豆胨琼脂培养基或胰酪大豆胨液体培 养基 30~35℃,18~24小时
2.1总则
• 控制菌检查法系用于在规定的试验条件下,检查 供试品中是否存在特定的微生物。
1.4.2供试品检查
• 供试液制备
– ⑷需用特殊方法制备供试液的供试品
• 膜剂供试品 • 肠溶及结肠溶制剂供试品 • 气雾剂、喷雾剂供试品[20版专用器具] • 贴膏剂供试品
1.4.2供试品检查
1. 平皿法
– 平皿法包括倾注法和涂布法。 – 除另有规定外,取规定量供试品,按方法适用性
试验确认的方法进行供试液制备和菌数测定,每 稀释级每种培养基至少制备2个平皿。 – 培养和计数 除另有规定外,胰酪大豆胨琼脂培养 基平板在30~35℃培养3~5天,沙氏葡萄糖琼脂 培养基平板在20~25℃培养5 ~7天, 观察菌落 生长情况,点计平板上生长的所有菌落数,必要时 可适当延长培养时间至7 天进行菌落计数并报告 。菌落蔓延生长成片的平皿不宜计数。点计菌落 数后,计算各稀释级供试液的平均菌落数,按菌 数报告规则报告菌数。 – 若同稀释级两个平皿的菌落数平均值不小于15, 则两个平皿的菌落数不能相差1 倍或以上。
1.4.2供试品检查
• 供试液制备
– ⑵ 水不溶性非油脂类供试品
• 取供试品, 用 pH7.0 无菌氯化钠-蛋白胨 缓冲液,或 pH7.2 磷酸盐缓冲液,或胰酪 大豆胨液体培养基制备成 1:10 供试液。 分散力较差的供试品,可在稀释液中加入 表面活性剂如 0.1%的聚山梨酯 80,使供 试品分散均匀。若需要,调节供试液 pH 值至 6~8。必要时,用同一稀释液将供 试液进一步 10倍系列稀释。
1.3.2计数培养基适用性检查【15版】
需氧菌总数 计数
霉菌和酵母 菌总数计数
金黄色葡萄球菌 铜绿假单胞菌 枯草芽孢杆菌
胰酪大豆胨琼脂培养基 或 胰酪大豆胨液体培养基
白色念珠菌
胰酪大豆胨琼脂培养基
黑曲霉
白色念珠菌
沙氏葡萄糖琼脂培养基
