高一化学无机推断综合练习题(附答案)
高中化学10道无机推断练习题(附答案)

高中化学10道无机推断练习题_一、推断题1.某课外学习小组对日常生活中不可缺少的调味品M进行探究。
已知C可在D中燃烧发出苍白色火焰。
M与其他物质的转化关系如下图所示(部分产物、反应条件已略去):(1)常温下,用惰性电极电解M溶液(足量)发生反应的离子方程式为___________________,电解一段时间后,让溶液复原的方法为______________________,若M溶液为0.5L,电解一段时间后,两极共生成气体1.12L(已折算为标准状况下的体积),则电解后溶液的pH为________(忽略溶液的体积变化)。
(2)若A是一种常见的难溶于水的酸性氧化物,可用于制造玻璃,则E溶液的俗称是_____________。
(3)若A是CO2气体,将一定量的A通入B溶液,得到溶液W,再向溶液W中滴入盐酸,相关量如图所示,则溶液W中的溶质及其物质的量分别为__________________、______________________。
(4)若A是一种化肥。
A和B反应可生成气体E,E与D相遇产生白烟,工业上可利用E与D的反应检查输送D的管道是否泄漏,是因为E与D可发生反应:____________________(写化学方程式)。
2.已知A为淡黄色固体,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀。
(1)物质A的化学式为 ________。
(2)H在潮湿空气中变成M的实验现象是_____________________,化学方程式为______________________。
(3)A和水反应生成B和C的离子方程式为_______________,列出A的一种重要用途_________。
(4)反应①的离子方程式为________________________。
3.A-I分别表示中学化学中的常见物质,它们之间的相互转化关系如下图所示(部分反应物、生成物没有列出),且已知G是一种两性氧化物,A、B、C、D、E、F六种物质中均含有同一种元素,F 为红褐色沉淀。
高考化学高无机综合推断综合练习题及答案

高考化学高无机综合推断综合练习题及答案一、无机综合推断1.A、B、C、W均为中学常见的物质,它们之间有如图所示的转化关系(其他产物及反应条件已略去,反应可以在水溶液中进行)。
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系:(1)若A、B、C三种物质都含有一种金属元素,且B为两性物质,W俗称苛性钠。
①A、B、C三种物质中所含有的金属元素单质与W反应的化学方程式为_______________。
②A溶液一步转化为C溶液的反应离子方程式为________________。
(2)若X是一种黄绿色的气体,Y的饱和溶液滴入沸水中能生成红褐色胶体。
①检验溶液Z是否变质最灵敏的一种试剂是____________________(名称);②一定条件下W与水反应的化学方程式_______________________________。
(3)X常温下为气体化合物,Z是一种红棕色气体,X气体的检验方法____________________,X转化为Y的化学方程式为______________________;(4)X为一元强碱溶液,W是形成酸雨的主要气体。
①则Y到Z的离子方程式为________________________________________;②请画出向含0.01molX和0.01molY的溶液中逐滴加入0.1mol/L稀盐酸的体积和生成气体的物质的量的关系的图像___________。
【答案】2Al+2NaOH+2H2O =2NaAlO2 +H2 Al3-+ 4OH- =AlO2- + 2H2O 硫氰化钾溶液 3Fe + 4H2O(g) === Fe3O4 + 4H2使湿润的红色石蕊试纸变蓝(或遇蘸有浓盐酸的玻璃棒产生白烟)4NH3+5O24NO+6H2O SO32-+SO2+H2O=2HSO3-【解析】【分析】W为NaOH。
B为两性物质且含有一种金属元素,确定该金属元素为铝元素,因在溶液中产生了B,所以B为Al(OH)3。
人教版高中化学必修一《无机推断》练习题.docx
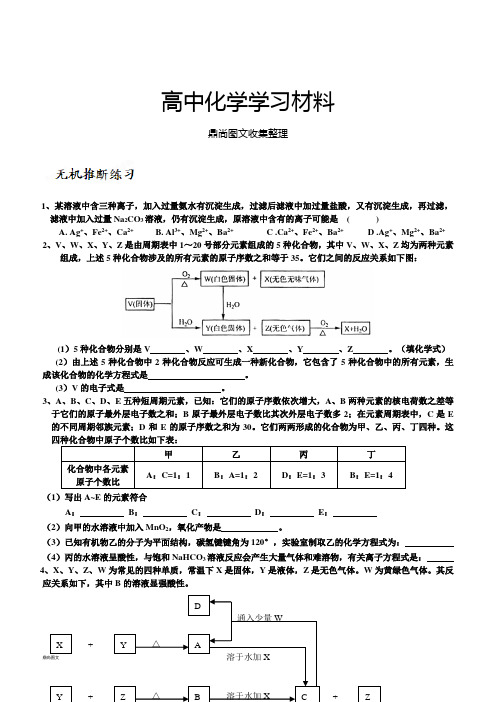
高中化学学习材料鼎尚图文收集整理1、某溶液中含三种离子,加入过量氨水有沉淀生成,过滤后滤液中加过量盐酸,又有沉淀生成,再过滤,滤液中加入过量Na 2CO 3溶液,仍有沉淀生成,原溶液中含有的离子可能是 ( )A. Ag +、Fe 2+、Ca 2+B. Al 3+、Mg 2+、Ba 2+ C .Ca 2+、Fe 2+、Ba 2+ D .Ag +、Mg 2+、Ba 2+ 2、V 、W 、X 、Y 、Z 是由周期表中1~20号部分元素组成的5种化合物,其中V 、W 、X 、Z 均为两种元素组成,上述5种化合物涉及的所有元素的原子序数之和等于35。
它们之间的反应关系如下图:(1)5种化合物分别是V 、W 、X 、Y 、Z 。
(填化学式) (2)由上述5种化合物中2种化合物反应可生成一种新化合物,它包含了5种化合物中的所有元素,生成该化合物的化学方程式是 。
(3)V 的电子式是 。
3、A 、B 、C 、D 、E 五种短周期元素,已知:它们的原子序数依次增大,A 、B 两种元素的核电荷数之差等于它们的原子最外层电子数之和;B 原子最外层电子数比其次外层电子数多2;在元素周期表中,C 是E 的不同周期邻族元素;D 和E 的原子序数之和为30。
它们两两形成的化合物为甲、乙、丙、丁四种。
这四种化合物中原子个数比如下表:甲 乙 丙 丁 化合物中各元素原子个数比A :C=1:1B :A=1:2D :E=1:3B :E=1:4(1)写出A~E 的元素符合A :B :C :D :E : (2)向甲的水溶液中加入MnO 2,氧化产物是 。
(3)已知有机物乙的分子为平面结构,碳氢键键角为120°,实验室制取乙的化学方程式为: (4)丙的水溶液呈酸性,与饱和NaHCO 3溶液反应会产生大量气体和难溶物,有关离子方程式是: 4、X 、Y 、Z 、W 为常见的四种单质,常温下X 是固体,Y 是液体,Z 是无色气体。
W 为黄绿色气体。
高中化学无机推断题带答案及高中化学无机推断题带答案解析
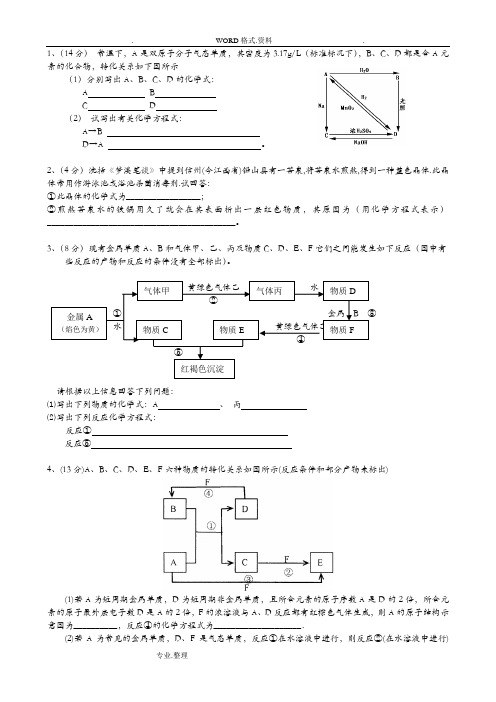
1、(14分) 常温下,A 是双原子分子气态单质,其密度为3.17g/L (标准标况下),B 、C 、D 都是含A 元素的化合物,转化关系如下图所示(1)分别写出A 、B 、C 、D 的化学式:A B C D (2) 试写出有关化学方程式:A →B D →A 。
2、(4分)沈括《梦溪笔谈》中提到信州(今江西省)铅山县有一苦泉,将苦泉水煎熬,得到一种蓝色晶体.此晶体常用作游泳池或浴池杀菌消毒剂.试回答: ①此晶体的化学式为_________________;②煎熬苦泉水的铁锅用久了就会在其表面析出一层红色物质,其原因为(用化学方程式表示)___________________________________________。
3、(8分)现有金属单质A 、B 和气体甲、乙、丙及物质C 、D 、E 、F 它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
黄绿色气体乙 水 ② ① 金属 B ③ 水 黄绿色气体乙 ④ ⑤请根据以上信息回答下列问题:⑴写出下列物质的化学式:A 、 丙 ⑵写出下列反应化学方程式:反应① 反应⑤4、(13分)A 、B 、C 、D 、E 、F 六种物质的转化关系如图所示(反应条件和部分产物未标出)(1)若A 为短周期金属单质,D 为短周期非金属单质,且所含元素的原子序数A 是D 的2倍,所含元素的原子最外层电子数D 是A 的2倍,F 的浓溶液与A 、D 反应都有红棕色气体生成,则A 的原子结构示意图为__________,反应④的化学方程式为____________________.(2)若A 为常见的金属单质,D 、F 是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)金属A (焰色为黄) 气体甲 气体丙 物质D 物质C 物质E 物质F 红褐色沉淀的离子方程式是____________________,已知常温下1g D与F反应生成B(气态)时放出92.3kJ热量,写出反应的热化学方程式____________________.(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为____________________,B固体属于__________晶体.5.(10分)短周期常见元素形成的纯净物A、B、C、D、E的转化关系如下图所示,物质A与物质B之间与A、B两种物质中的某种相同)。
高一化学无机推断试题答案及解析

高一化学无机推断试题答案及解析1. (15分)某混合物A ,含有KAl (SO 4)2、Al 2O 3和Fe 2O 3,在一定条件下可实现下图所示的物质之间的变化:据此回答下列问题:(1)I 、II 、III 、IV 四步中对于溶液和沉淀的分离采取的方法是 。
(2)根据上述框图反应关系,写出下列B 、C 、D 、E 所含物质的化学式 沉淀固体B ;C ; 沉淀D ;溶液E 。
(3)写出①、②、③、④四个反应方程式(是离子反应的写出离子方程式) ① ;② ; ③ ; ④ 。
【答案】(1)过滤 (2)Al 2O 3;Al 2O 3和Fe 2O 3;Fe 2O 3;K 2SO 4和(NH 4)2SO 4 (3)①Al 2O 3+2OH‾=2AlO 2-+H 2O ②Al 3++3NH 3•H 2O=Al(OH)3↓+3NH 4+ ③AlO 2-+H ++H 2O =Al(OH) 3↓+Cl‾ ④2Al(OH) 3Al 2O 3+3H 2O【解析】KAl (SO 4)2易溶于水,Al 2O 3和Fe 2O 3均不溶于水,混合物A 加水溶解后,溶液中是KAl (SO 4)2,沉淀C 为Al 2O 3和Fe 2O 3;由转化关系图可知,向沉淀C 中加NaOH 溶液,Fe 2O 3不反应,沉淀D 为Fe 2O 3,Al 2O 3可与NaOH 溶液反应生成NaAlO 2,向NaAlO 2溶液中通入CO 2可得Al (OH )3沉淀,Al (OH )3受热分解生成固体B 为Al 2O 3;向溶液中加过量氨水,溶液与过量氨水反应,Al 3+被沉淀,得到氢氧化铝沉淀,溶液中E 为K 2SO 4、(NH 4)2SO 4,经过蒸发、结晶,得到K 2SO 4和(NH 4)2SO 4。
(1)溶液和沉淀的分离方法为过滤。
(2)由上述分析知B 为Al 2O 3,C 为Al 2O 3和Fe 2O 3,D 为Fe 2O 3,溶液E 为K 2SO 4和(NH 4)2SO 4。
高一化学无机推断试题答案及解析

高一化学无机推断试题答案及解析1.(15分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。
其中,I是第三周期原子半径最小的金属元素组成的单质,D是一种红棕色固体粉末,G为单质,K是一种红棕色气体,A、B相对分子质量相差16,J、C都是常见的强酸。
请填写下列空白:(1)写出下列物质的化学式B E 。
(2)反应⑦的化学方程式为。
反应⑦属于。
A.吸热反应B.放热反应C.置换反应D.氧化还原反应(3)反应⑩的离子方程式为。
(4)将化合物D与KNO3、KOH混合,在高温条件下可制得一种“绿色”环保高效净水剂K2GO4(G显+6价),同时还生成KNO2和H2O。
该反应的化学方程式是:。
(5)反应①中生成的A、D物质的量之比为4:1,已知甲矿石的主要成分是由两种元素组成的化合物,则该化合物的化学式为。
【答案】(1)B SO3 E Fe(OH)3;(2) Fe2O3+ 2Al Al2O3+2Fe 。
反应⑦属于BCD 。
(3) 3Fe+2NO3-+8H+ = 3Fe2++2NO↑+4H2O 。
(4) Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O。
(5) FeS2。
【解析】(1)甲矿石是FeS2,矿石煅烧得到A:SO2和D:Fe2O3;SO2与O2发生反应得到B:SO3,SO3与水作用得到C:硫酸;I是Al,Al与Fe2O3发生铝热反应:Fe2O3+ 2Al Al2O3+2Fe,得到的G的Fe;H是Al2O3。
E是Fe(OH)3;F是Fe2(SO4)3和Fe(NO3)3的混合物,M是Fe(NO3)2.L是NO;K是NO2,J是 HNO3。
(1)B是SO3;E是Fe(OH)3;(2)反应⑦的铝热反应的化学方程式为Fe2O3+ 2Al Al2O3+2Fe,铝热反应是放热反应,因为符合置换反应的定义,所以属于置换反应,有元素的化合价的升高与降低,所以也是氧化反应反应。
因此选项是B、C、D。
高一无机推断题专题练习及答案
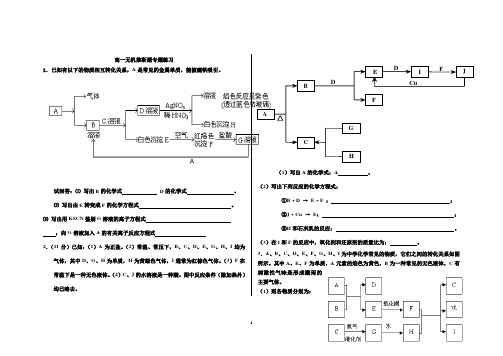
高一无机推断题专题练习1.已知有以下的物质相互转化关系,A是常见的金属单质,能被磁铁吸引。
试回答:⑴写出B的化学式D的化学式。
⑵写出由E转变成F的化学方程式。
⑶写出用KSCN鉴别G溶液的离子方程式;向G溶液加入A的有关离子反应方程式2.(11分)已知:(1)A为正盐。
(2)常温、常压下,B、C、D、E、G、H、I均为气体,其中D、G、H为单质,H为黄绿色气体,I通常为红棕色气体。
(3)F在常温下是一种无色液体。
(4)C、J的水溶液是一种酸。
图中反应条件(除加热外)均已略去。
(1)写出A的化学式:A 。
(2)写出下列反应的化学方程式:①B + D → E + F :;②J + Cu →E:;③H和石灰乳的反应:。
(3)在I和F的反应中,氧化剂和还原剂的质量比为:。
3.A、B、C、D、E、F、G、H、I为中学化学常见的物质,它们之间的转化关系如图所示。
其中A、E、F为单质,A元素的焰色为黄色,B为一种常见的无色液体,C有刺激性气味是形成酸雨的主要气体。
(1)则各物质分别为:ABCEFHI JGDD FCuA B C D E F G H I 。
(填化学式)(2)写出下列反应方程式:A+B→D+E (写离子方程式);C+氧气→G (写化学方程式);E+H(浓)→C+水+I (写化学方程式)。
4.室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们按图进行反应。
又知E溶液是无色的,H是红褐色难溶物。
请回答:(1)A是,B是,C是,G是。
(填化学式)(2)画出B原子结构示意图___________________________________________________________。
(3)写出①的化学反应方程式__________________________________________________________(4) 写出③④的离子反应方程③_____________________________________________________④________________________________________________________5、如下图所示,A、B、C、D、E五种物质的相互转化关系请回答:(1)若A通常状态下为固态单质,A→E分别为(写化学式)A ;B ;C ;D ;E 。
高考化学专题《高无机综合推断》综合检测试卷附答案

高考化学专题《高无机综合推断》综合检测试卷附答案一、无机综合推断1.X、Y、Z三种主族元素,原子序数依次增大且原子序数小于10,它们的单质在常温下都是常见的无色气体,在适当条件下,三者之间可以两两发生反应生成分别是双原子、三原子和四原子的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3。
请回答下列问题:(1)元素X的名称是______,丙分子的电子式为______。
(2)若甲与Y单质在常温下混合就有明显现象,则甲的化学式为________。
丙在一定条件下转化为甲和乙的反应方程式为____________________________________________。
(3)化合物丁含X、Y、Z三种元素,丁是一种常见的强酸,将丁与丙按物质的量之比1∶1混合后所得物质戊的晶体结构中含有的化学键为________(选填序号)。
a.只含共价键 b.只含离子键 c.既含离子键,又含共价键【答案】氢 NO 4NH3+5O24NO+6H2O C【解析】【分析】由X、Y、Z三种主族元素,原子序数依次增大且原子序数小于10,它们的单质在常温下都是常见的无色气体可知,三种气体单质为氢气、氮气、氧气,X为H元素、Y为N元素、Z 为O元素,由在适当条件下,三者之间可以两两发生反应生成分别是双原子、三原子和四原子的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3可知,甲为NO、乙为H2O、丙为NH3。
【详解】(1)元素X为H元素,名称为氢;丙为共价化合物NH3,电子式为,故答案为氢;;(2)甲为无色气体NO,NO与氧气反应生成红棕色的二氧化氮;氨气与氧气发生催化氧化反应生成一氧化氮和水,反应的化学方程式为4NH3+5O2 4NO+6H2O,故答案为4NH3+5O24NO+6H2O;(3)由化合物丁是一种含H、O、N三种元素的强酸可知,丁为HNO3,HNO3与NH3按物质的量之比1:1混合反应生成NH4NO3,NH4NO3为离子化合物,含有离子键和共价键,故答案为C。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高一化学无机推断综合练习题一、填空题1.化合物X 由三种元素组成,为探究其组成的性质,设计并完成如下实验:提示:化合物E 的焰色反应为紫色(透过蓝色钴玻璃) 请回答:(1)X 的化学式是___。
强碱Y 的电子式为___。
(2)在常温和干燥的条件下,化合物X 可以稳定的存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀和一种气体单质。
①化合物X 与水反应的离子方程式为___。
②人们针对化合物X 的稳定性进行了大量的研究,并取得了一定的进展。
下列物质可以提高化合物X 在水溶液由稳定性的是___。
A. 4KHSOB .23K COC .3CH COOKD .23K SO③为研究温度对化合物X 水溶液稳定性的影响,请设计一个实验方案:___(3)化合物X 有多种制备方法其中一种方法是强碱Y 条件下用次氯酸钾红褐色沉淀B ,其化学方程式为___。
2.物质A 、B 、C 、D 、E 、F 、G 、H 、I 、K 存在如图所示转化关系,其中气体D 、E 为单质,试回答写出下列物质的化学式:A 是______,D 是______,K 是______; 写出的离子方程式______写出反应F G −−→的离子方程式______;加热K 的化学方程式为______ 在溶液Ⅰ中滴入NaOH 溶液,可以观察到的现象是______实验室检验溶液B中阴离子的方法是______金属A混有少量金属H,除去H简单的操作是______3.中学化学中几种常见物质的转化关系如下:将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。
请回答下列问题:(1)红褐色胶体E粒子直径大小的范围:。
(2)A、B、H的化学式:A,B,H。
(3)①H O分子的电子式:。
22②写出C的酸性溶液与双氧水反应的离子方程式:。
(4)写出鉴定E中阳离子的实验方法和现象:。
4.现有金属单质A、B、C、D和气体甲、乙、丙及物质E、F、G、H、I,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:(1)写出下列物质的化学式: B ; F ;(2)已知A的一种氧化物可以做核潜艇的供氧剂,则其氧化物供氧时的化学方程式为_______________________(3)①、④离子方程式:;。
5.A---J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:(1)A 、B 、C 、D 、E 、F 六种物质中所含同一种元素在周期表中位置 , (2)写出检验D 溶液中阳离子的方法 。
(3)写出反应④的离子方程式 。
(4)若向气体K 的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH 7(填 “”“”“”><=、或),用离子方程式表示其原因: ;(5)若向气体K 的0.1 mol/L 水溶液中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子物质的量浓度由大到小的关系是 。
6.下图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A 、C 、D 为无色气体,C 能使湿润的红色石蕊试纸变蓝。
(1)写出物质X 的化学式:______________。
(2)写出下列变化的化学方程式:①A→D :____________________________________________________________; ②G→E :____________________________________________________________; ③F→G :____________________________________________________________; (3)实验室里,常用加热固体混合物的方法制取气体C ,请写出化学方程式:_______________________________________________________________________。
7.已知A 是一种淡黄色固体,可做供氧剂,C 为具有磁性的黑色晶体,E 的焰色反应为黄色,F 为红褐色固体(部分产物已略去)。
(1)物质A、F的化学式分别是、。
(2)C→D的过程中第②步反应的离子方程式是。
(3)如何检验D中的金属阳离子,说明具体的操作和实验现象。
(4)E溶液与铝单质发生反应的化学方程式为。
(5)G与D溶液也能发生反应,其反应的类型为(填序号)。
a.化合反应b.置换反应c.复分解反应d.氧化还原反应参考答案1.答案: (1)24K FeO ;;(2)①()2--42234FeO +10H O=4Fe OH +3O +8OH ↓↑②BC③取少量的样品放入试管加水溶解,分成两等份于两试管中,分别放在冷水和热水中,观察生成红褐色沉淀的快慢;(3) ()24233KClO+4KOH+2Fe OH =2K FeO +3KCl+5H O解析: (1)上述分析计算得到X 化学式为:K 2FeO 4,强碱Y 为KOH ,电子式为:,故答案为:24K FeO ;;(2)①()2--42234FeO +10H O=4Fe OH +3O +8OH ↓↑;②高铁酸钾与水反应生成氧气和()3Fe OH 、氢氧化钾,反应方程式为()242234K FeO +10H O=4Fe OH +8KOH+3O ↑,提高化合物X 在水溶液由稳定性需要避免和水接触,反应产物可知减小溶液中能提高其稳定性,A. 4KHSO 溶液中显酸性,促进高铁酸钾与水的反应,故A 错误;B. 23K CO 水解显碱性,反应逆向进行,可以提高高铁酸钾水溶液中的稳定性,故B 正确;C. 3CH COOK 水溶液中水解溶液显碱性,抑制高铁酸钾与水的反应,能提高其水溶液中的稳定性,故C 正确;D. 23K SO 具有较强还原性,乙被高铁酸钾氧化,故D 错误; 故答案为:BC ;③固定其他条件,改变温度,看析出沉淀的快慢,操作方法为取少量的样品放入试管加水溶解,分成两等份于两试管中,分别放在冷水和热水中,观察生成红褐色沉淀的快慢。
,故答案为:取少量的样品放入试管加水溶解,分成两等份于两试管中,分别放在冷水和热水中,观察生成红褐色沉淀的快慢;(3)强碱Y 条件下用次氯酸钾、红褐色沉淀B 反应制备高铁酸钾,氢氧化铁被次氯酸钾氧化为高铁酸钾,次氯酸钾被还原为氯化钾,同时生成2H O ,反应的方程式方程式为()24233KClO+4KOH+2Fe OH =2K FeO +3KCl+5H O ,故答案为:()24233KClO+4KOH+2Fe OH =2K FeO +3KCl+5H O ; 2.答案:(1)23Al;H ;F (OH)e(2) 3++3234Al +3NH H O=Al O ()H 3NH ⋅↓+ (3)322Al OH +NaOH=NaAlO +)2H (O; 32Fe OH ()232Fe O +3H O(4)先出现白色沉淀,迅速变成灰绿色,最后变成红褐色(5)取溶液B 少许,先滴入稀硝酸,再滴入硝酸银溶液,若有白色沉淀产生,则证明有该阴离子(6)用磁铁吸引解析: (1)由上述分析可知,A 是Al ,D 是 H 2,K 是Fe (OH )3,故答案为:23Al;H ;F (OH)e ; (2)C →F 的离子方程式为:3++3234Al +3NH H O=Al O ()H 3NH ⋅↓+,故答案为:3++3234Al +3NH H O=Al O ()H 3NH ⋅↓+;(3)反应“F →G ”的化学方程式:322Al OH +NaOH=NaAlO +)2H (O;,加热K 的化学方程式为:32Fe OH ()232Fe O +3H O ,故答案为:322Al OH +NaOH=NaAlO +)2H (O;32Fe OH ()232Fe O +3H O ;(4)在溶液2FeCl 中滴入NaOH 溶液,先生成氢氧化亚铁,然后被氧化为氢氧化铁,可观察到的现象是:先出现白色沉淀,迅速变成灰绿色,最后变成红褐色, 故答案为:先出现白色沉淀,迅速变成灰绿色,最后变成红褐色;(5)溶液B 为盐酸,含有的阴离子为-Cl ,检验氯离子方法为:取溶液B 少许,先滴入稀硝酸,再滴入硝酸银溶液,若有白色沉淀产生,则证明有该阴离子,故答案为:取溶液B 少许,先滴入稀硝酸,再滴入硝酸银溶液,若有白色沉淀产生,则有该阴离子;(6)金属Fe 混有少量金属Al ,除去Al 简单的操作是:用磁铁吸引, 故答案为:用磁铁吸引。
3.答案:(1)1nm~100nm (2)Fe ;FeS ;24H SO(3);2++3+2222Fe + 2H +H O =2Fe + 2H O(4)取少量E 溶液于试管中,加入NaOH 固体,用湿润的红色石蕊试纸靠近试管口,若变蓝,则含有4NH +,反之,则没有。
解析:4.答案:(1)Al 2FeCl (2)2222322Na O +2CO = 2Na CO +O(3)+-222Na+2H O =2Na +2OH +H ↑ ()3+-3Fe +3OH =Fe OH ↓解析:(1)B 的化学式为Al ,F 的化学式为:2FeCl ,故答案为:Al ;2FeCl ;(2)已知A 的一种氧化物可以做核潜艇的供氧剂,该氧化物为22Na O ,则其氧化物供氧时的化学方程式为:2222322Na O +2CO = 2Na CO +O ,故答案为:2222322Na O +2CO = 2Na CO +O ; (3)反应①的离子方程式为:+-222Na+2H O =2Na +2OH +H ↑,反应④的离子方程式:()3+-3Fe +3OH =Fe OH ↓,故答案为:+-222Na+2H O =2Na +2OH +H ↑;()3+-3Fe +3OH =Fe OH ↓.5.答案:(1)第四周期第Ⅷ族(2)取少量D 溶液,加KSCN 溶液,出现红色(3)-2222Al+2OH +2H O=2AlO +3H -↑ (4)<;4232NH +H O NH H O+OH +-⋅(5)2+44NH > SO >H >OH c c c c +--()()()() 解析:6.答案:(1)()43432NH HCO NH )CO (或 (2)① 2222322Na O 2CO =2Na CO O ++② ()33223Cu 8HNO =3Cu NO 2N 4H O )O (↑+稀++ ③ 2233NO H O=2HNO NO ++(3)()423222NH Cl Ca OH CaCl 2NH 2H O =↑△+++ 解析:7.答案:(1)22Na O ;()3Fe OH (2)2+3+22Fe Cl =2Fe 2Cl -++(3)取少量D 溶液于试管中,滴加KSCN 溶液,溶液显血红色(其它合理答案也得分) (4)2222Al 2NaOH 2H O 2NaAlO 3H ↑++=+ (5)ad 解析:。
