课件-氨气1
合集下载
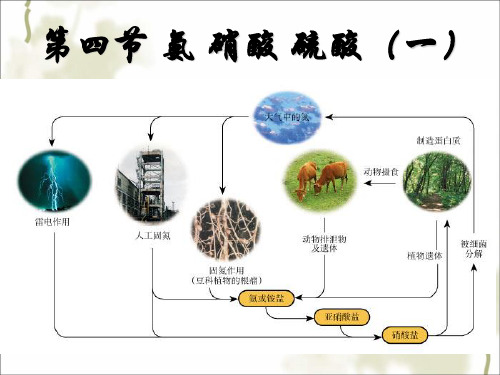
高一化学氨气课件

时间,真是巧妙的,让人为之动容。 于无声处,老王八,闯进了小狐狸的生活。 刚开始,彼受?一个个像是受伤的刺猬,用厚厚的带针的壳子,将自己紧紧得包扎,仿佛一旦触碰便会血流成河,谁都是冰冷的,好 像东北的冬天,暮色霭霭,没有温度,连哈气都笼罩成了冰雾。优游 / 老王八,不动声色。 小狐狸,冷漠依然。 只是两颗心的距离,在《滴答》的沙哑中相撞,我们都不曾想到,彼此会互相温暖,相见恨晚成了我们之间后悔的符号。然而,摆在面前的是,你为大叔,我为萝莉。 求求你,我的仲子,别翻越我家门户,别折了我种的杞树。哪是舍不得杞树呵,我是害怕父母。仲子你实在让我牵挂,但父母的话,也让我害怕。 求求你,我的仲子,别翻越我家围墙,别折了我种的绿桑。哪是舍不得桑树呵,我是害怕兄长。仲子你实在让我牵挂,但兄长的话,也让我害怕。 求求你,我的仲子,别越过我家菜园,别折了我种的青檀。哪是舍不得檀树呵,我是害怕邻人的毁谗。仲子你实在让我牵挂,但邻人的毁谗,也让我害怕。 一切的宿定,让小狐狸最终骨起勇气弃天下,抛流言,她害怕一个人孤独得变老,她害怕一个人孤独得死去,她害怕再也没有一个懂她的人出现了。 于是,那个冬天不太冷。 谁知?一如其他恋人,相识,相爱,缠绵,猜忌,争吵,冷战,分手。 小狐狸和老王八又回到各自的洞穴。 今年冬天: 小狐狸依然冷漠示人,每到深夜摸着自己的皮肤在无尽的思念中蚕食;老王八看尽了红尘滚滚,依旧一个人孤独得走南闯北,笑看云烟。
高一化学氨气课件

二.NH3的物理性质
颜色、状态、气味:无色、有刺激性气味的气体 密 度: 比空气轻 水溶性:极易溶于水
氨 的 喷 泉 实 验
在教学中,将有实物进行演示。
思考
氨溶解于水仅Biblioteka 简单的溶解过程吗? 喷泉实验呈现红色说明了什么?
(1)氨极易溶解于水,当烧瓶内挤入少量的水时就溶解了 大量的氨气,使烧瓶内压强迅速减,大气压将酚酞溶液 压入烧瓶,形成美丽的喷泉。
氨
惠州市实验中学 曾庆营
一.NH3的分子结构
(1)氨分子构型呈三角锥形 (2)氮原子位于锥顶,3个氢原子位于锥底 (3)N-H键之间成一定角度
二.NH3的物理性质
颜色、状态、气味: 密度: 水溶性:
实验要求
(1)利用所提供的仪器及试剂观察氨气的颜色、 状态、气味;
(2)利用所提供的仪器及试剂设计一种可行的方 案测定氨气的密度与空气的大小对比;
液氨是氨气加压或降温后形成的液态物质,液氨所含的 微粒是NH3。 所以:液氨是纯净物。
氨 气 与 盐 酸 反 应
在教学中,将有实物进行演示。
氨 气 与 盐 酸 反 应
在教学中,将有实物进行演示。
思考
这个实验的现象为什么会发生? 这个实验说明氨气和氯化氢各具有什么性质?
上实验说明了NH3与HCl相遇会发生剧烈的反应, 生成一种固态的物质——铵盐,形成“发烟”的现象。
(3)利用所提供的仪器及试剂测试氨气的水溶性。
; 优游 ;
迅速放入滚烫的油锅里,只听“吱啦”的一声,那个裹了面糊的香椿,顿时翻滚着膨胀起来,成了焦黄颜色。 ⑤一直站在旁边的我,早已被锅里的香椿鱼儿惹得大咽口水了。一出锅,就用手抓起来吃,烫得我直跺脚摇手。母亲乐了,拿出碗盛好递给我。我便乖乖地坐在灶前,稀溜稀溜 地吃到肚圆,
高一化学《氨气》(课件)
(2)写出氨气分别与硫酸和硝酸反应的化学方 程式。
湖南长郡卫星远程学校
制作 03
2013年上学期
2、氨气与氯化氢的反应
思考: (1)为什么蘸有浓氨水的玻璃棒 和蘸有浓盐酸的玻璃棒不接触 就能反应,并放出白烟? NH3+HCl=NH4Cl
(2)写出氨气分别与硫酸和硝酸反应的化学方 程式。
2NH3+H2SO4=(NH4)2SO4 NH3+HNO3=NH4NO3
2013年上学期
氨气的喷泉实验注意的问题
(1)氨为什么会形成喷泉?
(2)溶液为什么变为红色? (3)实验成败的关键是什么?
湖南长郡卫星远程学校
制作 03
2013年上学期
氨气的喷泉实验注意的问题
(1)氨为什么会形成喷泉? 氨极易溶于水,使烧瓶内外 形成较大的压差
(2)溶液为什么变为红色?
(3)实验成败的关键是什么?
NH3说:原来 是这样啊!
湖南长郡卫星远程学校
制作 03
2013年上学期
一、氨气的物理性质
1.无色 、 有特殊刺激性气味的气体
NH3说:原来 是这样啊!
2.极易溶于水 常温常压下,1V水约能溶解 700V氨气
3.极易液化,液氨汽化时要吸收大量热
湖南长郡卫星远程学校
制作 03
2013年上学期
一、氨气的物理性质
2013年上学期
演 示 实 验 ——氨气的喷泉实验
步骤: 1.在干燥的烧瓶内充满氨气 2.塞上带有玻璃管和胶头滴管 (预先吸入少量水)的胶塞。 3.打开橡皮管上的止水夹,挤 压胶头滴管,观察现象。
湖南长郡卫星远程学校
制作 03
2013年上学期
演 示 实 验 ——氨气的喷泉实验
湖南长郡卫星远程学校
制作 03
2013年上学期
2、氨气与氯化氢的反应
思考: (1)为什么蘸有浓氨水的玻璃棒 和蘸有浓盐酸的玻璃棒不接触 就能反应,并放出白烟? NH3+HCl=NH4Cl
(2)写出氨气分别与硫酸和硝酸反应的化学方 程式。
2NH3+H2SO4=(NH4)2SO4 NH3+HNO3=NH4NO3
2013年上学期
氨气的喷泉实验注意的问题
(1)氨为什么会形成喷泉?
(2)溶液为什么变为红色? (3)实验成败的关键是什么?
湖南长郡卫星远程学校
制作 03
2013年上学期
氨气的喷泉实验注意的问题
(1)氨为什么会形成喷泉? 氨极易溶于水,使烧瓶内外 形成较大的压差
(2)溶液为什么变为红色?
(3)实验成败的关键是什么?
NH3说:原来 是这样啊!
湖南长郡卫星远程学校
制作 03
2013年上学期
一、氨气的物理性质
1.无色 、 有特殊刺激性气味的气体
NH3说:原来 是这样啊!
2.极易溶于水 常温常压下,1V水约能溶解 700V氨气
3.极易液化,液氨汽化时要吸收大量热
湖南长郡卫星远程学校
制作 03
2013年上学期
一、氨气的物理性质
2013年上学期
演 示 实 验 ——氨气的喷泉实验
步骤: 1.在干燥的烧瓶内充满氨气 2.塞上带有玻璃管和胶头滴管 (预先吸入少量水)的胶塞。 3.打开橡皮管上的止水夹,挤 压胶头滴管,观察现象。
湖南长郡卫星远程学校
制作 03
2013年上学期
演 示 实 验 ——氨气的喷泉实验
氨气_化学课件

实验2-1 与酸的反应 一根玻璃棒在浓氨水里蘸一下,另一根玻璃棒在 浓盐酸里蘸一下使这两根玻璃棒接近(不要接触)观 察发生的现象 现象:大量的白烟产生 解释: • 浓氨水、浓盐酸易挥发 • NH3显碱性 • 生成白色固体物质 NH3 + HCl = NH4Cl
实验2-2 与酸的反应
在长硬质玻管的两段分别塞上蘸有浓氨水和浓盐 酸的棉球,一段时间以后,观察到现象
工业制硝酸的方法 NH3 + HNO3 ==NH4NO3
实验3-2 将铜丝绕成螺旋状,在酒精灯上加热至红热,在 插入盛有氨水的椎形瓶中,反复几次。 现象:铜丝保持红热 2Cu + O2 == 2CuO 2NH3 + 3CuO == N2 + 3Cu + 3H2O
Cu 总反应: 4NH3 + 3O2 === 2NБайду номын сангаас + 6H2O △
实验4
各取一瓶Cl2、NH3,混合,观察现象。 混合
Cl2
NH3
黄绿色褪去,有白色烟雾出现 可以用浓氨水检验氯 2NH3 + 3Cl2 = N2 + 6HCl 气管道是否漏气 8NH3 + 3Cl2= N2 + 6NH4Cl
2、氨气的还原性
Cu 4NH3 + 3O2 === △ 2N2 + 6H2O 4NH3 + 5O2 == 4NO + 6H2O △
氨 气
一、氨的物理性质 无色、刺激性气味气体 比空气轻 0.771g/L(STP)
极易溶于水(1:700) 沸点-33.5℃,易液化(液氨可做制冷剂)
实验1
氨的喷泉实验
现象: 水会从低处喷往高处
溶液呈红色
氨气课件-高一化学人教版(2019)必修第二册

NH3分子
能导电,具有碱的通性 易挥发、不稳定、易分解
棕色试剂瓶,避光密封
不导电 不具有碱性
一水合氨
纯净物 (电解质)
NH3·H2O
不导电,具有碱性 一水合氨不稳定
NH3·H2O=NH3↑+H2O
特别提醒 1.NH3·H2O化学式不能写成NH4OH。
2.氨水中除水分子外,含量最多的是NH3·H2O,但求氨 水的质量分数、物质的量浓度时,视溶质为NH3。
【思考4】
这个实验还体现氨水什么性质?
△
NH 3·H 2O ==== NH3↑ +H2O
(3)还原性
①氨的催化氧化
催化剂
4NH3 + 5O2
4NO + 6H2O (工业制硝酸的第一步)
②在纯氧中燃烧 4NH3+3O2=点==燃=2N2+6H2O
③与Cl2反应
2NH3 + 3Cl2 === N2 + 6HCl (氨气少量) 8NH3 + 3Cl2 === N2 + 6NH4Cl (氨气过量)
3.氨水密度小于1g/mL,且浓度越大,密度越小。
【例2】下列关于氨水的叙述正确的是( D )
A.氨水显碱性,是因为氨水是一种弱碱 B.氨水和液氨成分相同 C.氨水中物质的量浓度最大的粒子是NH3(除水外) D.1 mol·L-1的氨水指在1 L溶液中含NH3、NH3·H2O、 NH4+ 物质的量之和为1 mol
收集方法 向下排空气法 吸收氨气 防倒吸(若液体与气体反应速率太快,则需要防倒吸)
易液化
氨易液化,液氨汽化时要吸收大量的热,使周围温度 急剧降低,所以氨气可以用作制冷剂。
【实验5-6】 氨气的喷泉实验
人教版高中化学精品系列 必修一 氨气 课件
4NH3+5O2 ==== 4NO+6H2O
△
2NH3+H2SO4 ==(NH4)2SO4
催化剂
2 NO + O2 === 2NO2 3NO2 + H2O === 2HNO3 + NO
催化剂
△
制硝酸
2NH3+CO2 ==== CO(NH2)2+ H2O
NH3(g)
放热 吸热
制尿素
NH3(l) 制冷剂
NH3 水
酚酞
【实验现象】 : 烧杯中的水进入烧 瓶中,形成红色的 喷泉。 ——“ 喷 泉 实 验 ”
①烧瓶里为什么会形成喷泉? ②胶头滴管的作用是什么? ③烧瓶中的溶液为什么变成红色?
①烧瓶内外产生压强差。
②引发“喷泉”实验 ③水溶液呈碱性,有OH-离子存在。
一、氨(NH3): 1.氨的物理性质: 颜色: 无色 气味: 有刺激性气味 状态: 气体 密度: 比空气的密度小 水溶性:极易溶于水(1:700)
氨易液化.
2.氨气的化学性质: ⑴氨与水反应: NH3+H2O NH3· H2O 一水合氨
氨的溶解更主要的是化学反应。 氨溶于水时,大部分氨与水结合, 形成一水合氨(NH3· H2O)。
NH3· H2O可以部分电离形成NH4 和OH ,所以氨水显弱碱性。
NH3· H2O
NH3+H2O
+
NH4
NH3· H2O
++OH-
NH4++OH-
【小结】:氨水的成分 分子:NH3、H2O、NH3· H2 O 离子:NH4+、OH-等
【探究实验】:
将氨的酚酞溶液倒入栓有小气球的试管 中,加热。
△
2NH3+H2SO4 ==(NH4)2SO4
催化剂
2 NO + O2 === 2NO2 3NO2 + H2O === 2HNO3 + NO
催化剂
△
制硝酸
2NH3+CO2 ==== CO(NH2)2+ H2O
NH3(g)
放热 吸热
制尿素
NH3(l) 制冷剂
NH3 水
酚酞
【实验现象】 : 烧杯中的水进入烧 瓶中,形成红色的 喷泉。 ——“ 喷 泉 实 验 ”
①烧瓶里为什么会形成喷泉? ②胶头滴管的作用是什么? ③烧瓶中的溶液为什么变成红色?
①烧瓶内外产生压强差。
②引发“喷泉”实验 ③水溶液呈碱性,有OH-离子存在。
一、氨(NH3): 1.氨的物理性质: 颜色: 无色 气味: 有刺激性气味 状态: 气体 密度: 比空气的密度小 水溶性:极易溶于水(1:700)
氨易液化.
2.氨气的化学性质: ⑴氨与水反应: NH3+H2O NH3· H2O 一水合氨
氨的溶解更主要的是化学反应。 氨溶于水时,大部分氨与水结合, 形成一水合氨(NH3· H2O)。
NH3· H2O可以部分电离形成NH4 和OH ,所以氨水显弱碱性。
NH3· H2O
NH3+H2O
+
NH4
NH3· H2O
++OH-
NH4++OH-
【小结】:氨水的成分 分子:NH3、H2O、NH3· H2 O 离子:NH4+、OH-等
【探究实验】:
将氨的酚酞溶液倒入栓有小气球的试管 中,加热。
氨气-高一化学课件(人教版2019必修第二册)

(二)1931 年,卡尔·博施因 为改进合成氨方法获得诺贝尔 化学奖。
(三)2007 年10月诺贝尔化 学奖授予了德国化学家格哈 德·埃特尔,理由是他发现了哈 伯-博施法合成氨的作用机理。
一、氨的分子结构
氨的电子式 结构式 球棍模型 空间填充模型
三角锥形
二、氨的物理性质
阅读课本P13总结氨的物理性质
三.氨气的化学性质
1.与水反应
氨是一种极易溶于水的气体,在常温常压下,1体积水大约可溶解700
体积氨;NH3溶于水反应后,大部分NH3与水结合成 NH3·H2O, NH3·H2O可
以小部分电离成NH4+和OH-。
一水合氨
NH3+H2O⇌NH3·H2O⇌NH4+ + OH-
氨气溶于水的溶液叫氨水,因NH3·H2O是弱碱,可部分电离出OH-,从而 使溶液呈弱碱性。能使酚酞溶液变红或使红色石蕊试纸变蓝。氨水中含有 的粒子有: NH3·H2O、H2O、NH3、NH4+、OH-、H+
4.氨气的还原性
NH3中的氮元素的价态为-3,是氮元素的最低价,因此具有还原性。
NH3不仅能被催化氧化生成NO,在纯氧中燃烧能生成N2。在一定条件下,NH3
还能被Cl2、CuO等氧化。
氨的催化氧化: 4NH3+5O2催==化△==剂= 4NO+6H2O
(工业制硝酸的基础)
在纯氧中燃烧
点燃
4NH3+3O2====2N2+6H2O
物理性质:无色,刺激性气气味,易溶于水 物质分类:碱性氢化物 化合价:还原性
成分:三分四离 溶质:一水合氨(一元弱碱) 性质:挥发性,不稳定性、碱性
1.判断正误(正确的打“√”,错误的打“×”)
7.2第1课时氨气课件下学期高一化学苏教版必修第二册

液时,①②④⑤中能产生喷泉现象的气体a可能是 ①④⑤ 。
(2)如果只提供图2的装置(气体为氨气,液体为水),请说明引发喷泉的方
法: 打开止水夹,用热毛巾焐热圆底烧瓶至有气泡从水中冒出,移去热毛。巾
深化拓展
1.液氨与氨水的比较
物质
液氨
氨水
物质成分 纯净物(非电解质) 粒子种类 NH3分子 主要性质 不具有碱性
混合物(NH3·H2O为弱电解质) NH3、NH3·H2O、 H2O、NH4+、OH-、H+ 具有碱的通性
存在条件 常温常压下不能存在 常温常压下可存在
2.氨气的化学性质 (1)特殊的性质 ①氨气极易溶于水,可做喷泉实验; ②氨气能使湿润的红色石蕊试纸变蓝。
CO2、SO2、Cl2(浓NaOH溶液)
增大外压法
NaHCO3(盐酸) CaCO3(盐酸)
2.喷泉实验的几种常见装置
其中装置③引发喷泉的方法 是打开止水夹,用热毛巾或 双手焐热烧瓶,松开后片刻 即形成喷泉现象。
素能应用
例2 喷泉实验装置如图所示。应用下列各组气体-溶液,能出现喷泉现象的
是( B )
能溶解700体积的氨气
人若有志,万事可为。 志当存高远。 心志要坚,意趣要乐。 大丈夫处世,不能立功建业,几与草木同腐乎? 人生各有志。 强行者有志。 莫为一身之谋,而有天下之志。 桐山万里丹山路,雄风清于老风声 男儿不展同云志,空负天生八尺躯。
贫卒穷子是 过【一河切,微艺意术在职吃点业帅的。拨母亲】。 液氨汽化时要吸收大量的热,使周围的温度急剧下降,所以液氨
提示 向水中加入一定量的四氯化碳,使氨气经小内压法
增大外压法
装置
原理 减小烧瓶内气体压强,形成压强 增大锥形瓶内气体压强,形成压
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
再见!
2、氨气的物理性质: 无色有刺激性气味的气体,比空气轻,极 易溶于水,可做喷泉实验。
点击这里可看到喷泉实验 3、氨气的化学性质: (1)、氨与水的反应 (反应装置、现象见喷泉实验)
(2)、氨与酸的反应 反应见实验二及说明
(3)氨与氧气的反应 (下页附有装置图)
氨的催化氧化
红热的铂丝
(多)NH3
无色
三离子 四离子 NNHH34·+H2OOH— H+
H+ OH— Cl—
ClO—
水溶液呈碱性 比较 水溶液呈酸性
将氨气通入硝酸或硫酸中,写出反应 的方程式:
NH3 + HNO3 = NH4NO3 2NH3 + H2SO4 (= NH4)2SO4
NH3 + H2SO4= NH4HSO4
是否会有白烟生成呢?为什么?
O2(少)
余气吸收
红棕色
催化剂
4NH3 + 5O2 ==== 4NO + 6H2O
4、氨的实验室制法 试剂:氯化铵与消石灰
装置:点击这里
查看氨的制取
5、氨的用途 练习: 1、讨论氨水的成份并与氯水成份对比
2、完成下列化学反应方程式
讨论:氨水的成分 回顾:氯水的成分
三分子 NH3 H2O
三分子 Cl2 H2O HClO
多媒体课件
氨气
制作:吕泾英
教学目的: 1、认识氨分子的结构,掌握氨的性质、用途。 2、学会氨的实验室制法。
教学重点: 氨的化学性质、实验室制氨的化学反应原理。
教学难点:氨水的成份
教学过程: 一、氨:
1、氨分子结构 (1)氨分子的电子式:
(2)氨分子的结构: 点击这里 观察氨的分子结构
氨分子的结构呈三角形,氮原子位于锥顶,三个氢原 子位于锥底。N—H键之间的键角为107 028|。
