高中化学竞赛辅导无机化学18.4锰分族知识点素材
高中化学竞赛辅导 无机化学 18.1钛分族知识点素材

第十八章 过渡元素(I )Chapter 18 The Transition Elements (I )引 言(Introduction )一、Definition :具有部分充填d 或f 壳层电子的元素。
它包括第四、五、六周期从ⅢB到Ⅷ族的元素,共有8个直列,这些元素都是金属元素,也称为过渡金属。
人们也常将铜分族看作过渡元素,这是由于Cu 2+具有3d 9,Au 3+具有5d 8,且性质也与过渡元素十分相似的缘故。
二、Elements’ Symbol :Ac Pt Ir Os Re W Ta Hf La PdRh Ru Tc Mo Nb Zr Y NiCo Fe Mn Cr V Ti Sc三、Valence Orbital (n - 1)d 、n s 、n p 共九个轨道 四、Oxidation State : 1.过渡元素都有可变氧化态,2.+2氧化态几乎为所有过渡元素的特征氧化态,3.绝大部分过渡元素的最高氧化态等于其族数:Sc 2O 3、CrO 3、Mn 2O 7,4.随着原子序数的增加其高价氧化态越来越稳定:如未发现FeO 4,而发现OsO 4。
其 ∆f 4OsO m ,G = -302kJ·mol -1五、Coordination Capac ity :过渡元素有很强的配位能力,因为有空的价轨道,与配位原子形成σ配键;又有富的d 电子,可与配体的π*反键轨道或n d 空轨道形成反馈π键。
§18-1 钛分族 The Titanium Subgroup包括: Titanium (Ti) Zirconium (Zr) Hafnium (Ha) Rutherfordium (Rf) Valence electron configuration :(n - 1)d 2n s 2一、General Properties1.Radius :从Ti 到Zr 是增大的,而Zr 和Hf 是相似的,这是由于镧系收缩造成的,使Zr 、Hf 分离困难,只能采取离子交换(ion exchange )法或溶剂萃取(solventextraction )法来分离它们。
高中化学无机化学竞赛辅导课件.ppt
• d区元素的化合物
• 离子极化对ds区元素化合物性质的影响
•
颜色
•
溶解
•
HgF2 HgCl2 HgBr2 HgI2 水解性质
• Hg2+ 与卤素及拟卤离子形成的配合物 HgX42-
• HgNH2X
4) 常见配位化合物及配位数 Cu(I) Cu(NH3)2+ CuCl3- Cu(CN)43Cu(II) 配位数通常为4 CuCl42- Cu(NH3)42+ Cu(CN)42Ag(I) 配位数通常为2 Ag(NH3)2+ Ag(S2O3)23- Ag(CN)2Zn(II) 配位数为4和6 ZnCl42- Zn(NH3)42+ Zn(NH3)62+ Cd(II) 常见配位数为4 Hg(II) 配位数为4 与卤素和类卤离子
• 氢键
•
强弱次序:
F—H ···F > O—H ···O > O—H ···N &g ···Cl > O—H ···S
特点: 是特殊的分子间作用力
具有方向性和饱和性
晶体结构
1. 晶格和点阵、晶胞 晶系:立方 四方 正交 单斜 三斜 三方 六方
2. 金属晶体—堆积 非密置层的堆积:简单立方和体心立方 密堆积:立方密堆—面心立方 六方密堆—六方晶胞 空间利用率及配位数
• 离子晶体 • CsCl 负离子成简单立方堆积,正离子占据立方体间隙。
NaCl 负离子成面心立方堆积,正离子占据八面体体间隙。
ZnS 负离子成面心立方堆积,正离子占据四面体间隙。
• 分子晶体
• 共价晶体
•
金刚石和石墨的结构
• 离子极化 • 离子的极化能力 • 离子的变形性 • 离子极化对键型和晶型的影响
高中化学竞赛辅导无机元素练习题

(1)确定A的结构简式。写出生成A的化学反应方程式。
(2)在室温或高于室温的条件下,A能定量地分解,产生B和C。已知B的阳离子的价电子总数比C的价电子总数少4。试确定B的结构简式,写出B中阴、阳离子各中心原子的杂化形态。
3为什么NF3常温不水解,而NCl3常温可以水解?写出水解产物。
九、回答下列关于磷的问题:
高中化学竞赛练习(无机化学主族元素)
第一章卤素
一、于酸性溶液中混合等物质的量的KBrO3和KI,生成哪些氧化还原产物,它们的物质量的比是多少?
(2)用漂白粉漂白物料时,常采用以下步骤:将物料浸入漂白粉溶液,然后暴露在空气中;将物料浸在稀盐酸中;将物料浸在大苏打溶液中,最后取出放在空气中干燥;试说明每一步处理的作用,并写出有关的反应方程式。
(2)石硫合剂在空气中与H2O及CO2作用又生成具有杀虫作用的S,写出分步的反应方程式。
四.氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。
1.氯化亚砜分子的几何构型是;中心原子采取杂方式,
是(等性、不等性)杂化。
2.写出亚硫酸钙和五氯化磷共热,制备氯化亚砜反应的化学方程式
3.氯化亚砜在有机化学中用作氯化剂,写出乙醇和氯化亚砜反应的化学方程式
1.写出N2O4在登月飞船的液体推进系统中所发生主要反应的方程式;
2.说明N2O4分子中N原子的杂化方式和成键情况;
3.画出偏二甲肼的构型。
4.写出我国长征系列火箭二元推进剂反应的化学方程式。
5.偏二甲肼可用二甲胺被亚硝酸氧化、再用锌还原来制备,写出各步反应方程式。
高考化工流程新考点 锰及其化合物

高考化学工艺流程中的新考点锰及其化合物一、知识拓展1、金属锰锰是第25号元素,在周期表中位于第四周期,第ⅦB族,在地壳中主要以氧化物形式存在,如软锰矿MnO2⋅x H2O、黑锰矿Mn3O4和水锰矿Mn2O3⋅H2O等。
锰的氧化态有+2、+3、+4、+5、+6和+7,其中+2、+4、+6、+7为常见氧化态。
锰是活泼金属,它在空气中燃烧生成Mn3O4(类似Fe3O4,是MnO和Mn2O3的混合氧化物):3Mn+2O2Mn3O4锰能分解水,易溶于稀的非氧化性酸生成Mn(Ⅱ)盐和放出氢气:Mn + 2H2O == Mn(OH)2+ H2↑Mn+2H+== Mn2++H2↑锰与冷浓H2SO4作用缓慢。
有氧化剂存在时,锰与熔融碱作用生成锰酸盐:2Mn + 4KOH + 3O22K2MnO4+ 2H2O高温时,Mn 和X2、O2、S、B、C、Si、P 等非金属直接化合,更高温度时可与N2化合。
2、锰(Ⅱ)化合物Mn2+的价电子构型为较稳定的半充满d5结构,因此Mn2+是Mn的最稳定状态。
在酸性溶液中Mn2+的还原性很弱,只有在高酸度的热溶液中,与过二硫酸铵、铋酸钠等强氧化剂作用,才能将Mn2+氧化成MnO4-。
2Mn2++5S2O82-+8H2O2MnO4-+10SO42-+16H+2Mn2++5NaBiO3+14H+2MnO4-+5Na++5Bi3++7H2O2Mn2++5PbO2+4H+2MnO4-+5Pb2++2 H2O由于MnO4-是紫色的,故这些反应常用于定性检验Mn2+ 离子。
在碱性溶液中,Mn(Ⅱ)很容易被氧化成Mn(Ⅳ) 化合物。
2Mn(OH)2+O2== 2MnO(OH)2↓(棕褐)多数锰(Ⅱ)盐如MnX2、Mn(NO3)2、MnSO4等皆溶于水。
MnO2与浓H2SO4和C作用可制得硫酸锰:2MnO2+C+2H2SO4== 2MnSO4+CO2↑+2H2O锰(Ⅱ)的弱酸盐和氢氧化物难溶于水,如MnS、MnCO3、MnC2O4、Mn(OH)2等。
高中化学竞赛辅导无机化学18.2钒分族知识点素材

§18-2 钒分族The Vanadium Subgroup包括:Vanadium (V) Niobium (Nb) Tantalum (Ta) Dubnium (Du) Du 金属是人造元素,制备方法为1967年:)4( 5Db)( Db Ne Am 1010261105260105M eV 120221024395n n +−−−→−+Valence electron configuration :(n - 1)d 3n s 2,例外:Nb 4d 45s1 一、General Properties1.Radius :由于镧系收缩,Nb 和Ta 半径相近2.First ionization energy 随原子序数的增加而增加3.Oxidation number :V :+2,+3,+4,+5,Ta Nb 、:+54.Coordination number :V :4,6,Ta Nb 、:7,85.Occurrence in nature: 虽然在地壳中的丰度很大,却是稀有元素。
钒铅矿(vanadinite): Pb 5(VO 4)3Cl ,Nb 、Ta 性质相似,矿共生,若矿物中Ta 占优势,称为钽钛矿(tantalite): Fe(TaO 3)2,若矿物中Nb 占优势,称为铌铁矿(columbite): Fe(NbO 3)2。
二、The Simple Subs tance1.Physical properties :熔、沸点高,有较大的熔化热和气化热,这说明钒族元素有较强的金属键;纯金属的延展性好,但金属中含O 、H 和C 等杂质时,金属弹性减弱,硬度增大。
2.Chemical properties:(1) 在常温下,由于钝态存在,钒、特别是铌、钽化学活性低,虽然与其还原电位相 矛盾 V 2.1V /V 2-=+ϕ V 1.1Nb /Nb 3-=+ϕ V 81.0Ta /O Ta 52-=ϕ加热时:4M + 5O 22M 2O 5 2M + 5F 22MF 5 (M = V 、Nb 、Ta )(2) 钒仅溶于热的硝酸、热的浓硫酸、王水中,Nb 和Ta 溶于热的HNO 3-HF 的混合酸中(Ta 连王水都难溶)。
高考化学元素周期表知识点总结(2篇)

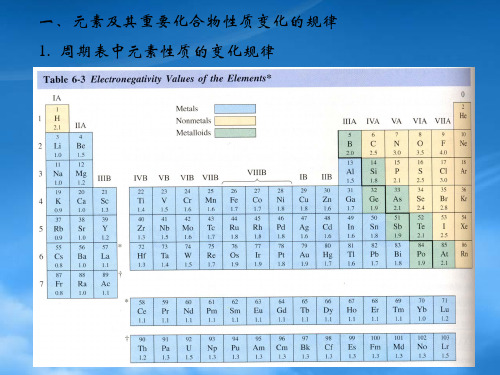
高考化学元素周期表知识点总结元素周期表共分8纵行,其中第、3、4、5、6、7七个纵行依次为ⅠA族、ⅡA族、ⅢA族、ⅣA族、ⅤA族、ⅥA族、ⅦA族(纵行序号的个位数与主族序数相等);第3、4、5、6、7、七个纵行依次为ⅢB 族、ⅣB族、ⅤB族、ⅥB族、ⅦB族、ⅠB族、ⅡB族(纵行序号个位数与副族序数相等);第8、9、0三个纵行为合称为Ⅷ族;第8纵行称为0族。
ⅠA族称为碱金属元素(氢除外);ⅡA族称为碱土金属元素;ⅢA 族称为铝族元素;ⅣA族称为碳族元素;ⅤA族称为氮族元素;ⅥA族称为氧族元素;ⅦA族称为卤族元素。
元素周期表共有七个横行,称为七个周期,其中第一(种元素)、二(____种元素)、三(____种元素)周期为短周期(只有主族元素);第四(____种元素)、五(____种元素)、六(____种元素)周期为长周期(既有主族元素,又有过渡元素);第七周期(目前已排____种元素)为不完全周期。
在元素周期表中,越在左下部的元素,其金属性越强;越在右上部的元素(惰性气体除外),其非金属性越强。
金属性最强的稳定性元素是铯,非金属性最强的元素是氟。
在元素周期表中位于金属与非金属分界处的金属元素,其氧化物或氢氧化物一般具有两性,如Be、Al等。
主族元素的价电子是指其最外层电子;过渡元素的价电子是指其最外层电子和次外层的部分电子;镧系、锕系元素的价电子是指其最外层电子和倒数第三层的部分电子。
在目前的种元素中,只有种非金属元素(包括____种稀有气体元素),其余____种都是金属元素;过渡元素全部是金属元素。
在元素周期表中,位置靠近的元素性质相近。
一般在周期表的右上部的元素用于合成新农药;金属与非金属分界处的元素用于制造半导体材料;过渡元素用于制造催化剂和耐高温、耐腐蚀的合金材料等等。
从原子序数为____号往后的元素,其原子序数的个位数与其所在的副族序数、Ⅷ族(包括08、09、0三号元素)、主族序数分别相等。
高考化学元素周期表知识点总结

高考化学元素周期表知识点总结元素周期表是化学中的一个重要工具,根据元素的物理和化学性质,以及元素的原子结构,将元素按一定的顺序排列起来。
元素周期表可以提供大量的化学信息,对于深入理解和学习化学知识非常重要。
以下是高考化学中与元素周期表相关的知识点总结。
1. 元素周期表的结构元素周期表的结构由7个“周期”和18个“族”组成。
周期是一横行,代表原子核周围电子层的数量;族是一竖行,代表元素的性质和化学反应的特点。
元素周期表中的元素按从左到右及从上到下的顺序排列。
2. 主族元素和过渡元素元素周期表可以分为主族元素和过渡元素两大类。
主族元素指1A、2A和13A到18A族元素,它们化合价数和氧化态的变化规律比较明显;过渡元素指3B到12B族元素,它们的价态和氧化态变化规律比较复杂。
3. 周期性规律元素周期表的排列使得元素的性质和周期性规律更加明显。
(1) 原子半径:原子半径随着周期数增加而减小,随着族数增加而增大。
(2) 电离能和电负性:电离能随着周期数增加而增大,随着族数增加而减小;电负性随着周期数增加而增大,随着族数增加而减小。
(3) 金属性和非金属性:依据周期表可以将元素大致分为金属性元素和非金属性元素。
金属性元素位于周期表左下角和中间区域,非金属性元素位于周期表右上角和边缘位置。
4. 周期性规律的解释(1) 周期性规律的解释——原子核电荷数增加:周期表的排列可以解释元素性质的周期性变化。
原子核的电荷数随着周期数增加而增加,增加的正电荷吸引外层电子,导致原子半径减小,电离能增大,电负性增大,金属性减小。
(2) 周期性规律的解释——屏蔽效应:原子核外还有一些电子,这些电子对外层电子的吸引力较小,被称为屏蔽效应。
原子核电荷数一定的条件下,屏蔽效应增加,原子半径增大,电离能减小,电负性减小,金属性增加。
5. 周期表中的异常规律(1) 周期表中的异常规律——过渡元素:过渡元素中的某些元素的电子构型不符合一般规律,具有较大的半径,较小的电离能等异常性质。
高中化学竞赛辅导

高中化学竞赛辅导高中化学竞赛是一项具有挑战性和专业性的活动,对于那些对化学有着浓厚兴趣和天赋的学生来说,是一个展现自我、提升能力的重要平台。
而有效的竞赛辅导则是帮助学生在竞赛中取得优异成绩的关键。
一、了解竞赛要求和范围在进行高中化学竞赛辅导之前,首先要深入了解竞赛的要求和范围。
不同的化学竞赛可能在侧重点、难度和考察内容上有所差异。
一般来说,高中化学竞赛涵盖了无机化学、有机化学、物理化学、分析化学等多个领域,并且要求学生具备较强的理论基础、实验技能和综合分析能力。
二、制定合理的学习计划针对竞赛的要求和学生的实际情况,制定一份详细而合理的学习计划至关重要。
学习计划应包括基础知识的巩固、拓展知识的学习、习题训练、实验操作等多个方面。
合理安排时间,确保每个阶段的学习任务都能够得到充分的完成。
对于基础知识的巩固,可以安排学生重新复习高中化学教材中的重点内容,如化学元素周期表、化学反应原理、化学平衡等。
同时,要引导学生深入理解这些知识,不仅仅是死记硬背。
拓展知识的学习则需要引入大学化学的相关内容,如高等无机化学、有机化学中的反应机理、物理化学中的热力学和动力学等。
可以推荐一些适合高中生阅读的大学化学教材或参考书籍。
三、教学方法与策略1、启发式教学在辅导过程中,采用启发式教学方法,引导学生主动思考问题,培养他们的独立思考能力和创新思维。
例如,通过提出一些具有启发性的问题,让学生自己去探索答案,而不是直接告诉他们结论。
2、案例分析结合实际的化学案例进行分析,让学生将所学的知识运用到实际问题中。
这样不仅能够加深学生对知识的理解,还能够提高他们解决实际问题的能力。
3、小组讨论组织学生进行小组讨论,让他们在交流中互相启发,共同解决问题。
同时,小组讨论也能够培养学生的团队合作精神和沟通能力。
四、习题训练习题训练是提高学生竞赛能力的重要手段。
选择具有代表性和难度适中的习题,让学生进行练习。
在习题讲解时,不仅要告诉学生答案,更要注重解题思路和方法的讲解,让学生能够举一反三。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
§18-4 锰分族The Manganese Subgroup包括:Manganese (Mn) Technetium (Te) Rhenium (Re) Bohrium (Bh) Valence electron configuration:(n- 1)d5n s2,例外:Tc 4d65s1铼是在化学周期律的指导下,有目的、有意识地发现的。
它发现于1925年(为纪念莱茵市而得名),锝在希腊文中的意思是“人工制造”,发现于1937年,没有稳定的同位素,虽已发现存在于自然界,但主要由人工核反应制得。
一、General Properties1.Oxidation number:Mn +2、+4、+7氧化态稳定(符合非键电子的稳定排布:d5、d3、d0)也存在+3、+5、+6、甚至0和负氧化态。
低氧化态主要存在于羰基配合物或有机金属化合物中,因为低氧化态的锰有更多d电子参与反馈π键。
Re、Tc:+7氧化态稳定。
2.Coordination number:Mn:4,6 Re、Tc:7,8,9 (ReH92-) 3.Occurrence in nature:软锰矿(pyrolusite):MnO2 Re很少有独立的矿,仅与钼共存于矿物中。
二、The Simple Substance1.Physical properties:锰族元素也形成较强的金属键(仅次于铬分族),因此是难熔金属(Re的熔点仅次于W),高沸点(Re的沸点是所有单质中最高的),它们有良好的延展性(纯Mn、Re 相当软)。
2.Chemical properties(1) reactions with non-metals:在室温下,由于锰表面形成氧化层,甚至与冷的浓HNO3也形成较强的氧化膜,所以呈化学惰性;但在高温下,与X2、B、C、Si、O2、P等直接化合:4Re + 7O22Re2O7 3Mn + 2O2Mn3O4(2) reactions with acids:Mn + 2H+Mn2+ + H2↑Tc、Re不溶于盐酸,但溶于浓硝酸:3M + 7HNO33HMO4 + 7NO↑+ 2H2O (M = Tc、Re)(3) reactions with water:Mn + 2H2O(热)Mn(OH)2 + H2↑,而Tc、Re不能发生与H2O(热)的反应。
(4) 在有氧化剂存在的条件下,金属锰又能同熔融碱作用,生成锰酸盐:2Mn + 4KOH + 3O2熔融2K2MnO4 + 2H2O3.Preparation:(1) Mn:2MnSO4 + 2H2O 电解2Mn + 4H+ + -24SO2+ O2↑(cathode) (anode)MnO2 + Si Mn + SiO2(2) Re:2N H4ReO4 + 4H22Re + N2 + 8H2O4.Usage:锰可以制锰钢,增强钢的耐腐蚀性、延展性和硬度。
铼广泛用于电子工业和作催化剂。
三、Their Compounds1.[0] O.S. M2(CO)10(M = Mn、Tc、Re)(1) structure and formation of bonds of carbonyl compoundsMn COof Mn Mnof Mn CO(2) Reactivity :Na 2][Mn(CO)25+]2Na[Mn(CO)5 225Br ][Mn(CO)+Br Mn(CO)52.[+2] O.S.(1) +262O)Mn(H 高自旋 (t 2g )3(e g )2:Mn 2+−−→−-OH Mn(OH)2↓(白色)−→−2O MnO(OH)(棕色)−→−2O MnO 2·n H 2O(2) MnO 难溶于水,但溶于稀酸,形成Mn 2+,MnS 溶于醋酸。
(3) 在酸性介质中,822O S Na 、2PbO 、3NaBiO 等强氧化剂氧化+2Mn ,生成-4MnO 。
该反应可用来鉴别+2Mn离子。
O8H O 5S 2Mn 22822++-+Ag ++--++16H 10SO 2MnO 244++++14H 5NaBiO 2Mn 32O 7H 2MnO 5Bi 5Na 243+++-++(4)在碱性介质中:222O Na MnCl +NaCl 2MnO 2+ KOH12KClO 23MnSO 34++熔融O H 6SO 3K KCl 2MnO 3K 24242+++3.[+4]O.S. 无[Mn(H 2O)6]4+存在,只有MnO 2或其它的配合物,如K 2MnF 6,存在。
(1) preparation :以菱锰矿MnCO 3为原料,电解法制MnO 2: 423SO H MnCO +O H CO MnSO 224++电解 anode :222Mn 2H O 2e MnO 4H +++-+−−→ cathode :22H 2e H ++↑−−→(2) properties :a .酸性介质中,显强氧化性 MnO 2 + 4HCl (浓)MnCl 2 + Cl 2↑+ 2H 2O2MnO 2 + 2H 2SO 42MnSO 4 + O 2↑+ 2H 2OMnO 2−−−−−−−→−)(HNO , )(SO H 342热热Mn 2++ O 2↑+ 2MnO 2 + 2H 2SO 4+ 2MnSO 4 + 3H 2Ob .遇强氧化剂,显还原性KOH6KClO 3MnO 32++熔融O 3H KCl MnO 3K 242++322HNO 6PbO 32MnO ++O H 2)Pb(NO 32HMnO 2234++4.[+6]O.S. Mn 只有-24MnO (绿色)形式,而Re 有-2436ReO ReO ReF 、、等形式。
(1) properties :a .水解歧化:O2H 3MO 224+---++4OH MO 2MO 24(M = Mn 、Tc 、Re)CHO CH 3在酸性介质中 243MO 4H -++O 2H MO 2MO 224++--24MO 仅存在于碱性溶液中,H 2MO 4是不存在的。
对于TcCl 6、ReCl 6: 20KOH ReCl 36+O 10H KCl 18ReO 2KReO 224+++b .V 26.2224M nO /M nO +=-ϕ,所以-24MnO 是强氧化剂,但在酸性条件下,-24MnO发生歧化反应,所以一般不用-24MnO 作氧化剂。
c .在-OH 中,-24MO 被氧化剂氧化 242Cl MnO 2K +KCl 22KMnO 4+4K 2MO 4 + O 2 + 2H 2O 4KMO 4 + 4KOH (M = Tc 、Re )5.[+7] O.S. (1) Mn(VII)以Mn 2O 7、MnO 3F 存在 ,Re (VII)以ReF 7、ReOF 5、ReO 3F 存在。
(2) properties :以-4MnO 为例 a .-4MnO 是紫色,电荷跃迁的结果。
b .在H +或h ν条件下分解,中性或微碱性下分解较慢。
+-+H44MnO 4O H 2O 34MnO 222++c .V 51.124M n /M nO +=+-ϕ,所以-4MnO 是强氧化剂,若-4MnO 过量,它可能与还原 产物+2Mn 反应,析出2MnO 。
O 2H 3Mn 2MnO 224+++- ++4H 5MnO 2 d .向浓硫酸中加入少量高锰酸钾固体,生成一种亮绿色溶液:)(424SO H 3KMnO 浓+343K MnO ()3HSO H O ++-++++平面三角形 若向浓硫酸中加入大量高锰酸钾固体,会得到Mn 2O 7(棕色油状物),易爆炸。
用CCl 4可以萃取Mn 2O 7,它在CCl 4中相当稳定安全。
(3) preparationa .以MnO 2(软锰矿)为原料制KMnO 4第一步:Mn(IV)Mn(VI)2KOH 4O MnO 22++O H 2MnO 2K 242+第二步:CO 2歧化K 2MnO 4242CO 2MnO K +3224CO K 2MnO 2KMnO ++ 这种制备方法的最高产率为66.7%b .电解法:anode :2e 2MnO 24---42MnOcathode :2H 2O + 2eH 2↑+ 2OH-总电解反应方程式为 2K 2MnO 4 + 2H 2O电解2KMnO 4 + 2KOH + H 2↑Element Reaction FlowchartFlowchart are shown for chromium, manganese.MnO Mn MnO ★MnO 24OH2 H 2O H 42⎪⎪⎩⎪⎪⎨⎧−−→−−−→−−−→−-+--+24-OH-(NH 4)Cr2O 72O 3Ag 2CrO 4 CrO 42272- Cr(OH 2)63+CrO 2Cl 2 K 2Cr 2O CrO 3MnO 42)62+Mn(OH)2MnO(OH)242Ag+H+e--e -NH 4+2-+eTechnetium in Diagnostic Nuclear Medicine99mTc is one of the most widely used isotopes in nuclear medicine. It is injectedinto the patient in the form of a saline solution of a compound, chosen because it will be absorbed by the organ under investigation, which can then be “imaged” by an X-ray camera or scanner. Its properties are ideal for this purpose : it decays into 99Tc by internal transition and γ-emission of sufficient energy to allow the use of physiologically insignificant quantities (nmol or even pmol — a permissible dose of 1 mCi corresponds to 1.92 pmol of 99mTc) and a half-life (6.01h) short enough to preclude radiological damage due to prolonged exposure. It is obtained form 99Mo (t 1/2 = 65.94h), which in turn is obtained from the fission products of natural or reactor uranium, or else by neutron irradiation of 98Mo.Although details vary considerably, the 99Mo is typically incorporated in a “generator” in the form of MoO 42-absorbed on a substr ate such as alumina whereit decays according to the scheme :99299m 99444MoO TcO TcO βγ---−−→−−→ These generators can be made available virtually anyw here and, when required, TcO 4-is eluted from the substrate and reduced (Sn IIis a common, but not the sole, reductant) in the presence of an appropriate ligand, ready for immediate use. A wide range of N -, P - and S -donor ligands has been used to prepare complexes of Tc, mainly in oxidation state III, IV and V, which are absorbed preferentially by different organs. Though the circumstances of clinical usage mean tha t the precise formulation of the compound actually administered is frequently uncertain, the imaging of brain, heart, lung, bone and tumours etc, is possible. It is the search for compounds of increased specificity which has stimulated most of the recent work on the coordination chemistry of Tc.Ziegler-Natta CatalystsThe original ICI process for producing polythene involved the use of high temperatures and pressures but K.Ziegler discovered that, in the presence of amixture of TiCl 4 and AlEt 3 in a hydrocarbon solvent, the polymerization will take place at room temperature and atmospheric pressure. G. Natta then showed that by suitable modification of the catalyst stereoregular polymers of almost any alkene (olefin), CH 2=CHR, can be produced. In general, these catalysts can be formed from an alkyl of Li, Be or Al together with a halide of one of the metals of Groups 4 to 6 in an oxidation state less than its maximum. As a result of their work, Ziegler and Natta were jointly awarded the 1963 Nobel Prize for Chemistry. Because of its commercially sensitive nature, much of the voluminous literature on this subject is in the from of patents, but a great deal of work has also been directed at ascertaining the mechanism of the catalyst. The initial reaction of TiCl 4 and AlEt 3 produces insoluble TiCl 3 (alternatively, preformed TiCl 3 can be used). The most plausible sequence of events on the surface of this catalyst is then as illustrated in Fig. A:24Ti ClCl Cl3ClEt Ti ClClEt Ti ClClClCH 2CH 2ClEt CH 2Ti ClCl2Figure A Possible mechanism of Ziegler-Natta catalyst(a) one of the chlorine atoms coordinated to a titanium atom is replaces by an ethylgroup from AlEt 3 ;(b) then, because the titanium atom on the surface of the solid has a vacantcoordination site, a molecule of ethylene (ethene) can attach itself; (c) migration of the ethyl group to the ethylene by a well-know process known as“cis -insertion ” occurs.The result of this cis -insertion is that a vacant site is left behind, and this can be occupied by another ethylene molecule and steps (a) and (b) repeated indefinitely.The efficacy of the catalyst seems to lie in the fact that in the case of propylene(CH 2=CHCH 3), for instance, the steric hindrance inherent in t he surface coordination sites ensures that the polymer which is pr oduced is stereoregular. Such a stereoregular polymer is stronger and has a higher mp than the non-regular (so-called “atactic ”) polymer. Furthermore, while the titanium provides bonds sufficiently strong to be able to hold the olefin and the alkyl in the correct orientations for reaction, they are not so strong as to prevent the migration which is essential to the reaction.。
