最全的化学方程式大全
化学方程式汇总(46个)
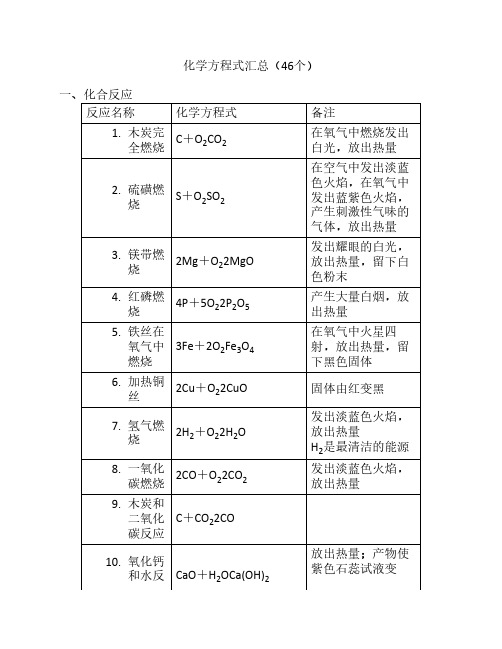
化学方程式汇总(46个)一、化合反应反应名称化学方程式备注1. 木炭完全燃烧C+O2CO2在氧气中燃烧发出白光,放出热量2. 硫磺燃烧S+O2SO2在空气中发出淡蓝色火焰,在氧气中发出蓝紫色火焰,产生刺激性气味的气体,放出热量3. 镁带燃烧2Mg+O22MgO发出耀眼的白光,放出热量,留下白色粉末4. 红磷燃烧4P+5O22P2O5产生大量白烟,放出热量5. 铁丝在氧气中燃烧3Fe+2O2Fe3O4在氧气中火星四射,放出热量,留下黑色固体6. 加热铜丝2Cu+O22CuO固体由红变黑7. 氢气燃烧2H2+O22H2O发出淡蓝色火焰,放出热量H2是最清洁的能源8. 一氧化碳燃烧2CO+O22CO2发出淡蓝色火焰,放出热量9. 木炭和二氧化碳反应C+CO22CO10. 氧化钙和水反CaO+H2OCa(OH)2放出热量;产物使紫色石蕊试液变应蓝,使无色酚酞试液变红11. 二氧化碳和水反应CO2+H2OH2CO3产物使紫色石蕊试液变红12. 硫酸铜粉末和水反应CuSO4+5H2OCuSO4·5H2O白色粉末变成蓝色晶体,放出热量CuSO4粉末用于检验物质是否含有水二、分解反应反应名称化学方程式备注13. 碳酸受热分解H2CO3H2O+CO2↑H2CO3不稳定14. 电解水2H2O2H2↑+O2↑正负极都产生气泡,负极产生的气体体积是正极产生气体的2倍负氢正氧,氢二氧一;工业上生产H215. 高温煅烧大理石或石灰石CaCO3CaO+CO2↑工业上生产CaO16. 过氧化氢在二氧化锰的催化作用下分解2H2O22H2O+O2↑产生大量气泡,放出热量实验室制取O217. 加热氯酸钾和二氧化锰的混合物2KClO32KCl+3O2↑实验室制取O218. 加热硫酸铜晶体CuSO4·5H2OCuSO4+5H2O蓝色晶体变成白色粉末,试管口产生无色液体三、置换反应反应名称化学方程式备注19. 木炭还原氧化铜C+2CuO2Cu+CO2↑产生红色固体20. 氢气还原氧化铜H2+CuOCu+H2O产生红色固体,试管口产生无色液体H2有还原性,用于冶炼金属21. 镁带在二氧化碳中燃烧2Mg+CO22MgO+C产生黑色和白色固体22. 锌粒和稀盐酸反应Zn+2HClZnCl2+H2↑实验室制取H223. 锌粒和稀硫酸反应Zn+H2SO4ZnSO4+H2↑实验室制取H224. 铁钉和稀盐酸反应Fe+2HClFeCl2+H2↑Fe元素从0价变成+2价25. 铁钉和稀硫酸Fe+H2SO4FeSO4+H2↑26. 铁丝和硫酸铜溶液反应Fe+CuSO4FeSO4+Cu铁丝表面产生红色固体27. 铜丝和硝酸银溶液反应Cu+2AgNO3Cu(NO3)2+2Ag铜丝表面产生银白色固体四、复分解反应反应名称化学方程式备注28. 氢氧化镁治疗胃“泛酸”Mg(OH)2+2HClMgCl2+2H2O29. 大理石或石灰石和稀盐酸反应CaCO3+2HClCaCl2+H2O+CO2↑实验室制取CO230. 硝酸银溶液和稀盐酸反应AgNO3+HClAgCl↓+HNO3产生白色沉淀31. 氯化钡溶液和稀硫酸反应BaCl2+H2SO4BaSO4↓+2HCl产生白色沉淀32. 硫酸铜溶液和氢氧化钠溶液反应CuSO4+2NaOHCu(OH)2↓+Na2SO4产生蓝色沉淀33. 氯化铁溶液和氢氧化钠溶液FeCl3+3NaOHFe(OH)3↓+3NaCl产生红褐色沉淀34. 碳酸钠溶液和石灰水反应Na2CO3+Ca(OH)2CaCO3↓+2NaOH35. 硫酸铜溶液和熟石灰制取农药波尔多液CuSO4+Ca(OH)2Cu(OH)2↓+CaSO436. 碳酸钠溶液和足量盐酸反应Na2CO3+2HCl2NaCl+H2O+CO2↑37. 氯化钠溶液和硝酸银溶液反应NaCl+AgNO3AgCl↓+NaNO3AgCl不溶于HNO338. 硫酸钠溶液和氯化钡溶液反应Na2SO4+BaCl2BaSO4↓+2NaClBaSO4不溶于HNO3五、其他反应反应名称化学方程式备注39. 甲烷燃烧CH4+2O2CO2+2H2O产生淡蓝色火焰40. 少量二氧化碳通入石灰水CO2+Ca(OH)2CaCO3↓+H2O产生白色沉淀;石灰水在空气中变质;石灰水用于检验CO241. 少量二氧NaOH在空气中变化碳和氢氧化钠溶液反应CO2+2NaOHNa2CO3+H2O质;NaOH溶液用于吸收CO242. 氢氧化钠溶液吸收二氧化硫SO2+2NaOHNa2SO3+H2ONa2SO3名称是亚硫酸钠43. 一氧化碳还原氧化铜CO+CuOCu+CO2产生红色固体尾气需要燃烧处理,防止CO污染空气44. 一氧化碳还原氧化铁3CO+Fe2O32Fe+3CO2工业炼铁的主要反应45. 盐酸除铁锈Fe2O3+6HCl2FeCl3+3H2O溶液变成棕黄色46. 硫酸溶解氧化铜固体CuO+H2SO4CuSO4+H2O溶液变成蓝色*固体小颗粒分散到气体中形成烟;小液滴分散到气体中形成雾。
化学方程式大全

化学方程式大全1.4Na+O2===2Na2O2.2Na+O2Na2O23.2Na+2H2O===2NaOH+H2↑4.Na2O+H2O===2NaOH5.Na2O+CO2===Na2CO36.Na2O+2HCl===2NaCl+H2O7.2Na2O2+2H2O===4NaOH+O2↑8.2Na2O2+2CO2===2Na2CO3+O29.Na2CO3+HCl===NaHCO3+NaCl10.NaHCO3+HCl===NaCl+H2O+CO2↑11.Na2CO3+2HCl===2NaCl+ H2O+ CO2↑12.2NaHCO3Na2CO3+ H2O+ CO2↑13.NaHCO3 + NaOH== Na2CO3 + H2O14.Na2CO3+ H2O+ CO2 = 2NaHCO315.2NaOH+ CO2 (少量)== Na2CO3 + H2O16.NaOH+ CO2(足量)== NaHCO317.4Al + 3O22Al2O318.2Al+6HCl===2AlCl3+3H2↑19.2Al+3H2SO4===Al2(SO4)3+3H2↑20.2Al + 2NaOH +2H2O==2NaAlO2 + 3H2↑21.Al2O3 + 6HCl==2AlCl3+ 3H2O22.Al2O3 + 2NaOH==2NaAlO2 + H2O23.Al(OH)3 + 3HCl==AlCl3 + 3H2O24.Al(OH)3 + NaOH==NaAlO2 + 2H2O25.2Al(OH)3Al2O3 + 3H2O26.AlCl3 + 3NH3·H2O=Al(OH)3↓+3NH4Cl27.Al2(SO4)3+6NH3·H2O===2Al(OH)3↓+3(NH4)2SO428.3Fe + 2O2Fe3O429.3Fe+4H2O(g)Fe3O4 + 4H230.Fe+2HCl===FeCl2+H2↑31.Fe+CuCl2===FeCl2+Cu32.FeO+ 2HCl === FeCl2 + H2O33.Fe2O3 + 6HCl === 2FeCl3 + 3H2O34.Fe3O4+8HCl === FeCl2 + 2FeCl3 +4H2O35.FeSO4+ 2NaOH==Fe(OH)2↓+Na2SO436.FeCl3+ 3NaOH==Fe(OH)3↓+3NaCl37.4Fe(OH)2+ O2+ 2H2O ==4Fe(OH)338.Fe(OH)2+2HCl === FeCl2 + 2H2O39.Fe(OH)3+3HCl === FeCl3 + 3H2O40.2Fe(OH)3Fe 2O3 + 3H2O41.2FeCl3+Fe===3FeCl242.2FeCl3+Cu===2FeCl2+CuCl243.2FeCl2+Cl2===2FeCl344.3CO+ Fe2O32Fe + 3CO245.2Al+ Fe2O32Fe + Al2O346.Si + 2F2== SiF447.Si + 4HF== SiF4↑+2H2↑48.Si+2NaOH+ H2O= Na2SiO3+2H2↑49.Si+O2SiO250.SiO2+2NaOH ===Na2SiO3+H2O51.SiO2+ CaO CaSiO352.SiO2+ 4HF ===SiF4↑+2H2O53.2C+ SiO22CO↑ + Si54.SiO2 + Na2CO3Na2SiO3+ CO2↑55.SiO2 + CaCO3CaSiO3+ CO2↑56.Na2SiO3 + 2HCl==2NaCl+ H2SiO3↓57.Na2SiO3 +CO2+H2O ==Na2CO3 + H2SiO3↓58.H2SiO3SiO2+H2O59.MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O60.Cl2+2Na 2NaCl61.3Cl2+2Fe2FeCl362.Cl2+Cu CuCl263.Cl2 + H22HCl(或光照)64.Cl2+H2O==HCl+HClO65.2HClO2HCl+O2↑66.Cl2+2NaOH===NaCl+NaClO+H2O67.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O68.Ca(ClO)2 + CO2(少量) +H2O == CaCO3↓+2HClO69.Ca(ClO)2+ 2CO2(多量) +2H2O == Ca(HCO3)2+2HClO70.F2 + H2 === 2HF71.Br2 + H2===2HBr(500o C)△72.I2 + H22HI73.2F2 +2H2O===4HF+O274.Cl2+2NaBr===2NaCl+Br275.Cl2 +2KI ===2KCl+I276.Br2 +2KI ===2KBr+I277.HCl + AgNO3=AgCl↓(白色)+HNO378.NaBr+AgNO3= AgBr↓(浅黄色)+NaNO379.NaI + AgNO3=== AgI↓(黄色)+ NaNO380.2AgBr2Ag+Br2(AgCl、AgI类似)81.Fe + S FeS82.2Cu + S Cu2S83.H2 + S H2S84.S + O2SO285.SO2 + H2O H2SO386.SO2 + 2NaOH=Na2SO3 + H2O87.Na2SO3 + H2O+SO2 =2NaHSO388.SO2(足量)+ NaOH=NaHS O389.SO2 + CaO == CaSO390.SO2 + O2 2SO391.Cl2 + SO2 + 2H2O=H2SO4+2HCl (Br2、I2 类似)92.2H2S+SO2==3S↓+2H2O93.SO3 + H2O == H2SO494.SO3 + CaO == CaSO495.SO3+ Ca(OH)2== CaSO4+ H2O96.2H2SO4(浓)+Cu CuSO4+2H2O +SO2↑97.2H2SO4(浓) + C CO2↑+ 2H2O + 2SO2↑98.N2 +3H22NH399.N2 + 3Mg Mg3N2100.N2 + O22NO(或高温)101.2NO + O2== 2NO2102.3NO2 + H2O ==2HNO3 + NO103.NH3 + H2O NH3·H2O NH4++OH-104.NH3·H2O NH3↑+ H2O105.NH3 + HCl==NH4Cl (白烟)106.NH3 + HNO3==NH4NO3 (白烟)107.2NH3 + H2SO4==(NH4)2SO4108.4NH3 + 5O24NO + 6H2O109.NH4Cl NH3↑+HCl↑110.NH4HCO3NH3↑+ H2O +CO2↑111.(NH4)2CO32NH3↑+ H2O +CO2↑112.NH4Cl+ NaOH NaCl+NH3↑+H2O113.NH4NO3 + NaOH NaNO3 + NH3↑+H2O114.(NH4)2SO4 + 2NaOH Na2SO4 +2NH3↑+2H2O115.2NH4Cl + Ca(OH)2CaCl2 + 2NH3↑+2H2O116.4HNO34NO2↑+ O2↑+ 2H2O117.Cu+4HNO3(浓)== Cu(NO3)2 +2NO2↑+2H2O118.3Cu+8HNO3(稀)===3Cu(NO3)2 +2NO↑+4H2O 119.C+4HNO3(浓) ==CO2↑+4NO2↑+2H2O有机化学反应方程式1.甲烷与氯气反应CH4+Cl2CH3Cl+HClCH3Cl+Cl2CH2Cl2+HClCH2Cl2+Cl2CHCl3+HClCHCl3+Cl2CCl4+HCl2. 乙烯通入溴水中(或溴的四氯化碳溶液中)CH2=CH2 + Br2CH2BrCH2Br3.乙烯和HCl的反应CH2=CH2 + HCl 催化剂CH3CH2Cl4. 乙烯水化制乙醇CH2=CH2 + H2O CH3CH2OH 5.乙烯和H2的反应CH2=CH2 + H2催化剂△CH3CH36. 制取聚乙烯、聚丙烯n CH 2=CH 2 催化剂n CH 3–CH=CH 2 催化剂CH 37. 苯与液溴反应(需铁作催化剂)8. 苯的硝化反应2O9. 苯与氢气加成生成环己烷10. 乙醇与钠反应 2CH 3CH 2OH + 2Na2CH 3CH 2ONa + H 2↑ 11. 乙醇催化氧化 2CH 3CH 2OH + O 2 2CH 3CHO + 2H 2O (乙酸的电离,与钠、氧化钠、氢氧化钠、碳酸钠、碳酸氢钠、氢氧化铜悬浊液的反应)12. 乙酸乙酯制取(用饱和碳酸钠溶液收集)CH 3COOH + CH 3CH 2OHCH 3COOC 2H 5 + H 2O 13. 蔗糖水解方程式C 12H 22O 11 + H 2O 催化剂C 6H 12O 6 + C 6H 12O 6蔗糖 葡萄糖 果糖14. 麦芽糖水解方程式C 12H 22O 11 + H 2O 催化剂2C 6H 12O 6麦芽糖 葡萄糖15. 淀粉(或纤维素)水解(C 6H 10O 5)n + nH 2O 催化剂nC 6H 12O 6淀粉 葡萄糖浓硫酸△ CH 2-CH 2 nFe浓H 2SO 4 50-60℃NO 2 Cu 或Ag △CH -CH 2 n。
高中化学方程式大全(完整版)

高中化学方程式总结第一章 卤素第一节 氯气1、NaCl 2Cl Na 22−−→−+点燃2、22CuCl Cl Cu −−→−+点燃3、32FeCl 2Cl 3Fe 2−−→−+点燃4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃6、523PCl Cl PCl →+7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()( 9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)(10、O H NaCl NaClO Cl NaOH 222++→+11、↑++−→−+∆2222Cl O H 2MnCl MnO HCl 412、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓) 13、2O HCl 2HClO 2+−−→−见光第二节 氯化氢14、↑+→+HCl NaHS O S O H NaCl 442(浓) 15、↑+−→−+∆HCl S O Na NaCl NaHS O 42416、↑+−→−+∆HCl 2S O Na S O H NaCl 24242(浓)(14、15结合) 17、33HNO AgCl AgNO HCl +↓→+18、33NaNO AgCl AgNO NaCl +↓→+19、33KNO AgCl AgNO KCl +↓→+20、↑++→+2223CO O H CaCl CaCO HCl 2第三节 氧化还原反应21、O H Cu H CuO 22+−→−+∆22、O H 2NO 4CO HNO 4C 2223+↑+↑→+23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++−→−+∆)((极稀) 24、4243324S O H 15PO H 6P Cu 5O H 24CuS O 15P 11++→++ 25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓)26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++−→−+∆)((极稀)27、O H 31S O K S O Fe 9S O Cr S O H 31O Fe 6O Cr K 2423423424243722+++→++)()( 28、↑+↑+→++2223CO 3N S K S C 3KNO 2第四节 卤族元素29、HF 2F H 22→+30、HBr 2Br H 22→+31、HI 2I H 22→+32、22Br NaCl 2Cl NaBr 2+→+33、22I KCl 2Cl KI 2+→+34、22I KBr 2Br KI 2+→+35、33NaNO AgBr AgNO NaBr +↓→+36、33KNO AgI AgNO KI +↓→+37、2Br Ag 2AgBr 2+−−→−光照第二章 摩尔 反应热第一节 摩尔38、22CO O C →+39、↑+→+22H MgCl HCl 2Mg第二节 气体摩尔体积40、22H ZnCl HCl 2Zn +→+第三节 物质的量浓度41、O H 2SO Na SO H NaOH 224242+→+第四节 反应热42、kJ 5.393CO O C 22+−−→−+(气)(气)(固)点燃 43、kJ 6.483O H 2O H 2222+→+(气)(气)(气) 44、kJ 6.571O H 2O H 2222+→+(液)(气)(气) 45、kJ 3.131H CO O H C 22-+−→−+∆(气)(气)(气)(固) 第三章 硫 硫酸第一节 硫46、S Cu S Cu 22−→−+∆47、FeS S Fe −→−+∆48、S H H S 22−→−+∆49、2CS C S −−→−+高温50、22S O O S −−→−+点燃51、O H 3S O K S K 2KOH 6S 32422++−→−+∆第二节 硫的氢化物和氧化物52、↓+−→−∆S H S H 2253、2222S O 2O H 2(O 3S H 2+−−→−+点燃足)54、↓+−−→−+S 2O H 2(O S H 2222点燃不足)55、↓+−−→−+S 3O H 2S O S H 2222点燃56、HBr 2S Br S H 22+↓→+57、↑+→+S H FeCl HCl 2FeS 2258、4224S O H CuS S H CuS O +↓→+59、HAc 2PbS S H PbAc 22+↓→+60、O H NaHS NaOH S H 22+→+61、O H S Na NaOH NaHS 22+→+62、O H 2S Na NaOH 2S H 222+→+(60、61结合) 63、HCl 2FeCl 2S FeCl 2S H 232++↓→+64、↑+→+S H FeS O FeS S O H 2442(稀) 65、3222S O H O H S O ⇔+66、3OV 22SO 2O SO 252∆−−→←+ 67、4223S O H O H S O →+68、↑++→+22424232S O O H S O Na S O H S O Na 69、O H S O Na NaOH 2S O 2322+→+70、32CaSO CaO SO →+71、O H CaSO OH Ca 2S O 2322+↓→+)( 72、23232HS O Ca O H CaS O S O )(→++73、O H 2S 3S H 2S O 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++75、42222SO H HBr 2O H 2Br SO +→++76、42424422SO H 2SO K MnSO KMnO 2O H 2SO 5++→++第三节 硫酸的工业制法77、↑+−−→−+23222S O 8O Fe 2O 11FeS 4高温78、3OV 22SO 2O SO 252∆−−→←+ 79、4232S O H S O O H →+第四节 硫酸 硫酸盐80、O H 2S O 2CO S O H 2C 22242+↑+↑−→−+∆(浓) 81、O H 2S O 3S O H 2S 2242+↑−→−+∆(浓)82、O H 2S O PO H S O H P 224342+↑+−→−+∆(浓) 83、O H 2S O S S O H S H 22422++−→−+∆(浓) 84、O H 2S O CuS O S O H 2Cu 22442+↑+−→−+∆(浓) 85、HCl 2BaS O S O H BaCl 4422+↓→+86、NaCl 2BaS O S O Na BaCl 4422+↓→+87、NaCl 2BaCO CO Na BaCl 3322+↓→+88、↑++→+2223CO O H BaCl HCl 2BaCO89、↑++→+222333CO O H NO Ba HNO 2BaCO )( 90、↑++→+2223232CO O H S Na S O H CO Na91、42232S O H 2O S O H 2→+92、42232S O Na 2O S O Na 2→+93、423CaS O 2O CaS O 2→+94、O H 6SO 3S O Fe S O H 6Fe 22234242+↑+−→−+∆)((浓) 95、O H S O Na S O Br S O H 2NaBr 22422242++↑+−→−+∆(浓) 96、↑+−→−+∆HCl 2S O Na S O H NaCl 24242(浓) 97、O H 11C 12O H C 2SOH 11221142+−−−→−浓 第四章 碱金属第一节 钠98、O Na 2O Na 422→+99、222O Na O Na 2→+100、NaCl 2Cl Na 22−−→−+点燃101、S Na S Na 22−−→−+研磨102、↑+→+22H NaOH 2O H 2Na 2103、↑++→++242242H SO Na OH Cu CuS O O H 2Na 2)( 第二节 钠的氧化物104、NaOH 2O H O Na 22→+105、↑+→+2222O NaOH 4O H 2O Na 2106、3222CO Na CO O Na →+107、232222O CO Na 2CO 2O Na 2+→+108、O H NaCl 2HCl 2O Na 22+→+109、↑++→+2222O O H 2NaCl 4HCl 4O Na110、O H CO NaCl 2HCl 2CO Na 2232+↑+→+111、O H CO NaCl HCl NaHCO 223+↑+→+112、O H CO CO Na NaHCO 222323+↑+−→−∆113、O H CO Na NaOH NaHCO 2323+−→−+∆114、O H 2CO Na CaCO OH Ca NaHCO 2232323++↓→+(少量))( 115、O H NaOH CaCO OH Ca NaHCO 2323++↓→+(足量))( 116、NaCl 2BaCO BaCl CO Na 3232+↓→+117、NaCl 2CaCO CaCl CO Na 3232+↓→+118、O H 2CO 2CaCl HCl 2HCO Ca 22223+↑+→+)( 119、O H 2CO Na CaCO NaOH 2HCO Ca 232323++↓→+)( 120、O H S O NaCl HCl NaHS O 223+↑+→+第三节 碱金属元素121、O Li 2O Li 422−−→−+点燃122、22KO O K −−→−+点燃123、MX 2X M 22→+(M 表示氧族元素,X 代表卤族元素)124、MH 2H M 22→+125、↑+→+22H MOH 2O H 2M 2第五章 物质结构 元素周期律本章内容、性质特殊,所有化学反应方程式均融在其他章节中。
化学方程式大全汇总

化学方程式大全汇总
1、水的化学方程式:H2O(水)=H+(氢离子)+OH-(氧离子)
2、氧气的化学方程式:O2(氧气)=2O-(氧离子)
3、二氧化碳的化学方程式:CO2(二氧化碳)=C(碳)+2O-(氧离子)
4、氢氧化钠的化学方程式:NaOH(氢氧化钠)=Na+(钠离子)+OH-(氧离子)
5、硫酸的化学方程式:H2SO4(硫酸)=2H+(氢离子)+SO4-(硫酸
离子)
6、乙醇的化学方程式:CH3CH2OH(乙醇)=C2H5(乙烷)+OH-(氧离子)
7、氯气的化学方程式:Cl2(氯气)=2Cl-(氯离子)
8、醋酸的化学方程式:CH3COOH(醋酸)=C2H4O2(乙酸)+H+(氢离子)
9、硝酸的化学方程式:HNO3(硝酸)=H+(氢离子)+NO3-(硝酸离子)
10、硫酸铵的化学方程式:NH4HSO4(硫酸铵)=NH4+(铵离子)
+HSO4-(硫酸离子)
11、硅酸钠的化学方程式:Na2SiO3(硅酸钠)=Na2+(钠离子)
+SiO3-(硅酸离子)
12、硝酸钾的化学方程式:KNO3(硝酸钾)=K+(钾离子)+NO3-(硝
酸离子)
13、钙氢氧化物的化学方程式:Ca(OH)2(钙氢氧化物)=Ca2+(钙离子)+2OH-(氧离子)。
化学方程式大全

化学方程式大全一、钠及其化合物①4Na+O2===2Na2O2Na+2H2O===2NaOH+H2↑②Na2O+H2O===2NaOH2Na2O+O2△2Na2O2③2Na2O2+2H2O===4NaOH+O2↑2Na2O2+2CO2===2Na2CO3+O2④CO2+2NaOH(过量)===Na2CO3+H2OCO2(过量)+NaOH===NaHCO3⑤Na2CO3+2HCl=2NaCl+H2O+CO2↑Na2CO3+HCl===NaHCO3+NaCl(碳酸钠稀溶液中逐滴滴加稀盐酸)⑥2NaHCO3△Na2CO3+H2O+CO2↑NaHCO3+HCl===NaCl+H2O+CO2↑少量碳酸氢钠与氢氧化钡溶液混合:NaHCO3+Ba(OH)=BaCO3↓+H2O+NaOH碳酸氢钠与少量氢氧化钡溶液混合:2NaHCO3+Ba(OH)=BaCO3↓+2H2O+Na2CO3二、镁及其化合物Mg+Cl2点燃MgCl2Mg+Br2===MgBr22Mg+O2点燃2MgO Mg+2H2O(沸腾)△Mg(OH)2+H22Mg+CO2点燃2MgO+CMgCl2(熔融)通电Mg+Cl2三、铝及其化合物①2Al+Fe2O3高温Al2O3+2Fe2Al+6HCl===2AlCl3+3H2↑2Al+3H2SO4===Al2(SO4)3+3H2↑2Al+2NaOH+2H2O===2Na[Al(OH)4]+3H2↑②Al2O3+3H2SO4===Al2(SO4)3+3H2OAl2O3+2NaOH+3 H2O ===2 Na[Al(OH)4]③Al3++3NH3.H2O===Al(OH)3↓+3NH4+Al3++3OH-===Al(OH)3↓④Al(OH)3+OH-===[Al(OH)4]-Al(OH)3+3H+=== Al3++3 H2O⑤[Al(OH)4]-+ 4H+ === Al3++4H2O[Al(OH)4]-+CO2=== Al(OH)3↓+HCO3-[Al(OH)4]-+ Al3+===4Al(OH)3↓四、碳硅及其化合物①C+H2O高温CO+H2(生成水煤气)②CO2+Ca(OH)2(过量)===CaCO3+H2O2CO2(过量)+Ca(OH)2===Ca(HCO3)2CO2+2[Al(OH)4]-===2Al(OH)3↓+CO32-+H2OCO2+C6H5ONa+H2O===C6H5OH+NaHCO3③2C+SiO2高温Si+2CO↑(制得粗硅)Si+2NaOH+H2O===Na2SiO3+2H2↑④SiO2+CaO高温CaSiO3SiO2+2NaOH===Na2SiO3+H2OSiO2+Na2CO3高温Na2SiO3+CO2↑SiO2+CaCO3高温CaSiO3+CO2↑4HF+SiO2===SiF4↑+2H2O五、氮及其化合物①N2+3H2催化剂高温高压2NH3②3NO2+H2O===2HNO3+NO③4NH3+5O2催化剂△4NO+6H2O④NH3+H+===NH4+2NH4Cl+Ca(OH)2△CaCl2+2NH3↑+2H2O⑤3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2OCu+4HNO3===Cu(NO3)2+2NO2↑+2H2O4HNO3(浓)+C△CO2↑+4NO2↑+2H2O六、硫及其化合物①S+Fe△FeSS+2Cu△Cu2S②SO2+H2O===H2SO3放电N2+O22NO4HNO3(浓)===O2+4NO2+2H2O光照1Cl2+SO2 +2H2O===H2SO4 +2HCl SO2+Br2+2H2O===H2SO4+2HBr SO2+2H2S===3S+2H2O2SO2+O2催化剂△2SO3③2H2SO4(浓)+C △CO2↑+2SO2↑+2H2O2H2SO4(浓)+Cu △CuSO4+SO2↑+2H2O2H2SO3+O2===2H2SO4七、卤素及其化合物①2F2 +2H2O===4HF+O2②3Cl2 +2P点燃2PCl35Cl2 +2P 点燃2PCl53Cl2 +2Fe点燃2FeCl3Cl2+Cu点燃CuCl2③2Cl2+2NaBr===2NaCl+Br2Cl2 +2NaI ===2NaCl+I2④Cl2+H2O===HCl+HClO⑤Cl2+2NaOH===NaCl+NaClO+H2O2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O3Cl2+6KOH(热,浓)===5KCl+KClO3+3H2O⑥4HCl(浓)+MnO2△MnCl2+Cl2↑+2H2O八、铁及其化合物①3Fe+4H2O(g)高温Fe3O4+4H2②2FeCl3+Fe===3FeCl22FeCl3+Cu===2FeCl2+CuCl2③2FeCl2+Cl2===2FeCl3九、水解①3CO32-+2Al3++3H2O===2Al(OH)3↓+3CO2↑3CO32-+2Fe3++3H2O===2Fe(OH)3↓+3CO2↑②3HCO3-+Al3+===Al(OH)3↓+3CO2↑3HCO3-+Fe3+===Fe(OH)3↓+3CO2↑③3S2-+Al3++6H2O===2Al(OH)3↓+3H2S↑④3[Al(OH)4]-+Al3+===4Al(OH)3↓十、原电池①铜锌原电池(电解质为硫酸铜溶液)负极:Zn—2e-=== Zn2+正极:Cu2++2e-===Cu电池反应:Zn +Cu2+ === Zn2++ Cu②氢氧燃料电池(电解质为酸性溶液):负极:2H2—4e-===4H+正极:O2+4H+ +4e-===2H2O电池反应:2H2+O2===2H2O③氢氧燃料电池(电解质为KOH溶液):负极:2H2+4OH--4e-===4H2O正极:O2+4H2O+4e-===4OH-电池反应:2H2+O2===2H2O④乙醇燃料电池(电解质为KOH溶液):负极:C2H5OH+16OH-===2CO32-+11H2O+12e-正极: O2+2H2O+4e-===4OH-电池反应:C2H5OH + 4OH-+3O2===2CO32-+ 5H2O十一、电解池①电解饱和食盐水:2Cl-+2H2O===Cl2+H2+2OH-阴极:2H+ +2e-=== H2↑阳极:2Cl- —2e-=== Cl2↑②电解硫酸铜溶液:2Cu2+ + 2H2O === 2Cu + O2 ↑+ 4H+阴极:2Cu2+ + 4e-===2Cu阳极:4OH-— 4e-===O2↑+2H2O③电解硫酸溶液:2H2O===2H2↑+ O2↑阴极:4H+ +4e-===2H2↑阳极:4OH--4e-=== O2↑+2H2O④电解精炼铜:阴极:Cu2+ +2e-=== Cu阳极:Cu —2e-=== Cu2+2限时45分钟,)一级方程式(限15分钟完成)1.钠在空气中点燃:2.用固液不加热法制O2的2种方法:3.P在足量氯气中点燃:4.有氮气参加的三个反应:;;。
化学方程式大全(免费)

一般通过电解熔融态的MgCl2和Al2O3制Mg和Al.
Fe2O3+3H2=2Fe+3H2O (制还原铁粉)
Fe3O4+4H2 3Fe+4H2O
(3)、与水的作用
Na2O+H2O=2NaOH
2Na2O2+2H2O=4NaOH+O2↑
(此反应分两步Na2O2+2H2O=2NaOH+H2O2;
Cl2+H2=2HCl (光照或点燃)
3Cl2+2P 2PCl3
Cl2+PCl3 PCl5
Cl2+2Na 2NaCl
3Cl2+2Fe 2FeCl3
Cl2+2FeCl2=2FeCl3
Cl2+Cu CuCl2
2Cl2+2NaBr=2NaCl+Br2
Clห้องสมุดไป่ตู้+2NaI=2NaCl+I2
* 5Cl2+I2+6H2O=2HIO3+10HCl
2Mg + CO2 2MgO+C
(CO2不能用于扑灭由Mg、Ca、Ba、Na、K等燃烧的火灾)
* SiO2+2H2 Si+2H2O
* SiO2+2Mg 2MgO+Si
(3)、与水的作用
SO2+H2O=H2SO3
SO3+H2O=H2SO4
3NO2+H2O=2HNO3+NO
N2O5+H2O=2HNO3
P2O5+H2O(冷)=2HPO3
2Al+3H2SO4=Al2(SO4)3+3H2↑
方程式汇总

方程式汇总是指将多个方程式整理在一起,以便于查阅和参考。
以下是一些常见的化学方程式汇总:
氢气与氧气反应生成水:2H2 + O2 = 2H2O
铁与盐酸反应生成氯化亚铁和氢气:Fe + 2HCl = FeCl2 + H2
氧化铁与盐酸反应生成氯化铁和水:Fe2O3 + 6HCl = 2FeCl3 + 3H2O
氢氧化钠与盐酸反应生成氯化钠和水:NaOH + HCl = NaCl + H2O
硫酸与氢氧化钠反应生成硫酸钠和水:H2SO4 + 2NaOH = Na2SO4 + 2H2O
碳酸钙与盐酸反应生成氯化钙、水和二氧化碳:CaCO3 + 2HCl = CaCl2 + H2O + CO2
一氧化碳与氧气反应生成二氧化碳:2CO + O2 = 2CO2
甲烷在空气中燃烧生成二氧化碳和水:CH4 + 2O2 = CO2 + 2H2O
乙醇在空气中燃烧生成二氧化碳和水:C2H5OH + 3O2 = 2CO2 + 3H2O
葡萄糖在空气中燃烧生成二氧化碳和水:C6H12O6 + 6O2 = 6CO2 + 6H2O
以上是一些常见的化学方程式,仅供参考。
高中化学方程式大全(完整版)

高中化学方程式大全(完整版) Chapter 1: Halogensn 1: Chlorine Gas1.2NaCl → 2Na + Cl2 (n)2.Cu + Cl2 → CuCl2 (n)3.2Fe + 3Cl2 → 2FeCl3 (n)4.H2 + Cl2 → 2HCl (n under light)5.2P + 3Cl2 → 2PCl3 (n)6.PCl3 + Cl2 → PCl57.Cl2 + H2O → HCl + HClO8.2Ca(OH)2 + 2Cl2 → Ca(ClO)2 + CaCl2 + 2H2O9.Ca(ClO)2 + CO2 + H2O → CaCO3 ↓ + 2HClO10.2NaOH + Cl2 → NaClO + NaCl + H2O11.MnCl2 + 2H2O + Cl2 → Δ MnO2 + 2HClO12.2KMnO4 + 16HCl (concentrated) → 2MnCl2 + 2KCl + 5Cl2 ↑ + 8H2O13.2HClO → (light)n 2: Hydrogen Chloride14.NaCl + H2SO4 (concentrated) → NaHSO4 + HCl ↑15.NaHSO4 + NaCl → Na2SO4 + HCl ↑ (combined with 14)16.2NaCl + H2SO4 (concentrated)17.HCl + AgNO3 → AgCl ↓ + HNO318.NaCl + AgNO3 → AgCl ↓ + NaNO319.KCl + AgNO3 → AgCl ↓ + KNO320.2HCl + CaCO3 → CaCl2 + H2O + CO2↑n 3: Redox ns21.CuO + H2 → Cu + H2O22.C + 4HNO3 → CO2 ↑ + 4NO2 ↑ + 2H2O23.4Zn + 10HNO3 (very dilute) → 4Zn(NO3)2 + NH4NO3 + 3H2O24.11P + 15CuSO4 + 24H2O → 5Cu3P + 6H3PO4 +15H2SO425.KClO3 + 6HCl (concentrated) → 3Cl2 ↑ + KCl + 3H2O26.4Mg + 10HNO3 (very dilute) → 4Mg(NO3)2 + NH4NO3 + 3H2O27.K2Cr2O7 + 6Fe3O4 + 31H2SO4 → Cr2(SO4)3 +9Fe2(SO4)3 + K2SO4第四节卤族元素卤族元素是指周期表中第17族元素,包括氟、氯、溴、碘和石蕊。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学方程式大全+高中的数学公式定理大集中非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si)1, 氧化性:F2 + H2 === 2HFF2 +Xe(过量)===XeF22F2(过量)+Xe===XeF4nF2 +2M===2MFn (表示大部分金属)2F2 +2H2O===4HF+O22F2 +2NaOH===2NaF+OF2 +H2OF2 +2NaCl===2NaF+Cl2F2 +2NaBr===2NaF+Br2F2+2NaI ===2NaF+I2F2 +Cl2 (等体积)===2ClF3F2 (过量)+Cl2===2ClF37F2(过量)+I2 ===2IF7Cl2 +H2 ===2HCl3Cl2 +2P===2PCl3Cl2 +PCl3 ===PCl5Cl2 +2Na===2NaCl3Cl2 +2Fe===2FeCl3Cl2 +2FeCl2 ===2FeCl3Cl2+Cu===CuCl22Cl2+2NaBr===2NaCl+Br2Cl2 +2NaI ===2NaCl+I25Cl2+I2+6H2O===2HIO3+10HCl Cl2 +Na2S===2NaCl+SCl2 +H2S===2HCl+SCl2+SO2 +2H2O===H2SO4 +2HCl Cl2 +H2O2 ===2HCl+O22O2 +3Fe===Fe3O4O2+K===KO2S+H2===H2S2S+C===CS2S+Fe===FeSS+2Cu===Cu2S3S+2Al===Al2S3S+Zn===ZnSN2+3H2===2NH3N2+3Mg===Mg3N2N2+3Ca===Ca3N2N2+3Ba===Ba3N2N2+6Na===2Na3NN2+6K===2K3NN2+6Rb===2Rb3NP2+6H2===4PH3P+3Na===Na3P2P+3Zn===Zn3P22.还原性S+O2===SO2S+O2===SO2S+6HNO3(浓)===H2SO4+6NO2+2H2O3S+4 HNO3(稀)===3SO2+4NO+2H2ON2+O2===2NO4P+5O2===P4O10(常写成P2O5)2P+3X2===2PX3 (X表示F2,Cl2,Br2)PX3+X2===PX5P4+20HNO3(浓)===4H3PO4+20NO2+4H2OC+2F2===CF4C+2Cl2===CCl42C+O2(少量)===2COC+O2(足量)===CO2C+CO2===2COC+H2O===CO+H2(生成水煤气)2C+SiO2===Si+2CO(制得粗硅)Si(粗)+2Cl===SiCl4(SiCl4+2H2===Si(纯)+4HCl)Si(粉)+O2===SiO2Si+C===SiC(金刚砂)Si+2NaOH+H2O===Na2SiO3+2H23,(碱中)歧化Cl2+H2O===HCl+HClO(加酸抑制歧化,加碱或光照促进歧化)Cl2+2NaOH===NaCl+NaClO+H2O 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O3Cl2+6KOH(热,浓)===5KCl+KClO3+3H2O 3S+6NaOH===2Na2S+Na2SO3+3H2O4P+3KOH(浓)+3H2O===PH3+3KH2PO211P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO43C+CaO===CaC2+CO3C+SiO2===SiC+2CO二,金属单质(Na,Mg,Al,Fe)的还原性2Na+H2===2NaH4Na+O2===2Na2O2Na2O+O2===2Na2O22Na+O2===Na2O22Na+S===Na2S(爆炸)2Na+2H2O===2NaOH+H22Na+2NH3===2NaNH2+H24Na+TiCl4(熔融)===4NaCl+TiMg+Cl2===MgCl2Mg+Br2===MgBr22Mg+O2===2MgOMg+S===MgSMg+2H2O===Mg(OH)2+H22Mg+TiCl4(熔融)===Ti+2MgCl2Mg+2RbCl===MgCl2+2Rb2Mg+CO2===2MgO+C2Mg+SiO2===2MgO+SiMg+H2S===MgS+H2Mg+H2SO4===MgSO4+H22Al+3Cl2===2AlCl34Al+3O2===2Al2O3(钝化)4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg 4Al+3MnO2===2Al2O3+3Mn2Al+Cr2O3===Al2O3+2Cr2Al+Fe2O3===Al2O3+2Fe2Al+3FeO===Al2O3+3Fe2Al+6HCl===2AlCl3+3H22Al+3H2SO4===Al2(SO4)3+3H22Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O (Al,Fe在冷,浓的H2SO4,HNO3中钝化)Al+4HNO(稀)===Al(NO3)3+NO+2H2O2Al+2NaOH+2H2O===2NaAlO2+3H22Fe+3Br2===2FeBr3Fe+I2===FeI2Fe+S===FeS3Fe+4H2O(g)===Fe3O4+4H2Fe+2HCl===FeCl2+H2Fe+CuCl2===FeCl2+CuFe+SnCl4===FeCl2+SnCl2(铁在酸性环境下,不能把四氯化锡完全还原为单质锡Fe+SnCl2==FeCl2+Sn)三, 非金属氢化物(HF,HCl,H2O,H2S,NH3)1,还原性:4HCl(浓)+MnO2===MnCl2+Cl2+2H2O4HCl(g)+O2===2Cl2+2H2O16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O 14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O2H2O+2F2===4HF+O22H2S+3O2(足量)===2SO2+2H2O2H2S+O2(少量)===2S+2H2OH2S+H2SO4(浓)===S+SO2+2H2O3H2S+2HNO(稀)===3S+2NO+4H2O5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O 3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2O H2S+4Na2O2+2H2O===Na2SO4+6NaOH2NH3+3CuO===3Cu+N2+3H2O2NH3+3Cl2===N2+6HCl8NH3+3Cl2===N2+6NH4Cl4NH3+3O2(纯氧)===2N2+6H2O4NH3+5O2===4NO+6H2O4NH3+6NO===5N2+6HO(用氨清除NO)NaH+H2O===NaOH+H24NaH+TiCl4===Ti+4NaCl+2H2CaH2+2H2O===Ca(OH)2+2H22,酸性:4HF+SiO2===SiF4+2H2O(此反应广泛应用于测定矿样或钢样中SiO2的含量)2HF+CaCl2===CaF2+2HClH2S+Fe===FeS+H2H2S+CuCl2===CuS+2HClH2S+2AgNO3===Ag2S+2HNO3H2S+Pb(NO3)2===PbS+2HNO3H2S+FeCl2===2NH3+2Na==2NaNH2+H2(NaNH2+H2O===NaOH+NH3)3,碱性:NH3+HCl===NH4ClNH3+HNO3===NH4NO32NH3+H2SO4===(NH4)2SO4NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl (此反应用于工业制备小苏打,苏打)4,不稳定性:2HF===H2+F22HCl===H2+Cl22H2O===2H2+O22H2O2===2H2O+O2H2S===H2+S2NH3===N2+3H2四,非金属氧化物低价态的还原性:2SO2+O2===2SO32SO2+O2+2H2O===2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)SO2+Cl2+2H2O===H2SO4+2HClSO2+Br2+2H2O===H2SO4+2HBrSO2+I2+2H2O===H2SO4+2HISO2+NO2===SO3+NO2NO+O2===2NO2NO+NO2+2NaOH===2NaNO2 (用于制硝酸工业中吸收尾气中的NO和NO2)2CO+O2===2CO2CO+CuO===Cu+CO23CO+Fe2O3===2Fe+3CO2CO+H2O===CO2+H2氧化性:SO2+2H2S===3S+2H2OSO3+2KI===K2SO3+I2NO2+2KI+H2O===NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)4NO2+H2S===4NO+SO3+H2O2NO2+Cu===4CuO+N2CO2+2Mg===2MgO+C(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)SiO2+2H2===Si+2H2OSiO2+2Mg===2MgO+Si3,与水的作用:SO2+H2O===H2SO3SO3+H2O===H2SO43NO2+H2O===2HNO3+NON2O5+H2O===2HNO3P2O5+H2O===2HPO3P2O5+3H2O===2H3PO4(P2O5极易吸水,可作气体干燥剂P2O5+3H2SO4(浓)===2H3PO4+3SO3)CO2+H2O===H2CO34,与碱性物质的作用:SO2+2NH3+H2O===(NH4)2SO3SO2+(NH4)2SO3+H2O===2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,再用H2SO4处理:2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2 生成的硫酸铵作化肥,SO2循环作原料气)SO2+Ca(OH)2===CaSO3+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO3+MgO===MgSO4SO3+Ca(OH)2===CaSO4+H2OCO2+2NaOH(过量)===Na2CO3+H2OCO2(过量)+NaOH===NaHCO3CO2+Ca(OH)2(过量)===CaCO3+H2O2CO2(过量)+Ca(OH)2===Ca(HCO3)2 CO2+2NaAlO2+3H2O===2Al(OH)3+Na2CO3CO2+C6H5ONa+H2O===C6H5OH+NaHCO3SiO2+CaO===CaSiO3SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3===Na2SiO3+CO2SiO2+CaCO3===CaSiO3+CO2五,金属氧化物1,低价态的还原性:6FeO+O2===2Fe3O4FeO+4HNO3===Fe(NO3)3+NO2+2H2O2,氧化性:Na2O2+2Na===2Na2O(此反应用于制备Na2O)MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al.一般通过电解制Mg和Al.Fe2O3+3H2===2Fe+3H2O (制还原铁粉)Fe3O4+4H2===3Fe+4H2O3,与水的作用:Na2O+H2O===2NaOH2Na2O2+2H2O===4NaOH+O2(此反应分两步:Na2O2+2H2O===2NaOH+H2O2 ; 2H2O2===2H2O+O2. H2O2的制备可利用类似的反应: BaO2+H2SO4(稀)===BaSO4+H2O2)MgO+H2O===Mg(OH)2 (缓慢反应)4,与酸性物质的作用:Na2O+SO3===Na2SO4Na2O+CO2===Na2CO3Na2O+2HCl===2NaCl+H2O2Na2O2+2CO2===2Na2CO3+O2Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2MgO+SO3===MgSO4MgO+H2SO4===MgSO4+H2OAl2O3+3H2SO4===Al2(SO4)3+3H2O(Al2O3是两性氧化物:Al2O3+2NaOH===2NaAlO2+H2O)FeO+2HCl===FeCl2+3H2OFe2O3+6HCl===2FeCl3+3H2OFe2O3+3H2S(g)===Fe2S3+3H2OFe3O4+8HCl===FeCl2+2FeCl3+4H2O六,含氧酸1,氧化性:4HClO3+3H2S===3H2SO4+4HClHClO3+HI===HIO3+HCl3HClO+HI===HIO3+3HClHClO+H2SO3===H2SO4+HClHClO+H2O2===HCl+H2O+O2 (氧化性:HClO>HClO2>HClO3>HClO4,但浓,热的HClO4氧化性很强)2H2SO4(浓)+C===CO2+2SO2+2H2O 2H2SO4(浓)+S===3SO2+2H2OH2SO4+Fe(Al) 室温下钝化6H2SO4(浓)+2Fe===Fe2(SO4)3+3SO2+6H2O 2H2SO4(浓)+Cu===CuSO4+SO2+2H2OH2SO4(浓)+2HBr===SO2+Br2+2H2OH2SO4(浓)+2HI===SO2+I2+2H2OH2SO4(稀)+Fe===FeSO4+H22H2SO3+2H2S===3S+2H2O4HNO3(浓)+C===CO2+4NO2+2H2O6HNO3(浓)+S===H2SO4+6NO2+2H2O5HNO3(浓)+P===H3PO4+5NO2+H2O6HNO3+Fe===Fe(NO3)3+3NO2+3H2O4HNO3+Fe===Fe(NO3)3+NO+2H2O30HNO3+8Fe===8Fe(NO3)3+3N2O+15H2O36HNO3+10Fe===10Fe(NO3)3+3N2+18H2O30HNO3+8Fe===8Fe(NO3)3+3NH4NO3+9H2O2,还原性:H2SO3+X2+H2O===H2SO4+2HX(X表示Cl2,Br2,I2)2H2SO3+O2===2H2SO4H2SO3+H2O2===H2SO4+H2O5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2O H2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl3,酸性:H2SO4(浓) +CaF2===CaSO4+2HFH2SO4(浓)+NaCl===NaHSO4+HClH2SO4(浓) +2NaCl===Na2SO4+2HClH2SO4(浓)+NaNO3===NaHSO4+HNO3 3H2SO4(浓)+Ca3(PO4)2===3CaSO4+2H3PO42H2SO4(浓)+Ca3(PO4)2===2CaSO4+Ca(H2PO4)2 3HNO3+Ag3PO4===H3PO4+3AgNO32HNO3+CaCO3===Ca(NO3)2+H2O+CO2(用HNO3和浓H2SO4不能制备H2S,HI,HBr,(SO2)等还原性气体)4H3PO4+Ca3(PO4)2===3Ca(H2PO4)2(重钙)H3PO4(浓)+NaBr===NaH2PO4+HBrH3PO4(浓)+NaI===NaH2PO4+HI4,不稳定性:2HClO===2HCl+O24HNO3===4NO2+O2+2H2OH2SO3===H2O+SO2H2CO3===H2O+CO2H4SiO4===H2SiO3+H2O七,碱低价态的还原性:4Fe(OH)2+O2+2H2O===4Fe(OH)3与酸性物质的作用:2NaOH+SO2(少量)===Na2SO3+H2ONaOH+SO2(足量)===NaHSO32NaOH+SiO2===NaSiO3+H2O2NaOH+Al2O3===2NaAlO2+H2O2NaOH+Cl2===NaCl+NaClO+H2ONaOH+HCl===NaCl+H2ONaOH+H2S(足量)===NaHS+H2O2NaOH+H2S(少量)===Na2S+2H2O3NaOH+AlCl3===Al(OH)3+3NaClNaOH+Al(OH)3===NaAlO2+2H2O(AlCl3和Al(OH)3哪个酸性强?)NaOH+NH4Cl===NaCl+NH3+H2OMg(OH)2+2NH4Cl===MgCl2+2NH3.H2OAl(OH)3+NH4Cl 不溶解3,不稳定性:Mg(OH)2===MgO+H2O2Al(OH)3===Al2O3+3H2O2Fe(OH)3===Fe2O3+3H2OCu(OH)2===CuO+H2O八,盐1,氧化性:2FeCl3+Fe===3FeCl22FeCl3+Cu===2FeCl2+CuCl2(用于雕刻铜线路版)2FeCl3+Zn===2FeCl2+ZnCl2FeCl3+Ag===FeCl2+AgCFe2(SO4)3+2Ag===FeSO4+Ag2SO4(较难反应)Fe(NO3)3+Ag 不反应2FeCl3+H2S===2FeCl2+2HCl+S2FeCl3+2KI===2FeCl2+2KCl+I2FeCl2+Mg===Fe+MgCl22,还原性:2FeCl2+Cl2===2FeCl33Na2S+8HNO3(稀)===6NaNO3+2NO+3S+4H2O3Na2SO3+2HNO3(稀)===3Na2SO4+2NO+H2O2Na2SO3+O2===2Na2SO43,与碱性物质的作用:MgCl2+2NH3.H2O===Mg(OH)2+NH4ClAlCl3+3NH3.H2O===Al(OH)3+3NH4ClFeCl3+3NH3.H2O===Fe(OH)3+3NH4Cl4,与酸性物质的作用:Na3PO4+HCl===Na2HPO4+NaClNa2HPO4+HCl===NaH2PO4+NaClNaH2PO4+HCl===H3PO4+NaClNa2CO3+HCl===NaHCO3+NaClNaHCO3+HCl===NaCl+H2O+CO23Na2CO3+2AlCl3+3H2O===2Al(OH)3+3CO2+6NaCl 3Na2CO3+2FeCl3+3H2O===2Fe(OH)3+3CO2+6NaCl 3NaHCO3+AlCl3===Al(OH)3+3CO23NaHCO3+FeCl3===Fe(OH)3+3CO2 3Na2S+Al2(SO4)3+6H2O===2Al(OH)3+3H2S 3NaAlO2+AlCl3+6H2O===4Al(OH)35,不稳定性:Na2S2O3+H2SO4===Na2SO4+S+SO2+H2ONH4Cl===NH3+HClNH4HCO3===NH3+H2O+CO22KNO3===2KNO2+O22Cu(NO3)3===2CuO+4NO2+O22KMnO4===K2MnO4+MnO2+O22KClO3===2KCl+3O22NaHCO3===Na2CO3+H2O+CO2Ca(HCO3)2===CaCO3+H2O+CO2CaCO3===CaO+CO2MgCO3===MgO+CO2高中化学方程式总结非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si)1, 氧化性:F2 + H2 === 2HFF2 +Xe(过量)===XeF22F2(过量)+Xe===XeF4nF2 +2M===2MFn (表示大部分金属)2F2 +2H2O===4HF+O22F2 +2NaOH===2NaF+OF2 +H2OF2 +2NaCl===2NaF+Cl2F2 +2NaBr===2NaF+Br2F2+2NaI ===2NaF+I2F2 +Cl2 (等体积)===2ClF3F2 (过量)+Cl2===2ClF37F2(过量)+I2 ===2IF7Cl2 +H2 ===2HCl3Cl2 +2P===2PCl3Cl2 +PCl3 ===PCl5Cl2 +2Na===2NaCl3Cl2 +2Fe===2FeCl3Cl2 +2FeCl2 ===2FeCl3Cl2+Cu===CuCl22Cl2+2NaBr===2NaCl+Br2Cl2 +2NaI ===2NaCl+I25Cl2+I2+6H2O===2HIO3+10HCl Cl2 +Na2S===2NaCl+SCl2 +H2S===2HCl+SCl2+SO2 +2H2O===H2SO4 +2HCl Cl2 +H2O2 ===2HCl+O22O2 +3Fe===Fe3O4O2+K===KO2S+H2===H2S2S+C===CS2S+Fe===FeSS+2Cu===Cu2S3S+2Al===Al2S3S+Zn===ZnSN2+3H2===2NH3N2+3Mg===Mg3N2N2+3Ca===Ca3N2N2+3Ba===Ba3N2N2+6Na===2Na3NN2+6K===2K3NN2+6Rb===2Rb3NP2+6H2===4PH3P+3Na===Na3P2P+3Zn===Zn3P22.还原性S+O2===SO2S+O2===SO2S+6HNO3(浓)===H2SO4+6NO2+2H2O 3S+4 HNO3(稀)===3SO2+4NO+2H2ON2+O2===2NO4P+5O2===P4O10(常写成P2O5)2P+3X2===2PX3 (X表示F2,Cl2,Br2)PX3+X2===PX5P4+20HNO3(浓)===4H3PO4+20NO2+4H2OC+2F2===CF4C+2Cl2===CCl42C+O2(少量)===2COC+O2(足量)===CO2C+CO2===2COC+H2O===CO+H2(生成水煤气)2C+SiO2===Si+2CO(制得粗硅)Si(粗)+2Cl===SiCl4(SiCl4+2H2===Si(纯)+4HCl)Si(粉)+O2===SiO2Si+C===SiC(金刚砂)Si+2NaOH+H2O===Na2SiO3+2H23,(碱中)歧化Cl2+H2O===HCl+HClO(加酸抑制歧化,加碱或光照促进歧化)Cl2+2NaOH===NaCl+NaClO+H2O2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O 3Cl2+6KOH(热,浓)===5KCl+KClO3+3H2O 3S+6NaOH===2Na2S+Na2SO3+3H2O4P+3KOH(浓)+3H2O===PH3+3KH2PO211P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO43C+CaO===CaC2+CO3C+SiO2===SiC+2CO二,金属单质(Na,Mg,Al,Fe)的还原性2Na+H2===2NaH4Na+O2===2Na2O2Na2O+O2===2Na2O22Na+O2===Na2O22Na+S===Na2S(爆炸)2Na+2H2O===2NaOH+H22Na+2NH3===2NaNH2+H24Na+TiCl4(熔融)===4NaCl+TiMg+Cl2===MgCl2Mg+Br2===MgBr22Mg+O2===2MgOMg+S===MgSMg+2H2O===Mg(OH)2+H22Mg+TiCl4(熔融)===Ti+2MgCl2Mg+2RbCl===MgCl2+2Rb2Mg+CO2===2MgO+C2Mg+SiO2===2MgO+SiMg+H2S===MgS+H2Mg+H2SO4===MgSO4+H22Al+3Cl2===2AlCl34Al+3O2===2Al2O3(钝化)4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg 4Al+3MnO2===2Al2O3+3Mn2Al+Cr2O3===Al2O3+2Cr2Al+Fe2O3===Al2O3+2Fe2Al+3FeO===Al2O3+3Fe2Al+6HCl===2AlCl3+3H22Al+3H2SO4===Al2(SO4)3+3H22Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O (Al,Fe在冷,浓的H2SO4,HNO3中钝化)Al+4HNO(稀)===Al(NO3)3+NO+2H2O2Al+2NaOH+2H2O===2NaAlO2+3H22Fe+3Br2===2FeBr3Fe+I2===FeI2Fe+S===FeS3Fe+4H2O(g)===Fe3O4+4H2Fe+2HCl===FeCl2+H2Fe+CuCl2===FeCl2+CuFe+SnCl4===FeCl2+SnCl2(铁在酸性环境下,不能把四氯化锡完全还原为单质锡Fe+SnCl2==FeCl2+Sn)三, 非金属氢化物(HF,HCl,H2O,H2S,NH3)1,还原性:4HCl(浓)+MnO2===MnCl2+Cl2+2H2O4HCl(g)+O2===2Cl2+2H2O16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O2H2O+2F2===4HF+O22H2S+3O2(足量)===2SO2+2H2O2H2S+O2(少量)===2S+2H2O2H2S+SO2===3S+2H2OH2S+H2SO4(浓)===S+SO2+2H2O3H2S+2HNO(稀)===3S+2NO+4H2O5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O 3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2O H2S+4Na2O2+2H2O===Na2SO4+6NaOH2NH3+3CuO===3Cu+N2+3H2O2NH3+3Cl2===N2+6HCl8NH3+3Cl2===N2+6NH4Cl4NH3+3O2(纯氧)===2N2+6H2O4NH3+5O2===4NO+6H2O4NH3+6NO===5N2+6HO(用氨清除NO)NaH+H2O===NaOH+H24NaH+TiCl4===Ti+4NaCl+2H2CaH2+2H2O===Ca(OH)2+2H22,酸性:4HF+SiO2===SiF4+2H2O(此反应广泛应用于测定矿样或钢样中SiO2的含量)2HF+CaCl2===CaF2+2HClH2S+Fe===FeS+H2H2S+CuCl2===CuS+2HClH2S+2AgNO3===Ag2S+2HNO3H2S+HgCl2===HgS+2HClH2S+Pb(NO3)2===PbS+2HNO3H2S+FeCl2===2NH3+2Na==2NaNH2+H2(NaNH2+H2O===NaOH+NH3)3,碱性:NH3+HCl===NH4ClNH3+HNO3===NH4NO32NH3+H2SO4===(NH4)2SO4NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl (此反应用于工业制备小苏打,苏打)4,不稳定性:2HF===H2+F22HCl===H2+Cl22H2O===2H2+O22H2O2===2H2O+O2H2S===H2+S2NH3===N2+3H2四,非金属氧化物低价态的还原性:2SO2+O2===2SO32SO2+O2+2H2O===2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)SO2+Cl2+2H2O===H2SO4+2HClSO2+Br2+2H2O===H2SO4+2HBrSO2+I2+2H2O===H2SO4+2HISO2+NO2===SO3+NO2NO+O2===2NO2NO+NO2+2NaOH===2NaNO2(用于制硝酸工业中吸收尾气中的NO和NO2)2CO+O2===2CO2CO+CuO===Cu+CO23CO+Fe2O3===2Fe+3CO2CO+H2O===CO2+H2氧化性:SO2+2H2S===3S+2H2OSO3+2KI===K2SO3+I2NO2+2KI+H2O===NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)4NO2+H2S===4NO+SO3+H2O2NO2+Cu===4CuO+N2CO2+2Mg===2MgO+C(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)SiO2+2H2===Si+2H2OSiO2+2Mg===2MgO+Si3,与水的作用:SO2+H2O===H2SO3SO3+H2O===H2SO43NO2+H2O===2HNO3+NON2O5+H2O===2HNO3P2O5+H2O===2HPO3P2O5+3H2O===2H3PO4(P2O5极易吸水,可作气体干燥剂P2O5+3H2SO4(浓)===2H3PO4+3SO3)CO2+H2O===H2CO34,与碱性物质的作用:SO2+2NH3+H2O===(NH4)2SO3SO2+(NH4)2SO3+H2O===2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,再用H2SO4处理:2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2 生成的硫酸铵作化肥,SO2循环作原料气)SO2+Ca(OH)2===CaSO3+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO3+MgO===MgSO4SO3+Ca(OH)2===CaSO4+H2OCO2+2NaOH(过量)===Na2CO3+H2OCO2(过量)+NaOH===NaHCO3CO2+Ca(OH)2(过量)===CaCO3+H2O2CO2(过量)+Ca(OH)2===Ca(HCO3)2CO2+2NaAlO2+3H2O===2Al(OH)3+Na2CO3 CO2+C6H5ONa+H2O===C6H5OH+NaHCO3SiO2+CaO===CaSiO3SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3===Na2SiO3+CO2SiO2+CaCO3===CaSiO3+CO2高中的数学公式定理大集中三角函数公式表同角三角函数的基本关系式倒数关系: 商的关系:平方关系:tanα 〃cotα=1sinα 〃cscα=1cosα 〃secα=1 sinα/cosα=tanα=secα/cscαcosα/sinα=cotα=cscα/secα sin2α+cos2α=11+tan2α=sec2α1+cot2α=csc2α(六边形记忆法:图形结构“上弦中切下割,左正右余中间1”;记忆方法“对角线上两个函数的积为1;阴影三角形上两顶点的三角函数值的平方和等于下顶点的三角函数值的平方;任意一顶点的三角函数值等于相邻两个顶点的三角函数值的乘积。
