实验05金属相图(Pb-Sn体系)
金属相图
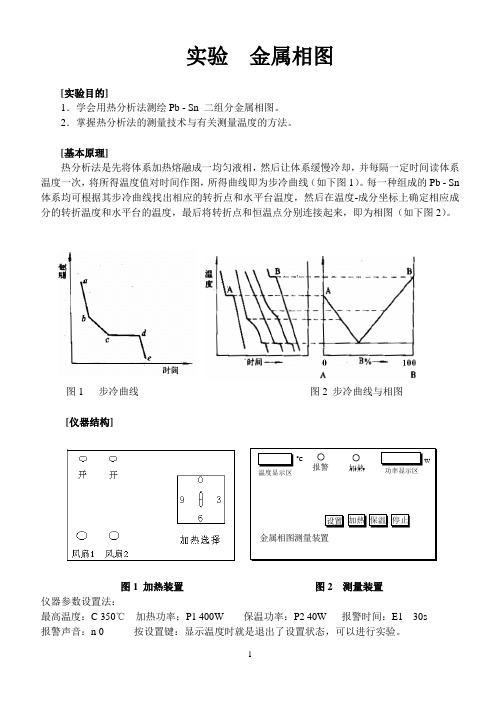
实验 金属相图[实验目的]1.学会用热分析法测绘Pb - Sn 二组分金属相图。
2.掌握热分析法的测量技术与有关测量温度的方法。
[基本原理]热分析法是先将体系加热熔融成一均匀液相,然后让体系缓慢冷却,并每隔一定时间读体系温度一次,将所得温度值对时间作图,所得曲线即为步冷曲线(如下图1)。
每一种组成的Pb - Sn 体系均可根据其步冷曲线找出相应的转折点和水平台温度,然后在温度-成分坐标上确定相应成分的转折温度和水平台的温度,最后将转折点和恒温点分别连接起来,即为相图(如下图2)。
图1 步冷曲线 图2 步冷曲线与相图[仪器结构]图1 加热装置 图2 测量装置仪器参数设置法:最高温度:C 350℃ 加热功率:P1 400W保温功率:P2 40W 报警时间:E1 30s 报警声音:n 0 按设置键:显示温度时就是退出了设置状态,可以进行实验。
[实验步骤]1.配制样品。
配制含锡量分别为20%,40%,61.9%,80%的铅-锡混合物各100g,装入4个样品管中,然后在样品管内插入玻璃套管(管中应有硅油,增加热传导系数),并在样品上方盖一层石墨粉;2.将需加热的样品管放入一炉子中,将加热选择旋钮指向该加热炉(加热炉和选择旋钮上均有数字标号),并将测温传感器置于需加热的样品管中;3.设定具体需加热的温度,加热功率和保温功率,本实验中这些参数依次设定为350o C,400W, 40W,参数设定完成后, 按下“加热”键,即进入加热状态;4.当测量装置上的温度示值接近于330 O C时,可停止加热。
待样品熔化后,用玻璃套管小心搅拌样品;5.待温度降到需要记录的温度值时(比如305 C),可点击测量软件中的“开始实验”按钮,降温过程中,若降温速度太慢,可打开风扇;若降温速度太快,则可按“保温”键,适当增加加热量。
当温度降到平台以下,停止记录。
按照上述步骤,测定不同组成金属混合物的温度—时间曲线。
[数据处理]1.依实验数据绘制T-t步冷曲线,6根曲线绘制在同一张图上;2.依样品的组成和步冷曲线中转折点和平台的温度绘制出Pb-Sn的T-w金属相图;3.你所测得的Pb, Sn的熔点与教材(东北师大第90面)上的值的相对误差分别为:%, %.[问答题]金属相图的用途有哪些?----------------------------------------------------------------------------------------------------------------班级: 姓名: 学号: 实验日期: 分数: 教师:。
物理化学实验实验报告五

二组分简单共熔系统相图的绘制一.实验目的1.用热分析法测绘Pb-Sn相图。
2.熟悉热分析法的测量原理。
3.掌握热电偶的制作、标定和测温技术。
二.实验原理本实验采用热分析法中的步冷曲线方法绘制Pb-Sn系统的固液平衡相图。
将系统加热熔融成一均匀液相,然后使其缓慢冷却,每隔一定时间记录一次温度,表示温度与时间的关系曲线,称为步冷曲线。
当熔融系统在均匀冷却过程中无相的变化,其温度将连续下降,得到一条光滑的冷却曲线,如在冷却过程中发生相变,则因放出相变热,使热损失有所抵偿。
步冷曲线就会出现转折点或水平线段。
转折点所对应的温度,即为该组成合金的相变温度。
对简单共熔系统,由这些步冷曲线,即可绘出合金相图。
用热分析法测绘相图时,被测系统必须时时处于或接近相平衡状态,因此,系统的冷却速度必须足够慢,才能得到较好的结果。
冷却速度是本实验成功的关键,冷却速度慢,被测系统时时处于或接近平衡状态,实验结果好。
冷却速度取决于冷却炉子的温度。
金属混合物冷却温度必须开始转折点以上30℃左右,否则不易读出第一转折点温度。
三.实验仪器和试剂仪器:镍铬—镍硅热电偶1支;UJ—36电势差计1台;高温管式电炉2只(加热炉、冷却炉);无纸记录仪一套(配备计算机系统)。
试剂:Pb、Sn、Bi、石墨粉。
四.实验步骤由于本次实验实验室已经制作好热偶电极、配备样品和安装仪器等工作,因此,实验的主要工作就是测绘步冷曲线。
依次测定质量分数Pb100%、Bi100%、Sn100%、Sn25%+Pb75%、Sn35%+ Pb65%、Sn45%+Pb55%、Sn61%+Pb39%、Sn75%+Pb25%等样品的冷却曲线。
装了样品的玻璃管放在加热炉中,接通电炉电源,使样品完全熔化后,再升高40℃,停止加热,然后把样品从加热炉中拿出放倒冷却炉中(冷却炉温度约比样品刚取出时低100℃左右)。
用无纸记录仪记录冷却过程中的热电势变化。
五.数据记录与处理室温:24.0℃大气压:102.81KPa电势温度转换公式:Y = 26.38645 + 24.36254 * X R=0.99993电势温度转换曲线:ζȵçÊÆ由以上电势温度转换曲线可以得到各个电势的温度数值。
Sn-Pb相图(Pb-Sn)

混合物步冷曲线如②、④所示,如② 起始温度下降很快(如a/b/段),冷却到b/ 点时,开始有固体A析出,这时体系呈两 相,因为液相的成分不断改变,所以其平 衡温度也不断改变。由于凝固热的不断放 出,其温度下降较慢,曲线的斜率较小 (b/c/段)。到了低共熔点c/后,体系出现 三相平衡L=A(s)+B(s),温度不再改变, 步冷曲线又出现水平段,直到液相完全凝 固后,温度又开始下降。
观察升温情况 启动自动平衡记 及时停止加热 录仪有关开关
取出样品、 观察降温情况 取出样品、放 实验结束记录 及时停止实验 入新样品测试 数据恢复原状
准备样品: 准备样品:
按以下比例配制
锡的百 分含量
0%
20%
30%
61.9%
80%
100%
锡(g) 70
61.9 38.1
样品加热及保温:
在样品表面覆盖少许石墨,插 好热电偶,围好保温砖,插上电炉 插头,开始加热。
何时停止加热? 何时停止加热?
纯Pb、纯Sn、含锡61.9%(低共 熔物)三个样品,如果出现转折点, 则停止加热。 含锡20%、含锡30%、含锡80%三 个样品,如果出现转折点,再升高 50 ℃后,则停止加热。 则停止加热。
实验结果与讨论
⑴结果:实测值为T铅= T锡= T低共熔= ⑵计算实验偏差: ⑶分析产生偏差的原因: ⑷有何建议与想法?
注意事项:
1.Pb-Sn混合物的液相必须均匀互溶(达 最高温度时,搅拌样品); 2.样品的降温速率必须缓慢; 3.操作过程中,要防止样品被氧化及混 入杂质; 4.热电偶要插到玻璃套的底部,以及热 电偶两极不能相碰。
0(Pb)
61.9%
100%(Sn)
Pb—Sn 金属相图
实验05金属相图(Pb-Sn体系)

药品仪器
1. EA/J2P00双笔自动平衡记录仪; 2. 电炉; 3. 镍铬—镍硅热电偶; 4. 大、小坩埚; 5. 保温瓶; 6. 坩埚钳; 7. 冰块、石墨; 8. 锡粒(AR),铅粒(AR); 9. 等等。
实验步骤
准备样品 取冰制热 小坩锅样品埋 加石墨覆盖 (按比例) 电偶零点 入大坩锅沙中 保温并加热
最低共熔点温度℃
181 181 181 181
最低共熔混合物组成: 含Sn63%
两种金属的
任何一种都能微 T/K
溶于另一种金属 中,是一个部分 600K
互溶的低共熔体 系,它用一般的 热分析法只能得
L(单相区)
505K
到一个相当于简
α
单的二元低共熔 454K
点相图(如本实
L+Pb(s) Pb(s)+Sn(s)
金属相图(Pb-Sn体系)
一、实验目的
二、实验原理
三、药品仪器
四、实验步骤
五、实验记录
六、数据处理
七、结果分析与讨论
八、注意事项
九、思考题
实验目的
⑴用热分析法测绘Pb-Sn二元金属相图, 并掌握应用步冷曲线数据绘制二元体系 相图的基本方法;
⑵了解步冷曲线及相图中各曲线所代表 的物理意义;
⑶学习并掌握热电偶的使用及校正和自 动平衡记录仪的使用方法。
温度到高 观察升温情况 启动自动平衡记 最点搅拌 及时停止加热 录仪有关开关
观察降温情况 取出样品、放 实验结束记录 及时停止实验 入新样品测试 数据恢复原状
准备样品:
按以下比例配制
锡的百 分含量
0%20% 30% 61.9% 80 Nhomakorabea 100%
锡(g) 0 20 30 61.9 80 100
金属相图(Pb-Sn体系)

实验数据记录
实验日期:
;室温: ℃;气压:
KPa
锡的百 0% 分含量 (纯铅)
20%
40%
61.9%
80% 100%
(低共熔物)
(纯锡)
转折点
(t℃)
水平段
(t℃)
数据处理
1.温度换算( ℃ 2.作出Pb-Sn相图; 3.与文献值比较。
K);
T/K
600K
454K
L+Pb(s)
L(单相区)
505K
固态晶形转变点。
真实的Pb—Sn 金属相图
实验结果与讨论
⑴结果:实测值为T铅= T锡= T低共熔=
⑵计算实验偏差: ⑶分析产生偏差的原因: ⑷有何建议与想法?
注意事项
1.Pb-Sn混合物的液相必须均匀互溶(达最高温 度时,搅拌样品);
2.样品的降温速率必须缓慢; 3.操作过程中,要防止样品被氧化及混入杂质; 4.热电偶温度计要插到玻璃套的底部。
观察升温情况 及时停止加热
取出样品、放 入新样品测试
实验结束记录 数据恢复原状
准备样品
按以下比例配制
锡的百 分含量
0%
20%
锡(g) 0 20
铅(g) 100 80
40% 61.9% 80% 100%
40 61.9 80 100 60 38.1 20 0
何时停止加热?
纯Pb、纯Sn、含锡61.9%(低共熔物)三个样品, 如果出现转折点,则停止加热,利用电炉的余热加 热到熔点以上30~40 ℃ 。
含锡20%、含锡40%、含锡80%三个样品,如果出 现转折点,则停止加热,利用电炉的余热使温度再 升高30~50 ℃。
何时停止实验?
金属相图PbSn体系
药品仪器
1. 金属相图实验炉 ; 2. 镍铬—镍硅热电偶; 3. 邻苯二甲酸酐(AR); 4. 石墨; 5. 锡粉(AR),铅粉(AR); 6. 等等。
Department of Chemistry
实验步骤
准备样品 (按比例)
加石墨覆盖 加热
观察升温情况 及时停止加热
Department of Chemistry
注意事项:
1.Pb-Sn混合物的液相必须均匀互溶(达 最高温度时,搅拌样品);
2.样品的降温速率必须缓慢; 3.操作过程中,要防止样品被氧化及混
入杂质; 4.热电偶要插到玻璃套的底部,以及热
电偶两极不能相碰。
Department of Chemistry
实验数据记录
实验日期:
;室温: ℃;气压:
kPa
锡的百 分含量
0% (纯铅)
20%
转折点
(t℃)
水平段
(t℃)
30% 61.9%
80%
(低共熔物)
100% (纯锡)
Department of Chemistry
数据处理
1.温度换算(℃ K); 2.作出Pb-Sn相图; 3.与文献值比较。
Department of Chemistry
Department of Chemistry
混合物步冷曲线如②、④所示,如②起 始温度下降很快(如a/b/段),冷却到b/点时, 开始有固体A析出,这时体系呈两相,因为 液相的成分不断改变,所以其平衡温度也不 断改变。由于凝固热的不断放出,其温度下 降较慢,曲线的斜率较小(b/c/段)。到了低 共熔点c/后,体系出现三相平衡L=A(s)+B (s),温度不再改变,步冷曲线又出现水平 段,直到液相完全凝固后,温度又开始下降。
金属相图

二、步冷曲线
当熔融的系统均匀冷却时, 则系统的温度随时间的变化 是均匀的;若在冷却过程中 发生了相变,由于在相变过 程中伴随着放热效应,所以 系统的温度随时间变化的速 率发生改变,步冷曲线上出 现转折;当熔液继续冷却到 某一点时,此时熔液系统以 低共熔混合物的固体析出, 步冷曲线上出现水平线段; 当熔液完全凝固后;温度才 迅速下降。
金属相图
实验目的
1.用热分析法(步冷曲线法)测绘Pb-Sn二组分金 属相图。 2.了解热电偶测量温度和进行热电偶校正ห้องสมุดไป่ตู้方 法 3.会用可控升降温电炉绘制金属及其混合物的 步冷曲线。
实验原理
一、热分析法
常用的绘制相图实验方法之一是热分析法,其原 理是根据系统在冷却过程中 , 温度随时间的变 化情况来判断系统是否发生了相变化。通常作法 是系统加热成一均匀液相,然后让系统缓慢冷却,使 被测系统时时处于或接近相平衡状态,记录系统随时 间变化的关系曲线(称冷却曲线或步冷曲线)。
三、金属相图
A
B%
B
实验仪器和药品
可控升降温电炉 锡和铅样品(8份)
思考题
1.步冷曲线各段的斜率以及水平段的长短与那些因素有 关? 2.对于不同成分的混合物的步冷曲线,其水平段有什么 不同? 3.若已知二组分系统的许多不同组成的冷却曲线,但不 知道低共熔物的组成,有何办法确定?
实验5 金属相图的绘制

五、数据处理
1、将实验数据记录于表5-1中。
表5-1实验数据记录表
时间/min
0
1
2
3
4
…
温度/℃
样品1
样品2
样品3
样品4
样品5
样品6
2、在同一直角坐标系中以T对t分别绘出每个样品的步冷曲线。
3、由步冷曲线找出每个样品的转折温度和平台温度,填到表5-2中。
石蜡油;
铅(化学纯)
四、实验步骤
1、配制样品。
用感量为0.1g的天平配制含Sn质量分数分别为0、0.20、0.40、0.60、0.80、1.00的Pb-Sn混合物各100g,分别装入编号为1~6的硬质试管中,再加入少许石蜡油(约5mL),以防止加热过程中金属被空气氧化。
2、设置仪器。
打开电源,预热2min,按照以下参数设置仪器:
a b
图5-1简单低共熔系统步冷曲线(a)及其固-液相图(b)
(1)体系均匀冷却过程中,若无相变发生,则温度随时间均匀的降低。(2)若有相变发生,由于相变过程中会产生相变热,使得温度随时间的下降速度将减慢,步冷曲线就出现转折。当熔液继续冷却到熔液的组成达到最低共熔混合物的组成时,开始有最低共熔混合物析出,在最低共熔混合物完全凝固以前,体系温度保持不变,步冷曲线出现平台。当熔液完全凝固后,体系又无相变发生,温度随时间又均匀的下降。
由此可知,对组成一定的二组分低共熔混合物体系,可以根据步冷曲线,判断有固体析出时的转折温度和最低共熔混合物析出时的平台温度。如果作出一系列组成不同的体系的步冷曲线,从中找出各转折点即能画出二组分体系最简单的T-x相图。
三、仪器试剂
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
观察降温情况 取出样品、放 实验结束记录 及时停止实验 入新样品测试 数据恢复原状
准备样品:
按以下比例配制
锡的百 分含量
0%
20% 30% 61.9% 80% 100%
锡(g) 0 20 30 61.9 80 100
铅(g) 100 80 70 38.1 20 0
在样品表面覆盖少许石墨,插 好热电偶,围好保温砖,插上电炉 插头,开始加热。
何时停止加热?
纯Pb、纯Sn、含锡61.9%(低共 熔物)三个样品,如果出现转折点, 则停止加热。
含锡20%、含锡30%、含锡80%三 个样品,如果出现转折点,再升高 50 ℃后,则停止加热。
何时停止实验?
纯Pb、纯Sn、含锡61.9%三个样品, 在作完水平线段后又继续降温,表明样 品已完全凝固,即可停止测量。
最低共熔点温度℃Βιβλιοθήκη 181 181 181 181
最低共熔混合物组成: 含Sn63%
两种金属的
任何一种都能微 T/K
溶于另一种金属 中,是一个部分 600K
互溶的低共熔体 系,它用一般的 热分析法只能得
L(单相区)
505K
到一个相当于简
α
单的二元低共熔 454K
点相图(如本实
L+Pb(s) Pb(s)+Sn(s)
2.样品的降温速率必须缓慢;
3.操作过程中,要防止样品被氧化及混 入杂质;
4.热电偶要插到玻璃套的底部,以及热 电偶两极不能相碰。
思考题
1.是否可用加热曲线作相图,为什么?
2.为什么要用步冷曲线作相图? 3.为什么坩锅中的样品要加盖石墨,并 严防混入杂质? 4.实验用各样品的总重量为什么要求相 等?若总重量不相等有什么影响? 5.样品量和冷却速度对实验有何影响?
1.温度换算(℃ K); 2.作出Pb-Sn相图; 3.与文献值比较。
T/K
600K
454K
L+Pb(s)
L(单相区)
505K
L+Sn(s)
Pb(s)+Sn(s)
0(Pb)
61.9% 100%(Sn)
Pb—Sn 金属相图
文献值:
Pb-Sn体系的熔点对照表:
锡%
0 20 40 60 80 100
熔点温度℃ 327 276 240 190 200 232
实验原理
相是指体系内部物理性质和化 学性质完全均匀的一部分。
相平衡是指多相体系中组分在 各相中的量不随时间而改变。
研究多相体系的状态如何随组 成、温度、压力等变量的改变而发 生变化,并用图形来表示体系状态 的变化,这种图就叫相图。
本实验采用热分析法绘制相图,其
基本原理:先将体系加热至熔融成一均 匀液相,然后让体系缓慢冷却,①体系 内不发生相变,则温度--时间曲线均匀 改变;②体系内发生相变,则温度--时 间曲线上会出现转折点或水平段。根据 各样品的温度--时间曲线上的转折点或 水平段,就可绘制相图。
金属相图(Pb-Sn体系)
一、实验目的
二、实验原理
三、药品仪器
四、实验步骤
五、实验记录
六、数据处理
七、结果分析与讨论
八、注意事项
九、思考题
实验目的
⑴用热分析法测绘Pb-Sn二元金属相图, 并掌握应用步冷曲线数据绘制二元体系 相图的基本方法;
⑵了解步冷曲线及相图中各曲线所代表 的物理意义;
⑶学习并掌握热电偶的使用及校正和自 动平衡记录仪的使用方法。
分析1:
纯物质的步冷曲线如①、⑤所
示,如①从高温冷却,开始降温很 快,ab线的斜率决定于体系的散热 程度,冷到A的熔点时,固体A开 始析出,体系出现两相平衡(液相 和固相A),此时温度维持不变, 步冷曲线出现水平段,直到其中液 相全部消失,温度才下降。
混合物步冷曲线如②、④所示,如② 起始温度下降很快(如a/b/段),冷却到b/ 点时,开始有固体A析出,这时体系呈两 相,因为液相的成分不断改变,所以其平 衡温度也不断改变。由于凝固热的不断放 出,其温度下降较慢,曲线的斜率较小 (b/c/段)。到了低共熔点c/后,体系出现 三相平衡L=A(s)+B(s),温度不再改变, 步冷曲线又出现水平段,直到液相完全凝 固后,温度又开始下降。
零点制备:
取出冰块,敲碎,放到500ml 水中搅拌至冰不再溶解,倒入保 温瓶中至3/4高,再放入少许冰块, 以保证保温瓶中的水温度为0℃ 。
样品埋入方法:
小坩锅放入被测样品,大坩 锅装满沙,用旋转的办法把小坩 锅埋入到大坩锅的沙中,埋入的 深度应保证沙比样品高,或至少 一样高。
样品加热及保温:
L+Sn(s) β
验Pb-Sn体系), 测不出来固态晶
0(Pb)
61.9% 100%(Sn)
形转变点。
真实的Pb—Sn 金属相图
实验结果与讨论
⑴结果:实测值为T铅= T锡= T低共熔=
⑵计算实验偏差:
⑶分析产生偏差的原因:
⑷有何建议与想法?
注意事项:
1.Pb-Sn混合物的液相必须均匀互溶(达 最高温度时,搅拌样品);
曲线③表示其组成恰为最低共 熔混合物的步冷曲线,其形状与纯 物质相似,但它的水平段是三相平 衡。
即 L=A(s)+B(s)
分析2:
相图由一个单相区和三个两相区组成: 即 ①溶液相区;
②纯A(s)和溶液共存的两相区;
③纯B(s)和溶液共存的两相区;
④纯A(s)和纯B(s)共存的两相区;
水平线段表示:A(s)、B(s)和溶液共 存的三相线;水平线段以下表示纯A(s)和 纯B(s)共存的两相区;O为低共熔点。
药品仪器
1. EA/J2P00双笔自动平衡记录仪; 2. 电炉; 3. 镍铬—镍硅热电偶; 4. 大、小坩埚; 5. 保温瓶; 6. 坩埚钳; 7. 冰块、石墨; 8. 锡粒(AR),铅粒(AR); 9. 等等。
实验步骤
准备样品 取冰制热 小坩锅样品埋 加石墨覆盖 (按比例) 电偶零点 入大坩锅沙中 保温并加热
温度--时间曲线,即步冷曲线
转折点:
表示温度随时间的变化 率发生了变化。
水平段:
表示在水平段内,温度 不随时间而变化。
温 度
①② a a/
③
④
⑤
B
温 度
B
A
A
b
b/
L
L+A(s)
L+B(s)
c/
O A(s)+B(s)
时间
0(A)
B% 100(B)
(a)步冷曲线
(b)二元组分凝聚系统相图
热分析法绘制相图
含锡20%、含锡30%、含锡80%三个 样品,出现了转折点,并在作完水平线 段后又继续降温,表明样品已完全凝固, 即可停止测量。
实验数据记录
实验日期:
;室温: ℃;气压:
KPa
锡的百 分含量
0% (纯铅)
20%
30%
61.9%
80% 100%
(低共熔物)
(纯锡)
转折点
(t℃)
水平段
(t℃)
数据处理
