大学有机化学 第13章_胺及其衍生物
有机化学第十三章

(3)单键的裂解 光解或电荷分解NH3或N2H4,也能生成没有取代 的乃春。
13.5 乃春的反应 乃春的反应也和卡宾的相似。乃春很容易发生插 入、加成、重排、氢提取、二聚和歧化反应。 (1)插入反应 乃春,特则是羧酰基乃春和磺酰基乃春,可以插 入C-H和其他的键,例如:
(2)对C=C键的加成 烷基乃春对双键环加成,形成氮杂环丙烷衍生 物。
(d)其它乃春 在-75°C,及四甲基乙烯中,用苯基锂处理氯 胺,确实产生了少量的四甲基氮杂环丙烷。
对甲苯磺酰基叠氮热分解,形成对甲苯磺酰基乃 春。
13.4 乃春的生成 (1)α-消去 例如,用碱处理苯磺酰羟胺,则生成乃春。
(2)叠氮化合物的分解 生成乃春最常用的方法是叠氮化合物的光分解或 热裂解。
(3)重排反应 烷基乃春的重排发生得很快,因而一般不发生上 述两种反应,烷基乃春重排,形成Schiff碱。
芳基乃春高温容易重排。
(4)氢提取 乃春可以从烷烃提取氢原子,形成游离基。
(5)二聚
(6)歧化反应 HN可以歧化,形成热力学稳定的氮乃春(nitrenes),R-N:是卡宾的氮类似物。它非常 活泼,以致在普通条件下是难以离析到的。在4K,在 模床中捕集,曾经离析到过烷基乃春;在77K,曾经 捕集过芳基乃春。HN:的基态是三线态;但是,乃春 也有两种形式单线态和三线态生成。
最简单的乃春是NH,可以把它看成是乃春的母 体,其他乃春则看成是它的衍生物。可用通式R-N表 示,式中的R用来代表H、F,Cl,Br,烷基、芳 基、酰基或磺酰基等。 13.2 乃春的结构 乃春的氮原于只有六个价电子,是缺电子的中性 物种。它与卡宾是等电子的,其结构与卡宾有些类 似。单重态氮烯具有亲电性,而三重态氮烯的行为则 象双自由基。
13-胺及其衍生物课件

2
5
4
1
3
2.酸性 . 由于伯胺和仲胺的氮原子上有氢,在强碱 由于伯胺和仲胺的氮原子上有氢, 作用下能失去一个质子而显酸性
CH3 H3C CH
THF NH + n-C4H9Li
CH3 H3C H3C CH NLi + n-C4H10 CH CH3
H3C CH CH3
pKa
40
LDA
50
13.3.2胺的烷基化和季铵化合物 胺的烷基化和季铵化合物
—CH2-CH-CH3 NH-CH3
N-甲基苯异丙胺(去氧麻黄素)
为无色透明晶体, 俗称冰毒,对人体 的损害甚于海洛因.
CH3 H———NH-CH3 N H———OH C6H5
麻黄素
为中药麻黄中的主要有效成 分。具有类似肾上腺素作用。 有兴奋交感神经、增高血压、 扩张气管的作用,用于支气 管哮喘症,疗效持久.
CH3 —N-C2H5
N,N-二甲基对-甲基苯胺 N-甲基-N-乙基苯胺
CH3 CH3NH2 methylamine H3C N C2H5 N-ethyl-N,4-di ethylbenzenamine
甲胺
N,4-二甲基 乙基苯胺 二甲基-N-乙基苯胺 二甲基
CH3 N(C2H5)2 CH3CH2CH CHCH3
(CH3)2CHCH2CHCH3 NH2
CH3 CH3NH C CH2CH2CH3 CH3
4-甲基 氨基戊烷 甲基-2-氨基戊烷 甲基 2-甲基 甲基-2-(N-甲胺基 戊烷 甲胺基)戊烷 甲基 甲胺基
较复杂的胺或多官能团化合物,按系统命名法命名. 较复杂的胺或多官能团化合物,按系统命名法命名 CH3 CH3 CH3-CH - CH—C—CH3 CH3HN-SO3H NH2 CH3
《有机化学》第13章 杂环化合物和生物碱

4-甲基嘧啶
4-甲基噻唑
⑶ 连有取代基的杂环化合物命名时,也可将杂环作为取代基,以侧链为母体来命名。
4-嘧啶磺酸
β-吲哚乙酸(3-吲哚乙酸)
2-苯并咪唑甲酸乙酯
⑷ 为区别杂环化合物的互变异构体,需标明杂环上与杂原子相连的氢原子所在的位 置,并在名称前面加上标位的阿拉伯数字和大写H的斜体字。
2023/6/13
⑴ 卤代反应
在室温条件下,吡咯、呋喃和噻吩能与氯或溴发生激烈反应,得到多卤代物。将反应 物用溶剂稀释并在低温下进行反应时,可以得到一氯代物或一溴代物。碘化反应需要 在催化剂存在下进行。例如:
2023/6/13
6
(2)硝化反应
在低温条件下,吡咯、呋喃和噻吩能与比较缓和的硝化剂硝酸乙酰酯(CH3COONO2) 发生硝化反应,主要生成α-硝基化合物。例如:
3. 颜色反应
生物碱能与一些试剂发生颜色反应,比如钒酸铵的浓硫酸溶液、浓硝酸、浓硫酸、 甲醛、氨水等,利用此性质可鉴别生物碱。比如莨菪碱遇1%钒酸铵的浓硫酸溶液显 红色,可待因遇甲醛-浓硫酸试剂显紫红色等。
二、重要的生物碱 1. 烟碱 又叫尼古丁,主要以苹果酸盐及柠檬酸盐的形式存在于烟草中。其结构式
2023/6/13
13
血红素是卟啉环与Fe2+形成的配合物;叶绿素是卟啉环与Mg2+形成的配合物,它们的 结构式如下:
血红素在体内与蛋白质结合形成血红蛋白,存在于红细胞中,是人和其他哺乳动物 体内运输氧气的物质。叶绿素是植物进行光合作用不可缺少的物质。
2023/6/13
14
二、呋喃衍生物
呋喃甲醛是最常见的呋喃衍生物,又称为糠醛,它是一种无色液体,沸点为161.7℃, 在空气中易氧化变黑,是一种良好的溶剂。 糠醛是合成药物的重要原料,通过硝化可制得一系列呋喃类抗菌药物,如治疗泌尿 系统感染的药物呋喃坦丁、治疗血吸虫病的药物呋喃丙胺等。
有机化学复习考试题及答案第十三章羧酸及其衍生物
13.5.3 丙烯酸 • 丙烯酸的制备
丙烯气相氧化
CH2=CH—CH3
O2,MoO3
280~360℃, 0.2~0.3MPa
CH2=CH—COOH
• 丙烯酸具有羧酸和烯烃双重性质。双键易发生氧化和 聚合反应。控制聚合反应程度,可得不同用途的聚合 物。工业上用作分散剂、涂料、粘合剂。
13.6 二元羧酸(自学 )
(2) 羧酸的命名 •俗名——根据天然来源
•系统命名法
(1)选择含有羧基的最长碳链为主链(母体);
(2)碳链编号时,从羧基的碳原子开始;
(3)酸前要冠以官能团位置的数字(编号最小);
(4)其它同烷烃的命名规则
俗名
系统名
O CCC C C C
OH
6 5432 1
例如:
CH2=CH-COOH C H3C -H = C HC -O O H
苯甲酸(安息香酸)
C H3
对甲苯甲酸
• 多元芳香族羧酸的命名 • 用“羧酸”或“甲酸”作字尾,其它作为取代基
COOH
COOH
COOH
COOH
对苯二羧酸
环己烷羧酸
(对苯二甲酸,1,4-苯二甲酸)(环己烷甲酸)
-萘羧酸 -萘甲酸;1- 萘甲酸
13.2 羧酸的制法 13.2.1 从伯醇或醛制备羧酸
• 不饱和醇或醛须用弱氧化剂制备
6MPa, 150~250℃
3. 烯烃制备羧酸——双键断裂
RCH=CHR’ + 4[O] K2Cr2O7+H2SO4 R’COOH
4. 环状烯烃制备——二元羧酸
RCOOH +
+ 4[O]
5. 丙烯酸的制备
CH2CH2COOH CH2CH2COOH
有机化学(第9版)第十三章 胺和生物碱

降低毒 副作用:
有机化学 (第9版)
四、化学性质
(三)磺酰化反应
伯胺、仲胺能与磺酰氯作用生成磺酰胺。常用的磺酰化试剂是苯磺酰氯和对甲基苯 磺酰氯。 兴斯堡试验(Hinsberg test):鉴别三类胺
有机化学 (第9版)
四、化学性质
(四)与亚硝酸的反应
伯胺与亚硝酸的反应 脂肪伯胺与HNO2反应定量放出氮气,常用于氨基酸和多肽的定量分析。
重点难点
掌握 胺的命名、结构和化学性质;胺的碱性及其影响因 素;芳香重氮化合物的化学性质;生物碱的通性。
熟悉 胺的分类、不同类型胺的鉴别;酰基化反应、芳香 重氮盐在有机合成上的应用。
了解 胺的物理性质;芳香重氮盐的结构;生物碱(常见) 的结构和生理活性及临床应用。
配套题库请下载 医学猫 APP,执业、三基、规培、主治、卫生资格、正副高等题库都已入库。
有机化学 (第9版)
四、化学性质
(二)酰化反应
伯胺、仲胺易与酰氯或酸酐等酰基化剂反应生成酰胺。可用于改善胺的脂溶 性、降低毒性、保护氨基。
有机化学 (第9版)
四、化学性质
(二)酰化反应
保护氨基:
CH3 CH3COCl
NH2
CH3 [O]
NHCOCH3
COOH
OH H2O NHCOCH3
ห้องสมุดไป่ตู้
COOH NH2
烈的致癌作用。
有机化学 (第9版)
四、化学性质
(四)与亚硝酸的反应
叔胺与亚硝酸的反应 脂肪叔胺与亚硝酸反应生成不稳定的季铵盐,碱性条
件下分解为原来的胺。芳香叔胺酸中与亚硝酸反应生成桔 黄色的盐,用碱中和后得到翠绿色的C-亚硝基化合物。
二乙胺、三乙胺、N,N,-二 甲基苯胺与亚硝酸反应结果
有机化学第章胺

+ N2+Cl-
OH
弱碱性 0~5℃
NN
OH
34
+ N2+Cl-
弱酸性 N(CH3)2 0~5℃
NN
N(CH3)2
进行重氮盐的偶联反应时,介质的酸碱性是很重 要的。一般说pH=5⎯7,重氮盐与酚类反应时,通常 用弱碱性介质;而与芳香胺反应时,常用中性或弱酸 性介质。
偶联反应的应用:
A)在有机分析中,用于对酚类及芳胺类化合物的 定性鉴定。
3
CH3NH2 ( CH3CH2)2NH ( CH3)2NCH2CH3 ( CH3)4N+Cl -
N H2
N HC H3
N (C H3)2
+ N(CH3)3
_ OH
伯胺
仲胺
叔胺
季铵类化合物
注意:
伯胺、仲胺、叔胺与伯醇、仲醇、叔醇的区别
胺类是指氮原子上所连接烃基的数目;
而醇类是指与羟基相连的碳原子上所连接的烃基
NH H
碱性: 氨 > 芳香胺
10
按碱性由强到弱的顺序排列下列化合物
NH2
CH3
①
CH2NH2
NH2
NO2
②
③
NH2 NO2
NO2
④
②> ①> ③> ④
11
3) 季铵碱的碱性
季铵碱是强碱性物质,其碱性与氢氧化钠相 似。季铵碱的分子中,四个无极性的烃基连接在带 正电荷的 N原子上,阻止了氢氧根与它的结合,使 季铵碱无论在固体或溶液中都完全解离,是典型的 离子键。
氢氧化二甲基乙基苄基铵
7
CH3
+
CH2 N C12H25 Br -
有机化学习题指南(2)
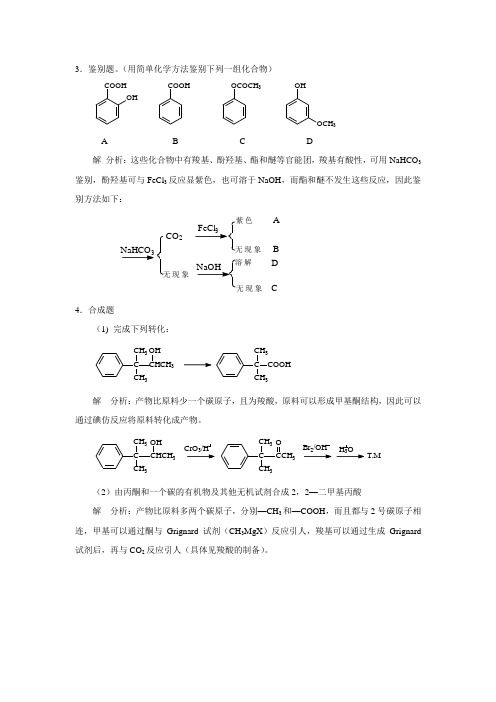
3.鉴别题。
(用简单化学方法鉴别下列一组化合物)COOHOHCOOH OCOCH3OHOCH3A B C D解分析:这些化合物中有羧基、酚羟基、酯和醚等官能团,羧基有酸性,可用NaHCO3鉴别,酚羟基可与FeCl3反应显紫色,也可溶于NaOH,而酯和醚不发生这些反应,因此鉴别方法如下:NaHCO3CO2无现象色现象解现象ABDC4.合成题(1) 完成下列转化:C CH3 CH3CHCH3OHCCH3COOHCH3解分析:产物比原料少一个碳原子,且为羧酸,原料可以形成甲基酮结构,因此可以通过碘仿反应将原料转化成产物。
C CH3 CH3CHCH3OH/HCCH3CH33OBr/OH H3O T.M(2)由丙酮和一个碳的有机物及其他无机试剂合成2,2—二甲基丙酸解分析:产物比原料多两个碳原子,分别—CH3和—COOH,而且都与2号碳原子相连,甲基可以通过酮与Grignard试剂(CH3MgX)反应引人,羧基可以通过生成Grignard 试剂后,再与CO2反应引人(具体见羧酸的制备)。
CH 3CH 33O CH 3MgX(1)2+CH 3CCH 3OHPBr 3CH 3CH 3CCH 3Br 2 Mg/无水乙醚CH 3CH 3CCH 3MgBr(2) H 2O/H +CH 3CH 3CCH 3COOH5.推导题化合物A (C 3H 4OCl 2) 与冷水作用生成酸性化合物B (C 3H 5O 2Cl),A 与乙醇反应生成液体化合物C(C 5H 9O 2Cl),A 在水中煮沸可得化合物D(C 3H 6O 3);D 含有手性碳原子并且可以被乙酰化。
试推断A 、B 、C 、D 的构造式。
解 通过计算可知,化合物A 的不饱和度u=1,与冷水作用生成酸性化合物B ,说明A 为酰氯,B 为羧酸,A 与乙醇反应生成的液体化合物C 为酯。
A 在水中煮沸可得化合物D ,D 含有手性碳原子并且可以被乙酰化,表明D 含有羟基,而且该羟基与手性碳相连,因此A 、B 、C 、D 的构造式分别为A B C DCH 3CHCOClClCH 3CHCOOHClCH 3CHC OOC 2H Cl5CH 3CHCOOHOH第13章 胺及其衍生物13.1 知识要点1.胺的命名简单的胺以习惯命名法命名,在胺之前加上烃基的名称来命名。
有机化学第13章 羧酸衍生物

35
另一方面,乙酰胺的水溶液能与氧化汞作用生成稳定的汞盐。
酰胺与金属钠在乙醚溶液中作用,也能生成钠盐,但它遇水即 分解。这些说明酰胺具有弱酸性。
O C NH C O
邻苯二甲酰亚胺
36
2.酰胺脱水
酰胺与强脱水剂共热或高温加热,则分子内脱水生成腈,这
是合成腈最常用的方法之一。常用的脱水剂有五氧化二磷和亚硫
10
IR:
11
酰卤的C=O伸缩振动在1815~1785cm-1区域有强吸收,其C—X
的面内弯曲振动在645 cm-1附近。
12
酸 酐的 C=O伸 缩 振动 吸 收 与其它 羰 基 化合物 明 显不 同 , 在 1850~1800cm-1和1780~1740 cm-1区域内有两个C=O伸缩振动的强 吸收峰。线型酸酐的高频峰强于低频峰,而环状酸酐则相反。酸酐
26
酰基化试剂中离去基团离去的难易,取决于离去基团(L)的碱 性。碱性愈弱,愈易离去。离去基团L的碱性由弱到强的次序是:
C1—<RCOO—<RO—<NH2—。因此氯原于是最容易离去的基团,
而氨基则是最难离去的基团。即酰氯是最活泼的酰基化试剂,而酰 胺是最弱者。 离去基团碱性的强弱,可从其共轭酸的酸性强弱得知(强酸的 共轭碱是弱碱):
酯的醇解亦称酯交换反应。例如:
21
腈的醇溶液和浓硫酸或盐酸共热,则发生醇解反应得到酯。 例如:
22
3.氨解
酰氯、酸酐和酯与氨或胺作用,都可以生成酰胺。例如:
23
N-未取代的酰胺与胺反应生成N-取代酰胺。例如:
以上这些反应对羧酸衍生物是发生了水解、醇解或氨解;但对 水、醇或氨则是发生了酰基化反应。酰氯、酸酐和酯都是酰基化试 剂,酰胺的酰化能力极弱,一般不用作酰基化试剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.29
3.36
4.4
N H
pKb 2.88
(CH3CH2)2NH
(CH3CH2)3N
CH3CH2NH2
3.06
RNH2 + H2O
3.25
RNH3+ + OH-
3.36
13 .3 胺类化合物的化学性质
芳香胺的碱性强弱与芳环上取代基的性质有关。
CH3 NH2 > NH2 > O2N NH2
RNH2 —————> N2
重氮化反应
CH3CH2CH2NH2 1o胺 NaNO2 HCl
NaNO2+HCl
+ H2O + 混合物
CH3CH2CH2N+ NCl重氮盐
CH3CH2CH2++Cl- + N2 醇、烯、卤代烃等
13 .3 胺类化合物的化学性质
NH2
氯化重氮苯 (重氮盐)
NaNO2 , HCl
季 铵 碱 (R4N+OH - ) 为 离 子 化 合 物 , 其 碱 性 与 NaOH相当,是强碱。季铵碱与酸作用生成季铵盐。 综合多种因素,各类胺碱性强弱的大致排列顺序为: 季铵碱(强碱) >>脂肪胺 ( 2o >1o >3o ) > NH3 >> 芳香胺
13 .3 胺类化合物的化学性质
13.3.2
CH3 N H
NaNO2 HCl
CH3 N NO
N-甲基-N-亚硝基苯胺
H2O
芳香胺的 N- 亚硝基化合物 在酸性条件下会立即发生重 排,生成对亚硝基化合物。
ON
H+ CH3 N H
3)
叔胺与亚硝酸的反应
R3N: + HNO2
R3NH+ NO2- NaOH R3N + NaNO2+ H2O
不稳定易 水解的盐
0~5℃ D H2O
NaNO2 , HCl 常温以上
OH + N2 + HCl
2) 仲胺与亚硝酸的反应: 生成13 .3 胺类化合物的化学性质黄色油状 物或固体N-亚硝基胺
Ar(R)NH(或R2NH) + HONO 2o胺 Ar(R)N NO(或R2N NO) N-亚硝基胺
强致癌性
13 .3 胺类化合物的化学性质
3)Hofmann降解反应
O RCNH2 NaOH + Br2
Br2 NaOH
RNH2
(CH3)3CCH2NH2
(CH3)3CCH2CONH2
反应机理如下:
Br
连贯发生
13.3.3
季胺碱的Hofmann消除反应
13.3.3
CH3
季胺碱的Hofmann消除反应
CH3CH2N(CH3)2 + CH=CH2
CH2CH2OH CH3 N+ CH3 OHCH3
氢氧化三甲基(2-羟乙基) 铵
(俗名胆碱)
CH3 NH2
甲胺
CH3 + CH CH3—N— 3 Br CH3
溴化四甲铵 CH3HN-SO3H
CH3 + CH CH3—N— 3 OH CH3 氢氧化四甲铵
CH3 CH3 CH3-CH - CH—C—CH3 NH2 CH3
+ RNH + H O RNH + OH 2 2 3 单一的电子效应使胺的碱性由强至弱顺序为(气相中):
R3N > R2NH > R→NH2 > NH3 > > 芳香胺 pKb 3~5 4.75 >9
碱性强度(在水溶液中) : 二甲胺 > 甲胺 > 三甲胺 N原子上连接的基团越多越大,对 N上孤对电子的屏 蔽作用越大,N上孤对电子与H+结合就越难,碱性就 越弱。 ?
SO2Cl
SO2NHR
分离鉴别一级、二级、三级胺
SO2NHR NaOH SO2NRNa
+
SO2NR2 (不溶于NaOH水溶液)
13 .3 胺类化合物的化学性质
13.3.5 1) 胺与亚硝酸反应 伯胺与亚硝酸的反应
脂肪伯胺与HNO2反应的产物常是醇、烯烃等 的混合物,并定量的放出 N2 。因此可用于-NH2 的定量测定.
叔丁醇(叔醇)
叔丁基氯(叔卤代烃)
叔丁基胺 (伯胺)
CH3 CH3 NH2 甲胺 伯胺 CH3 NH CH3 二甲胺 仲胺 CH3 N CH3 三甲胺 叔胺 CH3 + CH CH3—N— 3 Br CH3 溴化四甲铵 季铵盐
CH3 + CH CH3—N— 3 OH CH3
氢氧化四甲铵
季铵碱
13 .1 胺类化合物的分类与命名
对甲基苯胺
NHCH3 N-甲基苯胺
较复杂的胺或多官能团化合物,按系统命名法命名.
CH3CH2CHCH2CH2CH2CH3 NHCH2CH3 CH3CH2CHCHNHCH3 H3C CH3
3-(N-乙基氨基)庚烷 3-乙氨基庚烷
3-甲基-2-(N-甲基氨基)戊烷 3-甲基-2-甲氨基戊烷
13 .1 胺类化合物的分类与命名
13 .3 胺类化合物的化学性质
13.3.4 胺的酰化与磺酰化
NH2 (CH3CO)2O or CH3COCl NHCOCH3
O (n-C4H9)2NH + COCl CN(C4H9-n)2
HO
NH2
(CH3CO)2O
HO
NHCOCH3
扑热息痛
NH2
CH3CO-Cl (或乙酸酐)
NH-COCH3
13 .3 胺类化合物的化学性质
NH2
NaNO2 , HCl 0~5℃ D H2O
氯化重氮苯 (重氮盐)
NaNO2 , HCl 常温以上
CH3CH2CH2NH2 1o胺 NaNO2 HCl
—CH2-CH-CH3 NH2
苯异丙胺(1-苯基-2-丙胺)
13 .1 胺类化合物的分类与命名
—CH2-CH-CH3 NH-CH3 N-甲基苯异丙胺 (去氧麻黄素) CH3 H———NH-CH3 H———OH C6H5 麻黄素
为中药麻黄中的主要有效成 分。具有类似肾上腺素作用。 有兴奋交感神经、增高血压、 扩张气管的作用,用于支气 管哮喘症,疗效持久. 为无色透明晶体, 俗称冰毒,对人体 的损害甚于海洛因.
13 .1 胺类化合物的分类与命名
N 上连有脂肪烃基的芳香仲胺和叔胺的命名:用 “N”表示基团连在氮原子上,而不是连在芳环上。
CH3 —N-C2H5
N-甲基-N-乙基苯胺
-NH-C2H5
N-乙基苯胺
CH3-
-N(CH3)2
N,N,4-三甲基苯胺 N,N-二甲基对甲苯胺
CH2NH2 苯甲胺
CH3
NH2
+
CH2CH2N+CH2CH3OHCH3
H2O
RCH2CH2NH2
+
3 CH3I
+
RCH2CH2N(CH3)3I
+
+
AgOH
RCH2CH2N(CH3)3OH
+
_
RCH=CH2
(CH3)3N
H2O
H
+
H N(CH3)3
CH3CH2CH CH CH2
OH CH3CH2CH2CH=CH2 + (CH3)3N + H2O
2,2,4-三甲基-3-氨基戊烷
对甲氨基苯磺酸 NH3 氨
13 .1 胺类化合物的分类与命名
CH3 N (CH3)3 I
+ -
O (C2H5)2NCH2CH2OC H
+
NH2 Cl-
矮壮素
N O S N H N H NO2
普鲁卡因
HCl
盐酸雷尼替丁 于1887年首次人工 合成的兴奋剂,其 作用类似于麻黄素 .
RNH3+Cl-
RNH3+Cl- + NaOH —> RNH2 + NaCl + H2O 胺盐遇强碱则能释放出游离胺,说明胺是弱碱. 影响胺类化合物碱性强弱的主要因素有: ① 水的溶剂化效应; ② 电子效应; ③空间效应
13 .3 胺类化合物的化学性质
溶剂化效应使其碱性强弱顺序为:伯胺>仲胺>叔胺
R—N—R’ 叔胺
脂 C2H5-NH2 肪 胺 乙胺 芳 香 胺 -NH2
苯胺
CH3-NH-C2H5 甲乙胺 -NH-C2H5
N-乙基苯胺
CH3 C2H5-N-CH2CH2CH3
甲乙丙胺 -N(CH3)2
N,N-二甲基苯胺
13 .1 胺类化合物的分类与命名
伯、仲、叔胺的区别与伯、仲、叔醇或卤代烃不同. CH3 CH3—C—OH CH3 CH3 CH3—C—Cl CH3 CH3 CH3—C—NH2 CH3
由于空间位阻影响,消除反应产物主要遵守 Hofmann规则,即生成取代基较少的烯烃。
H CH2 H CH3CH2CH2CH CH2 (CH3)3N
C CH2 CH H + OH OH CH3 N CH3 CH3 CH3
H
+
H2O
H N(CH3)3
CH3CH2CH CH CH2
OH CH3CH2CH2CH=CH2 + (CH3)3N + H2O
13 .2 胺的物理性质与结构
110.5
N
o
H
H H CH3
R1 N
N
112.9o
N CH3
108o
H H
CH3
107.3o
CH3
R1 R2 N R3
