胺烯加成反应机理
有机化学反应机理(整理版)
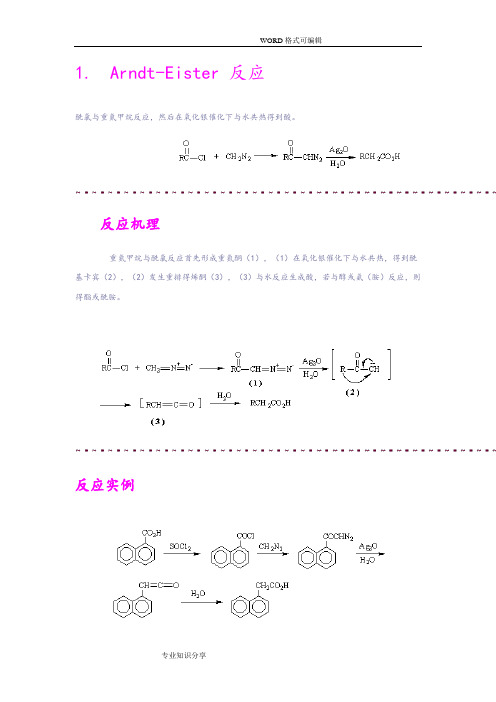
1.Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例2.Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。
3.Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例4.Birch还原芳香化合物用碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙醇或仲丁醇)的混合液中还原,苯环可被还原成非共轭的1,4-环己二烯化合物。
反应机理首先是钠和液氨作用生成溶剂化点子,然后苯得到一个电子生成自由基负离子(Ⅰ),这是苯环的л电子体系中有7个电子,加到苯环上那个电子处在苯环分子轨道的反键轨道上,自由基负离子仍是个环状共轭体系,(Ⅰ)表示的是部分共振式。
烯醇和烯胺衍生物的卤取代反应

烯醇和烯胺衍生物的卤取代反应烯醇的卤取代反应烯醇是由酮或醛与强碱反应生成的,其反应性较高,可与卤素发生加成反应,形成卤代烯醇。
反应机理如下:烯醇中的烯醇负离子进攻卤素分子,形成四面体加成物。
四面体加成物发生离去基团离去,生成卤代烯醇。
卤代烯醇可以进一步转化为其他衍生物,如醛、酮和环丙烷。
烯胺的卤取代反应烯胺是由胺与醛或酮反应生成的,其反应性类似于烯醇。
它可以与卤素反应,形成卤代烯胺。
反应机理如下:烯胺中的氨基氮进攻卤素分子,形成四面体加成物。
四面体加成物发生离去基团离去,生成卤代烯胺。
卤代烯胺也可以进一步转化为其他衍生物,如胺、亚胺和环丙胺。
卤取代反应的区域选择性烯醇和烯胺的卤取代反应通常具有区域选择性,主要取决于亲核亲电性质和位阻效应。
当卤素为亲电试剂时,反应倾向于发生在烯醇或烯胺中正电荷密度最大的碳原子上。
当卤素为亲核试剂时,反应倾向于发生在烯醇或烯胺中负电荷密度最大的碳原子上。
位阻效应也会影响反应的区域选择性,卤素优先进攻空间位阻最小的碳原子。
反应条件烯醇和烯胺的卤取代反应通常在溶剂中进行,如二氯甲烷或乙腈。
反应温度和催化剂的选择取决于卤素的亲核亲电性质和反应物本身的反应性。
当卤素为亲电试剂时,反应通常在低温下进行,以避免副反应。
当卤素为亲核试剂时,反应需要在高温下进行,以促进反应的进行。
催化剂的使用可以提高反应的速率和选择性,常用的催化剂包括路易斯酸和碱。
应用烯醇和烯胺的卤取代反应在有机合成中有着广泛的应用,包括:碳碳键的形成官能团的引入环状化合物的合成天然产物的合成。
第2章 加成反应

参考文献
[1] Berthelot, M. Justus Liebigs Ann. Chem. 1870, 156, 228‐229. [2] Tanaka, H.; Noguchi, H.; Abe, I. Org. Lett. 2004, 6, 803‐806.
2.1.1.2 烯烃和炔烃的水合 浓硫酸是强的质子酸,可以与烯烃加成得到硫酸氢酯,后者水解生成醇,反 应的区域选择性符合马氏规则。此反应称为烯烃的间接水合。
4
碳正离子本身也是亲电试剂,可以和烯烃再次发生亲电加成。一个经典例 子是角鲨烯在质子条件下的环合,生成甾族化合物。角鲨烯在酶(提供质子)作 用下,发生区域和立体选择性的、多米诺式的亲电环化反应,得到碳正离子中间 体,最后经-消除得到双键[2]。
炔烃与卤化氢加成首先生成卤代烯烃, 卤代烯烃继续与卤化氢加成生成二卤 代烷。
HCl Cl HBr Br HI I
反应机理涉及碳正离子中间体。烯烃的电子进攻 HX 的质子,X 带着一对电 子离去,由于电子转向质子生成 C-H 单键,另一个碳原子则成为碳正离子,这 是反应的决速步骤。碳正离子中间体一旦形成,便立即与体系中的 X 离子结合 生成加成产物。
-
加 HX 的反应需在惰性溶剂(如二氯甲烷、正己烷等)中进行,如果在水和 醇等具有亲核性的溶剂中反应,溶剂将和卤阴离子竞争,进攻碳正离子,生成相
Br2
对于不对称的烯烃,当亲电原子和亲核原子不同时,反应具有区域选择性。 以末端烯烃的反应为例,由于烷基的存在,反应决速步骤所形成的溴鎓离子中两 个 C-Br 键的键长是不等的。有两种可能的溴鎓离子 A 和 B,其中 A 较 B 稳定, 这与碳正离子的稳定性相似。因此,反应优先经历途径(a)生成马氏产物。
有机化学反应机理+范例+原理

1.A rndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例2.Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。
3.Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例4.Birch还原芳香化合物用碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙醇或仲丁醇)的混合液中还原,苯环可被还原成非共轭的1,4-环己二烯化合物。
反应机理首先是钠和液氨作用生成溶剂化点子,然后苯得到一个电子生成自由基负离子(Ⅰ),这是苯环的л电子体系中有7个电子,加到苯环上那个电子处在苯环分子轨道的反键轨道上,自由基负离子仍是个环状共轭体系,(Ⅰ)表示的是部分共振式。
胺烯加成反应机理

胺烯加成反应机理胺烯加成反应是一种重要的有机合成反应,其能够生成含有环且具有生物活性的化合物。
其中,胺烯化合物是指胺基和烯基在同一个分子中的化合物,这些化合物可以通过与另一个有机分子发生加成反应。
1. 形成亲电性间体在胺烯加成反应中,基本的前提条件是烯烃分子必须具有一个不饱和键,以提供反应所需的亲电性中间体。
首先,烯烃分子吸引胺基分子的亲电性中心,从而形成一个亲电性间体。
这个过程可以在光照、加热或使用催化剂的条件下实现。
2. 亲核加成接下来,作为亲核试剂的胺基分子进攻亲电性间体,形成Carbocation中间体。
这是一个高能状态的分子,因为它带有正电荷,因此它需要寻找更稳定的状态。
3. 消除质子由于Carbocation中间体是非常不稳定的,它会尝试通过消除质子来降低其能量。
这可能导致新的双键形成,并与烯烃原子形成一个碳-碳单键,从而形成了一个新的C-N键。
4. 闭合环此后,在反应中形成了一个C-N键,胺烯加成反应还有一个步骤,就是环化的过程。
在此步骤中,生成的分子会自我组装,使它们具有对称的几何结构。
5. 生成产物在完成环化过程后,分子中多余的分子或基团可能会被去除,以生成最终产物。
这个新的有机分子可以具有生物活性,例如可用于药物制备。
6. 反应机理总结综上所述,胺烯加成反应机理是一个多步反应。
其中,最重要的步骤是在亲核加成中形成Carbocation中间体,这是反应能量最高的步骤。
该反应的特点是需要烯烃分子在反应中提供亲电性,这是实现反应的最基本的条件。
通过这个反应机理,可以生成具有生物活性的化合物,为合成新的药物和抗生素提供了很好的基础。
100多个有机反应机理

1.Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则 Arbuzov 反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如:反应机理一般认为是按 S N2 进行的分子内重排反应:反应实例2.Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例3.Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
robinson-gabriel反应机理

robinson-gabriel反应机理
Robinson-Gabriel反应是一种有机合成反应,是通过将苯乙烯与丙烯酸酯进行加成反应,生成α,β-不饱和羧酸的方法。
该反应是由英国化学家Robert Robinson和Gabriel于1930年发现的。
反应机理如下:
首先,苯乙烯与丙烯酸酯在存在碱催化剂的条件下发生加成反应,生成一个间歇性的共轭烯烃中间体。
这个中间体是一个具有α,β-不饱和键的羧酸酯。
接下来,这个中间体会在碱的作用下发生内酰胺化反应,生成一个环状的酰胺中间体。
这个酰胺中间体是一个四元环结构,其上有两个羰基和一个双键。
最后,这个酰胺中间体会在酸的作用下发生水解反应,生成α,β-不饱和羧酸。
这个反应会在酸性条件下进行,生成的产物是一种具有α,β-不饱和键的羧酸。
总的来说,Robinson-Gabriel反应是一种通过加成反应生成α,β-不饱和羧酸的方法,其反应机理包括加成反应、内酰胺化反应和水解反应三个步骤。
有机物反应机理

有机物反应机理引言有机化学是研究碳原子及其化合物的化学性质和反应机理的科学。
有机物反应机理是指有机化合物在进行化学反应时,分子间键的形成、断裂和转移的过程。
了解有机物反应机理对于预测和控制有机化合物的合成、性质和反应具有重要意义。
本文将介绍有机物反应的一般性质、常见类型以及一些典型的反应机理。
一般性质反应速率有机化学反应速率受多种因素影响,包括温度、浓度、溶剂、催化剂等。
其中,温度是影响反应速率最为重要的因素。
通常情况下,随着温度升高,分子动力学活性增加,反应速率也随之增加。
势能面在有机物反应中,势能面描述了各个原子之间键的形成和断裂过程中势能变化的路径。
势能面可以通过构建分子轨道图来描述。
中间体在许多有机物反应中,会产生中间体。
中间体是指在一个或多个步骤中生成,并在反应的后续步骤中被消耗的物质。
中间体的形成和消耗是有机物反应机理中重要的环节。
反应类型取代反应取代反应是有机化学中最常见的一类反应。
它涉及到一个原子或官能团被另一个原子或官能团替代的过程。
取代反应可以分为三个主要类型:亲核取代、电子取代和自由基取代。
亲核取代亲核取代是指通过亲核试剂攻击电子丰富区域,将其替换为另一个官能团。
典型的例子包括酯水解和氨解。
电子取代电子取代是指通过电子丰富试剂攻击电子贫瘠区域,将其替换为另一个官能团。
典型的例子包括芳香族亲电取代和醇脱水。
自由基取代自由基取代是指通过自由基试剂攻击碳原子上的氢,将其替换为另一个官能团。
典型的例子包括卤代烷与氯气反应生成卤仿。
加成反应加成反应是指两个或多个分子结合形成一个新的分子的过程。
加成反应可以分为电子亲和性加成和亲核性加成两种类型。
电子亲和性加成电子亲和性加成是指通过电子丰富试剂攻击电子贫瘠区域,形成一个新的化学键。
典型的例子包括烯烃与卤素反应生成卤代烷。
亲核性加成亲核性加成是指通过亲核试剂攻击电子丰富区域,形成一个新的化学键。
典型的例子包括酮与氢氨酯反应生成胺。
消除反应消除反应是指一个分子中两个官能团之间或两个不同分子之间发生共价键断裂,形成双键或三键的过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
胺烯加成反应机理
胺烯加成反应是一种在有机合成中广泛应用的重要反应之一。
该反应的基本机理是烯烃与胺的亲核取代反应,生成3-胺基丙烯酸或其衍生物。
在反应中,烯烃的π电子云与胺的氮原子上的孤对电子形成一对新的化学键,同时原有的π键断裂,形成新的酯或酰胺官能团。
反应的催化剂可以是酸或碱,也可以是金属配合物或有机小分子催化剂。
反应条件常常是温和的,反应时间短,反应产物具有广泛的应用价值。
胺烯加成反应的机理包括以下步骤:1)烯烃与胺的亲核加成;2)形成共轭体系,形成共轭体系有利于进一步的加成反应;3)酰化或酰胺化反应;4)水解或脱保护反应。
在反应中,催化剂起到了关键的作用,可以促进反应的进行和产物的选择性。
总之,胺烯加成反应是一种重要的有机合成反应,其机理与催化剂的选择对产物的结构和选择性有着重要的影响。
该反应在医药、农药、化妆品等领域有着广泛的应用前景。
- 1 -。
