库仑滴定法
(完整版)库仑滴定法标定硫代硫酸钠溶液的浓度

库仑滴定法测定硫代硫酸钠溶液的浓度一、实验目的1.学习库仑滴定和永停法指示终点的基本原理。
2.学习库仑滴定的基本操作技术。
二、实验原理1.库仑滴定:化学分析法所用的标准溶液大部分是借助于另一种标准物质作基准,而基准物的纯度、使用前的预处理(如烘干、保干或保湿)、称量的准确度、以及滴定时对终点颜色变化的目视观察等等,无疑对标定的结果都有重要影响。
利用库仑滴定法通过电解产生纯物质与标准溶液反应,不但能对标准溶液进行标定,而且由于利用近代电子技术可以获得非常稳定而精度很高的恒电流,同时,电解时间也易精确记录,因此可以不必使用基准物质,而可避免上述以基准物标定时可能引入的分析误差,提高标定的准确度。
本实验是在0.1M NaAc-HAc缓冲介质中,以电解KI溶液产生的I2标定Na2S2O3溶液。
在工作电极上以恒电流进行电解,发生下列反应:阳极2I- ==== I2 +2e阴极2H++2e ==== H2工作阴极置于隔离室(玻璃套管)内,套管底部有一微孔陶瓷芯,以保持隔离室内外的电路畅通,这样的装置避免了阴极反应对测定的干扰。
阳极产物I2与Na2S2O3溶液发生作用:I2+2S2O32- ==== S4O62-+2I-由于上述反应,在化学计量点之前溶液中没有过量的I2,不存在可逆电对,因而两个铂指示电极回路中无电流通过,当继续电解,产生的I2全部与的Na2S2O3作用完毕,稍过量的I2即可与I-离子形成I2/2 I-可逆电对,此时在指示电极上发生下列电极反应:指示阳极2I- ==== I2 +2e指示阴极I2 +2e ==== 2I-由于在两个指示电极之间保持一个很小的电位差(约200mV),所以此时在指示电极回路中立即出现电流的突跃,以指示终点的到达。
正式滴定前,需进行预电解,以清除系统内还原性干扰物质,提高标定的准确度。
2.仪器工作原理:本实验采用江苏电分析仪器厂生产的KLT-1型通用库仑仪进行测定。
工作原理是:1)终点方式选择控制电路:指示电极由用户自己选用,其中有一铂片,电位法和电流法指示时共用,面板设有“电位、电流”“上升、下降”琴键开关,任用户根据需要选择。
库仑滴定法

2. 库仑分析法2.1 基本原理2.2 恒电流库仑分析法2.3 恒电位库仑分析法2.4 动态库仑分析法2.5 实验2.1 基本原理2.1.1 法拉第电解定律2.1.2 影响电流效率的因素及消除方法库仑分析法是在电解分析法的基础上发展起来的一种电化学分析法。
电解分析法是将直流电压施加于电解电池 ① 的两个电极上,电解池由被测物的溶液和一对电极构成,被测物质的离子在电极上(阴极或阳极)以金属单质或金属氧化物形式析出,根据电极增加的质量, 计算被测物的含量。
而库仑分析法不是通过称量电解析出物的质量,而是通过准确测量电解 过程中所消耗的电量(库仑数)进行定量分析的。
库仑分析法要得到准确的分析结果,需要保证电极反应有 100%电流效率 ② ,通过电解池的电量要有准确的测定方法;电解的终点要有合适方法作准确指示。
库仑分析法根据电解方式以及电量测量方式的不同分为控制电位库仑法、 恒电流库仑法 及动态库仑法。
2.1.1 法拉第电解定律库仑分析法的理论基础是法拉第电解定律。
2.1.1.1 法拉第电解定律内容法拉第电解定律包括下述两部分内容:第一,电流通过电解质溶液时,发生电极反应的物质的质量与所通过的电量(Q)成正 比,即与电流强度和通过电流的时间的乘积成正比:m∝Q 或 m∝i.t (2-1)式中 m 为电极上析出物质的质量,g;Q 为电量,C(库仑); i 为电流强度,A(安培);t 为时间, s(秒)。
第二,在电解过程中,通过电解池 1 法拉第电量(96487C),则在电极上析出 M/n 摩尔 质量的物质。
通常将 96487C 的电量称为 1 法拉第电量,以 F 表示,即 1F=96487C。
实验证明,在电极上析出 nM (g/mol)的任何物质所需的电量均为 1F。
因此上述法拉第 定律可用下列数学表达式表示:Fn itM Fn M Q m = = . (2-2) 式中 M 为在电极上析出的物质的摩尔质量,g/mol;n 为电解反应时电子转移数;t 为电解 的时间,s;i 为电解电流,当i 以 mA(毫安)表示时,电极析出物质的质量以 mg(毫克) 为单位;当 I 以 A(安培)表示时,电极析出物质的质量以 g 为单位。
实验十 库仑滴定法测砷

实验十库仑滴定法测砷一.实验目的通过本实验学习库仑滴定法的基本原理;了解电极反应与化学反应,掌握滴定终点的确定方法。
二.方法原理库仑分析法是根据电解过程中所消耗的电量来求被测的浓度或含量,它的理论依据是法拉弟定律:m=Q*M/(nF),则c=m/(M*V)=Q/(nFV),F=96487库仑。
库仑滴定法是由电解产生的“滴定剂”来测定微量或痕量物质的一种分析方法,“滴定剂”的量根据法拉弟定律求出。
在本实验中反应方程式:H2AsO3- + I3- + H2O = HAsO42- + 3I- + 3H+,H2AsO3-是被测物,此反应要求pH5~9;是I3-“滴定剂”,在恒电流的情况下于双铂片阳极上由KI氧化产生,3I- = I3- + 2e。
铂丝阴极置于烧结玻璃管内,以保持100%的电流效率,2H+ + 2e = H2。
终点利用两个铂片电极作为指示系统,以电流上升法检测(也可用淀粉指示剂)。
在整个滴定期间由于电生的I3-被As(III)所消耗,所以没有电流流过;当As(III)全部被氧化成As(V)后,产生过量的I3-;I3-可以在负极还原,I-在正极氧化,由于有氧化还原反应发生,因此就有电流通过指示系统,指示终点到达。
三.仪器与试剂1.通用库仑仪2.磁力搅拌器3.0.2mol/L KI:称取大约3g KI,溶解于100mL水中,加入0.01gNa2CO3以防止空气的氧化作用。
4.0.2mol/L磷酸盐缓冲液:将大约3g K2HPO4溶解于65mL水中,以3mol/LHCl把溶液pH调节到8.0±0.2。
5.淀粉溶液:0.5%(新配置)四.操作步骤1.将25mL KI、25mL磷酸盐缓冲液和1.00mL试液加到电解池中,用磷酸盐缓冲液充满隔阴极的管子。
2.把隔离阴极接到电解系统的负极,双铂片电极接到电解系统的正极;把两个铂片电极分别接到指示系统(即测量系统)的正极和负极。
3.开启电源前将所有琴键全部释放,“工作/停止”键置“停止”位置,电流微调放在最大位置,开启电源预热30min。
计时电量法和库仑滴定法
计时电量法和库仑滴定法一计时电量法使用原理在电分析化学中,记录电流或电极电势等与时间关系曲线的方法称为计时分析法.测量电流一时间的关系方法,称为计时电流法.记录电势一时间的关系方法,称为计时电势法,而记录电量一时间关系的方法,称为计时库仑法。
是研究电极过程和吸附的极好方法。
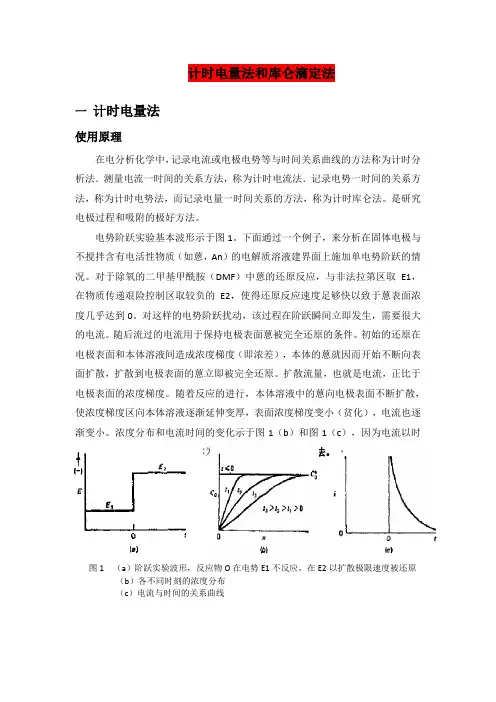
电势阶跃实验基本波形示于图1。
下面通过一个例子,来分析在固体电极与不搅拌含有电活性物质(如蒽,An)的电解质溶液建界面上施加单电势阶跃的情况。
对于除氧的二甲基甲酰胺(DMF)中蒽的还原反应,与非法拉第区取E1,在物质传递艰险控制区取较负的E2,使得还原反应速度足够快以致于蒽表面浓度几乎达到0。
对这样的电势阶跃扰动,该过程在阶跃瞬间立即发生,需要很大的电流。
随后流过的电流用于保持电极表面蒽被完全还原的条件。
初始的还原在电极表面和本体溶液间造成浓度梯度(即浓差),本体的蒽就因而开始不断向表面扩散,扩散到电极表面的蒽立即被完全还原。
扩散流量,也就是电流,正比于电极表面的浓度梯度。
随着反应的进行,本体溶液中的蒽向电极表面不断扩散,使浓度梯度区向本体溶液逐渐延伸变厚,表面浓度梯度变小(贫化),电流也逐渐变小。
浓度分布和电流时间的变化示于图1(b)和图1(c),因为电流以时间的函数记录,所以该方法称为计时电流法或计时安培法。
图1 (a)阶跃实验波形,反应物O在电势E1不反应,在E2以扩散极限速度被还原(b)各不同时刻的浓度分布(c)电流与时间的关系曲线在控制电势实验中,一般观测电流对事件或电势的关系,但有时,记录电流对时间的积分是很有用的。
由于该积分表示通过的电量,故这些方法称为库仑(或电量)方法。
库仑方法中最基本的是计时库仑法(计时电量法)和双电势计时库仑法(双电势阶跃计时电量法),它们事实上是相应计时电流法的积分量。
图2(c)就是对应图2(a)电势阶跃信号的库仑响应,通过积分,可以很容易看出图2(c)与图2(a)间的关系。
图2(a)电势阶跃实验波形(b)电流与时间的关系(c)计时库仑法的相应曲线计时电量法,记录电流的积分,即电量对时间的关系Q(t)。
计时电量法和库仑滴定法
计时电量法和库仑滴定法一计时电量法1.1使用原理在电分析化学中,记录电流或电极电势等与时间关系曲线的方法称为计时分析法.测量电流一时间的关系方法,称为计时电流法.记录电势一时间的关系方法,称为计时电势法,而记录电量一时间关系的方法,称为计时库仑法。
是研究电极过程和吸附的极好方法。
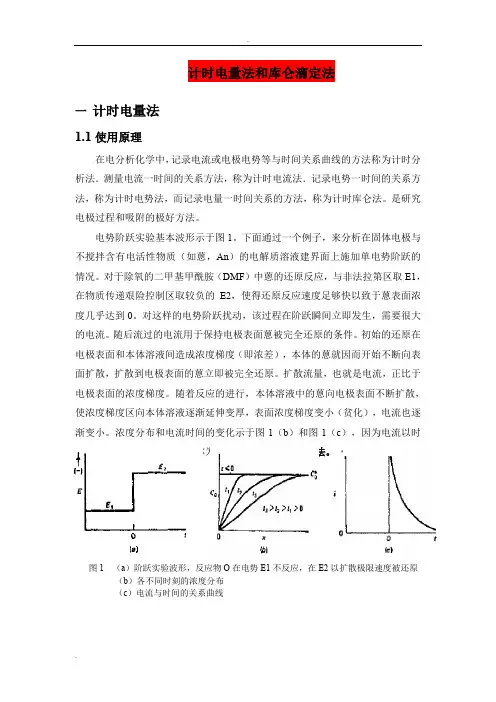
电势阶跃实验基本波形示于图1。
下面通过一个例子,来分析在固体电极与不搅拌含有电活性物质(如蒽,An)的电解质溶液建界面上施加单电势阶跃的情况。
对于除氧的二甲基甲酰胺(DMF)中蒽的还原反应,与非法拉第区取E1,在物质传递艰险控制区取较负的E2,使得还原反应速度足够快以致于蒽表面浓度几乎达到0。
对这样的电势阶跃扰动,该过程在阶跃瞬间立即发生,需要很大的电流。
随后流过的电流用于保持电极表面蒽被完全还原的条件。
初始的还原在电极表面和本体溶液间造成浓度梯度(即浓差),本体的蒽就因而开始不断向表面扩散,扩散到电极表面的蒽立即被完全还原。
扩散流量,也就是电流,正比于电极表面的浓度梯度。
随着反应的进行,本体溶液中的蒽向电极表面不断扩散,使浓度梯度区向本体溶液逐渐延伸变厚,表面浓度梯度变小(贫化),电流也逐渐变小。
浓度分布和电流时间的变化示于图1(b)和图1(c),因为电流以时间的函数记录,所以该方法称为计时电流法或计时安培法。
图1 (a)阶跃实验波形,反应物O在电势E1不反应,在E2以扩散极限速度被还原(b)各不同时刻的浓度分布(c)电流与时间的关系曲线在控制电势实验中,一般观测电流对事件或电势的关系,但有时,记录电流对时间的积分是很有用的。
由于该积分表示通过的电量,故这些方法称为库仑(或电量)方法。
库仑方法中最基本的是计时库仑法(计时电量法)和双电势计时库仑法(双电势阶跃计时电量法),它们事实上是相应计时电流法的积分量。
图2(c)就是对应图2(a)电势阶跃信号的库仑响应,通过积分,可以很容易看出图2(c)与图2(a)间的关系。
图2(a)电势阶跃实验波形(b)电流与时间的关系(c)计时库仑法的相应曲线计时电量法,记录电流的积分,即电量对时间的关系Q(t)。
库仑滴定法

(4)电流及时间可准确获得。
三、实验步骤
1. 试液的配制
取市售维生素C一片,称重,转入烧杯中,用5mL0.1mol/L HCl溶解并转入50mL容量瓶中,以二次水溶液清洗烧杯,并用之 稀释至刻度,摇匀,放置至澄清,备用。
2. 电解液的配制
称取1.66g KI,用10 mL 0.1 mol/L HCl溶液溶解后置于库仑池中, 用二次水稀释至60 mL,置于电磁搅拌器上搅拌均匀。取少量电解液 注入砂芯隔离的电极内,并使液面高于库仑池的液面。
7. 重复测定,电量取平均值 8. 复原仪器
将所有琴键弹起,关闭电源,洗净库仑池,存放备用。
四、数据处理
Vc ~ I2 ~ 2e,
100MQ Vc %= nFms
维生素片的质量(g)Leabharlann 即n=2176.1
×100%
移取Vc液的体积
电解消耗的电量 平均电量
Vc的含量(%)
五、思考题
1. 库仑滴定的原理是什么? 2. 库仑滴定的前提条件是什么? 3. 库仑滴定根据什么公式进行定量计算? 4. 配制维生素C试液的过程中,为什么要加入HCl? 5. 为什么要进行终点校正? 6. 该滴定反应能否在碱性介质中进行?
3. 调节仪器
调“补偿极化电位”在0.4左右,量程选择10 mA,将所有琴键全
部抬起,打开电源预热30分钟。
三、实验步骤
4. 接线
电解阳极(红)接电解池的双铂片电极,阴极(黑)接铂 丝电极,将“工作/停止”开关置“停止”,指示电极两个夹 子分别接在指示线路的两个独立的铂片上。
5. 校正终点
滴入数滴Vc试液于库仑池内,启动电磁搅拌器,按下“启 动”键,将“停止/工作”开关置“工作”,按一下“电解” 开关,终点指示灯灭,电解开始,电解到终点时指示灯亮,电 解自动停止,将 “工作/停止”开关置于“停止”,弹开“启 动”键,显示数码自动回零。
库仑滴定法测定硫代硫酸盐
库仑滴定法测定硫代硫酸盐一.实验目的1.学习库仑滴定法的原理,掌握库仑滴定法的实验原理。
2.应用法拉第定律求算未知物浓度。
二.实验原理1.库仑滴定法库仑滴定法是建立在恒电流电解过程基础上的一种准确而灵敏的分析方法。
可用于常量和痕量物质的测定,通过电极反应产生与待测物质定量反应的“滴定剂”,滴定终点借助电化学方法或指示剂指示。
根据法拉第定律由滴定过程中消耗的电量计算被测量物质的含量。
2.法拉第定律电解过程中,在电极上反应的物质的质量与通过电解池电量的关系: W = MQ / NF本实验中,通过测定电量Q来求得未知物的质量,进而求出其浓度。
3.本次实验用KI在阳极电解产生“滴定剂”I2来滴定S2O3-,通过电解消耗的电荷数来计算Na2S2O3浓度。
电极反应为:阳极: 2I-=I2+2e-阴极:2H++2e-=H2↑滴定反应为: I2+2S2O32-=2I-+S4O62-三.实验仪器与试剂仪器:铂片电极4支、电磁搅拌器、10mL移液管、2mL吸量管、烧杯2个。
试剂:0.1mol/LKI溶液、未知浓度Na2S2O3溶液。
四.实验过程1.准备工作接通电源,机器预热,量程选择10mA档,调节“补偿极化电位”旋钮,使微安表指针在20。
2.测量工作量取碘化钾电解液40ml置于电解池中,放入搅拌磁子,将电解池放在电磁搅拌器上,在铂丝阴极隔离管注入电解液至管的2/3处,连接好电极。
滴加几滴Na2S2O3溶液与电解池中,按下“启动”,“电解”,开始电解,“终点指示灯亮”,终点到,为能熟悉终点的判断,可反复练习几次。
准确移取待测Na2S2O3溶液0.5ml加入到电解池中,按下“启动”,“电解”,开始电解,“终点指示灯亮”,终点到,记录数据,重复测定五次。
3。
关闭仪器电源,拆除电极接线,电解液倒入回收瓶中,洗净电解池及电极。
五.实验数据每次加入的的体积:0.50 ml. 测量次数:6次组次 1 2 3 4 5 6电量(mC)745 867 763 713(舍)833 939(舍)根据几次测量的结果,用五次误差较小的数据算出毫库仑的平均值。
库仑滴定法测定药片中维生素C的含量
库仑滴定法测定药片中维生素C 的含量一、目的掌握库仑滴定法测定抗坏血酸的原理、方法和KLT —1型通用库仑仪的操作方法。
二、原理库仑滴定法是用恒电流电解产生滴定剂,在电解池中与被测定物质定量反应来测定该物质的一种分析方法。
若电解的电流效率为100%,电生滴定剂与被测物质的反应是完全的,而且有灵敏的确定终点的方法,那么,所消耗的电量与被测定物质的量成正比,根据法拉第定律可进行定量计算: m =it nFMQ nF M =m: 电解析出物质的质量(g )M: 电解析出物质的摩尔质量(g/mol ) n: 电极反应中的电子转移数 F: 法拉第常数(96487 C/mol )Q: 电量;t: 电流强度(A ); t: 电解时间本实验使用KLT —1型通用库仑仪,用恒电流电解KBr 的酸性溶液,使Br —在铂阳极上氧化为Br 2。
阳极 2Br —=Br 2+2e 有用电极(双铂片,红线) 阴极 2H ++2e=H 2↑ 辅助电极(铂丝) 电解产生的Br 2与抗坏血酸发生氧化—还原反应:抗坏血酸 脱氢抗坏血酸该反应能快速而定量地进行,因此可通过电生Br 2,用库仑滴定法测定抗坏血酸。
滴定终点用双铂电极电流法指示。
在双铂指示电极间加一小的极化电压(约150mV ),由于抗坏血酸和脱氢抗坏血酸电对的不可逆性,它们不会在电极上发生氧化还原反应。
在滴定的等当点前,由于溶液中没有过量的Br 2存在,阳极处于理想极化状态,所以只有极微小的残余电流通过。
一过等当点,溶液中有了过量的Br 2,则指示电极上便发生如下反应:阴极 Br 2+2e = 2Br —阳极 2Br —-2e = Br 2这时,指示电极的电流迅速增大。
此指示电流信号经过微电流放大器进行放大,然后经微OH OHO+ Br 2 =+ 2Br —+2H +OOHOH OH OHO辅助电极(铂丝)有用电极(双铂片)电解电极指示电极分电路输出一脉冲信号触发电路,再推动开关执行电路自动关断电解回路。
库仑法 容量法 水分滴定
库仑法容量法水分滴定
库仑法、容量法和水分滴定是化学分析中常用的技术方法,用于测定样品中的水分含量。
库仑法是一种基于电化学原理的测定方法。
它利用电解液中的电极间电荷传递的速率与含水量成正比的原理,通过测定电流变化来确定样品中的水分含量。
库仑法通常适用于液体样品,如食品、药品和化妆品等。
容量法是一种通过加热样品,使样品中的水分蒸发,并通过称量来确定失去的质量的方法。
容量法一般适用于固体样品,如粉末、颗粒和块状物等。
容量法的优点是测定简单快速,但可能存在误差,因为它无法准确测量蒸发过程中的其他挥发物质。
水分滴定是一种常用的分析方法,通过滴定试剂与样品中的水分反应,确定水分含量的方法。
常用的水分滴定试剂包括卡尔费休试剂、卢瑟福试剂和卡尔森试剂等。
水分滴定常用于液体和固体样品的测定,具有准确性高、操作简单的特点。
除了这些常用的方法外,还有其他一些测定水分含量的技术,如红外光谱法、核磁共振法和质谱法等。
这些方法根据样品的特性和要求选择,可以辅助库仑法、容量法和水分滴定进行验证和确认。
总之,库仑法、容量法和水分滴定是常用的测定水分含量的方法。
它们在不同的样品和实验需求下具有一定的优势和适用性。
研究人员和实验室可以根据具体情况选择合适的方法,并结合其他分析技术进行验证和确认,以确保结果的准确性和可靠性。
计时电量法和库仑滴定法
计时电量法和库仑滴定法一计时电量法1.1使用原理在电分析化学中,记录电流或电极电势等与时间关系曲线的方法称为计时分析法.测量电流一时间的关系方法,称为计时电流法.记录电势一时间的关系方法,称为计时电势法,而记录电量一时间关系的方法,称为计时库仑法。
是研究电极过程和吸附的极好方法。
电势阶跃实验基本波形示于图1。
下面通过一个例子,来分析在固体电极与不搅拌含有电活性物质(如蒽,An)的电解质溶液建界面上施加单电势阶跃的情况。
对于除氧的二甲基甲酰胺(DMF)中蒽的还原反应,与非法拉第区取E1,在物质传递艰险控制区取较负的E2,使得还原反应速度足够快以致于蒽表面浓度几乎达到0。
对这样的电势阶跃扰动,该过程在阶跃瞬间立即发生,需要很大的电流。
随后流过的电流用于保持电极表面蒽被完全还原的条件。
初始的还原在电极表面和本体溶液间造成浓度梯度(即浓差),本体的蒽就因而开始不断向表面扩散,扩散到电极表面的蒽立即被完全还原。
扩散流量,也就是电流,正比于电极表面的浓度梯度。
随着反应的进行,本体溶液中的蒽向电极表面不断扩散,使浓度梯度区向本体溶液逐渐延伸变厚,表面浓度梯度变小(贫化),电流也逐渐变小。
浓度分布和电流时间的变化示于图1(b)和图1(c),因为电流以时间的函数记录,所以该方法称为计时电流法或计时安培法。
图1 (a)阶跃实验波形,反应物O在电势E1不反应,在E2以扩散极限速度被还原(b)各不同时刻的浓度分布(c)电流与时间的关系曲线在控制电势实验中,一般观测电流对事件或电势的关系,但有时,记录电流对时间的积分是很有用的。
由于该积分表示通过的电量,故这些方法称为库仑(或电量)方法。
库仑方法中最基本的是计时库仑法(计时电量法)和双电势计时库仑法(双电势阶跃计时电量法),它们事实上是相应计时电流法的积分量。
图2(c)就是对应图2(a)电势阶跃信号的库仑响应,通过积分,可以很容易看出图2(c)与图2(a)间的关系。
图2(a)电势阶跃实验波形(b)电流与时间的关系(c)计时库仑法的相应曲线计时电量法,记录电流的积分,即电量对时间的关系Q(t)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2. 库仑分析法2.1 基本原理2.2 恒电流库仑分析法2.3 恒电位库仑分析法2.4 动态库仑分析法2.5 实验2.1 基本原理2.1.1 法拉第电解定律2.1.2 影响电流效率的因素及消除方法库仑分析法是在电解分析法的基础上发展起来的一种电化学分析法。
电解分析法是将直流电压施加于电解电池 ① 的两个电极上,电解池由被测物的溶液和一对电极构成,被测物质的离子在电极上(阴极或阳极)以金属单质或金属氧化物形式析出,根据电极增加的质量, 计算被测物的含量。
而库仑分析法不是通过称量电解析出物的质量,而是通过准确测量电解 过程中所消耗的电量(库仑数)进行定量分析的。
库仑分析法要得到准确的分析结果,需要保证电极反应有 100%电流效率 ② ,通过电解池的电量要有准确的测定方法;电解的终点要有合适方法作准确指示。
库仑分析法根据电解方式以及电量测量方式的不同分为控制电位库仑法、 恒电流库仑法 及动态库仑法。
2.1.1 法拉第电解定律库仑分析法的理论基础是法拉第电解定律。
2.1.1.1 法拉第电解定律内容法拉第电解定律包括下述两部分内容:第一,电流通过电解质溶液时,发生电极反应的物质的质量与所通过的电量(Q)成正 比,即与电流强度和通过电流的时间的乘积成正比:m∝Q 或 m∝i.t (2-1)式中 m 为电极上析出物质的质量,g;Q 为电量,C(库仑); i 为电流强度,A(安培);t 为时间, s(秒)。
第二,在电解过程中,通过电解池 1 法拉第电量(96487C),则在电极上析出 M/n 摩尔 质量的物质。
通常将 96487C 的电量称为 1 法拉第电量,以 F 表示,即 1F=96487C。
实验证明,在电极上析出 nM (g/mol)的任何物质所需的电量均为 1F。
因此上述法拉第 定律可用下列数学表达式表示:Fn itM Fn M Q m = = . (2-2) 式中 M 为在电极上析出的物质的摩尔质量,g/mol;n 为电解反应时电子转移数;t 为电解 的时间,s;i 为电解电流,当i 以 mA(毫安)表示时,电极析出物质的质量以 mg(毫克) 为单位;当 I 以 A(安培)表示时,电极析出物质的质量以 g 为单位。
应用法拉第电解定律时,必须保证电解时电流效率为 100%,即通过电解的电量全部用 于析出待测物质,而无其它副反应。
①可盛装电解质溶液,具有两个或两个以上电极,用以电解的容器称电解池。
②根据GB/T14666-93“分析化学术语”电流效率的定义为:某一物质在电解过程中,理论所需和实际 消耗电量之比。
例 2-1 某 Cu 2+溶液通过 0.500A 电流 28.7min。
如果电流效率为 100%计算:(1)阳极 ① 上放出氧多少克?(2)阴极 ② 上析出多少克铜?电解时,在阳极和阴极上发生的反应分别为:阳极:阴极:根据式(2-2)则(1)阳极上析出氧的质量为g m 2 10 14 . 7 9648760 7 . 28 500 . 0 2 16 - ´ = ´ ´ ´ = (2)阴极上析出铜的质量为g m Cu 283 . 0 9648760 7 . 28 500 . 0 2 5 . 63 = ´ ´ ´ = 2.1.2 影响电流效率的因素及消除方法库仑分析的先决条件是电流效率为 100%,但实际应用中由于副反应的存在,使 100%电 流效率难以实现。
其主要原因有以下几方面:2.1.2.1 溶剂参与电极反应库仑分析多数在水溶液中进行的,水在一定 pH 值及一定电极电位下,可能参加电极反 应而被电解。
阴极上可能发生还原反应析出氢气,其反应为:阳极上可能发生氧化反应析出氧气。
其反应如下: 可见,电极如果发生这些副反应,电量就要被消耗。
所以应控制适当的电位和溶液的 pH 值范围,以防止水的电解。
从这点出发,若采用汞阴极则要优于铂电极。
若用有机溶剂 或混合液作电解液,为防止它们的电解,一般都应先用空白溶液制出 i-E 曲线,以确定其适 宜的电压范围及电解条件。
2.1.2.2 共存杂质的电解试剂及溶剂中微量易氧化或易还原的杂质,可能在电极上参加反应而影响电流效率。
可 以用纯试剂作空白试验加以校正,也可以通过预电解除去杂质。
2.1.2.3 溶解氧的还原溶液中溶解的氧气可以在阴极上还原为 H 2O 2 或H 2O,因而造成电流效率降低。
消除溶 解氧影响的方法是:在电解前通入惰性气体(如氮气)数分钟。
必要时在惰性气氛下电解。
2.1.2.4 电极本身参与反应库仑分析中一般用铂电极作阳极,而铂电极在有 Cl - 或其他络合剂存在时可能发生氧化溶解,因而造成电流效率降低。
此时可选用其他材料制成的电极。
2.1.2.5 电解产物的副反应①电解池中与外加直流电源的正极相连的为阳极。
电解时,电子从阳极流出,电极上发生氧化反应。
②电解池中与外加直流电源的负极相连的为阴极。
电解时,电子从外加电源的负极流入阴极,电极上发 生还原反应。
H 2 O 2H + + 1 2 O 2 +2e C u 2+ +2e C u2H + +2eH 22H 2O O 2+4H + +4e电解时,两电极上的电解产物相互反应,或一个电极上的反应产物又在另一个电极上反应。
防止办法是选择合适的电解液和电极, 或采用隔膜套管将阳极和阴极隔开或将两电极分别置 两个容器中以盐桥相连。
思考与练习⒉11、什么是库仑分析法?库仑分析法分哪几类?2、库仑分析要获得准确分析结果必须具备哪些条件?3、简述法拉弟电解定律的内容,说明应用定律的先决条件是什么?4、简述影响电流效率的因素及消除方法。
5、 在 CuSO 4 溶液中, 用铂电极以 0.1000A 的电流通过 10min, 在阴极上沉积铜的质量是多少? 假设电流效率为 100%6、某电解池通过恒定电流 0.240A, 时间 19.6min, 析出 pbO 20.0764g。
计算该阴极电流效率。
电极反应如下(已知 M PbO2=239.2g.mol.L -1) 阅读材料科学家法拉第Micheal Faraday法拉第出身在英国的一个铁匠家庭。
由于家庭生活贫困,法拉第仅读过二年半的小学,12岁便到一家 书店当装订徒工。
由于他诚实、聪明、能干装订书籍既快又好,赢得店主和客人的赞扬和喜爱。
他一边装 订书,一边如饥似渴地乘机阅读着各种各样的书籍,随着阅读内容的不断深入,他越来越被物理、化学领 域的成果所吸引。
近十年的装订工经历,使他获得了丰富的知识。
被上进心和热爱科学所驱使的法拉第在友人的帮助下,从 1810 年始常去英国皇家学院听科学家的演 讲。
1812年,他听了著名科学家戴维的四次报告,每次听讲他都详细作记录,回家后把所听的材料精心整 理,绘制了许多图表,再装订成册,然后寄给戴维,并附上请求在皇家学院谋职的信。
戴维接受了法拉第 的请求,同意法拉第以皇家研究所助手的名义,在他的实验室工作。
戴维对法拉第严格要求,精心培养, 而法拉第则是刻苦学习,虚心求教。
几年后,法拉第就表现出惊人的才干 ,他连续发表了多篇论文,成绩 瞩目。
1821 年法拉第成为皇家学院实验室总监和实验室主任,1833 年任教授。
1831 年法拉第发表了电磁 感应产生电流的原理,1834年发表了著名的以他名字命名的电解定律。
法拉第的苦学成名和杰出成就,一直被后人传颂。
2.2 恒电流库仑分析法2.2.1 方法原理2.2.2 库仑滴定装置2.2.3 电生滴定剂的产生方式2.2.4 终点指示方法2.2.5 库仑滴定的误差来源2.2.6 库仑滴定法的特点和应用2.2.1 方法原理恒电流库仑分析法又称控制电流库仑分析法或库仑滴定法。
该法是以恒定的电流通p b 2+ +2H 2 O p b O 2 (s )+4H + +2e过电解池,使工作电极 ① 上产生一种能够与溶液中待测组分反应的滴定剂,称电生滴定剂。
反应的终点可以用加入指示剂或电化学方法来指示。
准确测量通过电解池的电流强度和从电 解开始到电生滴定剂与待测组分完全反应(即反应终点)的时间,利用法拉弟电解定律求出 组分含量。
库仑滴定与普通滴定分析在反应原理上是相同的, 所不同的是普通滴定法的滴定剂由化 学试剂配制成一定浓度的溶液后,由滴定管加入。
而库仑滴定的滴定剂则是通过电解在电极 上产生的。
2.2.2库仑滴定装置库仑滴定装置如图 2-1 所示。
它是由发生系统和指示系统两部分组成。
图 2-1 库仑滴定装置发生系统由恒电流电源,电解池、计时器等主要部件组成。
其中恒电流电源是一种能供 应直流电并保证所供电的电流恒定的装置,可以使用直流稳压器,也可以用几个串联的 45V B 电池(库仑滴定中所用的电流常在 1~20mA 左右,一般不超过 100mA)。
电解池(又称库仑 池)中工作电极直接浸在溶液中,辅助电极通常需要套一多孔隔膜,以防止辅助电极所发生 的反应干扰测定。
电解池还要设通 N2 除 O2 的通气口。
计时器采用精密电子计时器,利用双 掷开关可以同时控制电子计时器和电解电路,使电解和计时同步进行,(当然,也可用秒表 计时,但为了保证测量准确度,电解时间一般要在 100~200S 为宜)。
发生系统的作用是提 供一个数值已知的恒电流,产生滴定剂并准确记录电解时间。
指示系统用于指示滴定终点的到达, 其具体装置应视终点指示方法而定, 可以用指示剂, 也可用电化学方法中的电位法或电流法指示。
使用电化学法指示终点时,池内还要安一指示 电极对,这种方法的特点是易于实现自动化。
2.2.3电生滴定剂的产生方式由于库仑滴定法所用滴定剂是在电极上产生的并且瞬间便与被测物质作用而被消耗掉。
因此,克服了普通滴定分析中标准滴定溶液的制备、标定以及贮存等引起的误差。
电生滴定 剂产生方式主要有以下三种①在库仑分析中,把两个电极分别称为工作电极和辅助电极。
工作电极是指当比较大的电流通过时,能改 变主体溶液浓度的电极。
在工作电极上待测组分发生氧化还原反应或电生出滴定剂。
辅助电极只是提供电 子传递的场所,起导电作用,以构成回路。
2.2.3.1内部电生滴定剂法内部电生滴定剂法是指电生滴定剂的反应和滴定反应在同一电解池中进行的。
这种方法 的电解池内除了含有待测组分以外,还应含有大量的辅助电解质。
辅助电解质起三种作用: 一是电生出滴定剂;二是起电位缓冲剂作用;三是由于大量辅助电解质存在,可以允许在较 高电流密度 ① 下进行电解而缩短分析时间。
目前多数库仑滴定以此种方法产生滴定剂。
库仑滴定中对所使用的辅助电解质有以下几点要求:(1)要以 100%的电流效率产生滴定剂,无副反应发生。
(2)要有合适的指示终点的方法;(3)产生滴定剂与待测物之间能快速发生定量反应。
