常见氮原子的杂化类型
硝酸中氮原子的杂化方式

硝酸中氮原子的杂化方式
硝酸分子中的氮原子是一个非常重要的结构单元,它的杂化方
式对于理解硝酸分子的性质和反应具有重要意义。
硝酸分子的结构
中包含一个氮原子和三个氧原子,其中氮原子的杂化方式影响着硝
酸分子的稳定性和反应性。
在硝酸分子中,氮原子的杂化方式是sp2杂化。
在这种杂化方
式下,氮原子的一个2s轨道和两个2p轨道重新组合成三个等能的
sp2杂化轨道。
这些sp2杂化轨道与三个氧原子的p轨道形成σ键
和π键,从而构成硝酸分子的结构。
硝酸分子的杂化方式影响着其分子的平面性和稳定性。
由于氮
原子的sp2杂化,硝酸分子呈现出平面三角形的构型,这种构型使
得硝酸分子具有一定的稳定性。
此外,氮原子的杂化方式还影响着
硝酸分子的反应性,例如在硝化反应中,氮原子的sp2杂化方式使
得硝酸分子能够与其他物质发生反应,从而参与到许多有机合成和
爆炸性物质的制备中。
总之,硝酸分子中氮原子的sp2杂化方式对于硝酸分子的结构、
稳定性和反应性具有重要影响,深入理解这一杂化方式有助于我们更好地理解硝酸分子的性质和应用。
一氧化二氮的杂化类型

一氧化二氮的杂化类型一氧化二氮(N2O),也被称为笑气或亚氮气体,是一种无色、无味的气体。
在化学中,一氧化二氮也展现出了多种不同的杂化类型。
本文将就这些杂化类型进行详细的介绍。
1. sp杂化在一氧化二氮中,氮原子的杂化类型主要是sp杂化。
sp杂化是指一个s轨道和一个p轨道混合形成的杂化轨道。
在一氧化二氮中,氮原子的一个2s轨道和两个2p轨道通过杂化形成了三个sp杂化轨道。
这种sp杂化使得氮原子能够与其他原子形成共价键。
2. sp2杂化除了sp杂化之外,一氧化二氮中的氮原子还可以发生sp2杂化。
sp2杂化是指一个s轨道和两个p轨道混合形成的杂化轨道。
在一氧化二氮中,氮原子的一个2s轨道和两个2p轨道通过杂化形成了三个sp2杂化轨道。
这种杂化使得氮原子能够形成三个sigma键和一个pi键。
3. sp3杂化除了sp和sp2杂化之外,一氧化二氮中的氮原子还可以发生sp3杂化。
sp3杂化是指一个s轨道和三个p轨道混合形成的杂化轨道。
在一氧化二氮中,氮原子的一个2s轨道和三个2p轨道通过杂化形成了四个sp3杂化轨道。
这种杂化使得氮原子能够与其他原子形成四个sigma键。
4. d杂化除了s和p轨道的杂化外,一氧化二氮中的氮原子还可以发生d杂化。
d杂化是指s、p和d轨道混合形成的杂化轨道。
在一氧化二氮中,氮原子的2s、2p和3d轨道通过杂化形成了d杂化轨道。
这种杂化使得氮原子能够参与更复杂的化学反应。
一氧化二氮的杂化类型包括sp、sp2、sp3和d杂化。
这些不同的杂化使得一氧化二氮具有了多样的化学性质和反应能力。
通过了解这些杂化类型,我们可以更好地理解一氧化二氮在化学反应中的角色和作用,为相关的研究和应用提供更深入的理论基础。
三聚氰胺中氮原子杂化方式

三聚氰胺中氮原子杂化方式
三聚氰胺是一种有机化合物,化学式为C3H6N6。
它是一种白色结晶性粉末,可溶于水。
三聚氰胺的主要用途是用作氮肥、动物饲料、木材防腐剂等。
然而,由于它的毒性和致癌性,三聚氰胺已被禁止在食品和饲料中使用。
三聚氰胺中的氮原子可以通过不同的杂化方式来形成不同的化学键。
最常见的是sp2和sp3杂化。
在sp2杂化中,氮原子形成三个sp2杂化轨道和一个未杂化的p轨道。
这些sp2杂化轨道与三个碳原子上的sp2杂化轨道形成σ键,而未杂化的p轨道与其它原子上的p轨道形成π键。
在sp3杂化中,氮原子形成四个sp3杂化轨道。
这些轨道与四个碳原子上的sp3杂化轨道形成σ键。
除了这两种基本的杂化方式外,还有一些其他的杂化方式,如sp、sp3d、sp3d2等。
这些杂化方式可以产生更多的化学键和分子结构。
总之,三聚氰胺中氮原子的杂化方式对其性质和用途有着重要的影响。
通过掌握这些知识,我们可以更好地理解和应用这种有机化合物。
叠氮酸根的三个n原子杂化类型

叠氮酸根的三个n原子杂化类型叠氮酸根的三个氮原子杂化类型,哎呀,听起来就有点复杂对吧?别担心,今天我们就来轻松聊聊这个话题。
叠氮酸根(N₃⁻)可真是个有意思的家伙,里面有三个氮原子,这三个家伙可各有各的性格,像极了我们生活中的朋友,咱们来一一揭开他们的面纱。
你知道吗?在叠氮酸根里,这三个氮原子的杂化类型其实是不同的。
第一个氮原子,咱们叫它N1,个性非常鲜明,它采用的是sp杂化。
这家伙可真是聪明,和两个其他的氮原子紧密地联系在一起。
像个领头羊,把大家的力量都整合起来,形成一个稳固的“家族”。
这样的杂化方式让N1可以很有效地分享电子,增强了整个叠氮酸根的稳定性。
这就像一个团队合作,每个人都有自己的分工,最后达成共识,目标明确。
接着咱们说说N2,这个小家伙有点不同。
它采用的是sp²杂化,性格也稍微活泼一些,跟周围的环境互动得更频繁。
就像个社交达人,N2能够和周围的分子打交道,形成一些很有趣的反应。
这个氮原子身上的电子云呈现出一个平面状的分布,仿佛在跟其他分子跳舞,时不时还会抛出几个电子,交个朋友。
这种杂化类型让N2在叠氮酸根中起到了一个调节者的作用,既能保持稳定,又能让整个分子活跃起来。
然后再说说最后一个氮原子,N3。
这个家伙最独特了,它采用的是sp³杂化。
嗯,听起来很高大上对吧?其实这位老兄有点懒散,更多是以一种四面八方的态度存在,像是在享受生活。
它的电子分布让它显得相对自由,能在更大的空间内移动。
N3就像是个享乐主义者,在整个叠氮酸根中营造出了一种灵活的氛围,给这个分子带来了更多的可能性。
想象一下,这个家伙可能在四处游荡,不时参与到分子的各种反应中,增添了不少乐趣。
叠氮酸根的结构就像是一场小型的聚会,三位氮原子各自展示自己的特长。
它们之间的关系就像是亲密的朋友,既有合作又有互动。
不同的杂化类型让它们形成了一个既稳固又活泼的分子。
简直就是一场化学的狂欢派对,每个氮原子都在尽情展现自己。
常见氮原子的杂化类型
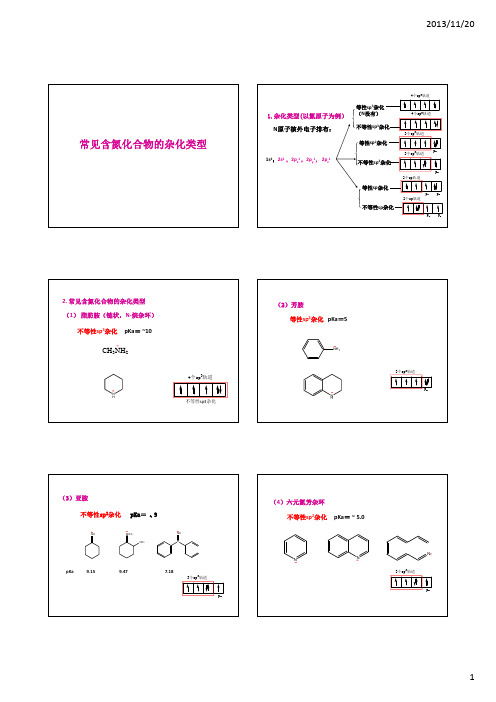
常见含氮化合物的杂化类型
1.杂化类型(以氮原子为例) N原子核外电子排布:
1s2;2s2 ,2px1 ,2py1, 2pz1
等性sp3杂化 (N没有) 不等性sp3杂化
等性sp2杂化
不等性sp2杂化
等性sp杂化
不等性sp杂化
4个sp3轨道 4个sp3轨道
3个sp2轨道
3个sp2轨道
2个sp轨道 py pz
2
pz
pz 2个sp轨道
py pz 2个sp轨道
py pz
2. 常见含氮化合物的杂化类型 (1) 脂肪胺(链状,N‐烷杂环)
不等性sp3杂化 pKa= ~10
CH3NH2
N H
4个sp3轨道 不等性sp3杂化
(2)芳胺 等性sp2杂化 pKa=5
NH2
N H
3个sp2轨道 pz
(3)亚胺 不等性Байду номын сангаасp2杂化 pKa= ~ 9
NH
NCH3
NH
CH3
C
pKa
9.15
9.47
7.18
3个sp2轨道
pz
(4)六元氮芳杂环 不等性sp2杂化 pKa= ~ 5.0
N
N
N
3个sp2轨道
pz
1
2013/11/20
(5)五元氮芳杂化 等性sp2杂化 , pKa往往为负值。
H N NH
3个sp2轨道 pz
(6)-CN类 CN
不等性sp杂化,碱性极弱
硝酸中氮原子的杂化方式

硝酸中氮原子的杂化方式【摘要】硝酸中氮原子的杂化方式是化学中一个重要的概念。
本文首先介绍了硝酸的结构和氮原子的杂化,然后详细讨论了sp杂化、sp2杂化和sp3杂化这三种杂化方式,以及它们在硝酸中的应用。
还探讨了杂化角度和影响杂化方式的因素。
通过对这些内容的分析,我们可以更好地理解硝酸中氮原子杂化的机制。
在文章总结了硝酸中氮原子的杂化方式,并展望了未来在这一领域的研究方向。
硝酸中氮原子的杂化方式对化学反应和物质性质有着重要的影响,深入研究这一领域有助于推动化学领域的发展。
【关键词】硝酸、氮原子、杂化、sp杂化、sp2杂化、sp3杂化、杂化角度、影响因素、总结、展望1. 引言1.1 硝酸的结构硝酸是一种包含有硝基(-NO3)的化合物,通常以化学式HNO3表示。
硝酸的分子结构是由一个氮原子、三个氧原子和一个负电荷所组成的。
氮原子在硝酸分子中呈现出sp杂化,这种杂化方式使得氮原子与氧原子的键形成了一个线性分子结构。
氮原子通过sp杂化形成的键角度约为180度,这种线性结构使得硝酸分子呈现出较高的极性。
硝酸的结构使其具有强氧化性和强酸性,常用于生产肥料、爆炸物和化学制品。
理解硝酸的结构对于进一步探讨氮原子杂化方式的影响具有重要意义。
硝酸分子中的氮原子杂化方式为我们提供了一个重要的范例,可以帮助我们深入理解杂化理论在分子结构中的应用和意义。
通过研究硝酸分子的结构,我们可以更好地理解杂化方式对分子性质和反应活性的影响,为未来的研究提供重要参考。
1.2 氮原子的杂化氮原子的杂化是一种化学概念,它在硝酸中起着至关重要的作用。
氮原子的杂化方式决定了硝酸分子的结构和性质。
在化学的世界里,氮原子通常会发生sp、sp2或sp3杂化,这取决于其周围的化学环境。
sp杂化是最简单的一种,其中氮原子的一个s轨道和一个p轨道混合形成两个sp杂化轨道。
这种杂化方式会使氮原子呈线性排列,如在亚硝酸根离子中常见。
杂化角度是决定杂化方式的重要因素之一,它直接影响了杂化轨道的方向和构型。
n2h4的中心原子杂化方式

N2H4,即肼,是一个由两个氮原子和四个氢原子组成的分子。
在这个分子中,每个氮原子都是中心原子。
在N2H4的稳定结构中,每个氮原子采用sp^3杂化。
具体来说,每个氮原子开始时有1个s轨道和3个p轨道。
通过sp^3杂化,氮原子形成了四个等价的sp^3杂化轨道,其中一个是s轨道的成分,其余三个是p轨道的成分。
这四个杂化轨道被用来形成四个N-H键,每个氮原子与两个氢原子形成σ键。
此外,两个氮原子之间还存在三个N-N σ键,其中一个是由两个氮原子的未杂化的p轨道重叠形成的,另外两个则是通过两个氮原子的杂化轨道形成的。
因此,N2H4分子中每个氮原子都达到了八个外层电子的稳定构型,符合八隅体规则。
氮原子的杂化与碱性的关系

氮原子的杂化与碱性的关系
氮原子是最重要的营养元素之一,它能够为植物、动物和微生物赋予复杂有机物质的形态。
氮原子是植物和微生物共同发展的基础,表现出独特的杂化性质。
有许多氮作为功能基团参与到复杂的生物学反应中。
氮原子通常与其他元素的化合物形成氨基单位,形成碳水化合物、蛋白质等复杂化合物,充分发挥作用。
氮原子通常与它们的原子对有强烈的
电性作用,大多数杂化的氮要就其他原子的电荷及强电荷敏感性有所调整,形成疏水性质或非疏水性质的化合物。
氮原子可以形成多种类型的杂化物,但它们最常见的杂化形式是碱性氮。
碱性氮具有碱性键,可以与其他原子或分子形成氢键,并能够将电荷及强电荷容易对对比,形成稳定的复杂的化合物。
碱性氮的最重要的特性在于它能把多个化合物的电性混合,从而使物质形成更加稳定的状态。
氮原子的碱性是很重要的,因此它们可以与其他原子或分子结合,形成混合及复合化合物,其中大部分表现出杂质性质,并可能有各种形态。
这种杂质性质使氮原子能够在其他原子或分子中进行效率高、稳定的反应。
因此,氮原子在生物化学中也发挥着重要作用,有助于复杂有机化合物的生成,并且能够促进许多其他反应的发生,使有机物质的结构及功能变得更稳定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2
pz
pz 2个sp轨道
py pz 2个sp轨道
py pz
2. 常见含氮化合物的杂化类型 (1) 脂肪胺(链状,N‐烷杂环)
不等性sp3杂化 pKa= ~10
CH3NH2
N H
4个sp3轨道 不等性sp3杂化
(2)芳胺 等性sp2杂化 pKa=5
NH2
N H
3个sp2轨道 pz
(3)亚胺 不等性sp2杂化 pKa= ~ 9
2013/11/20
常见含氮化合物的杂化类型
1.杂化类型(以氮原子为例) N原子核外电子排布:
1s2;2s2 ,2px1 ,2py1, 2pz1
等性sp3杂化 (N没有) 不等性sp3杂化
等性sp2杂化
不等性sp2杂化
等性sp杂化
不等性sp杂化
4个sp3轨道 4个sp3轨道
3个sp2轨道
3个sp2轨道
NH
NCH3
NH
CH3
C
ห้องสมุดไป่ตู้
pKa
9.15
9.47
7.18
3个sp2轨道
pz
(4)六元氮芳杂环 不等性sp2杂化 pKa= ~ 5.0
N
N
N
3个sp2轨道
pz
1
2013/11/20
(5)五元氮芳杂化 等性sp2杂化 , pKa往往为负值。
H N NH
3个sp2轨道 pz
(6)-CN类 CN
不等性sp杂化,碱性极弱
