医疗器械生产工艺流程图
医疗器械新产品开发设计流程图全图

采购与供方评估管 2016.09
理制度
生产岗位标准操作 2016.10~
定型阶段
注册资料 准备阶段
.
设计验证:型式检验 Y
更改、完善 N
设计确认:临床试验 N
总结评审
Y 技术文件定稿
会签批准
确定临床医院 入组病人选择 实验过程跟踪 结果统计
批生产记录 批检验记录
验证记录、报告
自测报告
留样记录 包装运输测试报告 样品送型式检验 型式检验报告 评审记录、报告 确认记录、报告 评审记录、报告 临床试验方案 临床试验合同 临床试验报告 产品技术报告 风险分析报告 产品说明书 临床试验报告
医疗器械产品的设计与开发 医疗器械产品的设计与开发 医疗器械产品的设计与开发 医疗器械产品的设计与开发 医疗器械产品的设计与开发
阶段划分 策划阶段
市场调研及项目论证
流程图 项目建议书
.
N 审批
Y
精品文档
相关流程记录
市场调研报告
同类产品对比情况表
项目可行性研究报告 立项报告
作业文件
时间表
记录操作规程
2015.03
建立产品设计历史 文件(获得项目编 号)
2015.04
2015.05
2015.06
输入阶段
产品性能指标 采用的标准 类似产品的设计 安全性分析
输出阶段
N
.
设计输入 设计开发任务书 设计开发计划书
会签/输入评审 Y
具体实施阶段和步骤 可行性研究 N
设计方案 方案/输出评审
产品质量标准 说明书 产品图纸 原材料清单 设备仪器清单 工艺流程图
2018.03
风险分析报告更新
产品注册 备注: 评审报总经理批准,评审小组成员:总经理、技术、质量、生产、采购、销售
医疗器械项目开发设计流程图详图

灭菌记录 性能测试报告 评审记录、报告 设计更改申请表
工艺流程 产品质量标准 使用说明书
安全防护规定 实验室管理制度 实验室生物安全规章制度 实验室样品管理制度 配液等实验标准操作规程
页脚内容
新法规下的医疗器械研发流程/管理体系
中试阶段
软件:试产方案 岗位操作规程 包装、灭菌工艺 硬件:人员 原辅料 生产、检验设备
市场调研报告
记录操作规程
同类产品对比情况表
项目可行性研究报告
立项报告
设计开发输入清单 设计开发任务书 设计开发计划书 评审记录、报告 初始过程流程图 项目进度跟踪表
新法规下的医疗器械研发流程/管理体系
输出阶段 N
小试阶段 加速老化测试 包装运输测试 内毒素测定 重要性能测试
设计方案 方案/输出评审 Y
Y 技术文件定稿
会签批准 产品注册
临床试验合同 临床试验报告 产品技术报告 风险分析报告 产品说明书 临床试验报告
备注: 评审报总经理批准,评审小组成员:总经理、研发、销售
页脚内容
新法规下的医疗器械研发流程/管理体系
医疗器械项目开发设计流程图
阶段划分 策划阶段
市场调研及项目论证
流程图 项目建议书
输入阶段
产品性能指标 采用的标准 类似产品的设计 安全性分析
设计输入 设计开发任务书
设计开发计划书 会签/输入评审
Y
N 审批
Y
具体实施阶段和步骤 可行性研究 N
页脚内容
相关质量记录
作业文件
小试评审 N
Y
小试验证:试生产
更改、完善 设计验证:型式检验
N Y
定型阶段
设计确认:临床试验 N
确定临床医院 入组病人选择 实验过程跟踪 结果统计
医疗器械设计和开发流程图

50.设计和开发更改 通知单 51.设计和开发评审 记录
52.设计验证报告
设计和开发更改
填写《设计更改通 知单》
审批
结束
根据清单采 购,保存采 购记录
11.原材料采购记 录,出入库记录 出入库 12.根据《设计和开 发计划》提供各阶 段的评审、验证和 确认记录 13.设计和开发更改 通知单 14.性能自测报告 15.设备使用记录 16.设计和开发输出 清单 17.产品技术要求 18.使用说明书 19.原材料清单 20.设计图纸:电气 图纸、机械图纸、 组件图纸、包装箱 图纸、标签图纸、 工艺流程图、合格 证图纸、注册检验 图纸 21.软件程序 22.生产操作规程
46.注册检报告 47.临床报告 48.医疗器械注册证 49.生产许可证
新产品注册
质量管理 体系现场 核查 监管部门 审批 申请生产 许可
新产品投产
销售预估
物料准备
包材修订
正式 生产
对以下情况提出修 改意见 研发阶段重大更改 情况 注册检、临床评价 或确认不符合要求 情况 投产后,对设计和 工艺文件提出更改 建议的情况
设计和开发转换
否
根据试生产任务 单制定原材料采 购计划
设计和开发流程图
市场部/ 销售部 项目组 项目负责人 质量部 采购管 理部
按采购计 划采购
计划物 料部
初检、 请检
生产 部
设备事业 法规注 部经理 册部
输出文档
33.原材料采购计划 34.请检单 35.原材料检验记录
原材料检验
设计和开发转换
合格
办理入库 手续
出库
36.入库单 37.出库单
半成品、 成品检验
组织生产 38.批记录 39.半成品、成品检 验记录 40.设备使用记录
医疗器械项目开发设计流程图详图

流程图 N 项目建议书 审批 Y
相关质量记录
市场调研报告 同类产品对比情况表 项目可行性研究报告 立项报告 设计开发输入清单 设计开发任务书 设计开发计划书
作业文件
记录操作规程
输入阶段
产品性能指标 采用的标准 类似产品的设计 安全性分析
设计输入
设计开发任务书 具体实施阶段和步骤 可行性研究 N 会签/输入评审 Y
评审记录、报告 初始过程流程图 项目进度跟踪表
设计开发计划书
输出阶段
设计方案 产品质量标准 说明书 产品图纸 原材料清单 设备仪器清单 工艺流程图 初始包装方案 灭菌方案 采购要求 合格证、 装箱单
设计开发输出清单 输出评审报告 工艺流程图 产品质量标准 产品使用说明书 产品设计图 初始包装方案 设备、仪器清单 原材料清单
定型阶段
设计确认: 临床试验 N 总结评审
确定临床医院 入组病人选择 实验过程跟踪 结果统计
确认记录、报告 评审记录、报告 临床试验方案 临床试验合同 临床试验报告
注册资料 准备阶段
Y 技术文件定稿
产品技术报告 风险分析报告 产品说明书 临床试验报告
会签批准
产品注册
备注: 评审报总经理批准,评审小组成员:总经理、研发、销售
工艺流程 产品质量标准 使用说明书
N
ቤተ መጻሕፍቲ ባይዱ
方案/输出评审 Y
小试阶段
实验原始记录 灭菌记录
安全防护规定 实验室管理制度
小样研制 加速老化测试 包装运输测试 内毒素测定 重要性能测试
原辅料准备 工艺优化 包装确定 更改、 完善
性能测试报告 评审记录、报告 设计更改申请表 采购合同 供应商评估
医疗器械项目开发设计流程图详图
确认记录、报告 评审记录、报告 临床试验方案
wjkz
注册资料 准备阶段
总结评审 Y
技术文件定稿
会签批准 产品注册
备注: 评审报总经理批准,评审小组成员:总经理、研发、销售
临床试验合同 临床试验报告 产品技术报告 风险分析报告 产品说明书 临床试验报告
页脚内容3
小试验证:试生产
设计验证:型式检验 Y
更改、完善 N
设计确认:临床试验
确定临床医院 入组病人选择 实验过程跟踪 页结脚内果容统2 计
原材料清单
实验原始记录 灭菌记录 性能测试报告 评审记录、报告 设计更改申请表 采购合同 供应商评估
安全防护规定 实验室管理制度 实验室生物安全规章制度 实验室样品管理制度 液等实验标准操作规程 不合格品管理规程 不合格品销毁管理规定
设备、仪器清单
工艺流程 产品质量标准 使用说明书
页脚内容1
wjkz
小试阶段
加速老化测试 包装运输测试 内毒素测定 重要性能测试
中试阶段
软件:试产方案 岗位操作规程 包装、灭菌工艺 硬件:人员 原辅料 生产、检验设备
定型阶段 N
小样研制 性能检测
更改、完善
原辅料准备 工艺优化 包装确定
小试评审 N
Y
立项报告
设计开发输入清单 设计开发任务书 设计开发计划书 评审记录、报告 初始过程流程图 项目进度跟踪表
作业文件
记录操作规程
产品质量标准 说明书 产品图纸 原材料清单 设备仪器清单 工艺流程图
初始包装方案 灭菌方案 采购要求 合格证、 装箱单
设计开发输出清单 输出评审报告 工艺流程图 产品质量标准 产品使用说明书 产品设计图 初始包装方案
医疗器械项目开发设计流程图详图
设计开发输出清单 输出评审报告 工艺流程图 产品质量标准 产品使用说明书 产品设计图 初始包装方案 设备、仪器清单 原材料清单 实验原始记录 灭菌记录 性能测试报告
工艺流程 产品质量标准 使用说明书
安全防护规定 实验室管理制度 实验室生物安全规章制度
N Y
中试阶段
软件:试产方案 岗位操作规程 包装、灭菌工艺 硬件:人员 原辅料 生产、检验设备
阶段划分 策划阶段
市场调研及项目论证
流程图 项目建议书
输入阶段
产品性能指标 采用的标准 类似产品的设计 安全性分析
设计输入 设计开发任务书
设计开发计划书
会签/输入评审 Y
N 审批
Y
具体实施阶段和步骤 可行性研究 N
相关质量记录
市场调研报告 同类产品对比情况表 项目可行性研究报告 立项报告 设计开发输入清单 设计开发任务书 设计开发计划书 评审记录、报告 初始过程流程图 项目进度跟踪表
作业文件
记录操作规程
输出阶段 N
小试阶段
加速老化测试 包装运输测试 内毒素测定 重要性能测试
设计方案 方案/输出评审 Y
小样研制 性能检测 小试评审
产品质量标准 说明书 产品图纸 原材料清单 设备仪器清单 工艺流程图
初始包装方案 灭菌方案 采购要求 合格证、 装箱单
更改、完善
原辅料准备 工艺优化 包装确定
确认记录、报告 评审记录、报告 临床试验方案 临床试验合同 临床试验报告
产品技术报告
风险分析报告
产品说明书
临床试验报告
备注: 评审报总经理批准,评审小组成员:总经理、研发、销售
试产方案、报告 自测报告 型式检验报告 验证记录、报告 批生产记录 批检验记录 留样记录 进货验证记录、报告
鼻氧管作业流程图
产品名称:鼻氧管 仓库
仓库发料
产品工艺流程图 文件编号: 生产部 品质部
使用表单
注塑生产 鼻插 调节器 5.0接头 三叉接头 自检
领料单 生产指令单 CAR品质异常单 BOM材料表 作业指导书
注
重新调整
NG
首件检验
QC报表 塑
注塑批量生产
OK
入库单
作
半成品
业
流 NG
不良品区 制程检验
程 返工
继续生产
图
OK NG
半成品
NG
不良品区
入库检验
返工 OK
入库
编制:
审核:
批准:
日期:
宁波蓝柏医疗器械有限公司
产品名称:鼻氧管 仓库仓库发料产品工源自流程图 文件编号: 生产部 品质部
使用表单
拉管生产
5.0mm软管
自检
领料单 生产指令单 CAR品质异常单 BOM材料表 作业指导书
拉 重新调整 管 OK
拉管批量生产
NG
首件检验
QC报表 入库单
作
业
半成品
流 NG 不良品区 程 OK 图 继续生产 制程检验
半成品
不良品区
NG
入库检验
返工挑选 OK 产品入库
编制:
审核:
批准:
日期:
医疗器械项目开发设计流程图详图
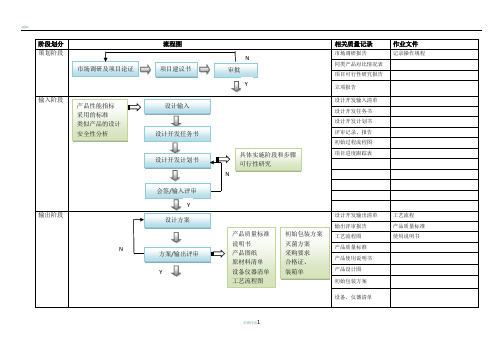
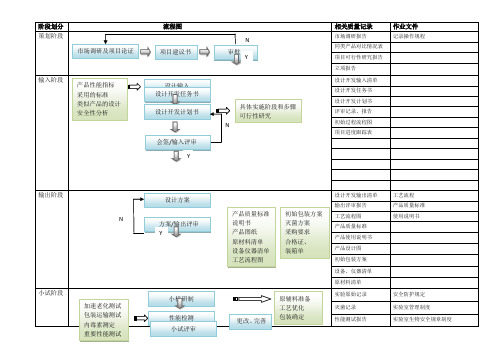
医疗器械项目开发设计流程图详图阶段划分:策划阶段:在这个阶段,我们需要进行市场调研和项目论证,确定产品性能指标和采用的标准,并进行类似产品的设计和安全性分析。
同时,我们需要绘制流程图,并进行项目建议书审批。
输入阶段:在这个阶段,我们需要制定设计开发任务书和计划书,列出设计开发输入清单,并记录操作规程、工艺流程、产品质量标准和使用说明书等相关质量记录。
输出阶段:在这个阶段,我们需要进行方案和输出评审,完成设计方案、产品质量标准、说明书、产品图纸、原材料清单、设备仪器清单、工艺流程图、初始包装方案、灭菌方案、采购要求、合格证、装箱单等输出。
小试阶段:在这个阶段,我们需要进行小样研制、加速老化测试、包装运输测试、性能检测、内毒素测定和重要性能测试,并进行小试评审。
中试阶段:在这个阶段,我们需要制定试产方案和操作规程,确定包装、灭菌工艺,选择生产、检验设备,并制定实验室管理制度、配液等实验标准操作规程、不合格品管理规程、采购与供方评估管理制度等相关规章制度。
同时,我们需要进行工艺优化、包装确定和更改完善,并撰写性能测试报告和评审记录、报告。
设计验证阶段:在这个阶段,我们需要进行试生产和型式检验,并进行自测报告、型式检验报告、验证记录、报告、批生产记录、批检验记录、留样记录、进货验证记录、报告、车间温、湿度监测记录和生产人员、产品清洁度的管理办法等相关工作。
定型阶段:在这个阶段,我们需要进行设计确认和临床试验,确定临床医院和入组病人选择,并进行实验过程跟踪和结果统计。
同时,我们需要完成注册资料和临床试验方案、合同和报告等相关工作。
准备阶段:在这个阶段,我们需要撰写产品技术报告。
医疗器械产品开发流程图(参考)
标题:医疗器械产品开发流程图(参考)一、引言医疗器械产品开发是一个复杂而严谨的过程,涉及到市场调研、设计开发、临床试验、注册审批等多个环节。
为了更好地指导医疗器械企业进行产品开发,本文将详细介绍医疗器械产品开发流程,以供参考。
二、市场调研1.1 市场需求分析在医疗器械产品开发初期,企业应对市场需求进行充分调研,了解目标市场的规模、竞争格局、用户需求等信息。
通过市场需求分析,企业可以确定产品开发的定位、功能和性能指标。
1.2 技术可行性分析在市场需求分析的基础上,企业还需对产品所需技术进行可行性分析,评估现有技术是否能满足产品开发的需求。
若现有技术无法满足需求,企业需进行技术研发或寻求外部技术支持。
三、设计开发2.1 概念设计根据市场需求和技术可行性分析,企业可进行产品概念设计,明确产品的基本功能、性能指标、外观设计等。
概念设计阶段需充分考虑用户体验,确保产品设计的合理性。
2.2 详细设计在概念设计的基础上,企业需进行详细设计,包括结构设计、电路设计、软件设计等。
详细设计阶段应注重产品的可制造性、可维护性和安全性。
2.3 原型制作与测试完成详细设计后,企业应制作产品原型,并进行功能测试、性能测试、可靠性测试等。
通过测试验证,确保产品设计满足预定要求。
四、临床试验3.1 试验方案设计根据产品特点,企业需制定临床试验方案,明确试验目的、试验方法、评价指标等。
试验方案应具有科学性、合理性和可操作性。
3.2 试验实施在临床试验方案获批后,企业应按照方案开展临床试验。
试验过程中,企业需密切关注试验进度,确保试验数据的真实性、准确性和完整性。
3.3 数据分析临床试验结束后,企业应对试验数据进行统计分析,评估产品安全性和有效性。
若试验结果符合预期,企业可进行产品注册申请。
五、注册审批4.1 准备注册资料企业需根据国家相关规定,准备产品注册申请所需资料,包括产品技术要求、临床试验报告、生产质量管理体系文件等。
4.2 提交注册申请企业向国家药品监督管理局提交产品注册申请,并按照要求缴纳注册费用。
医疗器械生产工艺中的工艺流程图绘制与规范
完善关键参数
在工艺流程图中标注关键工艺参数及其范围,为生产人员提供明确的操作指导。同时, 建立参数监控机制,确保生产过程中的参数控制符合要求。
预防措施和持续改进计划
第一季度
第二季度
第三季度
收集相关资料和数据
收集设备资料
收集生产线上各设备的操作手册、技术规格等资料。
收集生产数据
收集生产线上的生产数据,如产量、合格率、不良率 等。
了解生产流程
与生产人员沟通,了解实际生产流程中的各个环节和 操作。
选择合适绘图软件或工具
选择专业绘图软件
如AutoCAD、SolidWorks等,用于绘制复杂的工艺流程图。
随着人工智能和机器学习技 术的发展,未来医疗器械生 产工艺流程图绘制将更加智 能化,实现自动识别和绘制
工艺流程图。
个性化定制
根据不同医疗器械的特点和 生产需求,未来将实现工艺 流程图的个性化定制,提高
生产效率和产品质量。
跨领域融合
医疗器械生产工艺流程图绘 制将与先进制造技术、医疗 技术等领域进行跨领域融合 ,推动医疗器械产业的创新 发展。
选择通用办公软件
如Microsoft Office Visio、WPS Office等,用于绘制简单的工 艺流程图。
根据实际需求选择
根据工艺流程图的复杂程度和实际需求选择合适的绘图软件或工 具。
遵循一定逻辑进行绘制
流程顺序
按照生产流程的顺序进行绘制,确保流程图的 连贯性和逻辑性。
设备布局
根据实际生产线上的设备布局进行绘制,方便 理解和实际操作。
作用
