[理化生]乙炔炔烃
第57讲 乙炔 炔烃

②化学性质
2、强氧化剂氧化
【例1】关于炔烃的叙述中正确的是(D ) A.分子里含有碳碳叁键的烃叫炔烃 B.分子里所有碳原子都处在同一 条直线上
C.易发生加成反应,更易发生取 代反应
D.能使酸性KMnO4溶液或溴水褪色
【例2】某气态烃0.5mol能与1molHCl 完全加成,加成后产物分子上的氢原
(3)实验室能否用启 普发生器制乙炔.其 原因是_________。 (4)为了得到比较平稳 的乙炔气流,常可 用_用__饱__和__食__盐__水__代__替__水___ 代替水。
【例3】 某同学设计如图所示的实验装置来 粗略测定电石中碳化钙的质量分数。
(5)实验中测得排入量 筒中水的体积为vmL (1.01×105Pa,0℃), 电石质量为Wg。则电 石中碳化钙的质量分数 是___(_0_._2_8_V__/。W)% (不计算导管中残留的 水;气体__________________
反应生成的糊状物会堵塞发生器
③_________________________。
二、实验室制乙炔
2.制取乙炔时,为何在导气管口附近塞 入少量棉花?
防止反应生成的糊状物堵塞发生器
3.如何减小CaC2与水反应的速率?
用饱和食盐水代替水
为了_防__止__气_体__进__入__大__气___。 容器A中弯曲的玻璃管的 作用是_使__分__液_漏__斗__中__的_液__体. 能够顺利下滴
【例3】 某同学设计如图所示的实验装置来 粗略测定电石中碳化钙的质量分数。
(2)所用的电石质量不能太大,否则 _排__出__的__水_会__超__出__C_量__程__,_无__法_;测定C2H2的体积 也不能太小,否则
二、实验室制乙炔 4.工业上制备电石的反应为
高二化学乙炔炔烃知识点

高二化学乙炔炔烃知识点炔烃是烃类化合物中的一类,具有双键或三键的碳链结构。
在炔烃中,我们重点学习的是乙炔。
乙炔(C2H2)是一种有机化合物,也被称为乙炔气。
乙炔是无色、有刺激气味的气体,具有高燃烧性和不稳定性。
在化学中,乙炔是非常重要的一种物质,具有广泛的应用。
本文将介绍乙炔炔烃的相关知识点。
一、乙炔的物理性质乙炔是无色气体,具有特殊的气味。
它的密度比空气小,能够溶于乙炔解气器中的有机溶剂。
乙炔的熔点为-80.8℃,沸点为-84℃。
乙炔可以被液化,并且在常温下可以被压缩。
由于乙炔是不稳定的,容易聚集形成爆炸性的混合物,因此在储存和使用乙炔时需要特别谨慎。
二、乙炔的制取方法乙炔的制取方法主要有两种:一种是通过煤炭焦化产生的煤气制取乙炔,另一种是通过石油cracking过程中的副产物制取乙炔。
其中较为常用的是通过煤炭焦化产生的煤气制取乙炔的方法。
该方法是将煤气经过净化处理后,再通过加热去饱和来制取乙炔。
三、乙炔的化学性质1. 燃烧性:乙炔具有高燃烧性,能与空气中的氧气发生剧烈反应,产生大量的热和光。
乙炔的燃烧反应是一个放热反应,释放出的热量可以使石棉变红并熔化。
乙炔燃烧生成的产物有水和二氧化碳。
2. 加氢反应:乙炔可以与氢气发生加氢反应,生成乙烯,并放出大量的热量。
这个反应是一个吸热反应,需要在催化剂的存在下进行。
3. 反应性:由于乙炔中碳原子上的双键非常活泼,因此乙炔具有较高的反应活性。
它可以与卤素直接反应,生成相应的卤代烃。
乙炔还可以通过加成反应生成醇、醛、酮等化合物。
四、乙炔的应用领域1. 焊接和切割:乙炔可以与氧气在高温条件下进行燃烧,产生高温火焰,因此被广泛应用于金属焊接和切割的行业。
乙炔的高温火焰可以熔化金属,并将其焊接在一起,同时也可以切割金属。
2. 化学合成:乙炔是有机化学合成中的重要原料。
它可以通过加成反应合成醇、醛、酮等化合物,也可以通过聚合反应生成聚乙炔等高分子化合物。
3. 实验室研究:由于乙炔的独特性质,它在实验室中被广泛用于研究和分析。
必修乙炔炔烃

3)可用简易装置代替,但在导管口应放一团棉 花,避免泡沫从导管中喷出。
Ca2+
C C
2
5、除杂 电石中含有少量硫化钙、砷化钙、磷化钙等杂 质,与水作用时生成H2S、PH3、AsH3等气体 使乙炔有恶臭味。 方法:通常将气体通过CuSO4溶液除去H2S和 PH3,再通过碱石灰除去水蒸气。 了解:电石工业制法-生石灰和焦炭在电炉中高 温反应 高温 CaCO3 CaO + CO2
CaO + 3C
电炉
CaC2 + CO
反应原理: CaC2+2H—OH C2H2↑+Ca(OH)2 +127KJ
练:CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都 同属离子型碳化物,请通过对CaC2制C2H2的 反应进行思考,从中得到必要的启示,写出下 列反应的产物:
A.ZnC2水解生成: C2H2
△
(低聚)
烃 烷 烃
结构特点
通
式
不饱和度
仅含“C—C” 链状
CnH2n+2 (n≥1) CnH2n (n≥2) 1
烯 烃
含一个“C= C” 单烯烃 链状 二烯烃 环烷烃 炔 烃 含二个“C= C” 链状 仅含“C—C” 环状 含“C≡ C” 链状
CnH2n -2 (n≥3) CnH2n (n≥3)
(3)一定条件下与HX加成
催化剂 CH CH HCl CH 2 CHCl
nCH 2 CHCl — CH 2 — CH — n 聚氯乙烯 加压 | Cl (4)与HCN加成生成丙烯腈
催化剂
催化剂 CH CH HCN CH 2 CH — CN (丙烯腈)
高二化学乙炔炔烃1
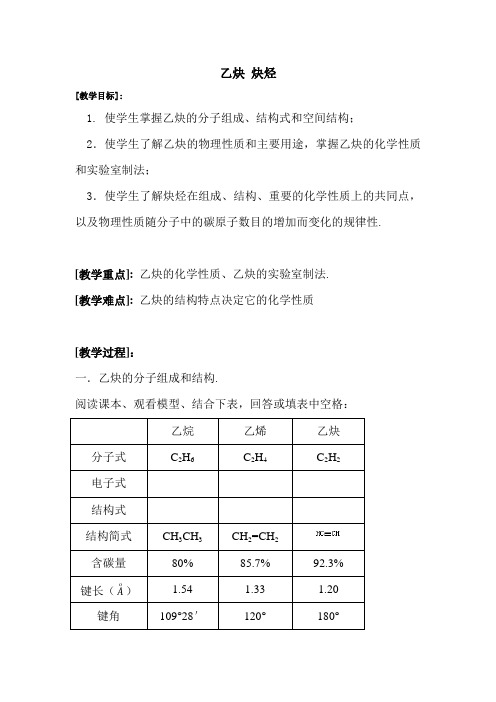
乙炔炔烃[教学目标]:1. 使学生掌握乙炔的分子组成、结构式和空间结构;2.使学生了解乙炔的物理性质和主要用途,掌握乙炔的化学性质和实验室制法;3.使学生了解炔烃在组成、结构、重要的化学性质上的共同点,以及物理性质随分子中的碳原子数目的增加而变化的规律性.[教学重点]:乙炔的化学性质、乙炔的实验室制法.[教学难点]:乙炔的结构特点决定它的化学性质[教学过程]:一.乙炔的分子组成和结构.阅读课本、观看模型、结合下表,回答或填表中空格:[讨论]:1.乙炔分子中碳原子的四个价键是怎样得到满足的?2.从叁键的键能、键长与双键及单键的比较,说明叁键中叁个楗的键能是否一样?由此请推测乙炔的化学性质和乙烯、乙烷比如何?[推测]:乙炔中有两个键较易断裂,因此它的化学性质比较活泼.二.乙炔的实验室制法.1. 原理:CaC2 + 2H2O → C2H2↑ + Ca(OH)23C + CaO −−高温 CaC2 + CO↑−→2.装置:固+液→气(类似于制H2、CO2,但不能用启普发生器.)3.除杂:常用碱液洗气,以除去 PH3、H2S等.(思考:可否用强氧化剂洗气?)控速:常用浓食盐水代替水,以降低反应速率.三.乙炔的性质.1.物理性质:无色、无味的气体;密度为d标=1.16g/L;微溶于水,易溶于某些有机溶剂(如丙酮).2.化学性质:[推测]:乙炔分子里的三个碳碳键的键能是不一样的,其中有两个键较易断裂,因而其化学性质类似于乙烯.即可被强氧化剂氧化,易发生加成反应.[演示实验5-7,5-8,5-9]模仿乙烯的化学性质,自我立出乙炔化学性质的提纲.(1).氧化反应.①.燃烧:2C2H2+5O2−−点燃4CO2+2H2O−→现象:明亮程度乙炔>乙烯>甲烷;烟的多少: 乙炔>乙烯>甲烷.②.被强氧化剂氧化:可使酸性高锰酸钾溶液褪色.(2).加成反应.①.跟卤素的加成:+Br 2→CHBr=CHBr (1,2-二溴乙烯)CHBr=CHBr+Br→CHBr2CHBr2 (1,1,2,2-四溴乙烷)②.跟氢气的加成:+H2−−催化剂 CH2=CH2−→CH2=CH2+H2−−催化剂CH3CH3−→③.跟卤化氯的加成:+HCl−−催化剂CH2=CHCl (氯乙烯)−→氯乙烯的加聚n CH2=CHCl−−催化剂[-CH2-CHCl-]n (聚氯乙烯)−→[讨论]:试列表对比乙烷、乙烯、乙炔的有关化学性质及反应现象.四.乙炔的用途:工业上用氧炔焰来焊接或切割金属.五.炔烃.1.结构特点和通式:链烃分子里含有碳碳三键的不饱和烃,叫炔烃.组成结构:均含有三键、组成上相差一个CH2原子团.炔烃的通式:C n H2n-2(n≥2)2.物理性质:碳原子数小于或等于4的烯烃在常温下是气态,熔沸点随碳原子数目的增加而增大.3.化学性质:跟乙炔相类似.(1).燃烧时火焰较烯烃明亮(含碳量高).(2).分子里含有不饱和的三键,容易发生氧化、加成和聚合反应.4.炔烃的命名:类似于烯烃.[课堂练习]:1.写出C5H8的链烃的同分异构体的结构简式并命名.解析:1-戊炔;2-戊炔;3-甲基-1-丁炔;1,3-戊二烯;1,4-戊二烯;2-甲基-1,3-丁二烯.2.分析分子中碳原子的空间相对位置.分析:6个碳原子有可能在同一平面上,但不在同一直线上.3.工业上电石(碳化钙)是由生石灰和焦炭在电炉中加高温而制得,同时有CO生成.试写出工业上用石灰石、焦炭、食盐(电解食盐水可生成NaOH、H2、Cl2)、水等为原料制取聚氯乙烯的有关反应的化学方程式.分析:制备物质的过程(路线)一般按“逆向思维,顺向作答”来思考解答.。
乙炔炔烃PPT课件2 人教版

3、制取:
收集一集气瓶乙炔气体,观察其物理性质 4、演示实验 ①将乙炔气体点燃,观察火焰颜色及燃烧情况 ②将乙炔气体通入溴水中 ③将乙炔气体通入酸性高锰酸钾中
二、乙炔的分子结构: 分子式:
C2H2 电子式: H C C H 结构式: H C C HC CH 结构简式:
结构特点:
H
分子里有碳-碳叁键(其中含两个不 牢固的共价键),键与键之间的夹角 是180°,是直线型分子。
生活就像海洋,只有意志坚强的人,才能到达彼岸。
读一切好的书,就是和许多高尚的人说话。 最聪明的人是最不愿浪费时间的人。
C
]
C.乙炔
2.请选择图中的仪器装配成一套制备乙炔的装置 [B、C ]
3.用电石、水、氯化氢为原料,制备聚氯乙烯,写 出反应的化学方程式。
CaC2 2H2O HC CH Ca(OH)2
nCH=CHCl
催化剂
[CH2—CH]n
Cl
五、炔烃
1、概念:链烃分子里含有碳碳叁键的不饱烃叫做炔烃。
第四节 乙炔 炔烃
一、乙炔的实验室制法:
1、反应原理:
CaC2+2H—OH
C2H2↑+Ca(OH)2
2、装置: 固液发生装置
(1)反应装置不能用启普发生器
因为:a 碳化钙与水反应较剧烈,难以控反制应速率; b 反应会放出大量热量,如操作不当,会使启 普发生器炸裂。
(2)实验中常用饱和食盐水代替水, 目的:降低水的含量,得到平稳的乙炔气流。 (3)制取时在导气管口附近塞入少量棉花 目的:为防止产生的泡沫涌入导管。 ( 4 )纯净的乙炔气体是无色无味的气体。用电石和 水反应制取的乙炔,常闻到有恶臭气味,是因为在电 石中含有少量硫化钙、砷化钙、磷化钙等杂质,跟水 作用时生成H2S、ASH3、PH3等气体有特殊的气味所 致。
高二化学课件《乙炔 炔烃》

Br2 Br Br
Br2
Hale Waihona Puke Br Br(Cl2) CH=CH (Cl2) Br CH CH Br
H2 催化剂
CH2=CH2
H2 催化剂
CH3-CH3
HCl(HBr)
催化剂, CH2=CHCl
二、炔烃
1、概念: 分子里含有碳碳三键的不饱和链烃叫炔烃。
2.炔烃的通式: CnH2n-2(n≥2)(与二烯烃相同) 但符合这个通式的却不一定是炔烃
②与酸性KMnO4溶液反应: 能使酸性 KMnO4溶液褪色。
(2)加成反应
使溴的四氯化碳溶液(或溴水)褪色
R-C CH + Br2 R-C CH + 2Br2
R-C CH
Br Br Br Br
R-C CH
Br Br
Ni
R-C C-R’ + 2H2 △ R-CH2-CH2-R’
(3)加聚反应
写出丙炔发生加聚反应的方程式
H2+Cl2 点燃 2HCl
CH≡CH+HCl
催化剂 △
CH2=CHCl(氯乙烯)
小 聚氯乙烯在使用的过程中,易发生老化,会变硬、发脆、
知 识
开裂等,并释放出对人体有害的氯化氢,故不宜使用聚氯
乙烯制品直接盛装食物。
③与HCl加成
CH CH + HCl催化剂 CH2= CHCl
n CH2=CH 催化剂 -CH2-CH-n
Cl
Cl
【实践探究】某气态烃0.5mol能与
1mol HCl 完全加成,加成后产物分子 上的氢原子又可被3molCl2取代,则此气
态烃可能是( C )
A、CHCH
B、CH2=CH2 C、 CHCCH3
高考化学58个考点精讲考点43乙炔炔烃

“饱和”
化学 活 动性
取代反应
化
燃烧
学
氧化反应
性
加成反应
质
聚合反应
鉴
别
稳定 卤代 火焰不明亮 KMnO4 溶液不褪色 —— —— KMnO4 溶液不褪色或 溴水不褪色
C = C (双键), 碳原子的化合价未
达“饱和”
活泼 —— 火焰明亮,带黑烟 KMnO4 溶液褪色 溴水褪色 能聚合 KMnO4 溶液褪色或溴 水褪色
由于炔烃中都含有相同的碳碳叁键,炔烃的化学性质就应与乙炔相似,如容易发生
加成反应、 氧化反应等, 可使溴的四氯化碳溶液、 溴的水溶液及酸性 KMnO4 溶液褪色等。
也可以利用其能使上述几种有色溶液褪色来鉴别炔烃和烷烃,另外在足够的条件下,
炔烃也能发生加聚反应生成高分子化合物,如有一种导电塑料就是将聚乙炔加工而成
四氯化碳溶液中,观察现象:溴的四氯化碳中溴的颜色逐渐褪去。
溴的四氯化碳溶液褪色, 说明二者可以反应且生成无色物质, 那么它们之间的反应属于
【高中化学】乙炔炔烃PPT课件2

(1)可燃性:
2C2H2+5O2 点燃 4CO2+2H2O(液)+2600KJ
火焰明亮,并伴有浓黑烟。
(2)乙炔能使酸性 KMnO4溶液褪色。
2.加成反应
A.使溴水褪色
B.催化加氢
C.制氯乙烯、聚氯乙稀
nCH=CHCl
催化剂
[CH2—CH]n Cl
3.加聚反应
小结
1.结构
决定 反映
乙炔、乙烷、乙烯分子结构的比较:
乙炔结构小结
1、 的键能和键长并不是C-C的三倍,也 不是C=C和C—C之和。说明叁键中有二个键不稳 定,容易断裂,有一个键较稳定。
2、含有叁键结构的相邻四原子在同一直线上。
3、链烃分子里含有碳碳叁键的不饱和烃称为炔烃。 4、乙炔是最简单的炔烃。
三、乙炔的化学性质:
H H : H: C: C: H : :
120° 活泼 ----使溴水褪色等
乙烷
氧化反应 燃烧 鉴别
KMnO4不褪色 火焰不明亮 溴水不褪色
乙烯
KMnO4褪色 火焰明亮、带浓烟 溴水褪色
乙炔
KMnO4褪色 火焰明亮、带浓烟 溴水褪色
练习
1.下列物质中,碳元素的质量分数最大的是[ A.乙烷 B.乙烯
3、制取:
收集一集气瓶乙炔气体,观察其物理性质 4、演示实验 ①将乙炔气体点燃,观察火焰颜色及燃烧情况 ②将乙炔气体通入溴水中 ③将乙炔气体通入酸性高锰酸钾中
二、乙炔的分子结构: 分子式:
C2H2 电子式: H C C H 结构式: H C C HC CH 结构简式:
结构特点:
H
分子里有碳-碳叁键(其中含两个不 牢固的共价键),键与键之间的夹角 是180°,是直线型分子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C.加聚反应 制氯乙烯、聚氯乙稀
聚氯乙烯薄膜
催化剂
nCH=CHCl
[CH2—CH]n Cl
小结
本节学习乙炔的结构、制法、重要性 质和主要用途。
乙炔结构 是含有CC叁键的直线型分子
化学性质 很活泼,可以发生氧化、加成等反应
1.乙炔的化学性质
O2
氧化反应 点燃
CO2 + H2O
酸性
乙
KMnO4溶液
二、乙炔的制法
2. 实验室制法 试剂:
碳化钙(电石)
水(常用饱和食盐水代替。目的:降低水的含 量,得到平稳的乙炔气流) 原理:碳化钙+水 乙炔+氢氧化钙+热量
电石的主要成分是一种离子化合物CaC2
电子式为
结构式为
Ca2+ C C 2
与水反应方程式为:
C Ca
C
CaC2 + 2H2O C2H2↑+ Ca(OH)2
褪色
炔
(BCr2l2)CHBr=CHBr(BCrl22)CHBr2-CHBr2
加成反应
H2 催化剂,
CH2=CH2
H2 催化剂,
CH3-CH3
HCl(HBr)
催化剂, CH2=CHCl
2.乙烷、乙烯、乙炔性质的比较
乙烷
乙烯
分子式
C2H6
C2H4
含碳量
结构式
电子式
键角 化学活动
性 取代反应 加成反应
键长(10-10m)
1.54
1.33
1.20
键能(KJ/mol) 348
615
812
键角
109028’ 1200
1800
二、乙炔的制法
1. 乙炔的工业制法
过去工业上用电石生产乙炔
高温
CaCO3
CaO + CO2
电炉
CaO + 3C CaC2 + CO
由于碳化钙生产耗电太多,目前已 改用天然气和石油为原料生产乙炔。
实验室中使用分液漏斗而不使用长颈漏斗, 因为长颈漏斗不能控制水的用量。水加太多,反 应会太剧烈。
乙炔的实验室制法
制取:
收集一集气瓶乙炔气体,观察其物理性质
①将乙炔气体点燃,观察火焰颜色及燃烧情况 ②将乙炔气体通入酸性高锰酸钾溶液中 ③将乙炔气体通入溴水中
乙炔的性质实验
三、乙炔性质
俗 名:电石气
CHCH + HCl 催化剂 CH2=CHCl
催化剂
nCH2=CH 加温、加压 CH2CH n
Cl
Cl
(2)乙炔燃烧时产生的氧炔焰可用来切割或 焊接金属。
五、炔烃
1、概念:链烃分子里含有碳碳叁键的不饱和烃叫做炔烃
2、炔烃的通式: CnH2n-2 (n≥2)
3、炔烃同系物的结构特点 同:含 C C ,链状 不同:分子组成上相差一个或多个CH2
1.物理性质: 纯净的乙炔气体是无色无味的气体。用电石
和水反应制取的乙炔,常闻到有恶臭气味,是因 为在电石中含有少量硫化钙、砷化钙、磷化钙等 杂质,跟水作用时生成H2S、AsH3、PH3等气体有 特殊的气味所致。
比空气稍轻,且微溶于水, 易溶于有机溶剂。
2.化学性质 (1)氧化反应 ①使酸性高锰酸钾溶液褪色
4、炔烃的通性: (1)物理性质: 随着碳原子数的增多,沸点逐渐升高,液态时的密 度逐渐增加。 C小于等于4时为气态
(2)化学性质 (同 CH CH )
(1)氧化
可使KMnO4(H+)溶液褪色 可燃
CnH2n-2+3n2-1O2 点燃 nCO2+(n-1)H2O
收集: 排水法
思考1、为什么不用启普发生器制取乙炔?
因为碳化钙与水反应剧烈,启普发生 器不易控制反应;
反应放出的热量较多,容易使启普发 生器炸裂。
反应的产物中还有糊状的Ca(OH)2, 碳 化钙粉化,易进入发生器底部,或堵住球型 漏斗和底部容器间的空隙,使发生器失去作 用。
思考2、能不能用制取氢气时所采用的那种 简易装置?为什么?
为何乙炔火焰温度最高?
乙炔完全燃烧所需氧的物质的量最少,生成水的物质的量也最 少,因此燃烧时用以提高氧温度以及水气化所需的消耗的反应热 也最少,所以乙炔火焰温度最高。
(2)加成反应
A.使溴水褪色
1, 2—二溴乙烯 1, 1, 2, 2—四溴乙烷
2.加成反应
B.催化加氢
1mol碳碳叁键最多需要2mol加成试剂
HH H-C-C-H
HH HH H:C:C:H HH
109°28"
稳定
卤代 ---
: :
:: ::
H
H
C=C
H
H
HH H:C ::C:H
120° 活泼
-----
使溴水褪色等
乙炔
C2H2
H:C ::::C:H
180° 活泼
-----
使溴水褪色等
甲烷、乙烯、乙炔的燃烧
3.乙烷、乙烯、乙炔燃烧比较
氧化反应 燃烧 鉴别
A.ZnC2水解生成 ( C2H2 ) B.Al4C3水解生成 ( CH4 ) C.Mg2C3水解生成 ( C3H4 ) D.Li2C2水解生成 ( C2H2 )
请选择图中的仪器装配成一套制备乙炔 的装置[ B、C ]
仪器:
分液漏斗 广口瓶(或烧瓶) 带胶塞的导管
若用试管做反应容器:
在导管口放一团棉花防止堵塞
第四节 乙炔 炔烃
一、乙炔的分子结构
分子式: C2H2 电子式: H C C H 结构式: H C C H
结构特点:分子里有碳碳叁键(其中含两个不牢
固的共价键),键与键之间的夹角是 180°,是直线型分子。
乙炔、乙烷、乙烯分子结构的比较:
决定
结构
反映
性质
物质 乙 烷
乙烯
乙炔
键参数
C C(单键) C C(双键) C C(叁键)
反应过程分析:
C C
Ca
+
HOH HOH
C CaC2+2H—OH
C2H2↑+Ca(OH)2 +127KJ
练:CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属离子 型碳化物,请通过对CaC2制C2H2的反应进行思考,从 中得到必要的启示,写出下列反应的产物:
乙烷
KMnO4不褪色 火焰不明亮 溴水不褪色
乙烯
KMnO4褪色 火焰明亮、带浓烟
溴水褪色
乙炔
KMnO4褪色 火焰明亮、带浓烟
溴水褪色
练习:
1.下列物质中,碳元素的质量分数最大的是[ C ]
A.乙烷 B.乙烯 C.乙炔
四、乙炔的用途
(1)乙炔是一种重要的基本有机原料,可以 用来制备氯乙烯、聚氯乙烯和乙醛等。
KMnO4 + H2SO4+ C2H2→ MnSO4+ K2SO4 + CO2↑+ H2O
②可燃性:
现象:火焰明亮,带浓烟
点燃
氧炔焰
火焰温度达3000℃以上,可用于切割、焊 接金属 C2H6+ 7/2O2 点燃 2CO2+3H2O+1561KJ CH2=CH2+3O2 点燃 2CO2+2H2O+1411KJ C2H2+5/2O2 点燃 2CO2+H2O+1300KJ
