DGGE实验
变性梯度凝胶电泳(DGGE)实验

变性梯度凝胶电泳(DGGE)实验一.DGGE的实验原理变性梯度凝胶电泳(DGGE)是一种根据DNA片段的熔解性质而使之分离的凝胶系统。
DGGE(denaturing gradient gel electrophoresis)不是将分子量不同的DNA分开,而是通过聚丙烯酰胺凝胶中变性剂浓度梯度的不同,将序列不同的DNA分开。
该方法的原理是根据DNA 的解链特性,不同碱基组成的DNA双螺旋发生变性所要求的变性剂浓度不同,混合双链DNA在变性剂浓度呈线性梯度增加的聚丙烯酰胺凝胶电泳时,当泳动到与DNA变性所需变性剂浓度一致的凝胶位置时,相对应的DNA发生解链变性,导致电泳迁移速率降低。
由于泳动受阻DNA分子在凝胶中的停留位置不同,从而使不同DNA分子得以分离。
根据变性剂梯度方向的不同, DGGE可分为:垂直DGGE,即变性剂梯度与电场方向垂直,常用于试验决定分离型、野生型和变异型的最佳变性剂梯度范围;平行DGGE,其变性剂的梯度和电场方向平行,主要用于解链范围明确的DNA片段的检测。
DGGE已广泛用于分析自然环境中细菌、蓝细菌, 古菌、微型真核生物、真核生物和病毒群落的生物多样性。
这一技术能够提供群落中优势种类信息并同时分析多个样品,具有可重复和操作简单等特点, 适合于调查种群的时空变化, 并且可通过对条带的序列分析或与特异性探针杂交分析鉴定群落组成。
然而一旦变性剂浓度达到DNA片段最高解链区域浓度时,DNA片段会完全解链,成为单链DNA分子,此时他们又能在胶中继续迁移。
因此如果不同DNA 片段的序列差异发生在最高解链区域时,这些片段就不能被区分开来。
在DNA 片段的一端加入一段富含GC的DNA片段(GC夹子,一般30-50个碱基对)可以解决这个问题。
含有GC夹子的DNA片段最高的解链区域在GC夹子这一段序列,它的解链温度很高可以防止DNA片段在胶中完全解链。
当加了GC夹子后,DNA片段中的每个碱基处的序列差异都能被分开。
DGGE操作步骤

DGGE操作步骤DGGE(denaturing gradient gel electrophoresis)是一种常用的DNA分析技术,用于研究DNA序列的变异情况和分类等。
DGGE的操作步骤如下:1.准备样品2.PCR扩增将待测DNA进行PCR扩增,以增加DNA的数量。
需要用到一对引物,它们会扩增出感兴趣的DNA片段。
PCR反应体系中含有模板DNA、引物、dNTPs、DNA聚合酶和缓冲液。
引物的选择需要根据研究的目的确定。
3.准备DGGE凝胶将一定比例的聚丙烯酰胺和甲酰胺溶液以一定的比例混合,制备得到DGGE凝胶。
这个比例可以根据需要调整,以获得所需的DNA分离效果。
其中甲酰胺会使凝胶变性,使DNA分子在电泳中以变性形式进行分离。
4.准备DGGE系统将DGGE凝胶置于DGGE装置中。
根据实验需要,在凝胶两端插入电极,接通电源。
将凝胶槽填满电泳缓冲液,用于维持凝胶均匀膨胀,快速散发产热,以及降低电阻。
一般来说,TAE或TBE缓冲液可用于DGGE。
5.准备DNA样品将PCR扩增得到的DNA样品处理成等浓度。
可以用醋酸抽提、酚-氯仿法或商业DNA提取试剂盒等方法进行纯化。
6.电泳分离将等量的DNA样品加入到DGGE样品孔中。
将样品孔上方和下方的空孔填满DNA负载缓冲液,以避免样品在电泳过程中干涸。
开始电泳,一般电泳时间和电场强度要根据平台的规格表决定。
7.停止电泳和染色当DNA样品从顶端到底端通过凝胶后,在适当的时间内停止电泳。
将凝胶取出,根据需要进行染色。
GelRed或者SYBR Green等染料可以用于可视化DNA条带。
8.分析使用相应的软件如Quantity One或ImageJ等,对电泳结果进行分析。
将得到的DGGE电泳图像转化成数值形式,以研究样品中的DNA序列变异情况。
总结:DGGE是一种用于分析DNA序列变异的常用技术。
通过PCR扩增得到的DNA样品,经过一系列处理后,加入到DGGE凝胶中进行电泳分离。
PCR-DGGE实验

2 实验流程1.提取DNA并用琼脂糖凝结电泳检验2.用带GC发夹的引物进行PCR,并用琼脂糖凝结电泳检验3.DGGE将长度相同但序列不同的DNA片段分开,并切胶纯化4.用不带GC发夹的引物进行PCR5.连接转化,需要用到感受态细胞6.菌落PCR进行验证2.1 DNA提取用DNA提取试剂盒提取DNA,用1%的琼脂糖凝胶电泳检验。
2.2 琼脂糖凝胶电泳将0.3g琼脂糖溶解于30ml的1×TAE缓冲溶液中,加热溶解(微波炉加热或沸水浴加热,至琼脂糖溶解),稍微降温后加入3µL的核酸染料,混匀后倒入托盘中,插入梳子,约半小时后其冷却。
将凝胶放入电解槽中,加样(加有loading buffer的DNA样品),在5V/cm 电压下电泳30min。
在紫外光下观察电泳条带。
2.3 PCR反应及产物纯化采用25µL的反应体系:PCR反应体系成分终浓度引物GC Clamp-F 0.2 μM引物R 0.2 μMM g2+(M g Cl2) 0.5 mMBSA 0.2 mg/lTaq DNA Polymerase 1.25 U10×Taq Buffer 1×dNTP Mixture 0.2 mMDNA模板1~2μldH2O To 25 μl反应条件:94 ℃预变性4 min;94 ℃变性45秒,65 ℃复性45秒,72 ℃延伸45秒,共30个循环;72 ℃最终延伸5min。
将PCR产物全部进行1%琼脂糖凝胶电泳,在紫外光下用无菌刀割下含目的DNA片段的琼脂糖块,称重,放入1.5 ml的离心管中,用DNA纯化通用试剂盒纯化PCR产物。
并用紫外分光光度计测定DNA浓度。
2.4 DGGE2.4.1 药品配制:1)40%聚丙烯酰胺丙烯酰胺38.93g双丙烯酰胺 1.07g dH2O To 100ml 2)0%变性剂6%Gel 8%Gel 10%Gel 12%Gel 40%聚丙烯酰胺15ml 20ml 25ml 30ml50×TAE缓冲液2ml 2ml 2ml 2ml dH2O 83ml(to 100) 78ml 73ml 68ml脱气15min,用0.45µm的滤膜过滤。
DGGE操作步骤

变性梯度凝胶电泳(DGGE)的溶液配制、操作步骤及注意事项一、实验试剂及配置1、40%丙烯酰胺/双丙烯酰胺(37.5:1)试剂用量丙烯酰胺38.93g双丙烯酰胺 1.07gMilliQ 水加到100mL 溶液采用0.45µm滤膜过滤,储存在4℃2、0%的变性储存液凝胶梯度6%8%10%12%40%丙烯酰胺/双丙烯酰胺15mL 20mL 25mL 30mL 50×TAE缓冲液2mL 2mL 2mL 2mL MilliQ 水83mL 78mL 73mL 68mL总容积100mL 100mL 100mL 100mL3、100%的变性储存液凝胶梯度6%8%10%12%40%丙烯酰胺/双丙烯酰胺15mL 20mL 25mL 30mL 50×TAE缓冲液2mL 2mL 2mL 2mL去离子甲酰胺40mL 40mL 40mL 40mL 尿素42g 42g 42g 42g MilliQ 水加到100mL 加到100mL 加到100mL 加到100mL4、50×TAE缓冲液试剂用量终浓度Tris碱242.0g 2M冰乙酸57.1 1M 0.5M EDTA,pH8.0 100.0mL 50mM MilliQ 水加到1000.0mL将溶液混合溶解,121℃下蒸汽灭菌20-30min,储存在室温5、银染液的配制:原液:8×固定液(250 ml):乙醇200 ml冰乙酸10mlMilliQ 水40ml(A):1×固定液(400 ml):8×固定液50mlMilliQ 水350ml(B)银染溶液(400ml):AgNO3 0.8 g8×固定液50mlMilliQ 水350ml(C):显影剂(500ml):NaOH 7.5gMilliQ 水500 ml甲醛 1.5ml6、10%过硫酸铵(AP):过硫酸胺0.3g超纯水 3.0ml溶解后使用0.45µm微孔滤膜过滤,4℃保存,保存时间为1周。
PCR-DGGE技术

PCR-DGGE技术一、实验原理变性梯度凝胶电泳(denatured gradient gel electrophoresis,DGGE)最早是Lerman 等人于20 世纪80 年代初期发明的,起初主要用来检测DNA 片段中的点突变。
Muyzer 等人在1993 年首次将其应用于微生物群落结构研究。
后来又发展出其衍生技术,温度梯度凝胶电泳(TGGE)。
该技术被广泛用于微生物分子生态学研究的各个领域,目前已经发展成为研究微生物群落结构的主要分子生物学方法之一。
双链DNA分子在一般的聚丙烯酰胺凝胶电泳时,其迁移行为取决于其分子大小和电荷。
不同长度的DNA片段能够被区分开,但同样长度的DNA片段在胶中的迁移行为一样,因此不能被区分。
DGGE技术在一般的聚丙烯酰胺凝胶基础上,加入了变性剂(尿素和甲酰胺)梯度,从而能够把同样长度但序列不同的DNA片段区分开来。
一个特定的DNA片段有其特有的序列组成,其序列组成决定了其解链区域和解链行为。
一个几百个碱基对的DNA片段一般有几个解链区域,每个解链区域有一段连续的碱基组成。
当变性剂浓度逐渐增加达到其最低的解链区浓度时,该区域这一段连续的碱基对发生解链。
当变性剂那浓度再升高依次达到其他解链区域浓度后,最高的解链区域也发生解链,从而双链DNA完全解链。
不同的双链DNA片段因为其序列组成不一样,所以其解链区域和解链区域的解链浓度也是不一样的。
当进行DGGE电泳时,一开始变性剂浓度比较小,不能使双链DNA片段最低的解链区域解链,此时DNA片段的迁移行为和在一般的聚丙烯酰胺凝胶中一样。
然而一旦DNA片段迁移到一特定位置,其变性剂浓度刚好能使双链DNA片段最低的解链区域解链时,双链DNA片段最低的解链区域立即发生解链。
部分解链的DNA片段在胶中的迁移速率会急剧下降。
因此同样长度但序列不同的DNA片段会在胶中不同位置处达到各自最低解链区域的解链变性剂浓度,因此它们会在胶中不同的位置分开。
DGGE原理和步骤

primer Sequence (5'-3')338f ACTCCTACGGGAGGCAGCAG519r ATTACCGCGGCTGCTGG338F 5’端带有一个40bp GC夹子:(5'-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGACGCGGGGGG-3')1、实验原理变性梯度凝胶电泳(DGGE)是一种根据DNA片段的熔解性质而使之分离的凝胶系统。
核酸的双螺旋结构在一定条件下可以解链,称之为变性。
核酸50%发生变性时的温度称为熔解温度(Tm)。
Tm值主要取决于DNA分子中GC含量的多少。
DGGE 将凝胶设置在双重变性条件下:温度50~60 ℃,变性剂0~100%。
当一双链DNA 片段通过一变性剂浓度呈梯度增加的凝胶时,此片段迁移至某一点变性剂浓度恰好相当于此段DNA的低熔点区的Tm值,此区便开始熔解,而高熔点区仍为双链。
这种局部解链的DNA分子迁移率发生改变,达到分离的效果。
Tm的改变依赖于DNA序列,即使一个碱基的替代就可引起Tm值的升高和降低。
因此,DGGE可以检测DNA分子中的任何一种单碱基的替代、移码突变以及少于10个碱基的缺失突变。
为了提高DGGE的突变检出率,可以人为地加入一个高熔点区——GC夹。
GC夹(GC clamp)就是在一侧引物的5′端加上一个30~40bp的GC结构,这样在PCR产物的一侧可产生一个高熔点区,使相应的感兴趣的序列处于低熔点区而便于分析。
因此,DGGE的突变检出率可提高到接近于100%。
作为一种突变检测技术,DGGE具有如下的优点:(1)突变检出率高。
DGGE的突变检出率为99%以上。
(2)检测片段长度可达1kb,尤其适用于100~500bp的片段。
(3)非同位素性。
DGGE不需同位素掺入,可避免同位素污染及对人体造成的伤害。
(4)操作简便、快速。
DGGE一般在24小时内即可获得结果。
(5)重复性好。
但是,该方法需要特殊的仪器,而且合成带GC夹的引物也比较昂贵。
变性梯度凝胶电泳DGGE实验报告

变性梯度凝胶电泳DGGE刘琳 1131428 环境科学一、 实验目的1. 学习掌握变性梯度凝胶电泳的原理和方法。
2. 练习变性梯度凝胶电泳的操作步骤。
3. 分析并掌握变性梯度凝胶电泳的思路,并了解其在微生物群落研究中的地位。
二、 实验原理双链DNA 分子在一般的聚丙烯酰胺凝胶电泳时,其迁移行为决定于其分子大小和电荷。
不同长度的DNA 片段能够被区分开,但同样长度的DNA 片段在凝胶中的迁移行为一样,因此不能被区分。
DGGE 技术在一般的聚丙烯酰胺凝胶基础上,加入了变性剂(尿素和甲酰胺)梯度,从而能够把同样长度但序列不同的DNA 片段区分开来。
不同的双链DNA 片段因为其序列组成不一样,所以其解链区域及各解链区域的解链温度也是不一样的。
同样长度但序列不同的DNA 片段会在胶中不同位置处达到各自最低解链区域的解链温度,因此它们会在胶中的不同位置处发生部分解链导致迁移速率大大下降,从而在胶中被区分开来。
然而,一旦温度(或变性剂浓度)达到DNA 片段最高的解链区域温度时,DNA 片段会完全解链,成为单链DNA分子,此时它们又能在胶中继续迁移。
因此,如果不同DNA 片段的序列差异发生在最高的解链区域时,这些片段就不能被区分开来。
DNA 片段在DGGE 胶中的迁移行为(如下图):变性剂LowHigh在DNA 片段的一端加入一段富含GC 的DNA 片段(一般30-50个碱基对),使DNA 片段最高的解链区域在GC 夹子这一段序列处,它的解链温度很高,可以防止DNA 片段在DGGE/TGGE 胶中完全解链。
当加了GC 夹子后,DNA 片段中基本上每个碱基处的序列差异都能被区分开(Myers, 1985)。
DGGE 有两种电泳形式:垂直电泳和水平电泳。
垂直电泳是为了确定变性剂梯度;而水平电泳则是对比分析不同样品的微生物差异。
本次试验做的是水平电泳,主要对比分析不同样品的微生物差异。
三、 实验器材与药剂器材:DGGE system (D-Code, Bio-Rad)、移液管、移液枪、枪头、制胶设备、30ml 针筒、聚乙烯细管、电泳仪试剂:16s rDNA V3区PCR 扩增产物、胶浓度为8%变性剂浓度分别为0%和90%丙烯酰胺胶、50×TAE buffer、去离子甲酰胺、尿素、去离子水、10%过硫酸铵(Aps)、TEMED 、sDNA 染料 变性剂Low high四、实验步骤1.首先按照实验要求将50x TAE buffer稀释为1×TAE buffer,并利用90%和0%的变性胶分别配置15.5ml的35%和55%的变性胶溶液。
DGGE实验方法
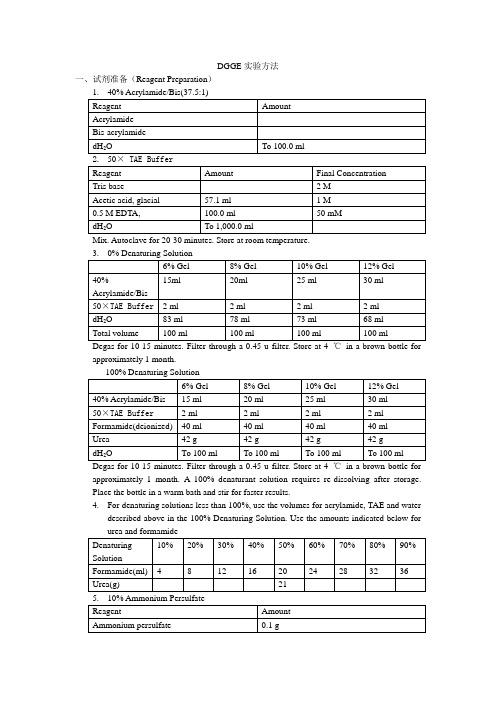
DGGE实验方法一、试剂准备(Reagent Preparation)Mix. Autoclave for 20-30 minutes. Store at room temperature.Degas for 10-15 minutes. Filter through a 0.45 u filter. Store at 4 ℃in a brown bottle for approximately 1 month.approximately 1 month. A 100% denaturant solution requires re-dissolving after storage.Place the bottle in a warm bath and stir for faster results.4.For denaturing solutions less than 100%, use the volumes for acrylamide, TAE and waterdescribed above in the 100% Denaturing Solution. Use the amounts indicated below forStore at room temperature.二、DGGE 凝胶制备及电泳步骤(1)仔细清洗玻璃板、塑料隔片和梳子,晾干水分,安装好玻璃板并固定到制胶底座上(短玻璃板面向自己,底座事先调水平),注意玻璃上缘与隔片、夹子平齐;(2)各取High/Low concentration 两种变性剂12.5 mL,分别加入两个离心管中,加入交联剂(先加APS,再加TEMED),轻轻旋转混匀,吸入相应注射器中,排尽注射器中的气泡,并迅速安装到凝胶传送系统相应的位置上;(3)将注射器上的塑料软管与Y形管相连,并用夹子将针头固定在长玻璃板上缘中央;(4)轻柔并匀速推动旋转凸轮来传送凝胶液体,使胶缓慢匀速的注入两块玻璃板中间,速度不易太快,但也不能太慢,以防胶凝固注射器中,直至胶液面距离短玻璃板1厘米左右为止;(5)迅速在胶液面上加封一层无菌蒸馏水,变性胶即灌制完毕。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
DGGE的基本原理
DGGE(denaturing gradient gel electrophoresis变性梯度凝胶电泳)不是将分子量不同的DNA分开,而是通过PAGE(聚丙烯酰胺)凝胶中变性剂浓度梯度的不同,将序列不同的DNA分开。
该方法的原理是根据DNA 的解链特性,不同碱基组成的DNA双螺旋发生变性所要求的变性剂浓度不同,混合双链DNA在变性剂浓度呈线性梯度增加的聚丙烯酰胺凝胶电泳时,当泳动到与DNA变性所需变性剂浓度一致的凝胶位置时,相对应的DNA发生解链变性,导致电泳迁移速率降低。
由于泳动受阻DNA分子在凝胶中的停留位置不同,从而使不同DNA分子得以分离。
根据变性剂梯度方向的不同, DGGE可分为:垂直DGGE,即变性剂梯度与电场方向垂直,常用于试验决定分离型、野生型和变异型的最佳变性剂梯度范围;平行DGGE,其变性剂的梯度和电场方向平行,主要用于解链范围明确的DNA片段的检测。
DGGE实验
一.
1.制胶:使用梯度胶制备装置,分别制备30%和60%的变性胶。
DGGE制胶参数
制胶30%变性胶的配置20(ml)60%变性胶的配置20(ml)40%丙烯酰胺(Bis-Acr)5ml 5ml
50×TAE 400ul 400ul
Formamide去离子甲酰胺 2.4ml 4.8ml
尿素(urea) 2.52g 5.04g
DdH
2
O 定容至20ml 定容至20ml
最后加(几分钟内凝固)10%AP(APS) 100ul 100ul TEMED 20ul 20ul
试剂配方:
40%丙烯酰胺(Bis-Acr):
Acrylamide 丙烯酰胺 38.93g
Bis-acylamide 双丙烯酰胺 1.07g
蒸馏水定容至100ml
50×TAE:
TrisBase 242.0g
冰醋酸 57.1ml
EDTA o.5M PH 8.0 100ml
去离子水定容至1000ml。
10%APS; Ammonium persulfate 过硫酸铵 0.1g,蒸馏水定容至1.0ml.
2.灌胶
具体步骤见设备说明
3.点样
缓冲液加热至60℃后准备点样。
将45微升的PCR产物和5微升6×loading buffer 混匀后加入上样孔。
若PCR产物亮
度一般,可加90微升PCR产物和10微升6×loading buffer混合液。
(微量进样器与色谱进样器相似)
4.电泳
在1×TAE缓冲液中(可加140m l50×TAE加蒸馏水至7L),只开heat,不开pump,先在200V电压下,10min,是样品快速跑出泳道,以免把DNA吹出,然后打开pump,85V,60℃,电泳14h.
2012-6-21 晴天
二、变性梯度凝胶电泳胶制备
1. 将海绵垫固定在制胶架上,把类似“三明治’结构的制胶板系统垂直放在海绵上方,用分布在制胶架两侧的偏心轮固定好制胶板系统,注意一定是短玻璃的一面正对着自己。
2. 共有三根聚乙烯细管,其中两根较长的为15.5cm,短的那根长9cm。
将短的那根与Y形管相连,两根长的则与小套管相连,并连在30ml的注射器上。
3. 在两个注射器上分别标记‘高浓度’与‘低浓度’,并安装上相关的配件,调整梯度传送系统的刻度到适当的位置。
4. 反时针方向旋转凸轮到起始位置。
为设置理想的传送体积,旋松体积调整旋纽。
将体积设置显示装置固定在注射器上并调整到目标体积设置,旋紧体积调整旋纽。
例如16*16cm gels(1mm thick):设体积调整装置到14.5。
5. 配制两种变性浓度的丙烯酰胺溶液到两个离心管中。
三. 微藻生物群落多样性研究变性梯度凝胶电泳技术
(denaturinggradient gel electrophoresis,DGGE)是一种重要的分子多态性技术,在物种鉴定及浮游生物群落多样性研究方面有着广泛的应用。
可以对多个样品同时进行分析,具有快速、简便、直观结果可靠、重现性好等特点,因此可以对环境中的微生物在时间和空间上的变化进行监测[11]。
四. 变性梯度凝胶电泳胶制备[12]
1. 将海绵垫固定在制胶架上,把类似“三明治’结构的制胶板系统垂直放在海绵上方,用分布在制胶架两侧的偏心轮固定好制胶板系统,注意一定是短玻璃的一面正对着自己。
2. 共有三根聚乙烯细管,其中两根较长的为15.5cm,短的那根长9cm。
将短的那根与Y形管相连,两根长的则与小套管相连,并连在30ml的注射器上。
3. 在两个注射器上分别标记‘高浓度’与‘低浓度’,并安装上相关的配件,调整梯度传送系统的刻度到适当的位置。
4. 反时针方向旋转凸轮到起始位置。
为设置理想的传送体积,旋松体积调整旋纽。
将体积设置显示装置固定在注射器上并调整到目标体积设置,旋紧体积调整旋纽。
例如16*16cm gels(1mm thick):设体积调整装置到14.5。
5. 配制两种变性浓度的丙烯酰胺溶液到两个离心管中。
配置剂量如下:
试剂35%45%0%变性剂9.75ml,8.25ml
100%变性剂5.25ml,6.75ml
APS : 80μl,80μl
TEMED:18μl,18μl
注意在加入100%变性剂后,在高浓度的丙烯酰胺溶液中加入摇匀的ER燃料
300μl。
以便于与低浓度的区分。
1. 加完后迅速盖上并旋紧帽后上下颠倒数次混匀。
用连有聚乙烯管标有
‘高浓度’的注射器吸取所有高浓度的胶,对于低浓度的胶操作同上。
2. 通过推动注射器推动杆小心赶走气泡并轻柔地晃动注射器,推动溶液到聚丙烯管的末端。
注意不要将胶液推出管外,因为这样会造成溶液的损失,导致最后凝胶体积不够。
3. 分别将高浓度、低浓度注射器放在梯度传送系统的正确一侧固定好,注意这里一定要把位置放正确!再将注射器的聚丙烯管同Y形管相连。
4. 轻柔并稳定地旋转凸轮来传送溶液,在这个步骤中最关键的是要保持恒定匀速且缓慢地推动凸轮,以使溶液恒速的被灌入到三明治式的凝胶板中。
5. 小心插入梳子,让凝胶聚合大约一个小时。
放入4℃冰箱中备用。
6. 迅速清洗用完的设备。
2.2.2.4电泳过程
1. 电泳控制装置打开,预热电泳缓冲液到60℃。
2. 移去顶部梳子之后,将相关设备和胶移至电泳槽内,使缓冲液高度刚刚没过胶上的加样孔。
清洗点样孔。
3. 用注射针吸取40μl样品点样。
样品为第一步中获得的PCR产物与2x
染色剂Loadingbuffer按照1:1比例混合而成的。
4. 200V,不开PUMP,电泳10min
5. 开PUMP,150V,电泳6h
2.2.2.5染色拍照
1. 配置0.5μg/mL溴化乙锭(EB),配方为500mlH2O﹢20mlEB
2. 电泳完毕,先拨开一块玻璃板,然后将胶放入盘中。
(用去离子水冲洗,使胶和玻璃板脱离。
)然后将盘中的的胶放入配置好的EB溶液中染色30min。
3. 染色后小心地将凝胶转移到gel documentation system中拍照,要尽快操作,否则在紫外光的作用下,很快图像的效果就会降低。
4. 用Quantity One进行定量分析图像。
