新人教版高中化学选修3金属晶体 同步练习
高中化学第三章晶体结构与性质第三节金属晶体练习(含解析)新人教版选修3

高中化学第三章晶体结构与性质第三节金属晶体练习(含解析)新人教版选修31.下列关于晶体的说法正确的是( )A.在晶体中只要有阴离子就一定有阳离子B.在晶体中只要有阳离子就一定有阴离子C.原子晶体的熔点一定比金属晶体的高D.分子晶体的熔点一定比金属晶体的低解析:金属晶体中只有金属阳离子和自由电子,无阴离子。
金属晶体的熔点相差比较大,金属钨的熔点(3 410 ℃)高于晶体硅(1 410 ℃),而金属汞的熔点(常温下呈液态)比白磷、碘等分子晶体的低。
答案:A2.依据“电子气”的金属键模型,下列对于金属导电性随温度变化的解释,正确的是( ) A.温度升高,自由电子的动能变大,以致金属导电性增强B.温度升高,阳离子的动能变大,阻碍电子的运动,以致金属导电性减弱C.温度升高,自由电子互相碰撞的次数增加,以致金属导电性减弱D.温度升高,阳离子的动能变大,自由电子与阳离子的吸引力变小,以致导电性增强解析:温度升高时,由于阳离子吸收大量的能量,动能变大,阻碍电子的运动,故温度越高,导电性越弱。
答案:B3.按下列四种有关性质的叙述,可能属于金属晶体的是( )A.由分子间作用力结合而成,熔点低B.固体或熔融后易导电,熔点在1 000 ℃左右C.由共价键结合成网状结构,熔点高D.固体不导电,但溶于水或熔融后能导电解析:A为分子晶体;B中固体能导电,熔点在1 000 ℃左右,不是很高,应为金属晶体;C 为原子晶体,D为离子晶体。
答案:B4.下列关于金属晶体的体心立方堆积的结构形式的叙述正确的是( )A.晶胞是六棱柱B.每个晶胞中含有2个原子C.每个晶胞中含4个原子D.每个晶胞中含5个原子解析:金属晶体的体心立方堆积的晶胞是平行六面体,体心立方堆积的堆积方式为立方体的顶点和体心各有1个原子,每个晶胞中含有8×18+1=2个原子。
答案:B5.某固体仅由一种元素组成,其密度为5.0 g·cm -3,用X射线研究该固体的结构时得知:在边长为1×10-7cm 的正方体中含有20个原子,则此元素的相对原子质量最接近下列数据中的( )A .32B .120C .150D .180解析:20个原子的质量为5.0 g·cm -3×(1×10-7cm)3=5.0×10-21g ,则1个碳原子的质量为2.5×10-22g ,则N A 个原子的质量为6.02×1023×2.5×10-22g =150.5 g ,故摩尔质量为150.5 g·mol -1,此元素的相对原子质量最接近150。
人教版高中化学选修3练习:3.3金属晶体
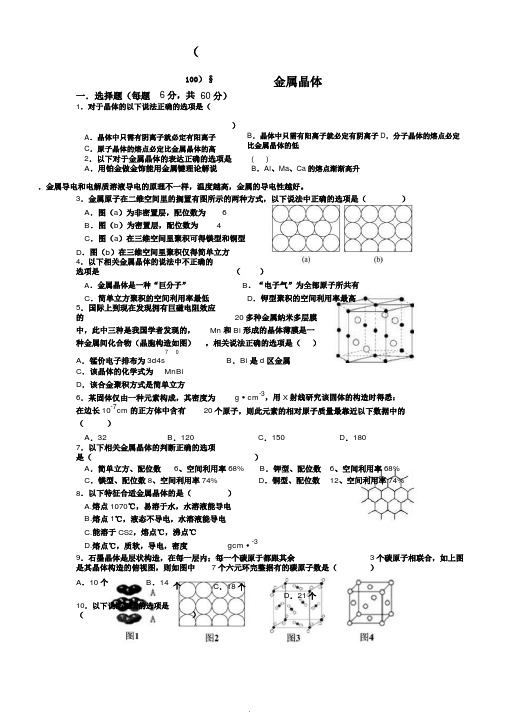
(100)§金属晶体一.选择题(每题6分,共60分)1.对于晶体的以下说法正确的选项是()A.晶体中只需有阴离子就必定有阳离子C.原子晶体的熔点必定比金属晶体的高B.晶体中只需有阳离子就必定有阴离子D.分子晶体的熔点必定比金属晶体的低2.以下对于金属晶体的表达正确的选项是()A.用铂金做金饰能用金属键理论解说B.Al、Ma、Ca的熔点渐渐高升.金属导电和电解质溶液导电的原理不一样,温度越高,金属的导电性越好。
3.金属原子在二维空间里的搁置有图所示的两种方式,以下说法中正确的选项是()A.图(a)为非密置层,配位数为6B.图(b)为密置层,配位数为4C.图(a)在三维空间里聚积可得镁型和铜型D.图(b)在三维空间里聚积仅得简单立方4.以下相关金属晶体的说法中不正确的选项是()A.金属晶体是一种“巨分子”B.“电子气”为全部原子所共有C.简单立方聚积的空间利用率最低D.钾型聚积的空间利用率最高5.国际上到现在发现拥有巨磁电阻效应的20多种金属纳米多层膜中,此中三种是我国学者发现的,Mn和Bi形成的晶体薄膜是一种金属间化合物(晶胞构造如图),相关说法正确的选项是()70B.Bi是d区金属A.锰价电子排布为3d4sC.该晶体的化学式为MnBiD.该合金聚积方式是简单立方g·cm-3,用X射线研究该固体的构造时得悉:6.某固体仅由一种元素构成,其密度为在边长10-7cm的正方体中含有20个原子,则此元素的相对原子质量最靠近以下数据中的()A.32B.120C.150D.1807.以下相关金属晶体的判断正确的选项是()A.简单立方、配位数6、空间利用率68%B.钾型、配位数6、空间利用率68%C.镁型、配位数8、空间利用率74%D.铜型、配位数12、空间利用率74%8.以下特征合适金属晶体的是()A.熔点1070℃,易溶于水,水溶液能导电B.熔点1℃,液态不导电,水溶液能导电C.能溶于CS2,熔点℃,沸点℃D.熔点℃,质软,导电,密度gcm·-39.石墨晶体是层状构造,在每一层内;每一个碳原于都跟其余3个碳原子相联合,如上图是其晶体构造的俯视图,则如图中7个六元环完整据有的碳原子数是()A.10个B.14个C.18个D.21个10.以下说法正确的选项是()A.和都采纳1的堆方式B.2金属原子在二空里的非密置搁置,此方式在三空里堆,得立方堆C.3是干冰晶体的晶胞,晶胞棱acm,在每个CO2周近来且等距离的CO2有8个D.4是一种金属晶体的晶胞,它是金属原子在三空以密置采纳ABCABC⋯堆的果二.非选择题(共40分)11.(40分)E、F、G三元素的原子序数挨次增大,它原子的最外子排布均4s1。
高中化学第三章晶体结构与性质3.3金属晶体精练(含解析)新人教版选修3

高中化学第三章晶体结构与性质3.3金属晶体精练(含解析)新人教版选修3金属晶体一、A组定向巩固定向巩固一、金属键和金属晶体1.金属键的强弱与金属价电子数的多少有关,价电子数越多金属键越强,与金属阳离子的半径大小也有关,金属阳离子的半径越大,金属键越弱。
据此判断下列金属熔点逐渐升高的是( )A.Li Na KB.Na Mg AlC.Li Be MgD.Li Na Mg、Na、K价电子数相同,金属阳离子半径逐渐增大,金属键逐渐减弱,熔点逐渐降低,A、D错误;Na、Mg、Al价电子数逐渐增多,金属阳离子半径逐渐减小,金属键逐渐增强,熔点逐渐升高,B正确;Be、Mg价电子数相同,金属阳离子半径逐渐增大,金属键逐渐减弱,熔点逐渐降低,C错误。
2.下列关于金属晶体的叙述中,正确的是( )A.温度越高,金属的导电性越强B.常温下,金属单质都以金属晶体形式存在C.金属晶体堆积密度大,能充分利用空间的原因是金属键没有饱和性和方向性D.金属阳离子与自由电子之间的强烈作用,在外力作用下会发生断裂,故金属无延展性,金属离子的热运动加快,对自由电子的移动造成阻碍,导电性减弱,A项错;常温下,Hg 为液态,不属于晶体形态,B项错;金属键无方向性和饱和性,在外力作用下,一般不会断裂,即金属具有延展性,D项错;正是因为金属键无方向性和饱和性,所以金属晶体中的金属原子一般采用最密堆积,尽量充分利用空间,C项正确。
3.下列晶体中,金属阳离子与自由电子间的作用最强的是( )A.NaB.MgC.AlD.K、Mg、Al均位于第三周期,原子半径逐渐减小,价电子数目逐渐增多,所以金属键逐渐增强,即铝的金属键最强,钠的金属键最弱,而K和Na位于同一主族,且K的半径比Na的大,钾的金属键比钠的弱。
4.下列四种叙述,可能为金属晶体性质的是( )A.由分子间作用力结合而成,熔点低B.固体或熔融后易导电,熔点在1 000 ℃左右C.由共价键结合成网状结构,熔点高D.固体不导电,但溶于水或熔融后能导电解析:由分子间作用力结合而成,熔点低是分子晶体的性质,A错;固体能导电是金属晶体的特性,B 对、D错,由共价键结合成网状结构,熔点高为原子晶体的性质,C错。
人教版化学选修三 第三章 第三节 金属晶体 同步练习题 教师版含解析与答案

人教版化学选修三第三章第三节金属晶体同步练习题1. 金属晶体的堆积方式、空间利用率和配位数关系正确的是( )A.钋Po——简单立方堆积——52%——6B.钠Na——体心立方堆积——74%——12C.锌Zn——六方最密堆积——68%——8D.银Ag——面心立方最密堆积——68%——12解析:利用堆积方式来推导空间利用率和配位数。
B项,体心立方堆积的空间利用率为68%,配位数为8;C项,Zn为六方最密堆积,空间利用率为74%,配位数为12;D项,Ag为面心立方最密堆积,空间利用率为74%,配位数为12;A项,堆积方式、空间利用率和配位数均正确。
答案:A2. 有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )A.①为简单立方堆积②为六方最密堆积③为体心立方堆积④为面心立方最密堆积B.每个晶胞含有的原子数分别为①1个②2个③2个④4个C.晶胞中原子的配位数分别为①6 ②8 ③8 ④12D.空间利用率的大小关系为①<②<③<④解析:①为简单立方堆积,②为体心立方堆积,③为六方最密堆积,④为面心立方最密堆积,A项错误;每个晶胞中含有的原子数分别为:①8×=1,②8×+1=2,③8×+1=2,④8×+6×=4,B项正确;晶胞③中原子的配位数应为12,其他判断正确,C项不正确;四种晶体的空间利用率分别为52%、68%、74%、74%,所以D项不正确。
答案:B3.下列四种有关性质的叙述,可能为金属晶体的是( )A.由分子间作用力结合而成,熔点低B.固体或熔融后易导电,熔点在1 000 ℃左右C.由共价键结合成网状结构,熔点高D.组成晶体的微粒为原子解析: 本题考查了晶体与结构的关系。
A项为分子晶体的性质;B项,固体能导电,熔点在1000℃左右,应该为金属晶体的性质;C项应该为原子晶体的性质;D项可能为分子晶体,如Ar,也可能是原子晶体,如金刚石。
高中化学金属晶体 同步练习 新课标 人教版 选修3

金属晶体同步练习
一、填空并计算
1、下图是金属钨晶体中的一个晶胞的结构模型图(原子间实际是相互接触的)。
它是一种体心立方结构。
实验测得金属钨的密度为19.30 g·cm—3,钨的相对原子质量为183.9。
假定金属钨为等直径的刚性球,请回答以下各题:
⑴每一个晶胞中分摊到个钨原子。
⑵计算晶胞的边长a。
⑶计算钨的原子半径r(提示:只有体对角线上的各个球才是彼此接触的)。
⑷计算金属钨原子采取的体心立方结构的空间利用率。
2、金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心也有一个金原子,每个金原子被相邻
表示阿伏加德罗常数,M表示金的的晶胞所共用。
金原子的直径为d,用N
A
摩尔质量。
(1)金晶体每个晶胞中含有个__________金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定________________。
(3)一个晶胞的体积是多少?
(4)金晶体的密度是多少?。
人教版高中化学选修3第三章 晶体结构与性质 同步训练

第三章晶体结构与性质一、选择题1.如图是CsCl晶体的一个晶胞,相邻的两个Cs+的核间距为a cm,N A为阿伏加德罗常数,CsCl的相对分子质量用M表示,则CsCl晶体的密度为()A.8MN A·a3B.6M N A·a3C.4MN A·a3D.M N A·a32.下列有关晶体的说法正确的是()A.晶体分子间作用力越大,分子越稳定B.原子晶体中共价键越强,熔点越高C.冰融化时水分子中共价键发生断裂D.氯化钠熔化时离子键未被破坏3.在解释下列物质的变化规律与物质结构间的因果关系时,与化学键的强弱无关的是()A.钠、镁、铝的熔点和沸点逐渐升高,硬度逐渐增大B.金刚石的硬度大于晶体硅的硬度,其熔点也高于晶体硅的熔点C.KF、KCl、KBr、KI的熔点依次降低D.CF4、SiF4、GeF4、SnF4的熔点和沸点逐渐升高4.晶体与非晶体的本质区别是()A.晶体有规则的几何外形,而非晶体没有规则的几何外形B.晶体内粒子有序排列,而非晶体内粒子无序排列C.晶体有固定熔、沸点,而非晶体没有固定熔、沸点D.晶体的硬度大,而非晶体的硬度小5.为了确定SbCl3、SbCl5、SnCl4是否为离子化合物,可以进行下列实验,其中合理、可靠的是()选项实验结论A 常温下观察,SbCl5为黄色液体,SnCl4为无色液体结论:SbCl5和SnCl4都是离子化合物B 测定三种物质的熔点,依次为73.5 ℃、2.8 ℃、-33 ℃结论:SbCl3、SbCl5、SnCl4都不是离子化合物C将三种物质分别溶解于水中,各滴入HNO3酸化的AgNO3溶液,产生白色沉结论:SbCl3、SbCl5、SnCl4都是离子化合物淀D 测定三种物质水溶液导电性,发现它们都可以导电结论:SbCl3、SbCl5、SnCl4都是离子化合物6.下列有关离子晶体的叙述中,不正确的是()A.1 mol氯化钠晶体中有N A个NaCl分子B.氯化钠晶体中,每个Na+周围距离相等的Cl-共有6个C.醋酸钠属于离子晶体,含非极性键D.平均每个NaCl晶胞有4个Na+、4个Cl-7.石墨晶体是层状结构如图。
人教版高中化学选修三:3.3金属晶体(第2课时)同步训练

人教版高中化学选修三:3.3金属晶体(第2课时)同步训练学校:___________姓名:___________班级:___________考号:___________一、单选题1.下列金属晶体采取的堆积方式是铜型的是()A.Ag B.Fe C.Zn D.Po2.下列说法正确的是()A.晶体是具有一定几何外观的,所以汞不属于金属晶体B.金属一般具有较高的硬度,而钠可以用小刀切,但钠属于金属晶体C.塑料具有一定延展性,所以属于金属晶体D.金属晶体一般具有较高的硬度,所以金刚石属于金属晶体3.下列物质的熔沸点依次升高的是()A.K、Na、Mg、Al B.Li、Na、Rb、CsC.Al、Mg、Na、K D.C、K、Mg、Al4.下列金属的密堆积方式,对应晶胞都正确的是A.Na、A1、体心立方B.Mg、A2、六方C.Ca、A3、面心立方D.Au、A1、体心立方5.下列有关金属晶体判断正确的是A.简单立方、配位数6、空间利用率68%B.钾型、配位数6、空间利用率68%C.镁型、配位数8、空间利用率74%D.铜型、配位数12、空间利用率74%6.下列对各组物质性质的比较中,正确的是 ( )。
A.熔点:Li<Na<KB.导电性:Ag>Cu>Al>FeC.密度:Na>Mg>AlD.空间利用率:体心立方堆积<六方最密堆积<面心立方最密堆积7.关于钾型晶胞结构(如图)的叙述中正确的是()A.是密置层的一种堆积方式B.晶胞是六棱柱C.每个晶胞内含2个原子D.每个晶胞内含6个原子8.有四种不同堆积方式的金属晶体的晶胞如图所示,下列有关说法正确的是()A.①为简单立方堆积,②为镁型,③为钾型,④为铜型B.每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个C.晶胞中原子的配位数分别为:①6,②8,③8,④12D.空间利用率的大小关系为:①<②<③<④9.几种晶体的晶胞如图所示:所示晶胞从左到右分别表示的物质正确的排序是A.碘、锌、钠、金刚石B.金刚石、锌、碘、钠C.钠、锌、碘、金刚石D.锌、钠、碘、金刚石二、多选题10.金属晶体的基本堆积方式中空间利用率最高的是A.简单立方B.钾型C.镁型D.铜型11.在下列有关晶体的叙述中错误的是()A.分子晶体中,一定存在极性共价键B.原子晶体中,只存在共价键C.金属晶体的熔沸点均很高D.稀有气体的原子能形成分子晶体三、原理综合题12.判断下列晶体类型。
高中化学第三章晶体结构与性质3.3金属晶体配套练习新人教版选修3(2021年整理)

高中化学第三章晶体结构与性质 3.3 金属晶体同步配套练习新人教版选修3 编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(高中化学第三章晶体结构与性质3.3 金属晶体同步配套练习新人教版选修3)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为高中化学第三章晶体结构与性质 3.3 金属晶体同步配套练习新人教版选修3的全部内容。
第三节金属晶体基础巩固1下列有关金属键的叙述错误的是( )A.金属键没有饱和性和方向性B.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用C.金属键中的电子属于整块金属D.金属的物理性质和金属固体的形成都与金属键有关答案:B解析:金属原子脱落下来的价电子形成遍布整块晶体的电子气,被所有原子所共用,从而把所有的金属原子维系在一起,故金属键无饱和性和方向性;金属键中的电子属于整块金属;金属键是金属阳离子和自由电子之间的强烈作用,既包括金属阳离子与自由电子之间的静电吸引作用,也存在金属阳离子之间及自由电子之间的静电排斥作用;金属的物理性质及固体的形成都与金属键强弱有关.2金属的下列性质中和金属晶体无关的是()A。
良好的导电性B。
反应中易失电子C.良好的延展性D.良好的导热性答案:B解析:选项A、C、D都是金属共有的物理性质,这些性质都是由金属晶体所决定的。
选项B中,金属易失电子是由金属原子的结构决定的,与金属晶体无关。
3金属能导电的原因是( )A。
金属晶体中的金属阳离子与自由电子间的作用较弱B.金属晶体中的自由电子在外加电场作用下可发生定向移动C。
金属晶体中的金属阳离子在外加电场作用下可发生定向移动D。
金属晶体在外加电场作用下可失去电子答案:B解析:根据电子气理论,电子是属于整块晶体的,在外加电场作用下,发生了定向移动从而导电,故B项正确.4下列关于金属性质和原因的描述不正确的是( )A。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
金属晶体 同步练习
1.金属的下列性质中,不能用金属晶体结构加以解释的是 ( )
A .易导电
B .易导热
C .有延展性
D .易锈蚀
2.金属能导电的原因是 ( )
A .金属晶体中金属阳离子与自由电子间的作用较弱
B .金属晶体中的自由电子在外加电场作用下可发生定向移动
C .金属晶体中的金属阳离子在外加电场作用下可发生定向移动
D .金属晶体在外加电场作用下可失去电子
3.金属晶体具有延展性的原因( )
A .金属键很微弱
B .金属键没有饱和性
C .密堆积层的阳离子容易发生滑动,但不会破坏密堆积的排列方式,也不会破坏金属键
D .金属阳离子之间存在斥力
4.在金属中,自由移动的电子所属的微粒 ( )
A .与电子最近的金属阳离子
B .整块金属的所有金属阳离子
C .在电子附近的金属阳离子
D .与电子有吸引力的金属阳离子
5.组成金属晶体的微粒 ( )
A .金属原子
B .金属阳离子和电子
C .金属原子和电子
D .阳离子和阴离子
6.下列各组物质中,按熔点由低到高排列正确的是( )
A .O 2、I 2、Hg
B .CO 2、KCl 、SiO 2
C .Na 、K 、Rb
D .SiC 、NaCl 、SO 2
7.下列各组物质中都存在非极性键的是( )
A .H 2、H 2O 、H 2O 2
B .H 2O 2、Cl 2、Na 2O 2
C .金刚石、石墨、Na 2O 2
D .CH 4、NaOH 、Br 2
8.下列微粒在固态时形成分子晶体的是( )
A .2MgCl
B .CO 2
C .NaOH
D .He
9.下列各组物质的熔点比较正确的是( )
A .金刚石>硫
B .NaCl >金刚石
C .MgO >I 2
D .CO 2>SiO 2
10.下列各组物质气化或熔化时,所克服的微粒间作用力,属同种类型的是( )
A .碘和干冰的升华
B .二氧化硅和生石灰的熔化
C .氯化钠和铁的熔化
D .苯和乙烷的蒸发
11.下列晶体中,不属于原子晶体的是( )
A .干冰
B .水晶
C .晶体硅
D .金刚石
12.固体熔化时必须破坏非极性共价键的是( )
A .冰
B .晶体硅
C .溴
D .二氧化硅
13.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A .SO 2和SiO 2
B .CO 2和H 2O
C .NaCl 和HCl
D .CCl 4和KCl
14.下列叙述中正确的是( )
A .离子晶体中肯定不含有非极性共价键
B .一般情况下,原子晶体的熔点高于其他晶体
C .由分子构成的物质其熔点一定较低
D .原子晶体中除非极性共价键外不存在其他类型的化学键
15.金属钾晶体为体心立方结构,则在单位晶胞中钾原子的个数是 。
16.参考下表中的熔点,回答有关问题:
物质 NaF NaCl NaBr NaI NaCl KCl RbCl CsCl
熔点(℃) 995 801 755 651 801 776 715 646
物质 4SiF 4SiCl 4SiBr 4SiI 4SiCl 4GeCl 4SnCl 4PbCl
熔点(℃) -90.2 -70.4 5.2 120.5 -70.4 -49.5 -36.2 -15.0
(1)钠的卤化物及碱金属的氯化物的熔点与________有关,随________增大________ 减小,故熔点依次降低。
(2)硅的卤化物及硅、锗、锡、铅的氯化物的熔点与________有关,随着________增 大________增大,故熔点依次升高。
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与________有关,因为 ________________________________,故前者熔点远远高于后者。
17.下图左是金属钨晶体的密堆结构模型图。
从金属钨晶体中划分出的一个晶胞(在晶体中,仍保持一定几何形状的最小单位,又称为单元晶胞,下图右)它是一个立方体,立方
体中每个角各有1个钨原子,中心有1个钨原子。
实验测得金属钨的密度为19.30g/cm3原子量为183.9,。
假定金属钨为等径的钨原子刚性球,采取上述方式的密
堆积。
试回答下列各问:
(1)每一个晶胞中分摊到几个钨原子?
(2)计算晶胞的边长a。
(3)计算钨原子的半径。
(提示:只有对角线上的各球是互相接触的)
18.某些金属晶体(Cu、Ag、Au)的原子按面心立方的形式紧密堆积,即在晶体结构中可以划出一块正立方体的结构单元,金属原子处于正立方体的八个顶点和六个侧面上,试计算这类金属中原子的空间利用率。
参考答案:
1.D
2.B
3.C
4.B
5.B 6.B 7.B、C 8.B、D 9.A、C 10.A、D 11.A 12.B 13.B 14.B
15. 2
16.(1)离子半径,离子半径,静电引力(离子键键能)(2)分子量,分子量,范德华力(3)晶体类型,离子键的键能一般比范德华力大得多
17.(1)2(2)a=0.3163nm(3)r(W)=0.137nm
18.74%。
