常用缓冲溶液的配制
常见缓冲溶液配制方法

常见缓冲溶液配制方法1.醋酸钠/醋酸酸性缓冲液醋酸钠/醋酸酸性缓冲液适用于pH范围为4.0-6.0的实验。
配制方法如下:- 准备质量浓度为0.1mol/L的醋酸钠溶液和0.1mol/L的醋酸溶液。
-根据所需pH值,按照相应的比例混合醋酸钠溶液和醋酸溶液即可。
2.磷酸/盐酸性缓冲液磷酸/盐酸性缓冲液适用于pH范围为1.0-3.0的实验。
配制方法如下:- 准备0.2mol/L的盐酸溶液。
- 准备分别为0.2mol/L和0.1mol/L的磷酸溶液。
-具体配制时,根据所需pH值,按照相应的比例混合盐酸溶液和磷酸溶液即可。
3.磷酸/氢磷酸二盐酸性缓冲液磷酸/氢磷酸二盐酸性缓冲液适用于pH范围为2.0-7.0的实验。
配制方法如下:- 准备0.2mol/L的盐酸溶液。
- 准备分别为0.2mol/L、0.1mol/L和0.05mol/L的氢磷酸二盐溶液。
-具体配制时,根据所需pH值,按照相应的比例混合盐酸溶液和氢磷酸二盐溶液即可。
4.磷酸盐缓冲液磷酸盐缓冲液适用于pH范围为5.0-8.0的实验。
配制方法如下:- 准备分别为0.2mol/L的梯度磷酸盐溶液。
-根据所需pH值,按照相应的比例混合相应浓度的磷酸盐溶液即可。
5.三氯乙酸/三氯乙酸钠酸性缓冲液三氯乙酸/三氯乙酸钠酸性缓冲液适用于pH范围为3.0-4.6的实验。
配制方法如下:- 准备质量浓度为0.2mol/L的三氯乙酸钠溶液和0.2mol/L的三氯乙酸溶液。
-根据所需pH值,按照相应的比例混合三氯乙酸钠溶液和三氯乙酸溶液即可。
以上是一些常见的缓冲溶液配制方法,具体的配制过程可能会因实验需求和具体试剂而略有不同。
在配制缓冲溶液时,一定要注意使用高纯度的试剂,并按照配制方法进行准确的实验操作。
常见缓冲溶液配制方法

常见缓冲溶液配制方法缓冲溶液是一种能够维持溶液酸碱性质相对稳定的溶液。
常见的缓冲溶液配制方法主要包括四种:酸碱对配制、酸碱配制、水解配制和氧化还原配制。
下面将详细介绍这四种配制方法以及常用的缓冲体系。
一、酸碱对配制酸碱对配制是以两种酸碱的共存为基础实现的。
常用的酸碱对包括:醋酸与醋酸钠对、琼脂酸与琼脂酸钠对、乙酸与乙酸-乙酸钠对等。
以醋酸和醋酸钠为例:1.根据所需的pH值,计算所需的酸碱物质的摩尔量比例,使用化学计算方法可以得到这个比例。
2.首先,在一定体积(如100mL)的蒸馏水中加入醋酸的量,根据计算结果。
3.然后,在同样的蒸馏水中加入醋酸钠的量,根据计算结果。
在加入醋酸钠之前,需要校对酸碱物质的总体积是否是所需的目标体积,如果不是,可以再加入适量的蒸馏水进行调整。
4.经过充分搅拌混合后,缓冲溶液就制备好了。
最后,根据需求进行PH值校准。
二、酸碱配制酸碱配制是指利用单一酸或碱的酸碱性质与反应物种数之间的关系,通过精确配比计算得出所需的缓冲体系,使溶液能够保持所需的酸碱性质稳定。
常见的酸碱配制方法有:乙酸钠-盐酸、蒸馏水盐酸-碳酸钠等。
以乙酸钠-盐酸为例:1. 根据所需的pH值,计算所需的酸碱物质的摩尔量比例。
根据缓冲溶液配制公式 pKa=pH-log([A-]/[HA]),可以反推得到[HA]/[A-]的比例,其中[A-]代表酸根离子的浓度,[HA]代表不电离酸的浓度。
2.根据计算结果和所需体积,将乙酸钠溶液添加到蒸馏水中,同时滴加适量的盐酸溶液以调整pH值。
3.增加或减少乙酸钠和盐酸的量,直到所需的pH值达到要求。
三、水解配制水解是指酸碱反应中一种物质在水中发生分解产生酸和碱的反应。
通过精确配比计算得出所需的缓冲体系,既可以保持所需的酸碱性质稳定,又可以实现水解反应的产物稳定。
常见的水解配制方法有:磷酸盐缓冲液、硼酸缓冲液、胸腺嘧啶缓冲液等。
以硼酸缓冲液为例:1.将一定体积(如100mL)的蒸馏水倒入容器中。
常用缓冲溶液配制方法
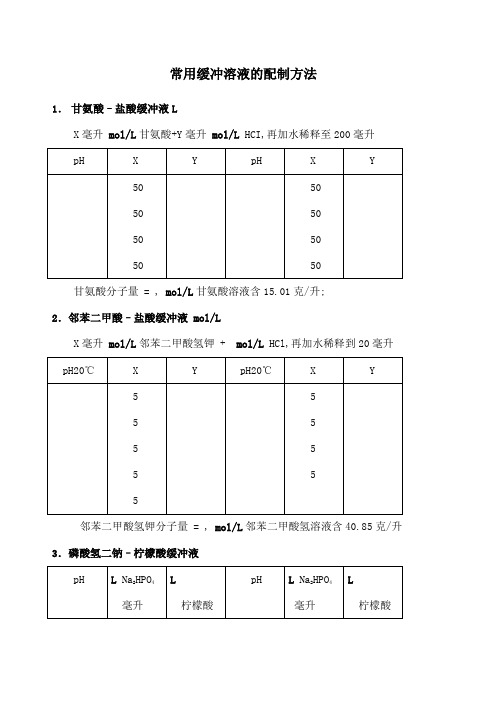
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液LX毫升 mol/L甘氨酸+Y毫升 mol/L HCI,再加水稀释至200毫升甘氨酸分子量 = , mol/L甘氨酸溶液含15.01克/升;2.邻苯二甲酸–盐酸缓冲液 mol/LX毫升 mol/L邻苯二甲酸氢钾 + mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量 = , mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量 = , mol/L溶液为28.40克/升;Na2HPO4·2H2O分子量 = , mol/L溶液含35.01克/升;C 4H2O7·H2O分子量 = , mol/L溶液为21.01克/升;4.柠檬酸–氢氧化钠-盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存;5.柠檬酸–柠檬酸钠缓冲液 mol/L柠檬酸C 6H 8O 7·H 2O :分子量, mol/L 溶液为21.01克/升;柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量, mol/L 溶液为29.41克/毫升; 6.乙酸–乙酸钠缓冲液 mol/LNa 2Ac·3H 2O 分子量 = , mol/L 溶液为27.22克/升; 7.磷酸盐缓冲液1磷酸氢二钠–磷酸二氢钠缓冲液Na2HPO4·2H2O分子量 = , mol/L溶液为85.61克/升;Na2HPO4·12H2O分子量 = , mol/L溶液为克/升;NaH2PO4·2H2O分子量 = , mol/L溶液为克/升;磷酸盐是化学研究中使用最广泛的一种缓冲剂,由于它们是二级解离,有二个pKa 值,所以用它们配制的缓冲液,pH 范围最宽:NaH2PO4: pKa1=,pKa2=;Na2HPO4:pKa1=,pKa2=配酸性缓冲液:用NaH2PO4,pH=1~4,配中性缓冲液:用混合的两种磷酸盐,pH=6~8,配碱性缓冲液:用Na2HPO4,pH=10~12;用钾盐比钠盐好,因为低温时钠盐难溶,钾盐易溶,但若配制SDS-聚丙烯酰胺凝胶电泳的缓冲液时,只能用磷酸钠而不能用磷酸钾,因为SDS十二烷基硫酸钠会与钾盐生成难溶的十二烷基硫酸钾;磷酸盐缓冲液的优点为:①容易配制成各种浓度的缓冲液;②适用的pH 范围宽;③pH 受温度的影响小;④缓冲液稀释后pH 变化小,如稀释10倍后pH 的变化小于;其缺点为:①易与常见的钙Ca2+离子、镁Mg2+离子以及重金属离子缔合生成沉淀;②会抑制某些化学过程,如对某些酶的催化作用会产生某种程度的抑制作用;2磷酸氢二钠–磷酸二氢钾缓冲液1/15 mol/L15M11.876克15M9.078克0.05M0.2M18℃0.04M8.25克0.05M25℃0.1M严;11.硼酸–硼砂缓冲液0.2M 硼酸根硼砂Na 2B 4O 7·10H 2O,分子量=;溶液=0.2M 硼酸根含19.07克/升; 硼酸H 3BO 3,分子量=,溶液为12.37克/升; 硼砂易失去结晶水,必须在带塞的瓶中保存; 12.甘氨酸–氢氧化钠缓冲液0.05MX 毫升0.2M甘氨酸+Y 毫升加水稀释至200毫升甘氨酸分子量=;0.2M 溶液含15.01克/升; 13.硼砂-氢氧化钠缓冲液0.05M 硼酸根 X 毫升0.05M 硼砂+Y 毫升加水稀释至200毫升硼砂Na 2B 4O 7·10H 2O,分子量=;0.05M 溶液为19.07克/升; 14.碳酸钠-碳酸氢钠缓冲液0.1M Ca 2+、Mg 2+存在时不得使用Na 2CO 2·10H 2O 分子量=;0.1M 溶液为28.62克/升; N 2HCO 3分子量=;0.1M 溶液为8.40克/升; 15.“PBS”缓冲液pH标准缓冲溶液Standard pH Buffer Solutions注:为保证pH值的准确度,上述标准缓冲溶液必须使用pH基准试剂配制;常用pH缓冲溶液的配制和pH值Preparation and pH Values of Common pH Buffer Solutions。
常用缓冲溶液配制方法
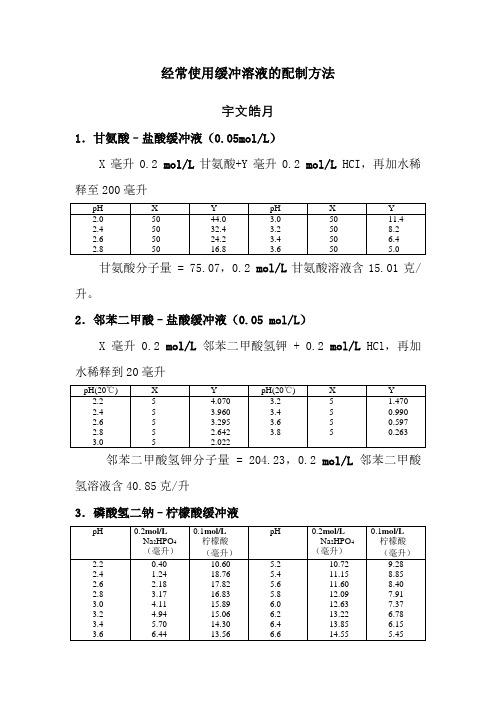
经常使用缓冲溶液的配制方法宇文皓月1.甘氨酸–盐酸缓冲液(0.05mol/L)X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升甘氨酸分子量 = 75.07,0.2 mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)X毫升0.2 mol/L邻苯二甲酸氢钾 + 0.2 mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量 = 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量 = 14.98,0.2 mol/L溶液为28.40克/升。
Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量 = 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变更,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保管。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L)柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L)Na2Ac·3H2O分子量 = 136.09,0.2 mol/L溶液为27.22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液为85.61克/升。
Na2HPO4·12H2O分子量 = 358.14,0.2 mol/L溶液为71.628克/升。
NaH2PO4·2H2O分子量 = 156.01,0.2 mol/L溶液为31.202克/升。
最全常见缓冲溶液配制方法

常见缓冲溶液配制方法乙醇-醋酸铵缓冲液(pH3.7):取5mol/L醋酸溶液15.0ml,加乙醇60ml和水20ml,用10mol/L氢氧化铵溶液调节pH值至3.7,用水稀释至1000ml。
三羟甲基氨基甲烷缓冲液(pH8.0):取三羟甲基氨基甲烷12.14g,加水800ml,搅拌溶解,并稀释至1000ml,用6mol/L盐酸溶液调节pH值至8.0。
三羟甲基氨基甲烷缓冲液(pH8.1):取氯化钙0.294g,加0.2mol/L三羟甲基氨基甲烷溶液40ml使溶解,用1mol/L盐酸溶液调节pH值至8.1,加水稀释至100ml。
三羟甲基氨基甲烷缓冲液(pH9.0):取三羟甲基氨基甲烷6.06g,加盐酸赖氨酸3.65g,氯化钠5.8g,乙二胺四醋酸二钠0.37g,再加水溶解使成1000ml,调节pH值至9.0。
乌洛托品缓冲液:取乌洛托品75g,加水溶解后,加浓氨溶液4.2ml,再用水稀释至250ml。
巴比妥缓冲液(pH7.4):取巴比妥钠4.42g,加水使溶解并稀释至400ml,用2mol/L盐酸溶液调节pH 值至7.4,滤过。
巴比妥缓冲液(pH8.6):取巴比妥5.52g与巴比妥钠30.9g,加水使溶解成2000ml。
巴比妥-氯化钠缓冲液(pH7.8):取巴比妥钠5.05g,加氯化钠3.7g及水适量使溶解,另取明胶0.5g 加水适量,加热溶解后并入上述溶液中。
然后用0.2mol/L盐酸溶液调节pH值至7.8,再用水稀释至500ml。
甲酸钠缓冲液(pH3.3):取2mol/L甲酸溶液25ml,加酚酞指示液1滴,用2mol/L氢氧化钠溶液中和,再加入2mol/L甲酸溶液75ml,用水稀释至200ml,调节pH值至3.25~3.30。
邻苯二甲酸盐缓冲液(pH5.6):取邻苯二甲酸氢钾10g,加水900ml,搅拌使溶解,用氢氧化钠试液(必要时用稀盐酸)调节pH值至5.6,加水稀释至1000ml,混匀。
枸橼酸盐缓冲液:取枸橼酸4.2g,加1mol/L的20%乙醇制氢氧化钠溶液40ml使溶解,再用20%乙醇稀释至100ml。
常见缓冲溶液配制方法

常见缓冲溶液配制方法 Revised as of 23 November 2020常见缓冲溶液配制方法乙醇-醋酸铵缓冲液:取5mol/L醋酸溶液,加乙醇60ml和水20ml,用10mol/L 氢氧化铵溶液调节pH值至,用水稀释至1000ml。
三羟甲基氨基甲烷缓冲液:取三羟甲基氨基甲烷12.14g,加水800ml,搅拌溶解,并稀释至1000ml,用6mol/L盐酸溶液调节pH值至。
三羟甲基氨基甲烷缓冲液:取氯化钙0.294g,加L三羟甲基氨基甲烷溶液40ml 使溶解,用1mol/L盐酸溶液调节pH值至,加水稀释至100ml。
三羟甲基氨基甲烷缓冲液:取三羟甲基氨基甲烷6.06g,加盐酸赖氨酸3.65g,氯化钠5.8g,乙二胺四醋酸二钠0.37g,再加水溶解使成1000ml,调节pH值至。
乌洛托品缓冲液:取乌洛托品75g,加水溶解后,加浓氨溶液,再用水稀释至250ml。
巴比妥缓冲液:取巴比妥钠4.42g,加水使溶解并稀释至400ml,用2mol/L盐酸溶液调节pH值至,滤过。
巴比妥缓冲液:取巴比妥5.52g与巴比妥钠30.9g,加水使溶解成2000ml。
巴比妥-氯化钠缓冲液:取巴比妥钠5.05g,加氯化钠3.7g及水适量使溶解,另取明胶0.5g加水适量,加热溶解后并入上述溶液中。
然后用L盐酸溶液调节pH值至,再用水稀释至500ml。
甲酸钠缓冲液:取2mol/L甲酸溶液25ml,加酚酞指示液1滴,用2mol/L氢氧化钠溶液中和,再加入2mol/L甲酸溶液75ml,用水稀释至200ml,调节pH值至~。
邻苯二甲酸盐缓冲液:取邻苯二甲酸氢钾10g,加水900ml,搅拌使溶解,用氢氧化钠试液(必要时用稀盐酸)调节pH值至,加水稀释至1000ml,混匀。
枸橼酸盐缓冲液:取枸橼酸4.2g,加1mol/L的20%乙醇制氢氧化钠溶液40ml使溶解,再用20%乙醇稀释至100ml。
枸橼酸盐缓冲液:取%枸橼酸水溶液,用50%氢氧化钠溶液调节pH值至。
常用缓冲溶液的配制方法

常用缓冲溶液的配制方法缓冲溶液是一种能够稳定溶液酸碱度的溶液,是化学和生物学实验中必不可少的试剂。
它们能够在一定范围内抵抗外界酸碱变化,保持溶液的PH值稳定,从而确保实验结果的准确性和可重复性。
本文将介绍一些常用的缓冲溶液的配制方法。
一、醋酸酸钠缓冲溶液醋酸酸钠缓冲溶液适用于酸性条件下的实验。
它的PH值稳定在4.0左右,适用于生物学实验和某些化学分析。
配制方法:1.称取3.9克醋酸酸钠三水合物(CH3COONa·3H2O)并溶解在80毫升蒸馏水中。
2.加入相同质量的冰乙酸,溶解均匀。
3.用蒸馏水稀释至100毫升。
将溶液过滤或使用磁力搅拌器搅拌,使溶液变得均匀。
二、磷酸二氢钠/磷酸氢二钠缓冲溶液磷酸二氢钠/磷酸氢二钠缓冲溶液适用于酸性至中性条件下的实验。
它的PH值稳定在6.8-7.4范围内,适用于细胞培养和某些生物化学实验。
配制方法:1.称取磷酸二氢钠(NaH2PO4)7.5克并溶解在200毫升蒸馏水中。
2.用氢氧化钠(NaOH)溶液调节至PH值7.4。
3.将溶液稀释至250毫升。
使用磁力搅拌器搅拌溶液使其均匀。
三、碳酸氢钠/碳酸钠缓冲溶液碳酸氢钠/碳酸钠缓冲溶液适用于中性至碱性条件下的实验。
它的PH值稳定在9.6-11.0范围内,适用于某些酶反应和某些化学分析。
配制方法:1.称取2.54克碳酸氢钠(NaHCO3)和2.93克碳酸钠(Na2CO3)并溶解在200毫升蒸馏水中。
2.使用酚红指示剂滴定硫酸(H2SO4)溶液,直至PH值为10.0。
3.将溶液稀释至250毫升。
使用磁力搅拌器搅拌溶液使其均匀。
四、Tris缓冲溶液Tris缓冲溶液适用于酸性至中性条件下的实验。
它是一种常用的生物化学缓冲溶液,适用于DNA/RNA电泳和蛋白质电泳等实验。
配制方法:1.称取12.11克Tris氨基甲烷(Tris base)并溶解在800毫升蒸馏水中。
2.使用盐酸(HCl)溶液调节至PH值 7.4。
3.加入1克EDTA四钠盐并溶解。
常见缓冲溶液配制

实验室常用缓冲液配置方案1)1 M Tris-HCl (pH7.4, 7.6, 8.0)组份浓度:1 M Tris-HCl配制量:1 L配制方法:1. 称量121.1 g Tris置于1 L烧杯中。
2. 加入约800 ml的去离子水,充分搅拌溶解。
值。
4.将溶液定容至1 L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高1℃,溶液的pH值大约降低个单位。
2)10×TE Buffer (pH7.4, 7.6, 8.0)组份浓度:100 mM Tris-HCl, 10 mM EDTA配制量:1 L配制方法:2.向烧杯中加入约800 ml的去离子水,均匀混合。
3. 将溶液定容至1 L后,高温高压灭菌。
4. 室温保存。
3)1.5 M Tris-HCl (pH8.8)组份浓度:1.5 M Tris-HCl配制量:1 L配制方法:1. 称量181.7 g Tris置于1 L烧杯中。
2. 加入约800 ml的去离子水,充分搅拌溶解。
3. 用浓盐酸调节pH值至。
4. 将溶液定容至1 L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高1℃,溶液的pH值大约降低个单位。
4)3 M 醋酸钠(pH5.2)组份浓度:3M 醋酸钠配制量:100ml配制方法:1.称量40.8g NaAc·3H2O〔或者NaAc〕置于100-200ml烧杯中,加入月40ml的去离子水搅拌溶解2.加入冰醋酸调节pH值至5.23.加去离子水将溶液定容至100ml4高温高压灭菌后,室温保存。
5)PBS Buffer组份浓度:137 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4, 2 mM KH2PO4配制量:1 L配制方法:2.向烧杯中加入约800 ml的去离子水,充分搅拌溶解。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常用缓冲溶液的配制方法
1.甘氨酸–盐酸缓冲液(0.05mol/L)
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)
邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液
24
Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液
① 使用时可以每升中加入1克克酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶
液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L )
6872柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1
mol/L 溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L ) Na 2Ac·3H 2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。
7.磷酸盐缓冲液
242
Na2HPO4·12H2O分子量= 358.22,0.2 mol/L溶液为71.64克/升。
Na2HPO4·2H2O分子量= 156.03,0.2 mol/L溶液为31.21克/升。
(2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L)
242
KH2PO4分子量= 136.09,1/15M溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M)
9.巴比妥钠-盐酸缓冲液(18℃)
巴比妥钠盐分子量=206.18;0.04M溶液为8.25克/升
10.Tris–盐酸缓冲液(0.05M,25℃)
50毫升0.1M三羟甲基氨基甲烷(Tris)溶液与X毫升0.1N盐酸混匀后,加水稀释至100
C
HOCH2 NH2
分子量=121.14;
0.1M溶液为12.114克/升。
Tris溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
11.硼酸–硼砂缓冲液(0.2M硼酸根)
硼砂Na2B4O7·H2O,分子量=381.43;0.05M溶液(=0.2M硼酸根)含19.07克/升。
硼酸H2BO3,分子量=61.84,0.2M溶液为12.37克/升。
硼砂易失去结晶水,必须在带塞的瓶中保存。
硼砂Na2B4O7·10H2O,分子量=381.43;0.05M溶液(=0.2M硼酸根)含19.07克/升。
硼酸H2BO3,分子量=61.84, 0.2M溶液为12.37克/升。
硼砂易失去结晶水,必须在带塞的瓶中保存。
12.甘氨酸–氢氧化钠缓冲液(0.05M)
甘氨酸分子量=75.07;0.2M溶液含15.01克/升。
13.硼砂-氢氧化钠缓冲液(0.05M硼酸根)
硼砂Na2B4O7·10H2O,分子量=381.43;0.05M溶液为19.07克/升。
14.碳酸钠-碳酸氢钠缓冲液(0.1M)
2+、Mg2+存在时不得使用
222
N 2HCO 3分子量=84.0;0.1M 溶液为8.40克/升。
附录四 常用缓冲溶液的配制
(一)磷酸氢二钠-柠檬酸缓冲液 pH 0.2 mol/L Na2HPO4 (mL) 0.1 mol/L 柠檬酸 (mL) pH 0.2 mol/L Na2HPO4 (mL) 0.1 mol/L 柠檬酸 (mL) 2.2 2.4 2.6 2.8 3.0 3.2 3.4 3.6 3.8 4.0 4.2 4.4 4.6 4.8 5.0
0.40 1.24 2.18 3.17 4.11 4.94 5.70 6.44 7.10 7.71 8.28 8.82 9.35 9.86 10.30
19.60 18.76 17.82 16.83 15.89 15.06 14.30 13.56 12.90 12.29 11.72 11.18 10.65 10.14 9.70
5.2 5.4 5.6 5.8
6.0 6.2 6.4 6.6 6.8
7.0 7.2 7.4 7.6 7.8
8.0
10.72 11.15 11.60 12.09 12.63 13.22 13.85 14.55 15.45 16.47 17.39 18.17 18.73 19.15 19.45
9.28 8.85 8.40 7.91 7.37 6.78 6.15 5.45 4.55 3.53 2.61 1.83 1.27 0.85 0.55
Na2HPO4分子量=141.98;0.2 mol/L 溶液为28.40 g/L 。
Na2HPO4·2H2O 分子量=178.05;0.2 mol/L 溶液为35.61 g/L 。
Na2HPO4·12H2O 分子量=358.22;0.2 mol/L 溶液为71.64 g/L 。
C6H8O7·H2O 分子量=210.14;0.1 mol/L 溶液为21.01 g/L 。
(二)柠檬酸-柠檬酸钠缓冲液(0.1 mol/L )
柠檬酸:C6H8O7·H2O分子量=210.14 ;0.1 mol/L溶液为21.01 g/L。
柠檬酸钠:Na3C6H5O7·2H2O分子量=294.12 ;0.1 mol/L溶液为29.41 g/L。
(三)醋酸-醋酸钠缓冲液(0.2 mol/L)
NaAc·3H2O分子量=136.09;0.2 mol/L溶液为27.22 g/L。
冰乙酸11.8 mL稀释至1 L(需标定)。
(四)磷酸二氢钾-氢氧化钠缓冲液(0.05 mol/L)
(五)磷酸氢二钠-磷酸二氢钠缓冲液(0.2 mol/L)
Na2HPO4·2H2O分子量=178.05;0.2 mol/L溶液为35.61 g/L。
Na2HPO4·12H2O分子量=358.22;0.2 mol/L溶液为71.64 g/L。
NaH2PO4·H2O分子量=138.01;0.2 mol/L溶液为27.6 g/L。
NaH2PO4·2H2O分子量=156.03;0.2 mol/L溶液为31.21 g/L。
(六)巴比妥纳-盐酸缓冲液
巴比妥钠分子量=206.18;0.04 mol/L溶液为8.25 g/L。
(七)Tris-HCl缓冲液(0.05 mol/L)
Tris分子量=121.14 ;0.1 mol/L溶液为12.114 g/L。
Tris溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
(八)、硼酸-硼砂缓冲液(0.2 mol/L硼酸根)
硼砂:Na2B4O7
·10H2O 分子量=381.43;0.05 mol/L 溶液(等于0.2 mol/L 硼酸根)含19.07 g/L 。
硼酸:H3BO3分子量=61.84;0.2 mol/L 的溶液为12.37 g/L 。
硼砂易失去结晶水,必须在带塞的瓶中保存。
(九)硼砂-氢氧化纳缓冲液(0.05 mol/L 硼酸根)。
(十)碳酸钠-碳酸氢钠缓冲液(0.1 mol/L )(此缓冲液在Ca2+、Mg2+存在时不得使用).
Na2CO3·10H2O 分子量=286.2; 0.1 mol/L 溶液为28.62 g/L 。
NaHCO3分子量=84.0; 0.1 mol/L 溶液为8.40 g/L 。
