生物化学实验常用缓冲液的配制方法
硼酸硼砂缓冲液的配制

硼酸硼砂缓冲液的配制
硼酸硼砂缓冲液是一种常用的实验室缓冲液,用于维持溶液的酸碱度在一定范围内。
它主要由硼酸和硼砂的混合物组成,可以在生物化学实验、分子生物学实验等多个领域中广泛使用。
硼酸硼砂缓冲液的配制方法相对简单,以下是一种常见的配制方法:
材料:
- 硼酸 (H3BO3)
- 硼砂 (Na2B4O7·10H2O)
- 蒸馏水或去离子水
步骤:
1. 准备所需材料并确保所有材料都是干净的。
2. 称取适量的硼酸和硼砂。
缓冲液的酸碱度通常由硼酸与硼砂的比例来控制,常见的比例为1:1或4:1。
3. 将硼酸和硼砂分别加入两个不同的容器中。
4. 使用蒸馏水或去离子水将硼酸和硼砂溶解,搅拌溶解直至完全溶解。
5. 将硼酸溶液和硼砂溶液混合在一起,并搅拌均匀。
6. 使用酸碱度计检测溶液的酸碱度,如果需要调整pH值,可以使用酸或碱来进行调节。
7. 最后,将缓冲液转移到一个干净的容器中,并密封保存。
需要注意的是,硼酸硼砂缓冲液的配制过程中要注意实验室安全操作,避免溅出或接触皮肤和眼睛。
此外,配制的缓冲液应尽快使用或在冷藏条件下保存,以确保其稳定性和有效性。
硼酸硼砂缓冲液的pH范围通常在7.0至9.0之间,可根据实际需要
进行调整。
它在许多实验中被用作DNA和RNA的电泳缓冲液、蛋白质分析缓冲液等,其缓冲效果稳定可靠。
总之,硼酸硼砂缓冲液的配制相对简单,但在实验中起到重要的作用。
正确配制并使用该缓冲液可有效维持溶液的酸碱度,确保实验结果的准确性和可重复性。
生物实验中常见buffer的配制
常用缓冲溶液配置方法常用缓冲溶液得配制方法1.甘氨酸–盐酸缓冲液(0、05mol/L)X甘氨酸分子量= 75、07,0、2 mol/L甘氨酸溶液含15、01克/升。
2.邻苯二甲酸–盐酸缓冲液(0、05 mol/L)X邻苯二甲酸氢钾分子量= 204、23,0、2 mol/L邻苯二甲酸氢溶液含40、85克/升Na2HPO4分子量= 14、98,0、2 mol/L溶液为28、40克/升。
Na2HPO4-2H2O分子量= 178、05,0、2 mol/L溶液含35、01克/升。
C4H2O7·H2O分子量= 210、14,0、1 mol/L溶液为21、01克/升。
4①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
②5柠檬酸C6H8O7·H2O:分子量210、14,0、1 mol/L溶液为21、01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294、12,0、1 mol/L溶液为29、41克/毫升。
6.乙酸–乙酸钠缓冲液(0、2 mol/L)Na2Ac·3H2O分子量= 136、09,0、2 mol/L溶液为27、22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0、2)Na2HPO4·2H2O分子量= 178、05,0、2 mol/L溶液为85、61克/升。
Na2HPO4·2H2O分子量= 358、22,0、2 mol/L溶液为71、64克/升。
Na2HPO4·2H2O分子量= 156、03,0、2 mol/L溶液为31、21克/升。
(2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L)Na2HPO4·2H2O分子量= 178、05,1/15M溶液为11、876克/升。
KH2PO4分子量= 136、09,1/15M溶液为9、078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0、05M)X巴比妥钠盐分子量=206、18;0、04M溶液为8、25克/升10.Tris–盐酸缓冲液(0、05M,25℃)50毫升0、1M三羟甲基氨基甲烷(Tris)溶液与X毫升0、1N盐酸混匀后,加水稀释至100毫升。
实验常用试剂缓冲液的配制方法

实验常用试剂缓冲液的配制方法
一、常用试剂和试剂配置
1、氯仿。
将1L 99.7%纯度的氯仿加入水中,调节pH值至7.4,溶解
即可得到0.5mol/L的氯仿溶液。
2、二氧化碳水。
将100mL弱碳酸氢氧化钠溶液(NaHCO3,0.5mol/L)加入1L水中,经过气泡交换,可制得CO2水。
3、磷酸盐缓冲液。
将200mL磷酸盐溶液(K2HPO4,0.5mol/L)加入800mL水中,调节pH值至7.2,搅拌均匀,即可得到0.2mol/L磷酸盐缓
冲液。
4、EDTA标准溶液。
将25.0g EDTA·4Na(C10H14N2O8Na2)加入
1000mL水中,热溶解,调节pH值至7.0,搅拌均匀,得到0.2mol/LEDTA
标准溶液。
5、肌酐标准溶液。
将10.0g肌酐(C10H13N3O8)=14.2H2O)加入
1000mL的水中,搅拌,调节pH值至7.4,搅拌均匀,即可得到0.1mol/L
的肌酐标准溶液。
二、缓冲液的配置
1、弱酸缓冲液。
将3.0mL 0.2mol/L磷酸钠溶液(Na2HPO4)加入到
97mL 0.2mol/L磷酸钙溶液(Ca(H2PO4)2)中,搅拌均匀,即可得到
0.2mol/L的弱酸缓冲液。
2、弱碱缓冲液。
将3.0mL 0.2mol/L磷酸氢氧化钠溶液(NaH2PO4)
加入到97mL 0.2mol/L碳酸氢钙溶液(Ca(HCO3)2)中,搅拌均匀,即可
得到0.2mol/L的弱碱缓冲液。
3、弱盐缓冲液。
2m-kci标准缓冲液的配制

2m-kci标准缓冲液的配制一、概述缓冲液是实验室常用的一种溶液,它可以帮助维持溶液的pH值,从而稳定化学反应的环境。
2m-kci标准缓冲液是一种常用的缓冲液,在生物化学实验中广泛应用。
本文将介绍2m-kci标准缓冲液的配制方法,希望可以帮助读者正确、高效地配制这种缓冲液。
二、材料准备1. 氯化钾(KCl)固体2. 纯水三、配制步骤1. 称取氯化钾固体:根据需要配制的缓冲液总体积,计算所需的氯化钾固体质量。
一般来说,2m-kci标准缓冲液的配制中,需要将氯化钾固体溶解在纯水中,配制成最终浓度为2m的缓冲液。
2. 溶解氯化钾固体:取一定容器,如烧杯或烧瓶,加入适量的纯水,用磁力搅拌器或振荡器将水搅动。
将称取好的氯化钾固体缓慢添加到搅拌的水中,直至氯化钾完全溶解。
3. 调整总体积:在氯化钾全部溶解后,继续加入适量的纯水,使最终的缓冲液体积达到所需的总体积。
4. 搅拌均匀:在调整好总体积后,用搅拌器或振荡器再次充分搅拌缓冲液,确保氯化钾的溶解和溶液的均匀混合。
四、注意事项1. 安全操作:在配制缓冲液的过程中,要注意化学品的安全操作,避免接触皮肤和吸入气体,避免化学品的飞溅。
2. 搅拌均匀:搅拌过程十分重要,确保氯化钾充分溶解,并且溶液充分均匀混合,以保证配制出来的缓冲液浓度均匀。
3. 存储条件:配制好的2m-kci标准缓冲液,需要储存在阴凉、干燥的地方,避免阳光直射或高温环境。
五、总结2m-kci标准缓冲液的配制是实验室常见的操作步骤,正确的配制方法能够保证溶液的质量和浓度,从而保证实验结果的准确性。
希望本文介绍的配制方法能够帮助读者正确、高效地配制2m-kci标准缓冲液。
六、实验应用1. 生物化学实验中的应用:2m-kci标准缓冲液在生物化学实验中有着广泛的应用,例如在蛋白质电泳实验中,用作电泳缓冲液,维持电泳系统中的pH稳定性;在酶动力学实验中,用作酶反应的缓冲液,帮助研究酶在不同pH条件下的活性变化。
生物化学常用缓冲液

生物化学常用缓冲液⑴ 磷酸盐缓冲液磷酸盐是生物化学研究中使用最广泛的一种缓冲剂,由於它们是二级解离,有二个pKa值,所以用它们配制的缓冲液,pH范围最宽:NaH2PO4: pKa1=2.12, pKa2=7.21Na2HPO4: pKa1=7.21, pKa2=12.32配酸性缓冲液:用 NaH2PO4,pH=1~4,配中性缓冲液:用混合的两种磷酸盐,pH=6~8,配碱性缓冲液:用 Na2HPO4,pH=10~12。
用钾盐比钠盐好,因为低温时钠盐难溶,钾盐易溶,但若配制SDS-聚丙烯酰胺凝胶电泳的缓冲液时,只能用磷酸钠而不能用磷酸钾,因为SDS(十二烷基硫酸钠)会与钾盐生成难溶的十二烷基硫酸钾。
磷酸盐缓冲液的优点为:①容易配制成各种浓度的缓冲液;②适用的pH 范围宽;③pH受温度的影响小;④缓冲液稀释后pH变化小,如稀释十倍后pH的变化小于0.1。
其缺点为:①易与常见的钙Ca++离子、镁Mg++离子以及重金属离子缔合生成沉淀;②会抑制某些生物化学过程,如对某些酶的催化作用会产生某种程度的抑制作用。
⑵Tris(三羟甲基氨基甲烷,N-Tris(hydroxymethyl)aminomethane)缓冲液Tris缓冲液在生物化学研究中使用的越来越多,有超过磷酸盐缓冲液的趋势,如在SDS-聚丙烯酰胺凝胶电泳中已都使用Tris缓冲液,而很少再用磷酸盐。
Tris缓冲液的常用有效pH范围是在“中性”范围,例如:Tris-HCl缓冲液: pH=7.5~8.5Tris-磷酸盐缓冲液: pH=5.0~9.0配制常用的缓冲液的方法有两种:①按书后附录中所列该缓冲液表中的方法,分别配制0.05mol/L Tris和0.05mol/L HCl溶液,然后按表中所列体积混合。
由于标准浓度的稀盐酸不易配制,所以常用另一种方法;②若配1L0.1mol/L的Tris-HCl缓冲液:先称12.11g Tris碱溶于950mL~970mL 无离子水中,边搅拌边滴加4N HCl,用pH计测定溶液pH值至所需的pH值,然后再加水补足到1L。
常见缓冲溶液配制方法

常见缓冲溶液配制方法1.醋酸钠/醋酸酸性缓冲液醋酸钠/醋酸酸性缓冲液适用于pH范围为4.0-6.0的实验。
配制方法如下:- 准备质量浓度为0.1mol/L的醋酸钠溶液和0.1mol/L的醋酸溶液。
-根据所需pH值,按照相应的比例混合醋酸钠溶液和醋酸溶液即可。
2.磷酸/盐酸性缓冲液磷酸/盐酸性缓冲液适用于pH范围为1.0-3.0的实验。
配制方法如下:- 准备0.2mol/L的盐酸溶液。
- 准备分别为0.2mol/L和0.1mol/L的磷酸溶液。
-具体配制时,根据所需pH值,按照相应的比例混合盐酸溶液和磷酸溶液即可。
3.磷酸/氢磷酸二盐酸性缓冲液磷酸/氢磷酸二盐酸性缓冲液适用于pH范围为2.0-7.0的实验。
配制方法如下:- 准备0.2mol/L的盐酸溶液。
- 准备分别为0.2mol/L、0.1mol/L和0.05mol/L的氢磷酸二盐溶液。
-具体配制时,根据所需pH值,按照相应的比例混合盐酸溶液和氢磷酸二盐溶液即可。
4.磷酸盐缓冲液磷酸盐缓冲液适用于pH范围为5.0-8.0的实验。
配制方法如下:- 准备分别为0.2mol/L的梯度磷酸盐溶液。
-根据所需pH值,按照相应的比例混合相应浓度的磷酸盐溶液即可。
5.三氯乙酸/三氯乙酸钠酸性缓冲液三氯乙酸/三氯乙酸钠酸性缓冲液适用于pH范围为3.0-4.6的实验。
配制方法如下:- 准备质量浓度为0.2mol/L的三氯乙酸钠溶液和0.2mol/L的三氯乙酸溶液。
-根据所需pH值,按照相应的比例混合三氯乙酸钠溶液和三氯乙酸溶液即可。
以上是一些常见的缓冲溶液配制方法,具体的配制过程可能会因实验需求和具体试剂而略有不同。
在配制缓冲溶液时,一定要注意使用高纯度的试剂,并按照配制方法进行准确的实验操作。
生物实验中常见buffer的配制

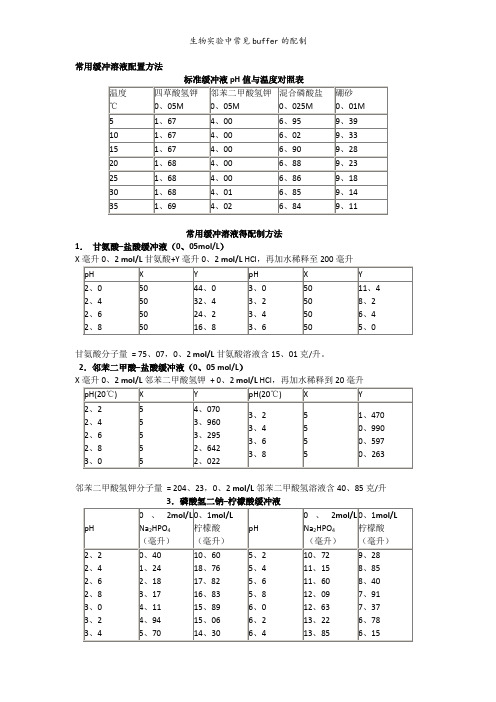
常用缓冲溶液配置方法标准缓冲液pH值与温度对照表常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(L)X毫升 mol/L甘氨酸+Y毫升 mol/L HCI,再加水稀释至200毫升甘氨酸分子量 = , mol/L甘氨酸溶液含克/升。
2.邻苯二甲酸–盐酸缓冲液( mol/L)X毫升 mol/L邻苯二甲酸氢钾 + mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量 = , mol/L邻苯二甲酸氢溶液含克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量 = , mol/L溶液为克/升。
Na2HPO4-2H2O分子量 = , mol/L溶液含克/升。
C4H2O7·H2O分子量 = , mol/L溶液为克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
②5.柠檬酸–柠檬酸钠缓冲液( mol/L)柠檬酸C6H8O7·H2O:分子量, mol/L溶液为克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量, mol/L溶液为克/毫升。
6.乙酸–乙酸钠缓冲液( mol/L)Na2Ac·3H2O分子量 = , mol/L溶液为克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液()Na2HPO4·2H2O分子量 = , mol/L溶液为克/升。
Na2HPO4·2H2O分子量 = , mol/L溶液为克/升。
Na2HPO4·2H2O分子量 = , mol/L溶液为克/升。
(2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L)1M溶液为克/升。
Tris溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
11.硼酸–硼砂缓冲液(硼酸根)硼砂Na2B4O7·H2O,分子量=;溶液(=硼酸根)含克/升。
硼酸H2BO3,分子量=,溶液为克/升。
ph5.5的乙酸乙酸钠缓冲液的配制方法

标题:ph5.5的乙酸乙酸钠缓冲液的配制方法一、概述在生物化学和生物实验中,常常需要使用缓冲液来稳定溶液的pH值,使实验条件更加稳定。
乙酸乙酸钠缓冲液是一种常用的缓冲液之一,其pH值通常在4.5-5.5之间。
在本文中,我们将介绍如何配制pH5.5的乙酸乙酸钠缓冲液,希望能为实验工作者提供帮助。
二、准备工作1. 实验室天平2. 蒸馏水3. 乙酸(冰乙酸)4. 碳酸钠5. 磁力搅拌器6. 磁力搅拌棒7. pH计8. 10mL、50mL和100mL三种容量瓶9. 烧杯10. 称量瓶三、配制步骤1. 计算所需物质的量根据所需制备的缓冲液体积和配制所需pH值,使用韦恩图(Henderson-Hasselbalch equation)计算所需的乙酸和乙酸钠的量。
具体计算公式如下:(1)乙酸的质量 = C1*V1*M1其中,C1为所需乙酸的浓度(mol/L),V1为所需溶液的体积(L),M1为乙酸的摩尔质量(g/mol)。
(2)乙酸钠的质量 = C2*V2*M2其中,C2为所需乙酸钠的浓度(mol/L),V2为所需溶液的体积(L),M2为乙酸钠的摩尔质量(g/mol)。
2. 称量乙酸使用天平称量所需的乙酸,并加入10mL容量瓶中。
3. 称量乙酸钠使用天平称量所需的乙酸钠,并加入10mL容量瓶中。
4. 添加蒸馏水分别向乙酸和乙酸钠中加入蒸馏水,使体积达到10mL,摇匀溶解。
5. 调整pH值使用pH计检测溶液的pH值,若不足5.5,逐滴加入盐酸或氢氧化钠调节pH值至所需的5.5。
6. 验证溶液验证调节后的溶液pH值是否达到5.5,确认无误后,将溶液转移到50mL容量瓶中。
7. 验证溶液浓度使用浓度计或pH计验证缓冲液的浓度是否符合预期。
8. 校正体积如有必要,校正缓冲液的体积,使其达到预期的体积。
9. 放置将制备好的缓冲液储存在干燥、阴凉的地方,避免阳光直射。
四、注意事项1. 乙酸和乙酸钠均为腐蚀性物质,使用时需戴手套、护目镜等防护设备。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
生物化学实验常用缓冲液的配制方法1、0.2mol/L 磷酸缓冲液 *组份浓度0.2mol/L (pH 6.0)*配制量1L*配置方法 1. 称取磷酸氢二钠.12水8.82 g。
2. 称取磷酸二氢钠.2水27.34g。
3. 用去离子水溶解并定容至1L。
室温保存。
注意:此为母液,使用时稀释40倍使用。
2、洗脱液*组份浓度0.15mol/L (含0.15mol/L 氯化钠的0.005mol/L pH 6.0的磷酸缓冲液)*配制量10L*配置方法 1.称取氯化钠87.66g。
2.用0.2mol/L pH6.0的磷酸缓冲液250mL溶解。
3.用去离子水稀释至10L。
室温保存。
3、0.3mol/L 磷酸缓冲液*组份浓度0.3mol/L (pH7.8)*配制量0.5L*配置方法 1.准确称取磷酸氢二钠.12水49.150g。
2.磷酸二氢钠.2水2.000g。
3.用去离子水溶解并定容至0.5L。
室温保存。
注意:此为母液,使用时稀释10 倍使用。
4、0.2mol/L 乙酸缓冲液*组份浓度0.2mol/L (pH4.6)*配制量2L*配置方法 1.准确称取乙酸钠.3水54.44g。
2.加入23mL冰乙酸,溶解。
3.用去离子水溶解并定容至2L。
4℃保存。
5、0.2mol/L 磷酸-柠檬酸缓冲液(pH 2.6、4.6、6.6)*组份浓度0.2mol/L *配制量各1L*配置方法 1.母液A(0.2mol/L 的Na2HPO4溶液):称取Na2HPO4.12 水143.256g,用去离子水定容至2L。
2.母液B(0.1mol/L 的柠檬酸溶液):称取柠檬酸.1水42.028g 用去离子水溶解定容至2L。
3. pH2.6、4.6、6.6的三种缓冲液如下表配制:pH值A(mL)B(mL)2.6 109.0 891.04.6 467.5 532.56.6 727.5 272.54.按上表混匀后,4℃保存。
6、20×SSC 缓冲液*配制量1L(pH7.0)*配置方法 1.准确称取175.2g氯化钠。
2.准确称取88.2g柠檬酸钠.2水。
3.溶解于800mL去离子水中。
4.加入数滴10mol/L 氢氧化钠溶液调节pH值至7.0。
5.加去离子水定容至1L。
注意:按实验需要可分装后高压灭菌。
10×SSC、5×SSC、1×SSC 可由20×SSC做相应稀释得到。
7、0.15mol/L 氯化钠-乙二胺四乙酸二钠缓冲液(pH8.0)*组份浓度0.15mol/L *配制量1L*配置方法 1.准确称取氯化钠8.77g。
2.称取乙二胺四乙酸二钠37.2g。
3.溶于800mL去离子水中。
4.用固体的氢氧化钠调pH 值为8.0。
5.加去离子水定容至1L。
8、1/15mol/L 的磷酸盐缓冲液(pH7.6)*组份浓度0.15mol/L *配制量1L*配置方法 1.溶液甲(1/15mol/L 的KH2PO4溶液):称取KH2PO49.078g,用去离子水溶解定容至1L。
2.溶液乙(1/15mol/L 的Na2HPO4溶液):称取Na2HPO4. 2水11.876g(或磷酸氢二钠.12水23.894g)用去离子水溶解定容至1L。
3.pH7.6磷酸盐缓冲液:将①和②按1.4:8.6比例混合即可。
9、5×TrisGlycineBuffer (SDSPAGE电泳缓冲液)*组份浓度0.125M Tris,1.25M Glycine,0.5%(w/v)SDS *配制量1L*配置方法 1.称取下列试剂,置于1L烧杯中。
Tris 15.1gGlycine 94gSDS 5.0g2.加入约800mL的去离子水,搅拌溶解。
3.加去离子水将溶液定容至1L后,室温保存。
10、5×SDSPAGE Loading Buffer *组份浓度250mM TrisHCl(pH6.8)10%(W/V)SDS0.5%(W/V)BPB50%(V/V)甘油5%(W/V)β巯基乙醇*配制量5mL*配置方法 1.量取下列试剂,置于10mL塑料离心管中。
1M TrisHCl1.25mLSDS 0.5gBPB 25mg甘油2.5mL2.加入去离子水溶解后定容至5mL。
3.小份(500μl/份)分装后,于室温保存。
4.使用前将25μl的2-ME加到每小份中。
5.加入2M-E的LoadingBuffer可在室温下保存一个月左右1、1M TrisHCl * 组份浓度1M TrisHCl (pH7.4,7.6,8.0) * 配制量1L* 配置方法 1.称量121.1gTris置于1L烧杯中。
2.加入约800mL的去离子水,充分搅拌溶解。
3.按下表量加入浓盐酸调节所需要的pH 值。
pH值浓HCl 7.4 约70mL7.6 约60mL8.0 约42mL4.将溶解定容至1L。
5.高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
2、1.5M TrisHCl *组份浓度1.5M TrisHCl (pH8.8)*配制量1L*配置方法 1.称取181.7gTris置于1L烧杯中。
2.加入约800mL的去离子水,充分搅拌溶解。
3.用浓盐酸调pH 值至8.8。
4.将溶液定容至1L。
5.高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
3、10×TE Buffer *组份浓度100 mM TrisHCl,10 mM EDTA (pH 7.4,7.6,8.0)*配制量1L*配置方法 1.量取下列溶液,置于1L烧杯中。
1M TrisHClBuffer(pH7.4,7.6,8.0)100mL500 mM EDTA(pH8.0)20mL2.向烧杯中加入约800mL的去离子水,均匀混合。
3.将溶液定至1L后,高温高压灭菌。
4.室温保存。
4、3 M 醋酸钠*组份浓度3M 醋酸钠(pH5.2)*配制量100mL*配置方法 1.称取40.8gNaOAc.3H2O置于100~200mL烧杯中,加入约40mL的去离子水搅拌溶解。
2.加入冰乙酸调节pH值至5.2。
3.加入去离子水将溶液定容至100mL。
4.高温高压灭菌后,室温保存。
5、PBSBuffer *组份浓度137mM NaCl,2.7mM KCl,10 mM Na2HPO4,2 mM KH2PO4 *配制量1L*配置方法 1.称量下列试剂,置于1L烧杯中。
NaCl 8 gKCl 0.2gNa2HPO4 1.42 gKH2PO4 0.27g2.向烧杯中加入约800mL的去离子水,充分搅拌溶解。
3.滴加HCl将pH 值调节至7.4,然后加入去离子水将溶液定容至1L。
4.高温高压灭菌后,室温保存。
注意:上述PBS Buffer中无二价阳离子,如需要,可在配方中补充1mM CaCl2 和0.5mM MgCl2。
6、10 M 醋酸铵*组份浓度10M 醋酸铵*配制量100mL*配置方法 1.称量77.1g 醋酸铵置于100~200 mL烧杯中,加入约30mL的去离子水搅拌溶解。
2.加去离子水将溶液定容至100mL。
3.使用0.22μm滤膜过滤除菌。
4.密封瓶口于室温保存。
注意:醋酸铵受热易分解,所以不能高温高压灭菌。
7、TrisHCl平衡苯酚*配置方法 1.使用原料:大多数市售液化苯酚是清亮无色的,无需重蒸馏便可用于分子生物学实验。
但有些液化苯酚呈粉红色或黄色,应避免使用。
同时也应避免使用结晶苯酚,结晶苯酚必须在160℃对其进行重蒸馏除去诸如醌等氧化产物,这些氧化产物可引起磷酸二酯键的断裂或导致RNA和DNA的交联等。
因此,苯酚的质量对DNA、RNA的提取极为重要,我们推荐使用高质量的苯酚进行分子生物学实验。
2.操作注意:苯酚腐蚀性极强,并可引起严重灼伤,操作时应戴手套及防护镜等。
所有操作均应在通风橱中进行,与苯酚接触过的皮肤部位应用大量水清洗,并用肥皂和水洗涤,忌用乙醇。
3.苯酚平衡:因为在酸性pH条件下DNA分配于有机相,因此使用苯酚前必须对苯酚进行平衡使其pH值达到7.8以上,苯酚平衡操作方法如下:①液化苯酚应贮存于20℃,此时的苯酚呈现结晶状态。
从冰柜中取出的苯酚首先在室温下放置使其达到室温,然后在68℃水浴中使苯酚充分溶解。
②加入羟基喹啉(8Quinolinol)至终浓度0.1%。
该化合物是一种还原剂、RNA酶的不完全抑制剂及金属离子的弱螯合剂,同时因其呈黄色。
有助于方便识别有机相。
③加入等体积的1M TrisHCl(pH8.0),使用磁力搅拌器搅拌15分钟,静置使其充分分层后,除去上层水相。
④重复操作步骤③。
⑤加入等体积的0.1M TrisHCl(pH8.0),使用磁力搅拌器搅拌15分钟,静置使其充分分层后,除去上层水相。
⑥重复操作步骤⑤,稍微残留部分上层水相。
⑦使用pH试纸确认有机相的pH值大于7.8。
⑧将苯酚置于棕色玻璃瓶中4℃避光保存。
8、苯酚/氯仿/异戊醇*配置方法 1.说明:从核酸样品中除去蛋白质时常常使用苯/酚/氯仿/异戊醇(25:24:1)。
氯仿可使蛋白质变性并有助于液相与有机相的分离,而异戊醇则有助于消除抽提过程中出现的气泡。
2.配置方法:将TrisHCl平衡苯酚与等体积的氯仿/异戊醇(24:1)均匀混合后,移入棕色玻璃瓶中4℃保存。
9、10%(W/V)SDS *组份浓度10%(W/V)SDS *配制量100mL*配置方法 1.称量10g高纯度的SDS 置于100~200mL烧杯中,加入约80mL 的去离子水,68℃加热溶解。
2.滴加数滴浓盐酸调节pH值至7.2。
3.将溶液定容至100mL后,室温保存。
10、2 N NaOH *组份浓度2N NaOH *配制量100mL*配置方法 1.量取80mL去离子水置于100~200mL塑料烧杯中(NaOH溶解过程中大量放热,有可能使玻璃烧杯炸裂)。
2.称取8g NaOH 小心地逐渐加入到烧杯中,边加边搅拌。
3.待NaOH完全溶解后,用去离子水将溶液体积定容至100mL。
4.将溶液转移至塑料容器中后,室温保存。
11、2.5N HCl *组份浓度2.5 N HCl *配制量100mL*配置方法 1.在78.4mL的去离子水中加入21.6mL的浓盐酸(11.6N),均匀混合。
2.室温保存。
12、5 M NaCl *组份浓度5M NaCl *配制量1L*配置方法 1.称取292.2gNaCl置于1L烧杯中,加入约800mL的去离子水后搅拌溶解。
2.加去离子水将溶液定容至1L后,适量分成小份。
