各种缓冲液配制方法
各种缓冲液的配制方法
1.甘氨酸–盐酸缓冲液(0.05mol/L)2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)24Na2HPO4-2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
②687·H2柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L溶液为29.41克/毫升。
7.磷酸盐缓冲液24·2H 2Na 2HPO 4·2H 2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。
Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
24·2H 2KH 2PO 4分子量 = 136.09,1/15M 溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M )10.Tris –盐酸缓冲液(0.05M ,25℃)C HOCH2NH2 分子量=121.14;0. 1M 溶液为12.114克/升。
Tris 溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
247·H 2硼酸H 2BO 3,分子量=61.84,0.2M 溶液为12.37克/升。
硼砂易失去结晶水,必须在带塞的瓶中保存。
247·10H 2硼酸H 2BO 3,分子量=61.84, 0.2M 溶液为12.37克/升。
硼砂 易失去结晶水,必须在带塞的瓶中保存。
12.甘氨酸–氢氧化钠缓冲液(0.05M )13.硼砂-氢氧化钠缓冲液(0.05M 硼酸根)247·10H 214.碳酸钠-碳酸氢钠缓冲液(0.1M ) 2+2+22·10H 2。
常见缓冲液配制方法

常见缓冲液配制方法
一、介绍
缓冲液是常见的生物或化学反应的催化剂,主要用于维持反应物的酸
碱度在一定的范围内,有利于提高反应效率。
缓冲液有许多种,其配制方
法也多种多样。
下面将介绍常见缓冲液的配制方法,包括常用缓冲液的配
制方法,复合缓冲液的配制方法,以及常见的国际标准缓冲液的配制方法。
二、常用缓冲液的配制方法
1、磷酸缓冲液的配制
磷酸缓冲液是常用的酸性缓冲液,可以根据需要使用不同浓度的磷酸
来配制。
比如,将0.2mol/L的磷酸钠和0.2mol/L的磷酸氢钠混合,可以
得到一种磷酸缓冲液,其碱度为pH7.0。
同样,如果需要制备一种低碱度
的磷酸缓冲液,可以将3mol/L的磷酸钠和3mol/L的磷酸氢钠混合,以得
到其pH值为2.12的缓冲液。
2、碳酸缓冲液配制
碳酸缓冲液是常用的酸性缓冲液,可以根据需要使用不同浓度的碳酸
氢钠来配制。
比如,将0.2mol/L碳酸氢钠和0.2mol/L碳酸钠混合,可以
得到一种碳酸缓冲液,其碱度为pH7.0。
同样,如果需要制备一种低碱度
的碳酸缓冲液,可以将3mol/L碳酸氢钠和3mol/L碳酸钠混合,以得到其pH值为2.12的缓冲液。
3、氨水缓冲液配制
氨水缓冲液是常用的碱性缓冲液。
各种缓冲液的配制方法_

各种缓冲液的配制方法Na2HPO4-柠檬酸钠缓冲液24。
2柠檬酸. H2O,分子量=210.14 0.1mol/L溶液含21.01g/L2柠檬酸钠. 2H2O,分子量=294.12;0.1mol/L溶液含29.4 g/LNaAC.3 H2O,分子量=136.09 0.2mol/L溶液含27.22g/L(1)醋酸盐溶液的配制:醋酸-醋酸钠缓冲液(pH3.6)取醋酸钠5.1g,加冰醋酸20ml,再加水稀释至250ml,即得。
醋酸-醋酸钠缓冲液(pH3.7)取无水醋酸钠20g,加水300ml溶解后,加溴酚蓝指示液1ml及冰醋酸60~80ml,至溶液从蓝色转变为纯绿色,再加水稀释至1000ml,即得。
醋酸-醋酸钠缓冲液(pH3.8)取2mol/L醋酸钠溶液13ml与2mol/L醋酸溶液87ml,加每1ml含铜1mg的硫酸铜溶液0.5ml,再加水稀释至1000ml,即得。
醋酸-醋酸钠缓冲液(pH4.5)取醋酸钠18g,加冰醋酸9.8ml,再加水稀释至1000ml,即得。
醋酸-醋酸钠缓冲液(pH4.6)取醋酸钠5.4g,加水50ml使溶解,用冰醋酸调节pH值至4.6,再加水稀释至100ml,即得。
醋酸-醋酸钠缓冲液(pH6.0)取醋酸钠54.6g,加1mol/L醋酸溶液20ml溶解后,加水稀释至500ml,即得。
用醋酸和醋酸钠配制的缓冲溶液的PH=PKa+lg[C(NaAc)/C(HAc)](在此,C(HAc)指醋酸的浓度,C(NaAc)指醋酸钠的浓度,Ka是醋酸的解离常数=1.8*10-5(1.8乘10的-5次方),PKa=-lgKa=4.75,将PH=5.5代入,可得C(NaAc)/C(HAc)=5.6 通常我们配制时会使C(HAc)=0.1mol/L,或是C(HAc)=0.2mol/L等。
若是配制C(HAc)=0.1mol/L,则C(NaAc)=0.56mol/L 称量醋酸钠固体质量为82*0.56=46克量取冰醋酸体积为0.1*1000/17.5=5.7mL。
各种缓冲液的配制方法

各种缓冲液的配制方法缓冲液(Buffer)在生物化学和分子生物学实验中起到了至关重要的作用,它可以维持溶液的稳定性,调节pH值,同时还提供所需的离子环境。
这是一个关于不同类型缓冲液的配制方法的综合指南。
1. Tris缓冲液Tris缓冲液是实验室中最常用的缓冲液之一、以下是Tris缓冲液的配制方法:- 配制0.1 M Tris缓冲液(pH 7.4):a. 在100 mL去离子水中加入12.11 g Tris(Tris(hydroxymethyl)aminomethane)粉末。
b.用盖住容器的滤纸纸带覆盖容器,并将其放在磁力搅拌器上。
c.用盖住容器的锡纸覆盖容器,加热至溶解。
搅拌以加速溶解过程。
d.继续搅拌,使其冷却至室温。
e.使用0.1MHCl或0.1MNaOH调节pH值至7.4,直到所需的pH值稳定。
f.用去离子水稀释至总体积100mL。
2.PBS缓冲液PBS缓冲液是生物学实验中常用的缓冲液之一、以下是PBS缓冲液的配制方法:-配制10×PBS缓冲液:a.在1L去离子水中加入80gNaCl,2gKCl,14.4gNa2HPO4,2.4gKH2PO4b.使用10MNaOH或10MHCl调节pH值至7.4c.用去离子水稀释至总体积1L。
-配制1×PBS缓冲液:a.取10×PBS缓冲液100mL,用去离子水稀释至总体积1L。
3.TAE缓冲液TAE缓冲液常用于琼脂糖凝胶电泳。
以下是TAE缓冲液的配制方法:-配制50×TAE缓冲液:a. 在1 L去离子水中加入242 g Tris base,57.1 mL 0.5 M EDTA,100 mL冰醋酸。
b.用10MNaOH或10MHCl调节pH值至8.3c.用去离子水稀释至总体积1L。
-配制1×TAE缓冲液:a.取50×TAE缓冲液20mL,用去离子水稀释至总体积1L。
4. Tris-HCl缓冲液Tris-HCl缓冲液常用于DNA或RNA的酶切反应。
常见缓冲溶液配制方法

常见缓冲溶液配制方法1.醋酸钠/醋酸酸性缓冲液醋酸钠/醋酸酸性缓冲液适用于pH范围为4.0-6.0的实验。
配制方法如下:- 准备质量浓度为0.1mol/L的醋酸钠溶液和0.1mol/L的醋酸溶液。
-根据所需pH值,按照相应的比例混合醋酸钠溶液和醋酸溶液即可。
2.磷酸/盐酸性缓冲液磷酸/盐酸性缓冲液适用于pH范围为1.0-3.0的实验。
配制方法如下:- 准备0.2mol/L的盐酸溶液。
- 准备分别为0.2mol/L和0.1mol/L的磷酸溶液。
-具体配制时,根据所需pH值,按照相应的比例混合盐酸溶液和磷酸溶液即可。
3.磷酸/氢磷酸二盐酸性缓冲液磷酸/氢磷酸二盐酸性缓冲液适用于pH范围为2.0-7.0的实验。
配制方法如下:- 准备0.2mol/L的盐酸溶液。
- 准备分别为0.2mol/L、0.1mol/L和0.05mol/L的氢磷酸二盐溶液。
-具体配制时,根据所需pH值,按照相应的比例混合盐酸溶液和氢磷酸二盐溶液即可。
4.磷酸盐缓冲液磷酸盐缓冲液适用于pH范围为5.0-8.0的实验。
配制方法如下:- 准备分别为0.2mol/L的梯度磷酸盐溶液。
-根据所需pH值,按照相应的比例混合相应浓度的磷酸盐溶液即可。
5.三氯乙酸/三氯乙酸钠酸性缓冲液三氯乙酸/三氯乙酸钠酸性缓冲液适用于pH范围为3.0-4.6的实验。
配制方法如下:- 准备质量浓度为0.2mol/L的三氯乙酸钠溶液和0.2mol/L的三氯乙酸溶液。
-根据所需pH值,按照相应的比例混合三氯乙酸钠溶液和三氯乙酸溶液即可。
以上是一些常见的缓冲溶液配制方法,具体的配制过程可能会因实验需求和具体试剂而略有不同。
在配制缓冲溶液时,一定要注意使用高纯度的试剂,并按照配制方法进行准确的实验操作。
常见缓冲液的配制

常见缓冲液的配制附溶液配制方法:pH7.2 0.01mol/L PBSKH2PO40.38gNa2HPO4 1.02g(或Na2HPO4·12H2O2.58g) NaCl8.0g蒸馏水加至1000mLpH7.4 PBS/TNaCl8.0gKH2PO40.2gNa2HPO4·12H2O(或Na2HPO4·7H2O) 2.89g(或2.16g)KCl0.2g吐温200.5mL蒸馏水加至1000mLpH9.6碳酸盐缓冲液Na2CO3 1.59gNaHCO3 2.93g蒸馏水加至1000mL0.075mol/L氯化钾低渗液氯化钾0.559g,蒸馏水100ml甲醇冰醋酸(3:1)固定液甲醇3份冰醋(乙)酸1份姬姆萨染液Giemsa原液1ml1/15mol/L磷酸缓冲液(pH6.8或7.4)10ml2.3% 柠檬酸钠溶液柠檬酸钠(Na C H O ·2H O)2.3g蒸馏水100ml明胶显影液明胶粉0.2g三蒸水10ml甲酸0.1ml1% 醋酸冰醋(乙)酸1ml蒸馏水99mlH"o"33342-若丹明123染液H"o"33342(Hoechst 33342)0.25μg 若丹明123(Rhodamine 123)1.0μg PBS 1mlDPH贮备液DPH(1.6-Dipnenyl-1,3, 5hexatriene, 4.65mg)四氢呋喃10mlDPH工作液(2×10-6mol/L)DPH贮备液0.1mlPBS 100mlFDA贮备液二醋酸脂荧光素(Fluorescein diacetate,FDA) 5.0mg丙酮1mlFDA工作液FDA贮备液0.1mlPBS 100mlM-缓冲液(pH7.2)咪唑50mmol/L 3.404g氯化钾50mmol/L 3.7g氯化镁(MgCl ·6H O)0.5mol/L 101.65mgEGTA(乙二醇双(a-氨基乙基)醚四乙酸) 1mmol/L 380.35mg EDTA(乙二胺四乙酸) 0.1mmol/L 29.22mg疏基乙醇1mmol 0.07ml4mol/L甘油292ml蒸馏水加至1000ml1% TritonX-100液Triton X-100(聚乙二醇辛基苯基醚)1mlM-缓冲液99ml3% 戊二醛液戊二醛25% 3mlPBS 液(pH7.2)97ml0.2% 考马斯亮蓝R250染液考马斯亮蓝R250(Coomassie brilliant blue R250)0.2g 甲醇46.5ml冰醋(乙)酸7ml蒸馏水46.5ml生理盐水(0.85%氯化钠)氯化钠8.5g三蒸水1000ml0.25mol/L蔗糖水溶液(含0.003mol/L氯华钙)蔗糖85.5g无水氯华钙0.33g蒸馏水1000ml0.17mol/L氯化铵液氯化铵4.574g蒸馏水500ml0.17mol/L硝酸钠液硝酸钠7.224g 蒸馏水500ml0.12mol/L硫酸钠液硫酸钠(Na SO ·H O)19.333g蒸馏水500ml0.12mol/L草酸铵液草酸铵((NH )C o ·H O)8.527g蒸馏水500ml0.17mol/L醋酸铵液醋酸铵6.552g蒸馏水500ml0.32mol/L葡萄糖液葡萄糖28.83g蒸馏水500ml0.32mol/L甘油液甘油(C H (OH) ·1.26g/ml) 11.7ml蒸馏水500ml0.32mol/L乙醇液无水乙醇9.33ml蒸馏水500ml0.32mol/L丙醇液正丙醇(比重0.803)11.976ml蒸馏水500ml化学名:2-[4-(2-Hydroxyethyl)-1-piperazinyl]ethanesulfonic acid 中文名:羟乙基哌嗪乙硫磺酸分子式:C8H18N2O4SHEPES是一种非离子两性缓冲液,其在pH 7.2 - 7.4 范围内具有较好的缓冲能力。
46种缓冲液配制

46种缓冲液配制1.乙醇-醋酸铵缓冲液取5mol/L醋酸溶液,加乙醇60ml和水20ml,用10mol/L氢氧化铵溶液调剂pH值至,用水稀释至1000ml,即得。
2.三羟甲基氨基甲烷缓冲液取三羟甲基氨基甲烷,加水800ml,搅拌溶解,并稀释至1000ml,用6mol/L盐酸溶液调剂pH值至,即得。
3.三羟甲基氨基甲烷缓冲液取氯化钙,加L三羟甲基氨基甲烷溶液40ml使溶解,用1mol/L盐酸溶液调剂pH值至,加水稀释至100m l,即得。
4.三羟甲基氨基甲烷缓冲液取三羟甲基氨基甲烷,加盐酸赖氨酸、氯化钠、乙二胺四醋酸二钠,再加水溶解使成1000ml,调剂pH值至,即得。
5.乌洛托品缓冲液取乌洛托品75g,加水溶解后,加浓氨溶液,再用水稀释至250ml,即得。
6.巴比妥缓冲液取巴比妥钠,加水使溶解并稀释至400ml,用2mo l/L盐酸溶液调剂pH值至,滤过,即得。
7.巴比妥缓冲液取巴比妥与巴比妥钠,加水使溶解成2000ml,即得。
8.巴比妥-氯化钠缓冲液取巴比妥钠,加氯化钠及水适量使溶解,另取明胶加水适量,加热溶解后并入上述溶液中。
然后用L盐酸溶液调剂pH值至,再用水稀释至500ml,即得。
9.甲酸钠缓冲液取2mol/L甲酸溶液25ml,加酚酞指示液1滴,用2mol/L氢氧化钠溶液中和,再加入2mol/L甲酸溶液75ml,用水稀释至200ml,调剂pH值至~,即得。
10.邻苯二甲酸盐缓冲液取邻苯二甲酸氢钾10g,加水900ml,搅拌使溶解,用氢氧化钠试液(必要时用稀盐酸)调剂pH值至,加水稀释至1000ml,混匀,即得。
11.枸橼酸盐缓冲液取枸橼酸,加1mol/L的20%乙醇制氢氧化钠溶液40ml使溶解,再用20%乙醇稀释至100ml,即得。
12.枸橼酸盐缓冲液取%枸橼酸水溶液,用50%氢氧化钠溶液调剂pH值至,即得。
13.枸橼酸-磷酸氢二钠缓冲液甲液:取枸橼酸21g或无水枸橼酸,加水使溶解成1000ml,置冰箱内保留。
各种缓冲液配制方法

各种缓冲液配制方法缓冲液是一种用于调节溶液的pH值的溶液,常用于实验室中的生物化学和分子生物学实验中。
根据所需的pH范围和实验目的,可以使用不同的缓冲液配制方法。
以下是一些常见的缓冲液配制方法:1.磷酸盐缓冲液(PBS)磷酸盐缓冲液是一种常见的生物学实验中使用的缓冲液。
它的制备方法如下:-取一个容器,加入8克氯化钠(NaCl),0.2克磷酸二氢钠(NaH2PO4),和1.44克磷酸氢二钠(Na2HPO4)。
-加入适量的去离子水,搅拌溶解。
-将溶液转移到一个容量为1升的烧杯中。
-用去离子水补足体积至1升,并用1升体积瓶准确稀释至1升。
2. Tris缓冲液Tris缓冲液适用于pH 7-9范围内的实验。
制备方法如下:- 取一个容器,加入121.14克Tris(羟甲基氨基甲烷)。
-加入适量的去离子水,搅拌溶解。
-将溶液转移到一个容量为1升的烧杯中。
-用去离子水补足体积至1升,并用1升体积瓶准确稀释至1升。
3.醋酸盐缓冲液醋酸盐缓冲液适用于pH3-5范围内的实验。
制备方法如下:-取一个容器,加入20毫升醋酸钠三水合物(NaC2H3O2·3H2O)。
-加入6毫升醋酸。
-加入适量的去离子水,搅拌溶解。
-将溶液转移到一个容量为1升的烧杯中。
-用去离子水补足体积至1升,并用1升体积瓶准确稀释至1升。
4.磷酸缓冲液磷酸缓冲液适用于pH2-8范围内的实验。
制备方法如下:-取一个容器,加入0.126克磷酸二氢钾(KH2PO4)。
-加入0.680克磷酸二氢钠(Na2HPO4)。
-加入适量的去离子水,搅拌溶解。
-将溶液转移到一个容量为1升的烧杯中。
-用去离子水补足体积至1升,并用1升体积瓶准确稀释至1升。
5.碳酸氢盐缓冲液(HEPES缓冲液)HEPES缓冲液适用于pH6-8范围内的实验。
-取一个容器,加入10克HEPES。
-加入适量的去离子水,搅拌溶解。
-将溶液转移到一个容量为1升的烧杯中。
-用去离子水补足体积至1升,并用1升体积瓶准确稀释至1升。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
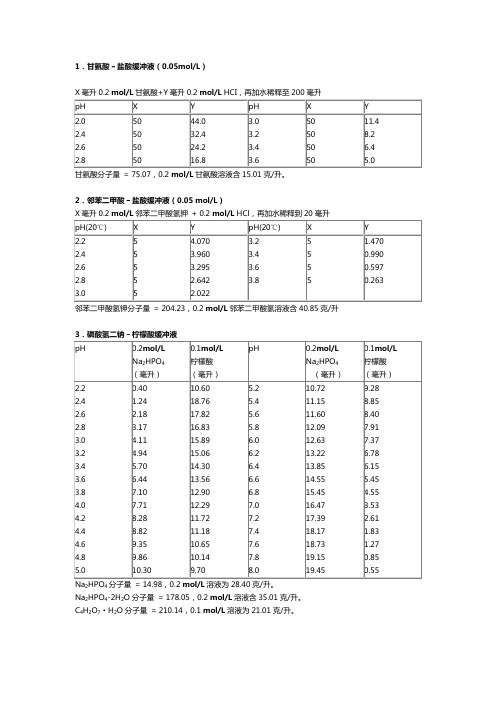
不同缓冲液的缓冲范围pH缓冲液六十一秒的常用缓冲溶液的配制&缓冲溶液原理(2007年6月16日更新)(一)甘氨酸-盐酸缓冲液(0.05 mol/L)甘氨酸分子量=75.07。
0.2 mol/L甘氨酸溶液含15.01 g/L。
(二)邻苯二甲酸-盐酸缓冲液(0.05 mol/L)邻苯二甲酸氢钾分子量=204.23。
0.2 mol/L邻苯二甲酸氢钾溶液含40.85 g/L。
(三)磷酸氢二钠-柠檬酸缓冲液Na2HPO4分子量=141.98;0.2 mol/L溶液为28.40 g/L。
Na2HPO4·2H2O分子量=178.05;0.2 mol/L溶液为35.61 g/L。
Na2HPO4·12H2O分子量=358.22;0.2 mol/L溶液为71.64 g/L。
C6H8O7·H2O分子量=210.14;0.1 mol/L溶液为21.01 g/L。
①使用时可以每升中加入1克酚,若最后pH值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
柠檬酸钠:Na3C6H5O7·2H2O分子量=294.12 ;0.1 mol/L溶液为29.41 g/L。
(六)醋酸-醋酸钠缓冲液(0.2 mol/L)NaAc·3H2O分子量=136.09;0.2 mol/L溶液为27.22 g/L。
冰乙酸11.8 mL稀释至1 L(需标定)。
(七)磷酸二氢钾-氢氧化钠缓冲液(0.05 mol/L)X 毫升0.2 mol/L KH2PO4+Y毫升0.2 mol/L NaOH 加水稀释至20毫升。
(八)磷酸盐缓冲液磷酸氢二钠-磷酸二氢钠缓冲液(0.2 mol/L)Na2HPO4·2H2O分子量=178.05;0.2 mol/L溶液为35.61 g/L。
Na2HPO4·12H2O分子量=358.22;0.2 mol/L溶液为71.64 g/L。
NaH2PO4·H2O分子量=138.01;0.2 mol/L溶液为27.6 g/L。
NaH2PO4·2H2O分子量=156.03;0.2 mol/L溶液为31.21 g/L。
(九)巴比妥纳-盐酸缓冲液巴比妥钠分子量=206.18;0.04 mol/L溶液为8.25 g/L。
(十)Tris-HCl缓冲液(0.05 mol/L)50毫升0.1mol/L三羟甲基氨基甲烷(Tris)溶液与X毫升0.1mol/L盐酸混匀并稀释至100Tris分子量=121.14 ;0.1 mol/L溶液为12.114 g/L。
Tris溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
(十一)、硼酸-硼砂缓冲液(0.2 mol/L硼酸根)硼砂:Na2B4O7·10H2O分子量=381.43;0.05 mol/L溶液(等于0.2 mol/L硼酸根)含19.07 g/L。
硼酸:H3BO3分子量=61.84;0.2 mol/L的溶液为12.37 g/L。
硼砂易失去结晶水,必须在带塞的瓶中保存。
(十二)甘氨酸-氢氧化钠缓冲液(0.05 mol/L)甘氨酸分子量=75.07;0.2 mol/L溶液含15.01 g/L(十三)硼砂-氢氧化纳缓冲液(0.05 mol/L硼酸根)硼砂Na2B4O7·10H2O分子量=381.43;0.05 mol/L硼砂溶液(等于0.2 mol/L硼酸根)为19.07Na2CO3·10H2O分子量=286.2;0.1 mol/L溶液为28.62 g/L。
NaHCO3分子量=84.0;0.1 mol/L溶液为8.40 g/L。
============================(2007年6月16日更新)==================================缓冲溶液的理论知识:一、缓冲溶液与缓冲作用原理(一)缓冲作用与缓冲溶液纯水在25℃时PH值为7.0,但只要与空气接触一段时间,因为吸收二氧化碳而使PH 值降到5.5左右。
1滴浓盐酸(约12.4mol·L-1)加入1升纯水中,可使[H+]增加5000倍左右(由1.0×10-7增至5×10-4mol·L-1),若将1滴氢氧化钠溶液(12.4mol·L-1)加到1升纯水中,PH变化也有3个单位。
可见纯水的PH值因加入少量的强酸或强碱而发生很大变化。
然而,1滴浓盐酸加入到1升HOAc-NaOAc混合溶液或NaH2PO4-Na2HPO4混合溶液中,[H+]的增加不到百分之一(从1.00×10-7增至1.01×10-7mol·L-1),PH值没有明显变化.这种能对抗外来少量强酸\强碱或稍加稀释不引起溶液PH值发生明显变化的作用叫做缓冲作用;具有缓冲作用的溶液,叫做缓冲溶液。
(二)缓冲溶液的组成缓冲溶液由足够浓度的共轭酸碱对组成。
其中,能对抗外来强碱的称为共轭酸,能对抗外来强酸的称为共轭碱,这一对共轭酸碱通常称为缓冲对、缓冲剂或缓冲系,常见的缓冲对主要有三种类型。
1.弱酸及其对应的盐例如,HOAc-NaOAc(实际上是OAc-);H2CO3-NaHCO3;H2C8H4O4-KHC8H4O4(邻苯二甲酸-邻苯二甲酸氢钾);H3BO3-Na2B4O7(四硼酸钠水解后产生H2BO-3)。
2.多元弱酸的酸式盐及其对应的次级盐,例如,NaHCO3-Na2CO3;NaH2PO4-Na2HPO4;NaH2C5HO7(柠檬酸二氢钠)-Na2HC6H5O7;KHC8H4O4-K2C8H4O4。
3.弱碱及其对应的盐例如NH3-NH+4CL-;RNH2-RNH+3A-(伯胺及其盐);Tris-TrisH+A-(三羟甲基烷及其盐)。
(三)缓冲溶液的作用原理现以HOAc-NaOAc缓冲溶液为例,说明缓冲溶液之所以能抵抗少量强酸或强碱使PH 稳定的原理。
醋酸是弱酸,在溶液中的离解度很小,溶液中主要以HOAc分子形式存在,OAc-的浓度很低。
醋酸钠是强电解质,在溶液中全部离解成Na+和OAc-,由于同离子效应,加入NaOAc后使HOAc离解平衡向左移动,使HOAc的离解度减小,[HOAc]增大。
所以,在HOAc-NaOAc混合溶液中,存在着大量的HOAc和OAc-。
其中HOAc主要来自共轭酸HOAc,OAc-主要来自NaOAc。
这个溶液有一定的[H+],即有一定的PH值。
在HOAc-NaOAc缓冲溶液中,存在着如下的化学平衡:在缓冲溶液中加入少量强酸(如HCL),则增加了溶液的[H+]。
假设不发生其他反应,溶液的PH值应该减小。
但是由于[H+]增加,抗酸成分即共轭碱OAc-与增加的H+结合成HOAc,破坏了HOAc原有的离解平衡,使平衡左移即向生成共轭碱HOAc分子的方向移动,直至建立新的平衡。
因为加入H+较少,溶液中OAc-浓度较大,所以加入的H+绝大部分转变成弱酸HOAc,因此溶液的PH值不发生明显的降低。
在缓冲溶液中加入少量强碱(如NaOH),则增加了溶液中OH-的浓度。
假设不发生其他反应,溶液的PH值应该增大。
但由于溶液中的H+立即加入的OH-结合成更难离解的H2O,这就破坏了HOAc原有的离解平衡,促使HOAc的离解平衡向右移动,即不断向生成H+和OAc-的方向移动,直至加入的OH-绝大部分转变成H2O,建立新的平衡为止。
因为加入的OH-少,溶液中抗碱成分即共轭酸HOAc的浓度较大,因此溶液的PH值不发生明显升高。
在溶液稍加稀释时,其中[H+]虽然降低了,但[OAc-]同时降低了,同离子效应减弱,促使HOAc的离解度增加,所产生的H+可维持溶液的PH值不发生明显的变化。
所以,溶液具有抗酸、抗碱和抗稀释作用。
多元酸的酸式盐及其对应的次级盐的作用原理与前面讨论的相似。
例如,在NaH2PO4-Na2HPO4溶液中存在着离解平衡:HPO2-4是抗酸成分,通过平衡移能对抗外加酸的影响。
H2PO2-4是抗碱成分,通过平衡右移能对抗外加碱的影响。
弱碱及其对应盐的缓冲作用原理,例如,NH3-NH4CL(即NH3-NH+4)溶液中,NH3能对抗外加酸的影响是抗酸成分,NH+4能对抗外加碱的影响是抗碱成分。
前者通过下述平衡向右移动而抗酸,后者通过平衡向左移动而抗碱,从而使溶液的PH值稳定。
二、缓冲溶液PH的计算(一)亨德森方程式在缓冲溶液例如HOAc-NaOAc溶液中,有以下的离解平衡:等式两边各取负对数,则即HOAc的离解度比较小,由于溶液中大量的OAc-对HOAc所产生的同离子效应,使HOAc的离解度变得更小。
因此上式中的[HOAc]可以看作等于HOAc的总浓度[共轭酸](即缓冲溶液中共轭酸的浓度)。
同时,在溶液中NaOAc全部离解,可以认为溶液中[OAc-]等于NaOAc的总浓度[共轭碱](即配制的缓冲溶液中共轭碱的浓度)。
将[共轭酸]和[共轭碱]代入上式,则得(3-11)上式称为亨德森-哈塞尔巴赫方程式,简称为亨德森(Henderson)方程式。
它表明缓冲溶液的PH值决定于共轭酸的离解常数Ka和组成缓冲溶液的共轭碱与共轭酸浓度的比值。
对于一定的共轭酸,PKa为定值,所以缓冲溶液的PH就决定于两者浓度的比值即缓冲比。
当缓冲溶液加水稀释时,由于共轭碱和共轭酸的浓度受到同等程度的稀释,缓冲比是不变的;在一定的稀释度范围内,缓冲溶液的PH值实际上也几乎不变。
式(3-11)中的浓度项指的是混合溶液中共轭酸碱的浓度,而不是混合前的浓度.若混合前共轭酸的量浓度是c酸,体积是V酸,共轭碱的量浓度是c碱,体积是V碱,则式(3-11)可改写成:(3-12)若两种溶液的量浓度相等,则(3-13)若是等体积的两溶液相混合,则(3-14)以上几种形式都称为亨德森方程式,可用以计算各种组成类型缓冲溶液的PH近似值。
当用于弱酸及其对应的盐组成的缓冲溶液的PH值时,PKa即弱酸的离解常数负对数(见书后附表),[共轭碱]即[弱酸盐]。
当用于多元弱酸的酸式盐及其对应的次级盐组成缓冲溶液的PH值时,共轭酸即酸式盐,pKa即该酸式盐负离子的离解常数的负对数,共轭碱即该酸式盐的次级盐。
例如,NaHCO3-Na2CO3缓冲溶液的PH值:(3-15)式中PKa即H2CO3的PKa2。
同样,NaH2PO4-Na2HPO4缓冲溶液的PH值:(3-16)式中PKa为H3PO4的PKa2。
弱碱和它的共轭酸缓冲溶液的PH值也可根据式(3-11)计算。
(二)缓冲溶液PH值计算举例例5 0.1mol.L-1的HOAc500mL与0.2mol.L-1的NaOAc250mL配成缓冲溶液,计算溶液的pH值。
解:把所给条件代入式(3-11),由书后附表查得HOAc的pKa=4.75,则得:例6 将0.3mol.L-1HOAc溶液10mL与0.1mol.L-1NaOH溶液10mL混合后制成缓冲溶液,试计算这个溶液的pH值(2.5℃时,HOAc时pKa=4.75)。
