专题2-5:主族金属-镓与铟的化合物(解析版)
2022届高考化学二轮复习——工业流程题专题训练
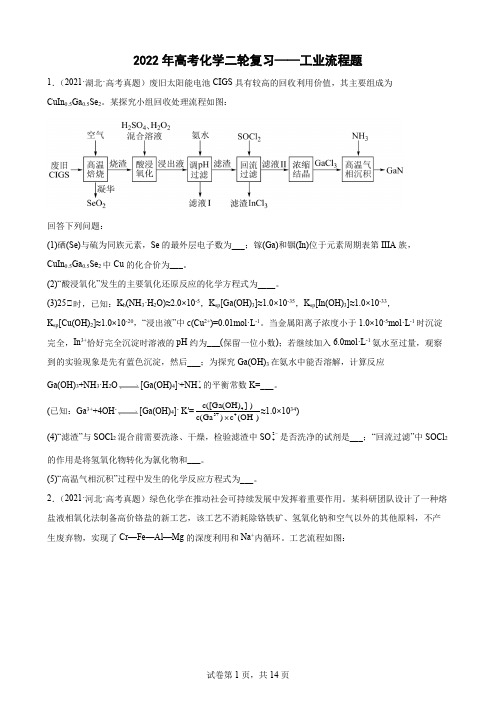
2022年高考化学二轮复习——工业流程题1.(2021·湖北·高考真题)废旧太阳能电池CIGS具有较高的回收利用价值,其主要组成为CuIn0.5Ga0.5Se2。
某探究小组回收处理流程如图:回答下列问题:(1)硒(Se)与硫为同族元素,Se的最外层电子数为___;镓(Ga)和铟(In)位于元素周期表第IIIA族,CuIn0.5Ga0.5Se2中Cu的化合价为___。
(2)“酸浸氧化”发生的主要氧化还原反应的化学方程式为____。
(3)25℃时,已知:K b(NH3·H2O)≈2.0×10-5,K sp[Ga(OH)3]≈1.0×10-35,K sp[In(OH)3]≈1.0×10-33,K sp[Cu(OH)2]≈1.0×10-20,“浸出液”中c(Cu2+)=0.01mol·L-1。
当金属阳离子浓度小于1.0×10-5mol·L-1时沉淀完全,In3+恰好完全沉淀时溶液的pH约为___(保留一位小数);若继续加入6.0mol·L-1氨水至过量,观察到的实验现象是先有蓝色沉淀,然后___;为探究Ga(OH)3在氨水中能否溶解,计算反应Ga(OH)3+NH3·H2O[Ga(OH)4]-+NH4+的平衡常数K=___。
(已知:Ga3++4OH-[Ga(OH)4]- K′=-4-3+4c([Ga(OH)])c(()a)c OHG⨯≈1.0×1034)(4)“滤渣”与SOCl2混合前需要洗涤、干燥,检验滤渣中SO24-是否洗净的试剂是___;“回流过滤”中SOCl2的作用是将氢氧化物转化为氯化物和___。
(5)“高温气相沉积”过程中发生的化学反应方程式为___。
2.(2021·河北·高考真题)绿色化学在推动社会可持续发展中发挥着重要作用。
某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了Cr—Fe—Al—Mg的深度利用和Na+内循环。
专题--金属及其化合物

一、第IA族(碱金属)(一)、包含的金属元素:(氢)锂钠钾铷铯(钫*)(铷和铯在高中阶段了解其危险性即可)(二)、物理性质:质软,具有金属光泽,可燃点低,锂密度小于煤油甚至小于液体石蜡,钠、钾密度比煤油大,比水小,因此锂封存于固体石蜡中,钠钾保存于煤油中,铷铯因过于活泼需要封存在在充满惰性气体的玻璃安瓿中。
(三)、化学性质:1、与氧气反应:①对于锂,R+O2→R2O(无论点燃还是在空气中均只能生成氧化锂)②对于钠,R+O2→R2O(空气中) R+O2→R2O2(点燃)③对于钾,R+O2→R2O(空气中) R+O2→R2O2(氧气不充足时点燃) R+O2→RO2(氧气充足时)因此,我们认为,钾在点燃时的产物为混合物④对于铷和铯,在空气中就可以燃烧,生成复杂氧化物,高中范围内不做过多了解2、与酸反应:R+H+→R++H2(碱金属先与水解氢离子较多的酸反应,然后才与水反应)3、与水反应: R+H2O→ROH+H2①锂与水反应现象:短暂的浮熔游响(因生成了溶解度较小的LiOH,附在锂的表面,影响了反应的继续进行,反应速率越来越慢,直至完全停止)②钠和钾常温反应现象:浮熔游响红,密度小于水,漂浮于水面,,迅速“熔”成小球(实际上是与水反应放热引起的、金属与水发生反应质量体积变小的共同作用,讲授时认为是反应放热),由于生成了氢气,小球四处游动,并发出呲呲的响声,在反应后的溶液里加入酚酞,发现溶液变为粉红色或红色。
③铷铯与水反应的现象:放入水中即发生爆炸反应,十分危险。
4、与有机物的反应:R+M-OH→M-OR+H2(反应不如与水反应剧烈,但仍可以看到低配版的浮熔游响红)5、与卤素反应:R+Cl2→RCl(现象:冒白烟)6、与硫反应:R+S→R2S(爆炸式反应,危险)7、锂与氮反应:Li+N2→Li3N(知道其为一种优良催化剂即可,高中范围内不需要掌握)8、钠与氢气反应:Na+H2→NaH(高温条件)(四)、常见化合物及其化学性质1、氢氧化钠(烧碱,有强烈的腐蚀性)可与酸及酸性气体反应,也可以与两性氧化物发生反应OH-+H+→H2O OH-+CO2→CO3-+H2O(过量CO2:OH-+CO2→HCO3-)OH-+Al→AlO2-+H2↑2、碳酸钠(苏打,纯碱)可与酸反应,可与酸性气体反应,可在高温下分解为氧化钠和二氧化碳CO3-+H+→H2O+CO2 CO3-+CO2+H2O→HCO3-3、碳酸氢钠(小苏打)可与酸反应可加热分解HCO3-+H+→H2O+CO2 NaHCO3—△→Na2CO3+H2O+CO2↑4、过氧化钠(优良制氧物质,具有强氧化性,可用作漂白剂)可与酸反应(注意反应顺序为先水后酸!),可与水反应可与湿润的二氧化碳反应(与干燥的二氧化碳不反应)可与二氧化硫反应可与三氧化硫反应可以与钠发生归中反应可吸收氮氧化合物Na2O2+H2O→NaOH+O2↑Na2O2+CO2→Na2CO3+O2↑Na2O2+SO2→Na2SO4 Na2O2+SO3→Na2SO4+O2Na2O2+Na→Na2O Na2O2+NO→NaNO2 Na2O2+2NO2= 2NaNO35、氢化钠(强碱性物质,极度危险品)NaH+O2→NaOH(潮湿的空气中极易自燃) 不溶于有机溶剂,溶于熔融金属钠中,是有机实验中用途广泛的强碱。
第二十讲 元素周期表与元素周期律(习题)-【大一轮课堂】2024年高考化学大一轮+习题(解析版)

第二十讲 元素周期表与元素周期律【基础巩固】1.2020年我国北斗三号全球卫星导航系统正式开通,其中“铷(Rb)原子钟”被誉为卫星的“心脏”,下列有关说法错误的是( )A.铷元素位于ⅠA 族B.Rb 的金属性比钠的弱C.8537Rb 的中子数为48 D.8537Rb 和8737Rb 具有相同的电子数【答案】B【解析】同主族元素,从上到下,元素的金属性逐渐增强,故铷的金属性比钠强,B 错误。
2.(2023·四川遂宁模拟)X 、Y 、Z 、W 属于短周期主族元素,其中X 、Y 、Z 在元素周期表中的相对位置关系如图,Y 原子的最外层电子数是其次外层电子数的12,W 的焰色反应呈现黄色火焰。
下列说法错误的是( )A .原子半径:W >Y >Z >XB .W 和X 形成的化合物可能含共价键C .气态氢化物的稳定性:X >Z >YD .Z 2X 5可以用作食品干燥剂【答案】D【解析】Y 原子的最外层电子数是其次外层电子数的12,则Y 为Si ;由元素在周期表中的相对位置关系可知,Z 为P 、X 为O ;W 的焰色反应呈现黄色火焰,则W 为Na 。
一般电子层数越多原子半径越大,同周期元素核电荷数越大原子半径越小,故原子半径由大到小为Na >Si >P >O ,故A 正确;Na 和O 形成的Na 2O 2中既含有离子键又含有共价键,故B 正确;元素非金属性越强其气态氢化物越稳定,故稳定性:H 2O >PH 3>SiH 4,故C 正确;P 2O 5有毒,不能用作食品干燥剂,故D 错误。
3.(2022·全国甲卷,12)Q 、X 、Y 、Z 是原子序数依次增大的短周期主族元素,其最外层电子数之和为19。
Q 与X 、Y 、Z 位于不同周期,X 、Y 相邻,Y 原子最外层电子数是Q 原子内层电子数的2倍。
下列说法正确的是( )A .非金属性:X>QB .单质的熔点:X>YC .简单氢化物的沸点:Z>QD .最高价含氧酸的酸性:Z>Y【答案】D【解析】由题干信息可知Q应为第二周期元素,X、Y、Z位于第三周期,Y为Si元素,X为Al元素,Q 可能为N或O或F,Z可能为Cl或S或P,N或O或F元素非金属性均比Al强,故非金属性:Q>X,A 错误;X为Al,属于金属晶体,Y为Si,属于原子晶体,故单质熔点:Si>Al,即Y>X,B错误;Q的简单氢化物为NH3或H2O或HF,Z的简单氢化物为HCl或H2S或PH3,由于前者物质中存在分子间氢键,而后者物质中不存在,故沸点:Q>Z,C错误;P、S、Cl的非金属性均强于Si,因此最高价含氧酸的酸性:Z>Y,D正确。
三五族化合物的晶格常数

三五族化合物的晶格常数三五族元素包括硼、铝、镓、铟和砷,它们的化合物在化学和材料科学中具有重要的应用价值。
这些化合物的晶格常数是指晶体中原子之间的距离,是描述晶体结构的重要参数之一。
下面将分别介绍硼化合物、铝化合物、镓化合物、铟化合物和砷化合物的晶格常数。
硼化合物的晶格常数主要取决于硼元素和其他元素的配位方式。
其中,硼化物B12H122-是一种典型的硼簇合物,它的晶格常数为8.29 Å。
硼矿石中最常见的硼矿物为硼硅石,其晶格常数为a=5.14 Å,c=5.42 Å。
硼化铝(AlB2)的晶格常数为a=3.084 Å,c=2.512 Å。
硼化镓(GaB3)的晶格常数为a=4.80 Å,c=4.69 Å。
硼化铟(InB)的晶格常数为a=6.06 Å,c=3.28 Å。
这些硼化合物的晶格常数反映了硼与其他元素之间的化学键长度和键角。
铝化合物的晶格常数受到晶体结构类型的影响。
例如,氧化铝(Al2O3)具有多种晶体结构,其中最常见的是α-Al2O3(刚玉)和γ-Al2O3(氧化铝胶体)。
α-Al2O3的晶格常数为a=4.758 Å,c=12.991 Å,γ-Al2O3的晶格常数为a=7.865 Å,c=20.975 Å。
氧化铝是一种重要的陶瓷材料,具有优异的电绝缘性能、高熔点和良好的耐腐蚀性。
镓化合物的晶格常数也取决于晶体结构。
例如,三氧化二镓(Ga2O3)具有多种晶体结构,其中最常见的是β-Ga2O3。
β-Ga2O3的晶格常数为a=12.18 Å,b=3.03 Å,c=5.82 Å。
镓化铝(AlGaAs)是一种重要的半导体材料,其晶格常数随铝和镓元素的摩尔比例变化而变化。
铟化合物的晶格常数也受到晶体结构和配位方式的影响。
例如,氧化铟(In2O3)具有多种晶体结构,其中最常见的是立方相(In2O3-C)。
稀散金属——镓

镓,原子序数31,原子量69.723。
1875年法国化学家布瓦博德朗在闪锌矿中离析出几克性质与门捷列夫预言的“类铝”相同的元素,并命名。
元素名来源于他的祖国,愿意为“法国的”。
镓是化学史上第一个先从理论预言,后在自然界中被发现验证的化学元素。
镓在地壳中的含量约0.001%,含量最富的锗石中也只含0.5%左右。
固体镓为蓝灰色,液体镓为银白色;熔点29.78°C,沸点2403°C,固体密度5.907克/厘米³。
镓与钒、铌、锆形成的合金具有超导性。
镓的化学活性低于铝,在常温下几乎不受氧和水的侵蚀,只在高温下才被氧化;它与稀酸作用缓慢,可溶于热的强酸及强碱中,分别形成镓盐或镓酸盐;卤素与镓反应生成三卤化镓或一卤化镓;镓在高温下能与硫、硒、碲、磷、砷、锑反应,生成的化合物都有半导体性质;镓的氧化和氢氧化物都是两性的,可溶于酸和碱中。
镓可用作高温温度计和真空装置中的密封液;镓的最重要的应用是在制造半导体器件方面;镓还用来制造阴极蒸汽灯等。
稀散金属——镓介绍镓是一种有白色光泽的软金属。
熔点出奇的低,只有29.78℃。
取一小粒镓放在手心里,过不多久就熔化成小液珠滚来滚去,像水银珠一样。
人们认识镓历史人们认识镓这个元素已经有一百多年的历史了。
它是在1875年被法国化学家布瓦菩德朗发现的。
像在地壳中的量约为0. 0004%,与锡差不多,不算太少。
然而,锡矿比较集中,镓在自然界的分布却非常分散,几乎没有单独存在的镓矿。
所以镓又称作“稀散金属”。
镓有时和铝混合在一起,存在于铝土矿里。
这是因为镓和铝在元素周期表里都属于第三主族,而镓离子和铝离子大小也差不多,所以它们就容易在一种矿石里共存。
又因为镓原子和锌原子大小也接近,所以镓和锌也容易同处于散锌矿中。
镓还容易和锗共存于煤中。
所以煤燃烧后剩下的烟道灰里就含有微量的镓和锗。
镓的宝贵特性镓的很多宝贵特性和它的纯度有关。
用普通化学方法提炼,最多只能得到 99. 99%的纯度,也就是平常说的四个九。
2020-2021高考化学综合题专题复习【原子结构与元素周期表】专题解析含详细答案

2020-2021高考化学综合题专题复习【原子结构与元素周期表】专题解析含详细答案一、原子结构与元素周期表练习题(含详细答案解析)1.硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。
完成下列填空: I.某些硅酸盐具有筛选分子的功能,一种硅酸盐的组成为:M 2O·R 2O 3·2SiO 2·nH 2O ,已知元素M 、R 均位于元素周期表的第3周期。
两元素原子的质子数之和为24。
(1)该硅酸盐中同周期元素原子半径由大到小的顺序为________________; (2)写出M 原子核外能量最高的电子的电子排布式:__________________; (3)常温下,不能与R 单质发生反应的是___________(选填序号);a .CuCl 2溶液b .Fe 2O 3c .浓硫酸d .Na 2CO 3溶液(4)写出M 、R 两种元素的最高价氧化物对应的水化物反应的离子方程式:____________________________________________。
II.氮化硅(Si 3N 4)陶瓷材料硬度大、熔点高。
可由下列反应制得:SiO 2+C+N 2−−−→高温Si 3N 4+CO(5)Si 3N 4晶体中只有极性共价键,则氮原子的化合价为______,被还原的元素为______________。
(6)C 3N 4的结构与Si 3N 4相似。
请比较二者熔点高低。
并说明理由:_____________________。
(7)配平上述反应的化学方程式,并标出电子转移的数目和方向。
_________________ (8)如果上述反应在10L 的密闭容器中进行,一段时间后测得气体密度增加了2.8g/L ,则制得的Si 3N 4质量为_____________。
【答案】Na >Al>Si 3s 1 bd ()-23-2Al OH +OH =lO +H A O -3 N 2中氮元素 两者均为原子晶体,碳原子半径小于硅原子半径,因此C 3N 4中碳原子与氮原子形成的共价键键长较Si 3N 4中硅原子与氮原子形成的共价键键长小,键能较大,熔点较高35g【解析】【分析】【详解】I .(1)化合物的化合价代数和为0,因此M 呈+1价,R 呈+3价,M 、R 均位于元素周期表的第3周期,两元素原子的质子数之和为24,则M 为Na ,R 为Al ,该硅酸盐中Na 、Al 、Si 为同周期元素,元素序数越大,其半径越小,因此半径大小关系为:Na >Al>Si ; (2)M 原子核外能量最高的电子位于第三能层,第三能层上只有1个电子,其电子排布式为:3s 1;(3)常温下,Al 与CuCl 2溶液反应能将铜置换出来;Al 与Fe 2O 3在高温反应;Al 与浓硫酸发生钝化;Al 与Na 2CO 3溶液在常温下不发生反应;故答案为:bd ;(4)Na 、Al 两种元素的最高价氧化物对应的水化物分别为:NaOH 、Al(OH)3,二者反应的离子方程式为:()-23-2Al OH +OH =lO +H A O ; II .(5)非金属性N>Si ,因此Si 3N 4中N 元素化合价为-3价;该反应中N 元素化合价从0价降低至-3价,N 元素被还原;(6)Si 3N 4陶瓷材料硬度大、熔点高,晶体中只有极性共价键,说明Si 3N 4为原子晶体,C 3N 4的结构与Si 3N 4相似,说明C 3N 4为原子晶体,两者均为原子晶体,碳原子半径小于硅原子半径,因此C 3N 4中碳原子与氮原子形成的共价键键长较Si 3N 4中硅原子与氮原子形成的共价键键长小,键能较大,熔点较高;(7)该反应中Si 元素化合价不变,N 元素化合价从0价降低至-3价,C 元素化合价从0价升高至+2价,根据得失电子关系以及原子守恒配平方程式以及单线桥为:;(8)气体密度增加了2.8g/L ,说明气体质量增加了2.8g/L ×10L=28g ,2234=3SiO +6C +2N Si N +6CO 140g 112g28gm∆高温气体质量变化 因此生成的Si 3N 4质量为28g 140g 112g⨯=35g 。
高考化学微专题训练:物质结构与性质(原卷+解析卷)

物质结构与性质【原卷】大题训练(共17题)1.含第VA族的磷、砷(As)等元素的化合物在研究和生产中有许多重要用途。
回答下列问题:(1)基态P原子的核外电子排布式为____,有____个未成对电子。
(2)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如图甲所示,由A、B两种微粒构成。
将其加热至148℃熔化,形成一种能导电的熔体。
已知A、B两种微粒分别与CC14、SF6互为等电子体,则A为____,其中心原子杂化轨道类型为____,B为____。
(3)PO43-的空间构型为____,其等电子体有____(请写出一种)。
(4)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%。
推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。
已知砷化镓的晶胞结构如图乙,晶胞参数a= 565pm。
①砷化镓的化学式为____,镓原子的配位数为____。
②砷化镓的晶胞密度=____g/cm3(列式并计算,精确到小数点后两位),m位置Ga原子与n位置As原子之间的距离为____pm(列式表示)。
2.大型客机燃油用四乙基铅[Pb(CH2CH3)4])做抗震添加剂,但皮肤长期接触四乙基铅对身体健康有害,可用硫基乙胺(HSCH2CH2NH2)和KMnO4清除四乙基铅。
(1)锰元素在周期表中的位置是_____,基态锰原子的外围电子排布式为_____,该原子能量最高的电子的电子云轮廓图形状为____。
(2)N、C和Mn电负性由大到小的顺序为_____。
(3)HSCH2CH2NH2中C的杂化方式为____,其中NH2-空间构型为____;N和P 的价电子相同,但磷酸的组成为H3PO4,而硝酸的组成不是H3NO4,其原因是____。
(4)Pb(CH2CH3)4是一种难电离且易溶于有机溶剂的配合物,其晶体类型属于_____晶体。
已知Pb(CH2CH3)4晶体的堆积方式如下。
专题02 元素与元素周期表(解析版)2023-2024年中考化学压轴题

专题02 元素与元素周期表元素与元素周期表是学习化学的基本,中考中常以元素在元素周期表中的信息及其原子结构示意图的形式专题训练一、选择题(小题)1.(2022年山西省中考模拟百校联考)氮化镓是实现5G 技术的关键材料之一,镓在元素周期表中的信息如图,下列说法错误的是()A.镓属于金属元素B.镓的元素符号为GaC.镓原子有31 个中子D.镓的相对原子质量为69.72【答案】C【解析】A、镓为“钅”字旁,属于金属元素,A正确;B、由格中信息可知,镓的元素符号为Ga,B正确;C、31是镓的原子序数,原子序数等于质子数,即镓的质子数为31,C错误;D、由格中信息可知,镓的相对原子质量为69.72,D正确。
综上所述:选择C。
2.(2022年河南省许昌市中考一模)钛合金具有记忆效应,如图为钛元素在周期表中的信息。
下列说法错误的是()A.钛元素属于金属元素B.钛原子核内有22个质子C.钛的元素符号是Ti D.钛元素原子质量为47.87g【答案】D【解析】A、根据元素周期表中的一格可知,中间的汉字表示元素名称,该元素的名称是钛,带“钅”字旁,属于金属元素,故选项说法正确,不符合题意;B、根据元素周期表中的一格可知,左上角的数字表示原子序数,该元素的原子序数为22;根据原子中原子序数=核电荷数=质子数=核外电子数,则钛原子核内有22个质子,故选项说法正确,不符合题意;C、根据钛元素在周期表中的信息可知,字母表示该元素的元素符号,钛的元素符号是Ti,故选项说法正确,不符合题意;D、根据钛元素在周期表中的信息可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为47.87,单位为1,省略不写,故选项说法错误,符合题意;综上所述:选择D。
3.(2022年湖南省衡阳市中考一模)下列几种微粒结构示意图,表示阳离子的是()A.B.C.D.【答案】B【解析】A、该示意图的微粒中,质子数为8,核外电子数为2+8=10,质子数<核外电子数,属于阴离子,故选项A不符合题意;B、该示意图的微粒中,质子数为13,核外电子数为2+8=10,质子数>核外电子数,属于阳离子,故选项B符合题意;C、该示意图的微粒中,质子数为16,核外电子数为2+8+8=18,质子数<核外电子数,属于阴离子,故选项C不符合题意;D、该示意图的微粒中,质子数为18,核外电子数为2+8+8=18,质子数=核外电子数,属于原子,故选项D不符合题意。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
系列二 主族金属专题5 镓与铟及其化合物一、镓单质(1)Ga 熔点29.78℃,在手中融化,但Ga 的沸点为2403℃,是液相存在的温度范围最大的金属单质,常用于制造高温下使用的温度计,镓之所以有此特性在于镓的晶体中似存在Ga 2,因此其熔点低,当沸腾时,Ga 2分裂为原子,所以沸点高。
(2)常温下,镓与铟表面存在氧化层,导致其化学性质不活泼。
Ga 与铝类似,具有两性,金属性若于铝,既可以与酸反应也可以与碱反应:2Ga+3H 2SO 4=====Ga 2(SO 4)3+3H 2↑;2Ga+2NaOH+2H 2O=====2NaGaO 2 +3H 2↑(3)常温下,镓与铟可以和氯气和溴反应;高温下,都可以与O 2、S 、P 、As 等非金属直接化合。
二、氧化物和氢氧化物(4)Ga 2O 3和Ga(OH)3两性偏酸;Ga(OH)3+3OH -=====[Ga(OH)6]3-。
Ga(OH)3可溶于NH 3·H 2O ,而Al(OH)3不溶于NH 3·H 2O(5)In 2O 3和In(OH)3几乎无两性表现,In 2O 3溶于酸,但不溶于碱。
(6)Ga(OH)3、In(OH)3微热时脱水,生成氧化物:2M(OH)3=====△M 2O 3+3H 2O(M 表示Ga 或In)。
三、镓与铟的制备(7)因为镓常与铝、锌、锗等金属混在一起,所以可在提取出这些金属之后的废料中提取。
例如由铝矾土矿制备Al 2O 3的工艺流程中,铝酸盐溶液经CO 2酸化后分离出Al(OH)3沉淀的母液富集了镓。
将母液再次经CO 2酸化后便可得到富集的Ga(OH)3,使之溶于碱再进行电解即可得到单质镓。
Ga(OH)3 + OH -=====Ga(OH)4-,Ga(OH)4-+3e -=====Ga + 4OH -。
(8)铟的制备方法是将提取过的闪锌矿残渣用硫酸浸取,酸浸取液经中和后投入锌片,铟就沉积在锌片上,用极稀的硫酸溶去锌,将不溶杂质溶于硝酸,再加入BaCO 3,便沉淀出氧化铟,在高温下用氢气还原制得金属铟。
【习题1】镓是1871年俄国化学家门捷列夫在编制元素周期表时曾预言的“类铝”元素。
镓的原子序数为31,属△A族。
镓的熔点为29.78 △,沸点高达2 403 △。
镓有过冷现象(即冷至熔点下不凝固),它可过冷到-120 △。
由此判断下列有关镓的性质及其用途的叙述不正确的是()。
A.镓是制造高温温度计的上佳材料B.镓能溶于强酸和强碱中C.镓与锌、锡、铟等金属制成的合金,可用在自动救火的水龙头中D.近年来镓成为电子工业的新宠,其主要用途是制造半导体材料,被誉为“半导体家族的新成员”,这是利用了镓的导电性介于导体和绝缘体之间的性质【答案】D【解析】镓的熔点为29.78 △,沸点高达2 403 △;镓有过冷现象(即冷至熔点下不凝固),它可过冷到-120 △,因此A、C两项正确。
铝能溶于强酸和强碱中,铝是电的良导体而不是半导体,镓是“类铝”元素,所以镓能溶于强酸和强碱中,镓是电的良导体而不是半导体,即B项正确,D项不正确。
【习题2】砷化镓为第三代半导体材料,晶胞结构如图所示(1)砷化镓可由(CH3)3Ga和AsH3在700△下反应制得,反应的化学方程为。
(2)AsH3空间构型为。
已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式是______________________。
(3)砷化镓晶体中最近的砷和镓原子核间距为a cm,砷化镓的摩尔质量为b g·mol-1,阿伏伽德罗常数值为N A,则砷化镓晶体密度表达式是g·cm-3。
【答案】(1)(CH3)3Ga+AsH33CH4+GaAs(2)三角锥形sp2(3)33·b/16a3N A【解析】(1)该反应为(CH3)3Ga和AsH3反应生成为GaAs,根据质量守恒可知还有CH4生成,所以反应的化学方程式为:(CH3)3Ga+AsH33CH4+GaAs;(2)AsH3中含有3个δ键和1个孤电子对,空间构型为三角锥形,(CH3)3Ga中Ga形成3个δ键,没有孤电子对,为sp2杂化。
(3)AB、AC、AD、BC、BD、CD的边长相等,AF、BF的长相等为a,F位于体心上,O位于正三角形BCD的重心上,在正三角形BCD中,BE为三角形BCD的高,则CE为BC的一半,如图,设正四面体的边长为x,CE的长为0.5x,BE=;BO与OE的长之比为2:1,则BO的长为,在三角形ABO中,AO的长为,在三角形BFO中,OF的长为,解得,正四面体的边长为x,对角线长2x,晶胞的棱长为,一个晶胞中含有4个砷化镓,所以密度表达式为。
【习题3】镓是制作高性能半导体的重要原料。
工业上常从锌矿冶炼的废渣中回收镓。
已知某锌矿渣主要含Zn、Si、Pb、Fe、Ga的氧化物,利用该矿渣制镓的工艺流程如下:已知:△镓在元素周期表中位于第四周期第△A族,化学性质与铝相似。
△lg2=0.3 lg3=0.48。
△部分物质的Ksp如下表所示。
(1)为了提高酸浸速率,除适当增加硫酸浓度外,应采取的措施有__________________(写出两条)。
滤渣1的主要成分是硫酸铅及_________________(写化学式)。
(2)加入H2O2的目的是(用离子方程式表示)______________________ 。
(3)室温条件下,若浸出液中各阳离子的浓度均为0.01mo/L,当溶液中某种离子浓度小于1×10-5mol/L时即认为该离子已完全除去,则pH应调节的范围为___________________。
(4)操作D包括:_______________过滤、洗涤、干燥。
(5)电解法制备金属镓。
用惰性电极电解NaGaO2溶液即可制得金属镓,写出阴极电极反应式________________________。
【答案】(1)升高温度、粉碎、搅拌等SiO2(2)2Fe2++H2O2+2H+=2Fe3++2H2O(3)5.48<pH<6.6(4)蒸发浓缩、冷却结晶(5)GaO2-+2H2O+3e-=Ga+4OH-【解析】(1)为了提高酸浸速率,除适当增加硫酸浓度外,应采取的措施有将矿物质粉碎、升高温度、搅拌等;由以上分析可知滤渣1为SiO2、PbSO4;(2)在滤液中加入H2O2的目的是氧化Fe2+,调节溶液pH沉淀Fe3+,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;(3)调pH的目的是使Fe3+、Ga3+沉淀完全而Zn2+不沉淀,Ga(OH)3完全沉淀时,c(OH-mol/L=3×10-9mol/L,则此时溶液的pH=5.48;如生成Zn(OH)2,则c(OH-171.6100.01-⨯-8mol/L,则此时溶液的pH=6.6,故应调节pH范围为5.48<pH<6.6;(4)操作D得到晶体,涉及操作为:蒸发浓缩,冷却结晶过滤、洗涤、干燥;(5)△阴极上GaO2-发生还原反应生成Ga,电极方程式为GaO2-+2H2O+3e-=Ga+4OH-。
【习题4】我国某地粉煤灰中镓含量丰富,其主要成分以Ga2O3的形式存在,除此之外还含有A12O3、Fe3O4、SiO2等杂质。
已知从粉煤灰中回收镓的艺流程如图甲所示。
信息:(i)转型液中镓以GaO2-的形式存在;(ii)K sp[Ga(OH3)]=1.4×10-34,K sp[Fe(OH)3]=2.7×10-39,K sp[Fe(OH)2]=4.87×10-17。
回答下列问题:(1)滤渣A中一定含有的成分是___________________________。
(2)“氧化”过程中加入H2O2的目的是___________________,该过程中发生反应的离子方程式为___________________________________。
()3洗脱液中还有少量的Fe3+、Ga3+,其中Ga3+浓度为1.4×10-4mol/L,列式计算当Fe3+恰好沉淀完全时[c(Fe3+)≤1.0×10-5mol/L],G a3+是否开始沉淀___________________________。
(4)流程图中两次调节pH的目的分别是___________________________。
(5)电解法可以提纯粗镓,具体原理如图乙所示△粗镓与电源___________极相连(填“正”或“负”)。
△镓在阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,GaO2-在阴极放电的电极反应式为___________________。
【答案】(1)SiO2(2)将Fe2+氧化为Fe3+,便于后续操作分离2Fe2++H2O2+2H+==2Fe3++2H2O(3)当Fe3+恰好沉淀时,溶液中c3(OH-)=K sp[Fe(OH)3]/c(Fe3+)=2.7×10-39/1.0×10-5mol3/L3=2.7×10-34mol3/L3,Q c[Ga(OH)3]=c(Ga3+)•c3(OH-)=1.4×10-4mol/L×2.7×10-34mol3/L3 =3.78×10-38<K sp[Ga(OH)3],故Ga3+未开始沉淀(4)第一次调节pH是为了使Fe3+沉淀从而分离,第二次调节pH是为了将Ga3+转化为GaO2—得到转型液(5)正GaO2—+3e—+2H2O==Ga+4OH—【解析】粉煤灰中主要成分Ga2O3,还含有A12O3、Fe3O4、SiO2等杂质,加入盐酸后,SiO2不反应,过滤留在滤渣A 中,浸出液中的Fe2+被H2O2氧化,变成Fe3+,加氢氧化钠调节pH后,根据K sp[Ga(OH3)]=1.4×10-34,K sp[Fe(OH)3]=2.7×10-39,使Fe3+变成沉淀进行分离,第二次调节pH是为了将Ga3+转化为GaO2—得到转型液,GaO2—在阴极得电子,被还原为金属Ga。
(1)结合上述分析滤渣A中一定含有的成分是SiO2。
(2)“氧化”过程中加入H2O2的目的是将Fe2+氧化为Fe3+,便于后续操作分离,该过程中发生反应的离子方程式为2Fe2++H2O2+2H+==2Fe3++2H2O。
(3)当Fe3+恰好沉淀时,溶液中c3(OH-)=K sp[Fe(OH)3]/c(Fe3+)=2.7×10-39/1.0×10-5mol3/L3=2.7×10-34mol3/L3,Q c[Ga(OH)3]=c(Ga3+)•c3(OH-)=1.4×10-4mol/L×2.7×10-34mol3/L3 =3.78×10-38<K sp[Ga(OH)3],故Ga3+未开始沉淀。
