降钙素原(PCT)测定试剂盒(化学发光免疫分析法)产品技术要求深圳华迈兴微
Roche降钙素原电化学发光法定量检测试剂盒的临床性能评价

Roche降钙素原电化学发光法定量检测试剂盒的临床性能评价范华杰;张鹏;唐古生;沈茜【期刊名称】《检验医学》【年(卷),期】2010(025)008【摘要】目的对Roche降钙素原(PCT)电化学发光法定量检测试剂盒(简称Roche试剂盒)进行性能评估.方法以Biomérieux化学发光PCT试剂盒(简称Biomérieux试剂盒)为参比试剂,同时用2种试剂盒测定212例患者样本.分别以0.5和2.0 μg/L为Cut-off值进行定性统计分析;并分析2种试剂盒测定值的相关性、偏倚以及脂血、溶血、类风湿因子(RF)等对检测结果的干扰.结果在0.5和2.0 μg/L 这2个医学决定水平,Roche试剂盒的相对灵敏度均>75%、相对特异性均>90%.与Biomerieux试剂盒的相对总体符合率较高,Kappa值均>0.8.Roche试剂盒与Biom rieux试剂盒的测定值具有良好的相关性,2种试剂盒测定值间线性偏倚无统计学意义,平均偏倚为1.0 μg/L,一致性界限为-4.6~6.6 μg/L.肝素抗凝血浆及一定浓度的脂血[三酰甘油(TG)≤18.29 mmol/L]、黄疸[总胆红素(TBil)≤541 μmol/L]、溶血[血红蛋白(Hb)≤7.6 g/L]和RF(RF≤1 380 kIU/L)对Roche试剂盒测定PCT不构成干扰.结论 Roche试剂盒在全自动电化学发光免疫检测仪上实现了PCT检测的自动化和快速化,所受干扰因素少,能完全满足临床检测需求.【总页数】5页(P654-658)【作者】范华杰;张鹏;唐古生;沈茜【作者单位】第二军医大学附属长海医院实验诊断科,上海,200433;第二军医大学附属长海医院实验诊断科,上海,200433;第二军医大学附属长海医院实验诊断科,上海,200433;第二军医大学附属长海医院实验诊断科,上海,200433【正文语种】中文【中图分类】R446.1【相关文献】1.两种降钙素原定量检测试剂盒的比较研究 [J], 李沛然;苑文雯;王晗;朱剑功;何叶莉;郭桐生2.Roche Cobas E411电化学发光分析仪检测降钙素原的方法学性能评价 [J], 彭丽华;沈传兵;叶顺星;杨玉兰3.基于时间分辨免疫荧光法的降钙素原试剂盒临床性能评价 [J], 李登红;陆建伟;王洪涛;蔡美玲;农丽松;黄光强4.两种降钙素原定量检测试剂盒的比较分析 [J], 杜琴;杜娟;蔡艳娟;王强;王东生;张国元5.循环增强荧光分析仪及配套降钙素原定量检测试剂盒的分析性能评价 [J], 黄迪;尚陈宇;刘冬冬;余锦旗;潘敏旋;李思挺;柯培锋因版权原因,仅展示原文概要,查看原文内容请购买。
降钙素原(PCT)测定试剂盒(磁微粒化学发光免疫分析法)产品技术要求runnuosi
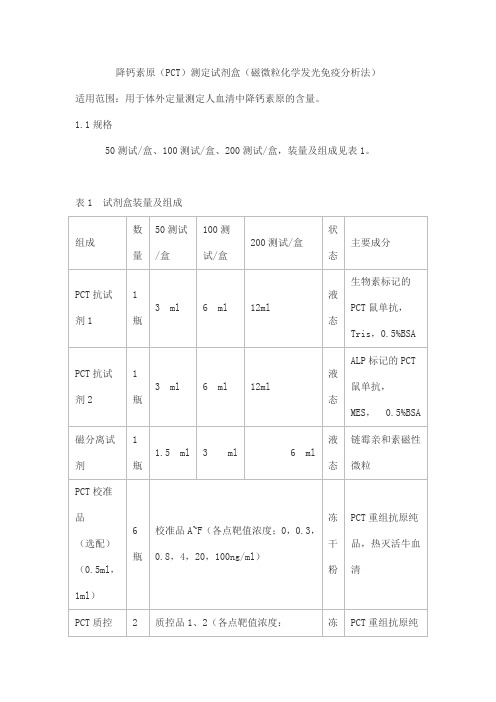
降钙素原(PCT)测定试剂盒(磁微粒化学发光免疫分析法)适用范围:用于体外定量测定人血清中降钙素原的含量。
1.1规格50测试/盒、100测试/盒、200测试/盒,装量及组成见表1。
表1 试剂盒装量及组成2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后为均匀悬浊液,无明显凝集;2.1.3 液体组分应澄清,无沉淀或絮状物;2.1.4 包装标签应清晰,无磨损。
2.2准确度将已知浓度的PCT抗原加入到样本中,其回收率应在(85%~115%)范围内。
2.3空白检测限应不大于0.02ng/ml。
2.4线性在(0.02,100)ng/ml的测量范围内,试剂盒的相关系数r应≥0.99。
2.5重复性变异系数(CV)应不大于10%。
2.6质控品测值测值应在质控范围内。
2.7批间差批间变异系数(CV)应不大于15%。
2.8校准品瓶间差校准品的瓶间变异系数(CV)应不大于10%。
2.9分析特异性2.9.1 浓度不低于5000pg/ml白介素(IL-6)的零浓度PCT样本,在本试剂盒上测定结果应不高于0.03ng/ml。
2.9.2 浓度不低于10ng/ml降钙素(CT)的零浓度PCT样本,在本试剂盒上测试结果应不高于0.02ng/ml。
2.10稳定性2.10.1效期稳定性:试剂盒在2℃~8℃贮存,有效期为12个月,到效期后的试剂盒检测外观、准确度、空白检测限、线性、重复性和质控品测值,应符合2.1~2.6的要求。
2.10.2复溶稳定性:校准品与质控品复溶后,在2℃~8℃环境下保存3天后进行以下检测:a)校准品:进行准确度、质控品测值的检测,结果应符合2.2,2.6的要求。
b)质控品:进行质控品测值的检测,结果应符合2.6的要求。
人降钙素原(PCT)ELISA试剂盒说明书

人降钙素原(PCT)酶联免疫吸附测定试剂盒使用说明书厦门慧嘉生物科技有限公司本试剂盒仅供体外研究使用、不用于临床诊断!预期应用ELISA法定量测定人血清、血浆或其它相关生物液体中PCT含量。
实验原理用纯化的PCT抗体包被微孔板,制成固相载体,往微孔中依次加入标本或标准品、生物素化的PCT抗体、HRP标记的亲和素,经过彻底洗涤后用底物(TMB)显色。
TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的PCT呈正相关。
用酶标仪在450nm波长下测定吸光度(值),计算样品浓度。
试剂盒组成及试剂配制1、酶标板:一块(96孔)2、标准品(冻干品): 2瓶,请临用前15分钟内配制。
每瓶以样品稀释液稀释至1ml,盖好后室温静置大约10分钟,同时反复颠倒/搓动以助溶解,其浓度为2,000 pg/ml,将其稀释为1,000 pg/ml后,再做系列倍比稀释(注:不要直接在板中进行倍比稀释),分别配制成1,000 pg/ml,500 pg/ml,250 pg/ml,125 pg/ml,62.5 pg/ml,31.2 pg/ml,15.6 pg/ml,样品稀释液直接作为空白孔 0 pg/ml。
如配制500 pg/ml标准品:取0.5ml(不要少于0.5ml )1,000 pg/ml的上述标准品加入含有0.5ml样品稀释液的Eppendorf 管中,混匀即可,其余浓度以此类推。
3、样品稀释液:1×20ml。
4、检测稀释液A:1×10ml。
5、检测稀释液B:1×10ml。
6、检测溶液A:1×120/瓶(1:100)。
临用前以检测稀释液A 1:100稀释(如:10 检测溶液A / 990检测稀释液A),充分混匀,稀释前根据预先计算好的每次实验所需的总量配制(100/孔),实际配制时应多配制 0.1-0.2ml。
7、检测溶液B:1×120/瓶(1:100)。
降钙素原(PCT)测定试剂盒(时间分辨荧光免疫层析法)产品技术要求注册版

医疗器械产品技术要求编号:降钙素原(PCT)测定试剂盒(时间分辨荧光免疫层析法)1.产品型号/规格及其划分说明1.1包装规格25人份/盒。
1.2主要组成成分由PCT测试卡、降钙素原(PCT)质控品、ID卡组成。
其中,PCT测试卡由试纸条、塑料盒组成;试纸条上的主要成分有硝基纤维素膜、吸水纸、样本垫、偶合物垫及PVC板;硝基纤维素膜包被有鼠抗人PCT抗体和羊抗鸡IgY抗体;样本垫上有鼠抗人红细胞抗体;偶合物垫上有荧光标记的鼠抗人PCT抗体和荧光标记的鸡IgY抗体。
降钙素原(PCT)质控品:重组人PCT蛋白。
ID卡:内含校准曲线信息。
1.3适用范围:用于体外定量测定人全血、血浆或血清中降钙素原(PCT)的含量。
临床上主要用于细菌感染性疾病的辅助诊断。
2.产品性能指标2.1试剂盒性能指标2.1.1外观a)试剂盒外观应整洁,文字符号标识清晰,封装无破损,内容物齐全。
b)测试卡外观应平整、色泽均匀、边缘无毛刺,无色斑或污渍,卡固定紧密。
2.1.2膜条宽度膜条宽度应不小于 1.4mm。
2.1.3液体移行速度液体移行速度应不低于10mm/min。
2.1.4准确度测定具有溯源性的PCT工作校准品,测量结果与标定浓度的相对偏差应不超过±10%。
2.1.5空白限应不大于0.04ng/mL。
2.1.6线性范围在0.05ng/mL~100ng/mL区间内,线性相关系数r≥0.9900。
2.1.7批内精密度用同一批次的试剂盒,两个浓度工作校准品测定结果的变异系数CV<10.0%。
2.1.8批间精密度用三个不同批次的试剂盒测试,两个浓度工作校准品测定结果的变异系数CV<15.0%。
2.2质控品性能指标2.2.1外观无色澄清透明液体。
2.2.2装量质控品装量为0.5mL,应不少于标示值。
2.2.3准确度和赋值程序质控品测试结果应在靶值范围之内,赋值程序见附录1。
2.2.4均一性对一瓶质控品重复10次检测,对同一批号的10瓶质控品进行检测,批内瓶间差CV应≤15%。
降钙素原(PCT)测定试剂盒(磁微粒化学发光免疫分析法)产品技术要求puenguangde
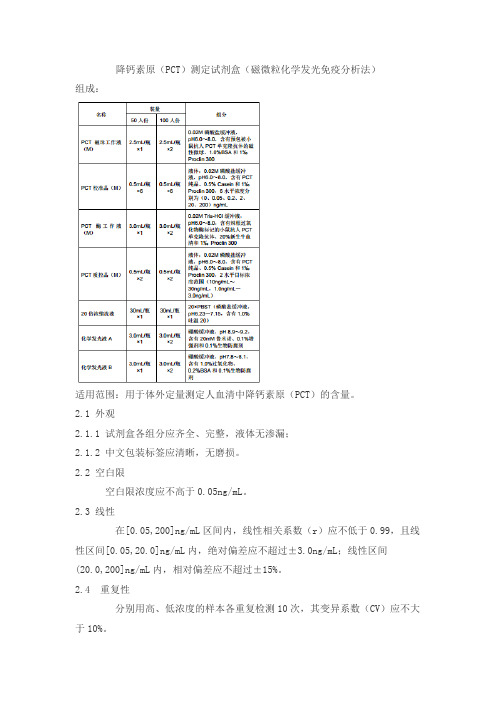
降钙素原(PCT)测定试剂盒(磁微粒化学发光免疫分析法)组成:适用范围:用于体外定量测定人血清中降钙素原(PCT)的含量。
2.1 外观2.1.1 试剂盒各组分应齐全、完整,液体无渗漏;2.1.2 中文包装标签应清晰,无磨损。
2.2 空白限空白限浓度应不高于0.05ng/mL。
2.3 线性在[0.05,200]ng/mL区间内,线性相关系数(r)应不低于0.99,且线性区间[0.05,20.0]ng/mL内,绝对偏差应不超过±3.0ng/mL;线性区间(20.0,200]ng/mL内,相对偏差应不超过±15%。
2.4 重复性分别用高、低浓度的样本各重复检测10次,其变异系数(CV)应不大于10%。
2.5 准确度将纯品配制的溶液(A)加入到人源样本(B)中,其回收率应在85%~115%之间。
2.6 分析特异性将下表规定浓度的干扰物质用试剂盒进行测定,检测结果的浓度值不得超过0.05ng/mL。
2.7 溯源性根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容。
校准品溯源至企业工作校准品,并与已上市产品比对赋值。
2.8 质控品赋值有效性本试剂盒质控品的测定结果应在质控范围内。
2.9 批间差用3个批号的产品分别检测同一份样本,3批产品间的相对极差(R)应不大于15%。
2.10稳定性试剂盒在(2~8)℃储存条件下的有效期为12个月,试剂盒在规定的条件下保存,取到效期后的试剂盒进行检测,检验结果应符合2.1、2.2、2.3、2.4、2.5、2.6的规定。
降钙素原(PCT)测定试剂盒(胶体金免疫层析法)产品技术要求meikang

降钙素原(PCT)测定试剂盒(胶体金免疫层析法)适用范围:用于体外定量检测人血清中的降钙素原,与南京美宁康诚生物科技有限公司生产的Mokosensor-A300型胶体金免疫分析仪配套使用。
1.1 包装规格20人份/盒、100人份/盒。
1.2 主要组成成分由相应人份的检测卡组成,其中,检测卡:检测线包被来源于小鼠的降钙素原单克隆抗体A、质控线包被羊抗鼠IgG多克隆抗体、金标垫上固定胶体金标记来源于小鼠的降钙素原单克隆抗体B。
2.1外观2.1.1外观平整,材料附着牢固,内容齐全,包装标签应清晰;2.1.2膜条宽度为4mm±0.2mm;2.1.3液体移行速度应不低于10mm/min。
2.2 空白限不高于0.10μg/L。
2.3 线性2.3.1试剂盒线性范围为[0.10,100.00]μg/L,线性相关系数r不低于0.9900;2.3.2 [0.10,0.25]μg/L绝对偏差不超过±0.02μg/L,(0.25,100.00]μg/L 线性偏差在±10%范围内。
2.4重复性检测高、低两个浓度的样本,变异系数(CV)应不大于10% 。
2.5准确度回收率在85%~115%。
2.6分析特异性检测浓度为100.00μg/L超敏C反应蛋白中降钙素原的浓度,计算交叉反应率,应小于10%。
2.7批间差检测一个高浓度的样本,相对极差应在±10%范围内。
2.8稳定性:常温(10℃~30℃)保存,有效期12个月,有效期末分别检测2.2~2.5项,其结果应符合各项要求。
2.9 校准品溯源性试剂盒校准信息所用校准品按照GB/T 21415-2008 《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,溯源到本公司工作校准品,工作校准品通过已上市产品试剂盒比对赋值。
降钙素原(PCT)测定试剂盒(荧光免疫层析法)产品技术要求puenguangde

降钙素原(PCT)测定试剂盒(荧光免疫层析法)
适用范围:用于体外定量测定人血清、血浆或全血中降钙素原(PCT)含量。
1.1包装规格
10人份/盒,25人份/盒,50人份/盒。
1.2主要组成成分
试剂盒由PCT荧光免疫层析检测卡、PCT样品稀释液(F)、PCT校准卡组成,各组分及数量见表1。
表1:试剂盒组成成分
2.1外观
外包装盒应完整,无破损;单包铝箔袋应完整,无破损,保持密封包装;液体组分应澄清透明,无沉淀、无渗漏。
2.2物理性状
2.2.1 试纸条的宽度:应不超于(
3.40±0.10)mm 。
2.2.2 液体移行速度:应不低于5mm/min。
2.3空白检出限
空白检出限浓度应不高于0.05ng/ml。
2.4线性范围
在[0.05,40]ng/ml范围内线性相关系数r≥0.990。
2.5精密度
2.5.1 重复性
变异系数CV不超于15%。
2.5.2 批间差
变异系数CV不超于20%。
2.6准确度
回收率应在85%~115%之间。
2.7分析特异性
测试按表2规定浓度范围的降钙素、白介素-6、C反应蛋白的样品,检测结果应不超过0.1ng/ml。
表2:交叉反应物及浓度列表
2.8效期稳定性试验
试剂盒2℃~30℃保存,铝箔袋密封状态下存放,取有效期满后两个月内的产品进行检测,结果应符合2.2、2.3、2.4、2.5.1、2.6项要求。
降钙素原(PCT)检测试剂盒(免疫层析法)产品技术要求模板

医疗器械产品技术要求编号:
降钙素原(PCT)检测试剂盒(免疫层析法)
1.产品型号/规格及划分说明
1.1产品型号/规格
20人份/盒。
1.2结构组成
由检测卡、干燥剂、比色卡、使用说明书组成。
其中:检测卡由检测区(T)(鼠抗PCT单抗)、质控区(C)(羊抗鼠IgG)和胶体金结合物(胶体金鼠抗PCT单抗)和硝酸纤维素膜支持物等组成。
1.3 适用范围
适用于体外检测全血、血浆或血清样本中的降钙素原(PCT)的含量。
2.性能指标
2.1外观及性状
2.1.1检测卡应无明显划痕、气泡、外观平整,材料附着牢固。
2.1.2检测卡的文字和标记应清晰、准确。
2.2膜条宽度
检测条的宽度应≥2.5mm。
2.3液体移行速度
液体移行速度应不低于 10mm/分钟。
2.4灵敏度(最低检出限)
本试剂盒对 PCT 最低检出限为 0.1ng/mL。
2.5检测范围
本试剂盒对 PCT 检测范围为 0.1ng/mL~250.0ng/mL。
2.6特异性
当样本中血红蛋白(Hb)浓度≤9mg/mL,胆红素(Bil)浓度≤0.5mg/mL,甘油三酯(TG)浓度≤18mg/mL 时,对试剂盒检测结果无干扰。
2.7精密度
2.7.1批内精密度
取同一批号试剂对精密度参考品分别进行 10 次测定,反应结果应一致,且显色度应均一。
2.7.2批间精密度
分别取连续三个批号试剂对精密度参考品分别进行 10 次测定,反应结果应一致,且显色度应均一。
1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
降钙素原(PCT)测定试剂盒(化学发光免疫分析法)
2.性能指标
2.1外观
试剂盒上标签标识内容应清晰,无磨损;试剂盒无破损,试剂盒内各组份齐全、完整,液体无渗漏。
试剂盒各组分外观和性状为:Rm 应为含棕色固体微粒的液体,无板结、无絮状物;Rb、Rd、清洗液和发光液均应为清澈透明的液体,无沉淀、无絮状物。
校准品和质控品冻干组分呈疏松体,加入纯化水后应在10min 内完全溶解,溶液无沉淀或絮状物
2.2装量
试剂盒内各组分装量不少于标示量。
2.3线性
本试剂盒的测定范围为0.02ng/mL~100ng/mL 的范围内,相关系数r≥0.9900。
2.4检出限
本试剂盒的检出限:≤0.02ng/mL。
2.5准确度
用具有溯源性的正确度控制品作为样本进行检测,其测量结果的相对偏差应
在±15%范围内。
2.6重复性
测试(0.5±0.1)ng/mL 和(10±1)ng/mL 两个区间样本,所得结果的变异系数(CV)应不大于10%。
2.7批间差
测试(0.5±0.1)ng/mL 和(10±1)ng/mL 两个区间样本,所得结果的变异系数(CV)应不大于15%。
2.8校准品均一性
校准品A 和B 瓶间变异系数(CV)应不大于10%,校准品C 瓶间变异系数
(CV)应不大于20%。
2.9校准品准确度
校准品A 和B 测量结果的相对偏差应在±10%范围内,校准品C 浓度应不大于0.02ng/mL。
2.10质控品均一性
质控品瓶间变异系数(CV)应不大于10%。
2.11质控品测定值
以质控品作为样本进行检测,其检测结果应在试剂盒规定的范围内。
