高中化学必修一二化学方程式汇总
人教版高中化学必修一必修二化学方程式汇总

必修一、必修二化学方程式汇总必修一1、硫酸根离子的检验: BaCl2 + Na2SO4 ==== BaSO4↓+ 2NaCl2、碳酸根离子的检验: CaCl2 + Na2CO3 ===== CaCO3↓ + 2NaCl3、碳酸钠与盐酸反应: Na2CO3 + 2HCl ===== 2NaCl + H2O + CO2↑4、木炭还原氧化铜: 2CuO + C 高温2Cu + CO2↑5、铁片与硫酸铜溶液反应: Fe + CuSO4 ===== FeSO4 + Cu6、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 ===== CaCO3↓+ 2NaCl7、钠在空气中燃烧:2Na + O2 Na2O2钠与氧气反应:4Na + O2 ==== 2Na2O8、过氧化钠与水反应:2Na2O2 + 2H2O ==== 4NaOH + O2↑9、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 ==== 2Na2CO3 + O210、钠与水反应:2Na + 2H2O ==== 2NaOH + H2↑11、铁与水蒸气反应:3Fe + 4H2O(g) ==== Fe3O4 + 4H2↑12、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O ==== 2NaAlO2 + 3H2↑13、氧化钙与水反应:CaO + H2O ==== Ca(OH)214、氧化铁与盐酸反应:Fe2O3 + 6HCl ===== 2FeCl3 + 3H2O15、氧化铝与盐酸反应:Al2O3 + 6HCl ===== 2AlCl3 + 3H2O16、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH ===== 2NaAlO2 + H2O17、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH ===== Fe(OH)3↓+ 3NaCl18、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH ==== Fe(OH)2↓+ Na2SO419、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 ==== 4Fe(OH)320、氢氧化铁加热分解:2Fe(OH)3 Fe2O3 + 3H2O↑21、实验室制取氢氧化铝:Al2(SO4)3 + 6NH3·H2O ==== 2Al(OH)3↓ + 3(NH3)2SO422、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl ==== AlCl3 + 3H2O23、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH ==== NaAlO2 + 2H2O24、氢氧化铝加热分解:2Al(OH)3 Al2O3 + 3H2O25、三氯化铁溶液与铁粉反应:2FeCl3 + Fe ==== 3FeCl226、氯化亚铁中通入氯气:2FeCl2 + Cl2 ===== 2FeCl327、二氧化硅与氢氟酸反应:SiO2 + 4HF ==== SiF4 + 2H2O硅单质与氢氟酸反应:Si + 4HF ==== SiF4 + 2H2↑28、二氧化硅与氧化钙高温反应:SiO2 + CaO 高温CaSiO329、二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH ==== Na2SiO3 + H2O30、往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O === Na2CO3 + H2SiO3↓31、硅酸钠与盐酸反应:Na2SiO3 + 2HCl === 2NaCl + H2SiO3↓32、氯气与金属铁反应:2Fe + 3Cl2点燃2FeCl333、氯气与金属铜反应:Cu + Cl2点燃CuCl234、氯气与金属钠反应:2Na + Cl2点燃2NaCl35、氯气与水反应:Cl2 + H2O ==== HCl + HClO36、次氯酸光照分解:2HClO 光照2HCl + O2↑37、氯气与氢氧化钠溶液反应:Cl2 + 2NaOH ===== NaCl + NaClO + H2O38、氯气与消石灰反应:2Cl2 + 2Ca(OH)2 ==== CaCl2 + Ca(ClO)2 + 2H2O39、盐酸与硝酸银溶液反应:HCl + AgNO3 ==== AgCl↓ + HNO340、漂白粉长期置露在空气中:Ca(ClO)2 + H2O + CO2 ==== CaCO3↓ + 2HClO41、二氧化硫与水反应:SO2 + H2O === H2SO342、氮气与氧气在放电下反应:N2 + O2放电2NO43、一氧化氮与氧气反应:2NO + O2 ==== 2NO244、二氧化氮与水反应:3NO2 + H2O ==== 2HNO3 + NO45、二氧化硫与氧气在催化剂的作用下反应:2SO2 + O2催化剂2SO346、三氧化硫与水反应:SO3 + H2O ==== H2SO447、浓硫酸与铜反应:Cu + 2H2SO4(浓) CuSO4 + 2H2O + SO2↑48、浓硫酸与木炭反应:C + 2H2SO4(浓) CO2↑+ 2SO2↑ + 2H2O49、浓硝酸与铜反应:Cu + 4HNO3(浓) ==== Cu(NO3)2 + 2H2O + 2NO2↑50、稀硝酸与铜反应:3Cu + 8HNO3(稀) 3Cu(NO3)2 + 4H2O + 2NO↑51、氨水受热分解:NH3·H2O NH3↑ + H2O52、氨气与氯化氢反应:NH3 + HCl ==== NH4Cl53、氯化铵受热分解:NH4Cl NH3↑ + HCl↑54、碳酸氢氨受热分解:NH4HCO3 NH3↑ + H2O↑ + CO2↑55、硝酸铵与氢氧化钠反应:NH4NO3 + NaOH NH3↑ + NaNO3 + H2O56、氨气的实验室制取:2NH4Cl + Ca(OH)2 CaCl2 + 2H2O + 2NH3↑57、氯气与氢气反应:Cl2 + H2点燃2HCl58、硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH 2NH3↑ + Na2SO4 + 2H2O59、SO2 + CaO ==== CaSO360、SO2 + 2NaOH ==== Na2SO3 + H2O61、SO2 + Ca(OH)2 ==== CaSO3↓ + H2O62、SO2 + Cl2 + 2H2O ==== 2HCl + H2SO463、SO2 + 2H2S ==== 3S + 2H2O64、NO、NO2的回收:NO2 + NO + 2NaOH ==== 2NaNO2 + H2O65、Si + 2F2 === SiF466、Si + 2NaOH + H2O ==== Na2SiO3 +2H2↑67、硅单质的实验室制法粗硅的制取:SiO2 + 2C 高温电炉Si + 2CO(石英沙)(焦碳)(粗硅)粗硅转变为纯硅:Si(粗) + 2Cl2 SiCl4SiCl4 + 2H2高温Si(纯)+ 4HCl必修二第一章物质结构元素周期律1、Li与O2反应(点燃): 4Li + O2 2Li2 ONa与O2反应(点燃): 2Na+O2Na2O2Na与H2O反应: 2Na+2H2O===2NaOH+H2↑K与H2O反应: 2K+2H2O===2KOH+H2↑2、卤素单质F2、Cl2、Br2、I2与氢气反应:F2 + H2 === 2HF Cl2 + H2 === 2HCl Br2 + H2 === 2Br I2 + H2 === 2HI 3、卤素单质间的置换反应:(1)氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:① Cl2+2NaBr===Br2+2NaCl ② Cl2+2NaI===I2+2NaCl(2)溴水与碘化钠溶液反应:Br2+2NaI===I2+2NaBr4、Mg与H2O反应:Mg+2H2O === Mg(OH)2+H2↑Al与HCl反应: 2Al+6HCl===2AlCl3+3H2↑Mg与HCl反应: Mg+2 HCl === MgCl2+ H2↑5、Na与Cl2反应(点燃):6、用电子式表示氯化氢的形成过程:第二章化学反应与能量1、Ba(OH)2•8H2O与NH4Cl的反应 : Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O2、原电池原理典型的原电池(Zn-Cu原电池)负极(锌):Zn-2e-===Zn2+(氧化反应)正极(铜):2H++2e-===H2↑(还原反应)电子流动方向:由锌经过外电路流向铜。
人教版高中化学必修一必修二化学方程式汇总

必修一、必修二化学方程式汇总必修一1、硫酸根离子的检验: BaCl2 + Na2SO4 ==== BaSO4↓+ 2NaCl2、碳酸根离子的检验: CaCl2 + Na2CO3 ===== CaCO3↓ + 2NaCl3、碳酸钠与盐酸反应: Na2CO3 + 2HCl ===== 2NaCl + H2O + CO2↑4、木炭还原氧化铜: 2CuO + C 高温2Cu + CO2↑5、铁片与硫酸铜溶液反应: Fe + CuSO4 ===== FeSO4 + Cu6、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 ===== CaCO3↓+ 2NaCl7、钠在空气中燃烧:2Na + O2 Na2O2钠与氧气反应:4Na + O2 ==== 2Na2O8、过氧化钠与水反应:2Na2O2 + 2H2O ==== 4NaOH + O2↑9、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 ==== 2Na2CO3 + O210、钠与水反应:2Na + 2H2O ==== 2NaOH + H2↑11、铁与水蒸气反应:3Fe + 4H2O(g) ==== Fe3O4 + 4H2↑12、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O ==== 2NaAlO2 + 3H2↑13、氧化钙与水反应:CaO + H2O ==== Ca(OH)214、氧化铁与盐酸反应:Fe2O3 + 6HCl ===== 2FeCl3 + 3H2O15、氧化铝与盐酸反应:Al2O3 + 6HCl ===== 2AlCl3 + 3H2O16、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH ===== 2NaAlO2 + H2O17、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH ===== Fe(OH)3↓+ 3NaCl18、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH ==== Fe(OH)2↓+ Na2SO419、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 ==== 4Fe(OH)320、氢氧化铁加热分解:2Fe(OH)3 Fe2O3 + 3H2O↑21、实验室制取氢氧化铝:Al2(SO4)3 + 6NH3·H2O ==== 2Al(OH)3↓ + 3(NH3)2SO422、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl ==== AlCl3 + 3H2O23、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH ==== NaAlO2 + 2H2O24、氢氧化铝加热分解:2Al(OH)3 Al2O3 + 3H2O25、三氯化铁溶液与铁粉反应:2FeCl3 + Fe ==== 3FeCl226、氯化亚铁入氯气:2FeCl2 + Cl2 ===== 2FeCl327、二氧化硅与氢氟酸反应:SiO2 + 4HF ==== SiF4 + 2H2O硅单质与氢氟酸反应:Si + 4HF ==== SiF4 + 2H2↑28、二氧化硅与氧化钙高温反应:SiO2 + CaO 高温CaSiO329、二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH ==== Na2SiO3 + H2O30、往硅酸钠溶液入二氧化碳:Na2SiO3 + CO2 + H2O === Na2CO3 + H2SiO3↓31、硅酸钠与盐酸反应:Na2SiO3 + 2HCl === 2NaCl + H2SiO3↓32、氯气与金属铁反应:2Fe + 3Cl2点燃2FeCl333、氯气与金属铜反应:Cu + Cl2点燃CuCl234、氯气与金属钠反应:2Na + Cl2点燃2NaCl35、氯气与水反应:Cl2 + H2O ==== HCl + HClO36、次氯酸光照分解:2HClO 光照2HCl + O2↑37、氯气与氢氧化钠溶液反应:Cl2 + 2NaOH ===== NaCl + NaClO + H2O38、氯气与消石灰反应:2Cl2 + 2Ca(OH)2 ==== CaCl2 + Ca(ClO)2 + 2H2O39、盐酸与硝酸银溶液反应:HCl + AgNO3 ==== AgCl↓ + HNO340、漂白粉长期置露在空气中:Ca(ClO)2 + H2O + CO2 ==== CaCO3↓ + 2HClO41、二氧化硫与水反应:SO2 + H2O === H2SO342、氮气与氧气在放电下反应:N2 + O2放电2NO43、一氧化氮与氧气反应:2NO + O2 ==== 2NO244、二氧化氮与水反应:3NO2 + H2O ==== 2HNO3 + NO45、二氧化硫与氧气在催化剂的作用下反应:2SO2 + O2催化剂2SO346、三氧化硫与水反应:SO3 + H2O ==== H2SO447、浓硫酸与铜反应:Cu + 2H2SO4(浓) CuSO4 + 2H2O + SO2↑48、浓硫酸与木炭反应:C + 2H2SO4(浓) CO2↑+ 2SO2↑ + 2H2O49、浓硝酸与铜反应:Cu + 4HNO3(浓) ==== Cu(NO3)2 + 2H2O + 2NO2↑50、稀硝酸与铜反应:3Cu + 8HNO3(稀) 3Cu(NO3)2 + 4H2O + 2NO↑51、氨水受热分解:NH3·H2O NH3↑ + H2O52、氨气与氯化氢反应:NH3 + HCl ==== NH4Cl53、氯化铵受热分解:NH4Cl NH3↑ + HCl↑54、碳酸氢氨受热分解:NH4HCO3 NH3↑ + H2O↑ + CO2↑55、硝酸铵与氢氧化钠反应:NH4NO3 + NaOH NH3↑ + NaNO3 + H2O56、氨气的实验室制取:2NH4Cl + Ca(OH)2 CaCl2 + 2H2O + 2NH3↑57、氯气与氢气反应:Cl2 + H2点燃2HCl58、硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH 2NH3↑ + Na2SO4 + 2H2O59、SO2 + CaO ==== CaSO360、SO2 + 2NaOH ==== Na2SO3 + H2O61、SO2 + Ca(OH)2 ==== CaSO3↓ + H2O62、SO2 + Cl2 + 2H2O ==== 2HCl + H2SO463、SO2 + 2H2S ==== 3S + 2H2O64、NO、NO2的回收:NO2 + NO + 2NaOH ==== 2NaNO2 + H2O65、Si + 2F2 === SiF466、Si + 2NaOH + H2O ==== Na2SiO3 +2H2↑67、硅单质的实验室制法粗硅的制取:SiO2 + 2C 高温电炉Si + 2CO(石英沙)(焦碳)(粗硅)粗硅转变为纯硅:Si(粗) + 2Cl2 SiCl4SiCl4 + 2H2高温Si(纯)+ 4HCl必修二第一章物质结构元素周期律1、Li与O2反应(点燃): 4Li + O2 2Li2 ONa与O2反应(点燃): 2Na+O2Na2O2Na与H2O反应: 2Na+2H2O===2NaOH+H2↑K与H2O反应: 2K+2H2O===2KOH+H2↑2、卤素单质F2、Cl2、Br2、I2与氢气反应:F2 + H2 === 2HF Cl2 + H2 === 2HCl Br2 + H2 === 2Br I2 + H2 === 2HI 3、卤素单质间的置换反应:(1)氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:① Cl2+2NaBr===Br2+2NaCl ② Cl2+2NaI===I2+2NaCl(2)溴水与碘化钠溶液反应:Br2+2NaI===I2+2NaBr4、Mg与H2O反应:Mg+2H2O === Mg(OH)2+H2↑Al与HCl反应: 2Al+6HCl===2AlCl3+3H2↑Mg与HCl反应: Mg+2 HCl === MgCl2+ H2↑5、Na与Cl2反应(点燃):6、用电子式表示氯化氢的形成过程:第二章化学反应与能量1、Ba(OH)2•8H2O与NH4Cl的反应 : Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O2、原电池原理典型的原电池(Zn-Cu原电池)负极(锌):Zn-2e-===Zn2+(氧化反应)正极(铜):2H++2e-===H2↑(还原反应)电子流动方向:由锌经过外电路流向铜。
必修一必修二化学方程式汇总

必修一必修二化学方程式汇总化学方程式是化学变化的一种表达方式,用化学符号和化学式表示化学变化中参与物质的种类和数量。
必修一和必修二中有许多重要的化学方程式,下面对其中的一些进行汇总。
必修一中的化学方程式:1.金属与非金属的单质反应:-2Na+Cl2-->2NaCl(氯化钠的合成)2.酸与碱的中和反应:-HCl+NaOH-->NaCl+H2O(氯化钠的合成)3.金属与酸的反应:-Mg+2HCl-->MgCl2+H2(氯化镁的合成)4.氧化还原反应:-2Fe+3Cl2-->2FeCl3(三氯化铁的合成)必修二中的化学方程式:1.酸碱滴定反应:-HClO4+NaOH-->NaClO4+H2O(高氯酸钠的合成)2.氧化还原反应:-FeSO4+H2O2-->Fe2(SO4)3+H2O(硫酸铁(III)的合成)3.燃烧反应:-CH4+2O2-->CO2+2H2O(二氧化碳和水的生成)4.酸碱中和反应:-HClO3+NaOH-->NaClO3+H2O(高氯酸钠的合成)5.酸碱滴定反应:-H2SO4+2NaOH-->Na2SO4+2H2O(硫酸钠的合成)以上只是一部分重要的化学方程式,其中涉及了单质反应、酸碱反应、氧化还原反应和燃烧反应等。
这些方程式是化学反应的核心内容,通过它们可以了解化学变化的过程和产物,进而深入理解化学的基本概念和原理。
化学方程式的学习对于化学学科的学习至关重要。
掌握了方程式的书写和解析,能够更好地理解化学反应的机理和过程,有助于深入理解化学的基本概念和原理。
通过大量的练习,可以提高对方程式的运用能力,培养化学思维和分析问题的能力。
化学方程式是化学学科中的基础知识,实际应用广泛。
在工业生产、环境保护、农业生产等方面,化学方程式的应用都发挥着重要的作用。
只有深入理解化学方程式的原理和规律,才能更好地利用化学的力量,解决实际问题。
总之,化学方程式是化学变化的一种表达方式,必修一和必修二中的化学方程式涉及了单质反应、酸碱反应、氧化还原反应和燃烧反应等多个方面,掌握了这些方程式对于理解化学的基本概念和原理、提高分析和解决问题的能力都具有重要意义。
高中化学必修一必修二必备化学方程式归纳汇总

高中化学必修一必修二必备化学方程式归纳汇总高中化学是一门重要的自然科学课程,它为我们了解物质的本质和变化规律提供了基础知识。
在高中化学学习过程中,我们经常会接触到各种化学方程式。
下面,我将为大家归纳汇总必修一、必修二中的一些重要化学方程式。
一、必修一中的重要化学方程式:1.酸和金属的反应:酸+金属=相应的盐+氢气例如:2HCl+Zn=ZnCl2+H22.酸和碱的中和反应:酸+碱=相应的盐+水例如:HCl+NaOH=NaCl+H2O3.酸和碳酸盐的反应:酸+碳酸盐=相应的盐+水+二氧化碳例如:2HCl+CaCO3=CaCl2+H2O+CO24.金属氧化物和非金属氧化物的反应:金属氧化物+非金属氧化物=相应的盐例如:CaO+CO2=CaCO35.燃烧反应:烃+氧气=二氧化碳+水例如:C3H8+5O2=3CO2+4H2O6.金属与盐酸的反应:金属+盐酸=氯化金属+氢气例如:Zn+2HCl=ZnCl2+H27.碱金属和水的反应:2M+2H2O=2MOH(碱式)+H2例如:2Na+2H2O=2NaOH+H28.实验室制取氢气:锌与稀硫酸反应生成氢气:Zn+H2SO4=ZnSO4+H2以上是必修一中一些重要的化学方程式。
这些方程式反映了化学反应的变化过程,通过学习和掌握这些方程式,我们可以更好地理解化学的基本原理和规律。
二、必修二中的重要化学方程式:1.相对分子质量的计算:相对分子质量=各原子的相对原子质量之和例如:H2O的相对分子质量=2*1+16=182.电极反应:电解质溶液中的正极反应:正极:离子的还原→金属例如:2H++2e-=H2电解质溶液中的负极反应:负极:正离子的氧化→气体、非金属元素或非金属氧化物(除还原物)例如:2Cl-=Cl2+2e-3.阳离子分离检验:铁离子的检验:Fe2++3OH-=Fe(OH)3↓Fe3++3OH-=Fe(OH)3↓铜离子的检验:Cu2++2OH-=Cu(OH)2↓以上是必修二中一些重要的化学方程式。
人教版高中化学必修一必修二化学方程式汇总

必修一、必修二化学方程式汇总必修一1 、硫酸根离子的检验: B a C l2 + N a 2 S O 4 = = = = B a S O 4 ↓+ 2 N a C l2 、碳酸根离子的检验: C a C l 2 + N a 2 C O3 = = = = = C a C O 3 ↓+ 2 N a C l3 、碳酸钠与盐酸反应: N a 2 C O 3 + 2 H C l = = = = = 2 N a C l + H 2 O + C O 2 ↑高温4 、木炭还原氧化铜: 2 C u O + C 2 C u + C O 2 ↑5 、铁片与硫酸铜溶液反应: F e + C u S O 4 = = = = = F e S O 4 + C u6 、氯化钙与碳酸钠溶液反应: C a C l 2 + N a 2 C O 3 = = = = = C a C O 3 ↓+ 2 N a C l7 、钠在空气中燃烧: 2 N a + O 2 N a 2 O 2钠与氧气反应: 4 N a + O 2 = = = = 2 N a 2 O8 、过氧化钠与水反应: 2 N a 2 O 2 + 2 H 2 O = = = = 4 N a O H + O 2 ↑9 、过氧化钠与二氧化碳反应: 2 N a 2 O 2 + 2 C O 2 = = = = 2 N a 2 C O 3 + O 21 0 、钠与水反应:2 N a + 2 H 2 O = = = = 2 N a O H + H 2 ↑1 1 、铁与水蒸气反应: 3 F e + 4 H2 O ( g ) = = = = F e3 O4 + 4 H 2 ↑1 2 、铝与氢氧化钠溶液反应: 2 A l + 2 N a O H + 2 H 2 O = = = = 2 N a A l O 2 + 3 H 2 ↑1 3 、氧化钙与水反应: C a O + H2 O = = = = C a ( O H ) 21 4 、氧化铁与盐酸反应: F e2 O3 + 6 H C l = = = = = 2 F e C l 3 + 3 H 2 O第 1 页共11 页1 5 、氧化铝与盐酸反应: A l2 O3 + 6 H C l = = = = = 2 A l C l 3 + 3 H 2 O1 6 、氧化铝与氢氧化钠溶液反应: A l2 O3 + 2 N a O H = = = = = 2 N a A l O 2 + H 2 O1 7 、氯化铁与氢氧化钠溶液反应: F e C l 3 + 3 N a O H = = = = = F e ( O H ) 3 ↓+ 3 N a C l1 8 、硫酸亚铁与氢氧化钠溶液反应: F e S O 4 +2 N a O H = = = = F e ( O H ) 2 ↓+ N a 2 S O 41 9 、氢氧化亚铁被氧化成氢氧化铁: 4 F e ( O H )2 + 2 H 2 O + O 2 = = = = 4 F e ( O H ) 32 0 、氢氧化铁加热分解: 2 F e ( O H )3 F e 2 O 3 + 3 H 2 O ↑2 1 、实验室制取氢氧化铝: A l 2 ( S O 4 )3 + 6 N H 3 ·H 2 O = = = =2 A l ( O H )3 ↓+ 3 ( N H 3 ) 2 S O 42 2 、氢氧化铝与盐酸反应: A l ( O H )3 + 3 H C l = = = = A l C l 3 + 3 H 2 O2 3 、氢氧化铝与氢氧化钠溶液反应: A l ( O H ) 3 + N a O H = = = = N a A l O 2 + 2 H 2 O2 4 、氢氧化铝加热分解: 2 A l ( O H )3 A l 2 O 3 + 3 H 2 O2 5 、三氯化铁溶液与铁粉反应: 2 F e C l3 + F e = = = = 3 F e C l 22 6 、氯化亚铁中通入氯气: 2 F e C l 2 + C l 2 = = = = = 2 F e C l 32 7 、二氧化硅与氢氟酸反应:S i O 2 + 4 H F = = = = S i F 4 + 2 H 2 O硅单质与氢氟酸反应:S i + 4 H F = = = = S i F 4 + 2 H 2 ↑第 2 页共11 页高温2 8 、二氧化硅与氧化钙高温反应:S i O 2 + C a O C a S i O 32 9 、二氧化硅与氢氧化钠溶液反应:S i O 2 + 2 N a O H = = = = N a 2 S i O3 + H 2 O3 0 、往硅酸钠溶液中通入二氧化碳:N a 2 S i O 3 + C O 2 + H 2 O = = = N a 2 C O 3 + H 2 S i O 3 ↓3 1 、硅酸钠与盐酸反应:N a 2 S i O 3 + 2 H C l = = = 2 N a C l + H 2 S i O 3 ↓点燃3 2 、氯气与金属铁反应: 2 F e + 3 C l 2 2 F e C l 3点燃3 3 、氯气与金属铜反应: C u + C l 2 C u C l 2点燃3 4 、氯气与金属钠反应: 2 N a + C l 2 2 N a C l3 5 、氯气与水反应: C l 2 + H 2 O = = = = H C l + H C l O光照3 6 、次氯酸光照分解: 2 H C l O 2 H C l + O 2 ↑3 7 、氯气与氢氧化钠溶液反应: C l 2 + 2 N a O H = = = = = N a C l + N a C l O + H 2 O3 8 、氯气与消石灰反应: 2 C l 2 + 2 C a ( O H ) 2 = = = = C a C l 2 +C a ( C l O ) 2 + 2 H 2 O3 9 、盐酸与硝酸银溶液反应:H C l + A g N O 3 = = = = A g C l ↓+ H N O 34 0 、漂白粉长期置露在空气中: C a ( C l O ) 2 + H 2 O + C O 2 = = = = C a C O 3↓+ 2 H C l O4 1 、二氧化硫与水反应:S O 2 + H 2 O = = = H 2 S O 3第 3 页共11 页放电4 2 、氮气与氧气在放电下反应:N 2 + O 2 2 N O4 3 、一氧化氮与氧气反应: 2 N O + O 2 = = = = 2 N O 24 4 、二氧化氮与水反应: 3 N O 2 + H 2 O = = = = 2 H N O 3 + N O催化剂4 5 、二氧化硫与氧气在催化剂的作用下反应: 2 S O 2 + O 2 2 S O 34 6 、三氧化硫与水反应:S O 3 + H 2 O = = = = H 2 S O 44 7 、浓硫酸与铜反应: C u + 2 H 2 S O 4 ( 浓) C u S O 4 + 2 H 2 O + S O 2 ↑4 8 、浓硫酸与木炭反应: C + 2 H 2 S O 4 ( 浓) C O 2 ↑+ 2 S O 2 ↑+ 2 H 2 O 4 9 、浓硝酸与铜反应: C u + 4 H N O 3 ( 浓) = = = = C u ( N O 3 ) 2 + 2 H 2 O + 2 N O 2 ↑5 0 、稀硝酸与铜反应: 3 C u + 8 H N O 3 ( 稀) 3 C u ( N O 3 ) 2 + 4 H 2 O + 2 N O ↑5 1 、氨水受热分解:N H 3 ·H 2 O N H 3 ↑+ H 2 O5 2 、氨气与氯化氢反应:N H 3 + H C l = = = = N H 4 C l5 3 、氯化铵受热分解:N H 4 C l N H 3 ↑+ H C l ↑5 4 、碳酸氢氨受热分解:N H 4 H C O 3 N H 3 ↑+ H 2 O ↑+ C O 2 ↑5 5 、硝酸铵与氢氧化钠反应:N H 4 N O 3 + N a O H N H 3 ↑+ N a N O 3 +H 2 O第 4 页共11 页5 6 、氨气的实验室制取: 2 N H 4 C l + C a ( O H ) 2 C a C l 2 + 2 H 2 O + 2 N H 3 ↑点燃5 7 、氯气与氢气反应: C l 2 + H 2 2 H C l5 8 、硫酸铵与氢氧化钠反应:(N H 4 )2 S O 4 + 2 N a O H 2 N H 3 ↑+N a 2 S O 4 + 2 H 2 O5 9 、S O 2 + C a O = = = = C a S O 36 0 、S O 2 + 2 N a O H = = = = N a 2 S O 3 + H 2 O6 1 、S O 2 + C a ( O H ) 2 = = = = C a S O 3 ↓+ H 2 O6 2 、S O 2 + C l 2 + 2 H 2 O = = = = 2 H C l + H 2 S O 46 3 、S O 2 + 2 H 2 S = = = = 3 S + 2 H 2 O6 4 、N O 、N O 2 的回收:N O 2 + N O + 2 N a O H = = = = 2 N a N O 2 +H 2 O6 5 、S i + 2 F 2 = = = S i F 46 6 、S i + 2 N a O H + H 2 O = = = = N a 2 S i O 3 + 2 H 2 ↑6 7 、硅单质的实验室制法高温电炉粗硅的制取:S i O 2 + 2 C S i + 2 C O(石英沙)(焦碳)(粗硅)粗硅转变为纯硅:S i (粗)+ 2 C l 2 S i C l 4高温S i C l 4 + 2 H 2 S i (纯)+ 4 H C l第 5 页共11 页必修二第一章物质结构元素周期律1 、L i 与O2 反应(点燃): 4 L i + O 2 2 L i 2 ON a 与O 2 反应(点燃): 2 N a + O 2 N a 2 O 2N a 与H 2 O 反应: 2 N a + 2 H 2 O = = = 2 N a O H + H 2 ↑K 与H 2 O 反应: 2 K + 2 H 2 O = = = 2 K O H + H 2 ↑2 、卤素单质 F 2 、C l 2 、B r 2 、I 2 与氢气反应:F 2 + H 2 = = = 2 H F C l 2 + H 2 = = = 2 H C l B r 2 +H 2 = = = 2 B r I 2 + H 2 = = = 2 H I3 、卤素单质间的置换反应:(1 )氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:① C l 2 + 2 N a B r = = = B r 2 + 2 N a C l ②C l 2 + 2 N a I = = = I 2 + 2 N a C l(2 )溴水与碘化钠溶液反应: B r 2 + 2 N a I = = = I 2 + 2 N a B r4 、M g 与H 2 O 反应:M g + 2 H 2 O = = = M g ( O H ) 2 + H 2 ↑A l 与H C l 反应: 2 A l + 6 H C l = = = 2 A l C l 3 + 3 H 2 ↑M g 与H C l 反应: M g + 2 H C l = = = M g C l 2 + H 2 ↑5 、N a 与C l 2 反应(点燃):6 、用电子式表示氯化氢的形成过程:第二章化学反应与能量第 6 页共11 页1 、B a ( O H )2 ? 8 H 2 O 与N H 4 C l 的反应:B a ( O H ) 2 ·8 H 2 O + 2 N H 4C l = = B a C l 2 + 2 N H 3 ↑+ 1 0 H 2 O2 、原电池原理典型的原电池(Z n - C u 原电池)负极(锌):Z n - 2 e- == = Z n- = = = Z n2 +(氧化反应)正极(铜): 2 H + + 2 e - = = = H 2 ↑(还原反应)电子流动方向:由锌经过外电路流向铜。
人教版高中化学必修一必修二化学方程式汇总

必修一、必修二化学方程式汇总必修一1、硫酸根离子的检验:BaCl2+Na2SO4====BaSO4↓+2NaCl2、碳酸根离子的检验:CaCl2+Na2CO3=====CaCO3↓+2NaCl3、碳酸钠与盐酸反响:Na2CO3+2HCl=====2NaCl+H2O+CO2↑高温4、木炭复原氧化铜:2CuO+C2Cu+CO2↑5、铁片与硫酸铜溶液反响:Fe+CuSO4=====FeSO4+Cu6、氯化钙与碳酸钠溶液反响:CaCl2+Na2CO3=====CaCO3↓+ 2NaCl7、钠在空气中燃烧:2Na+O2Na2O2钠与氧气反响:4Na+O2====2Na2O8、过氧化钠与水反响:2Na2O2+2H2O====4NaOH+O2↑9、过氧化钠与二氧化碳反响:2Na2O2+2CO2====2Na2CO3+O210、钠与水反响:2Na+2H2O====2NaOH+H2↑11、铁与水蒸气反响:3Fe+4H2O(g)====Fe3O4+4H2↑12、铝与氢氧化钠溶液反响:2Al+2NaOH+2H2O====2NaAlO2 +3H2↑13、氧化钙与水反响:CaO+H2O====Ca(OH)214、氧化铁与盐酸反响:Fe2O3+6HCl=====2FeCl3+3H2O第1页共11页15、氧化铝与盐酸反响:Al2O3+6HCl=====2AlCl3+3H2O16、氧化铝与氢氧化钠溶液反响:Al2O3+2NaOH=====2NaAlO2 +H2O17、氯化铁与氢氧化钠溶液反响:FeCl3+3NaOH=====Fe(OH)3 ↓+3NaCl18、硫酸亚铁与氢氧化钠溶液反响:FeSO4+2NaOH====Fe(OH)2 ↓+Na2SO419、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2+2H2O+O2====4Fe(OH)320、氢氧化铁加热分解:2Fe(OH)3Fe2O3+3H2O↑21、实验室制取氢氧化铝:Al2(SO4)3+6NH3·H2O====2Al(OH)3↓+3(NH3)2SO422、氢氧化铝与盐酸反响:Al(OH)3+3HCl====AlCl3+3H2O23、氢氧化铝与氢氧化钠溶液反响:Al(OH)3+NaOH====NaAlO2 +2H2O24、氢氧化铝加热分解:2Al(OH)3Al2O3+3H2O25、三氯化铁溶液与铁粉反响:2FeCl3+Fe====3FeCl226、氯化亚铁中通入氯气:2FeCl2+Cl2=====2FeCl327、二氧化硅与氢氟酸反响:SiO2+4HF====SiF4+2H2O硅单质与氢氟酸反响:Si+4HF====SiF4+2H2↑第2页共11页高温28、二氧化硅与氧化钙高温反响:SiO2+CaOCaSiO329、二氧化硅与氢氧化钠溶液反响:SiO2+2NaOH====Na2SiO3+H2O30、往硅酸钠溶液中通入二氧化碳:Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓31、硅酸钠与盐酸反响:Na2SiO3+2HCl===2NaCl+H2SiO3↓点燃32、氯气与金属铁反响:2Fe+3Cl22FeCl3点燃33、氯气与金属铜反响:Cu+Cl2CuCl2点燃34、氯气与金属钠反响:2Na+Cl22NaCl35、氯气与水反响:Cl2+H2O====HCl+HClO光照36、次氯酸光照分解:2HClO2HCl+O2↑37、氯气与氢氧化钠溶液反响:Cl2+2NaOH=====NaCl+NaClO+H2O38、氯气与消石灰反响:2Cl2+2Ca(OH)2====CaCl2+Ca(ClO)2+2H2O39、盐酸与硝酸银溶液反响:HCl+AgNO3====AgCl↓+HNO340、漂白粉长期置露在空气中:Ca(ClO)2+H2O+CO2====CaCO3↓+2HClO41、二氧化硫与水反响:SO2+H2O===H2SO3第3页共11页放电42、氮气与氧气在放电下反响:N2+O22NO43、一氧化氮与氧气反响:2NO+O2====2NO244、二氧化氮与水反响:3NO2+H2O====2HNO3+NO催化剂45、二氧化硫与氧气在催化剂的作用下反响:2SO2+O22SO346、三氧化硫与水反响:SO3+H2O====H2SO447、浓硫酸与铜反响:Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑48、浓硫酸与木炭反响:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O49、浓硝酸与铜反响:Cu+4HNO3(浓)====Cu(NO3)2+2H2O+2NO2↑50、稀硝酸与铜反响:3Cu+8HNO3(稀)3Cu(NO3)2+4H2O+2NO↑51、氨水受热分解:NH3·H2ONH3↑+H2O52、氨气与氯化氢反响:NH3+HCl====NH4Cl53、氯化铵受热分解:NH4ClNH3↑+HCl↑54、碳酸氢氨受热分解:NH4HCO3NH3↑+H2O↑+CO2↑55、硝酸铵与氢氧化钠反响:NH4NO3+NaOHNH3↑+NaNO3+H2O第4页共11页56、氨气的实验室制取:2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑点燃57、氯气与氢气反响:Cl2+H22HCl58、硫酸铵与氢氧化钠反响:〔NH4〕2SO4+2NaOH2NH3↑+ Na2SO4+2H2O59、SO2+CaO====CaSO360、SO2+2NaOH====Na2SO3+H2O61、SO2+Ca(OH)2====CaSO3↓+H2O62、SO2+Cl2+2H2O====2HCl+H2SO463、SO2+2H2S====3S+2H2O64、NO、NO2的回收:NO2+NO+2NaOH====2NaNO2+H2O65、Si+2F2===SiF466、Si+2NaOH+H2O====Na2SiO3+2H2↑67、硅单质的实验室制法高温电炉粗硅的制取:SiO2+2CSi+2CO〔石英沙〕〔焦碳〕〔粗硅〕粗硅转变为纯硅:Si〔粗〕+2Cl2SiCl4高温SiCl4+2H2Si〔纯〕+4HCl第5页共11页必修二第一章物质构造元素周期律1、Li与O2反响〔点燃〕:4Li+O22Li2ONa与O2反响〔点燃〕:2Na+O2Na2O2Na与H2O反响:2Na+2H2O===2NaOH+H2↑K与H2O反响:2K+2H2O===2KOH+H2↑2、卤素单质F2、Cl2、Br2、I2与氢气反响:F2+H2===2HFCl2+H2===2HClBr2+H2===2BrI2+H2===2HI3、卤素单质间的置换反响:〔1〕氯水与饱和溴化钠、氯水与饱和碘化钠溶液反响:①Cl2+2NaBr===Br2+2NaCl②Cl2+2NaI===I2+2NaCl〔2〕溴水与碘化钠溶液反响:Br2+2NaI===I2+2NaBr 4、Mg与H2O反响:Mg+2H2O===Mg(OH)2+H2↑Al与HCl反响:2Al+6HCl===2AlCl3+3H2↑Mg与HCl反响:Mg+2HCl===MgCl2+H2↑5、Na与Cl2反响〔点燃〕:6、用电子式表示氯化氢的形成过程:第二章化学反响与能量第6页共11页1、Ba(OH)2?8H2O与NH4Cl的反响:Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O2、原电池原理典型的原电池〔Zn-Cu原电池〕负极〔锌〕:Zn-2e-===Zn-===Zn2+〔氧化反响〕正极〔铜〕:2H ++2e-===H 2↑〔复原反响〕电子流动方向:由锌经过外电路流向铜。
人教版高中化学必修一必修二化学方程式汇总

必修一、必修二化学方程式汇总必修一1、硫酸根离子的检验: BaCl2 + Na2SO4 ==== BaSO4↓+ 2NaCl2、碳酸根离子的检验: CaCl2 + Na2CO3 ===== CaCO3↓ + 2NaCl3、碳酸钠与盐酸反应: Na2CO3 + 2HCl ===== 2NaCl + H2O + CO2↑4、木炭还原氧化铜: 2CuO + C 高温2Cu + CO2↑5、铁片与硫酸铜溶液反应: Fe + CuSO4 ===== FeSO4 + Cu6、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 ===== CaCO3↓+ 2NaCl7、钠在空气中燃烧:2Na + O2 Na2O2???? 钠与氧气反应:4Na + O2 ==== 2Na2O8、过氧化钠与水反应:2Na2O2 + 2H2O ==== 4NaOH + O2↑9、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 ==== 2Na2CO3 + O210、钠与水反应:2Na + 2H2O ==== 2NaOH + H2↑11、铁与水蒸气反应:3Fe + 4H2O(g) ==== Fe3O4 + 4H2↑12、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O ==== 2NaAlO2 + 3H2↑13、氧化钙与水反应:CaO + H2O ==== Ca(OH)214、氧化铁与盐酸反应:Fe2O3 + 6HCl ===== 2FeCl3 + 3H2O15、氧化铝与盐酸反应:Al2O3 + 6HCl ===== 2AlCl3 + 3H2O16、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH ===== 2NaAlO2 + H2O17、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH ===== Fe(OH)3↓+ 3NaCl18、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH ==== Fe(OH)2↓+ Na2SO419、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 ==== 4Fe(OH)320、氢氧化铁加热分解:2Fe(OH)3 Fe2O3 + 3H2O↑21、实验室制取氢氧化铝:Al2(SO4)3 + 6NH3·H2O ==== 2Al(OH)3↓ + 3(NH3)2SO422、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl ==== AlCl3 + 3H2O23、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH ==== NaAlO2 + 2H2O24、氢氧化铝加热分解:2Al(OH)3 Al2O3 + 3H2O25、三氯化铁溶液与铁粉反应:2FeCl3 + Fe ==== 3FeCl226、氯化亚铁中通入氯气:2FeCl2 + Cl2 ===== 2FeCl327、二氧化硅与氢氟酸反应:SiO2 + 4HF ==== SiF4 + 2H2O??? 硅单质与氢氟酸反应:Si + 4HF ==== SiF4 + 2H2↑28、二氧化硅与氧化钙高温反应:SiO2 + CaO 高温CaSiO329、二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH ==== Na2SiO3 + H2O30、往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O === Na2CO3 + H2SiO3↓31、硅酸钠与盐酸反应:Na2SiO3 + 2HCl === 2NaCl + H2SiO3↓32、氯气与金属铁反应:2Fe + 3Cl2点燃2FeCl333、氯气与金属铜反应:Cu + Cl2? 点燃CuCl234、氯气与金属钠反应:2Na + Cl2点燃2NaCl35、氯气与水反应:Cl2 + H2O ==== HCl + HClO36、次氯酸光照分解:2HClO 光照2HCl + O2↑37、氯气与氢氧化钠溶液反应:Cl2 + 2NaOH ===== NaCl + NaClO + H2O38、氯气与消石灰反应:2Cl2 + 2Ca(OH)2 ==== CaCl2 + Ca(ClO)2 + 2H2O39、盐酸与硝酸银溶液反应:HCl + AgNO3 ==== AgCl↓ + HNO340、漂白粉长期置露在空气中:Ca(ClO)2 + H2O + CO2 ==== CaCO3↓ + 2HClO41、二氧化硫与水反应:SO2 + H2O === H2SO342、氮气与氧气在放电下反应:N2 + O2放电2NO43、一氧化氮与氧气反应:2NO + O2 ==== 2NO244、二氧化氮与水反应:3NO2 + H2O ==== 2HNO3 + NO45、二氧化硫与氧气在催化剂的作用下反应:2SO2 + O2催化剂2SO346、三氧化硫与水反应:SO3 + H2O ==== H2SO447、浓硫酸与铜反应:Cu + 2H2SO4(浓) CuSO4 + 2H2O + SO2↑48、浓硫酸与木炭反应:C + 2H2SO4(浓) CO2↑+ 2SO2↑ + 2H2O49、浓硝酸与铜反应:Cu + 4HNO3(浓) ==== Cu(NO3)2 + 2H2O + 2NO2↑50、稀硝酸与铜反应:3Cu + 8HNO3(稀) 3Cu(NO3)2 + 4H2O + 2NO↑51、氨水受热分解:NH3·H2O NH3↑ + H2O52、氨气与氯化氢反应:NH3 + HCl ==== NH4Cl53、氯化铵受热分解:NH4Cl NH3↑ + HCl↑54、碳酸氢氨受热分解:NH4HCO3 NH3↑ + H2O↑ + CO2↑55、硝酸铵与氢氧化钠反应:NH4NO3 + NaOH NH3↑ + NaNO3 + H2O56、氨气的实验室制取:2NH4Cl + Ca(OH)2 CaCl2 + 2H2O + 2NH3↑57、氯气与氢气反应:Cl2 + H2点燃2HCl58、硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH 2NH3↑ + Na2SO4 + 2H2O59、SO2 + CaO ==== CaSO360、SO2 + 2NaOH ==== Na2SO3 + H2O61、SO2 + Ca(OH)2 ==== CaSO3↓ + H2O62、SO2 + Cl2 + 2H2O ==== 2HCl + H2SO463、SO2 + 2H2S ==== 3S + 2H2O64、NO、NO2的回收:NO2 + NO + 2NaOH ==== 2NaNO2 + H2O65、Si + 2F2 === SiF466、Si + 2NaOH + H2O ==== Na2SiO3 +2H2↑67、硅单质的实验室制法粗硅的制取:SiO2 + 2C 高温电炉Si + 2CO(石英沙)(焦碳)? (粗硅)粗硅转变为纯硅:Si(粗) + 2Cl2 SiCl4SiCl4 + 2H2高温Si(纯)+ 4HCl必修二第一章物质结构元素周期律1、Li与O2反应(点燃): 4Li + O2 2Li2 ONa与O2反应(点燃): 2Na+O2Na2O2Na与H2O反应: 2Na+2H2O===2NaOH+H2↑K与H2O反应: 2K+2H2O===2KOH+H2↑2、卤素单质F2、Cl2、Br2、I2与氢气反应:F2 + H2 === 2HF Cl2 + H2 === 2HCl Br2 + H2 === 2Br I2 + H2 === 2HI 3、卤素单质间的置换反应:(1)氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:① Cl2+2NaBr===Br2+2NaCl ② Cl2+2NaI===I2+2NaCl(2)溴水与碘化钠溶液反应:Br2+2NaI===I2+2NaBr4、Mg与H2O反应:Mg+2H2O === Mg(OH)2+H2↑Al与HCl反应: 2Al+6HCl===2AlCl3+3H2↑Mg与HCl反应: Mg+2 HCl === MgCl2+ H2↑5、Na与Cl2反应(点燃):6、用电子式表示氯化氢的形成过程:第二章化学反应与能量1、Ba(OH)2?8H2O与NH4Cl的反应 : Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O2、原电池原理典型的原电池(Zn-Cu原电池)负极(锌):Zn-2e-===Zn2+(氧化反应)正极(铜):2H++2e-===H2↑(还原反应)电子流动方向:由锌经过外电路流向铜。
高中化学必修1、2化学方程式总结
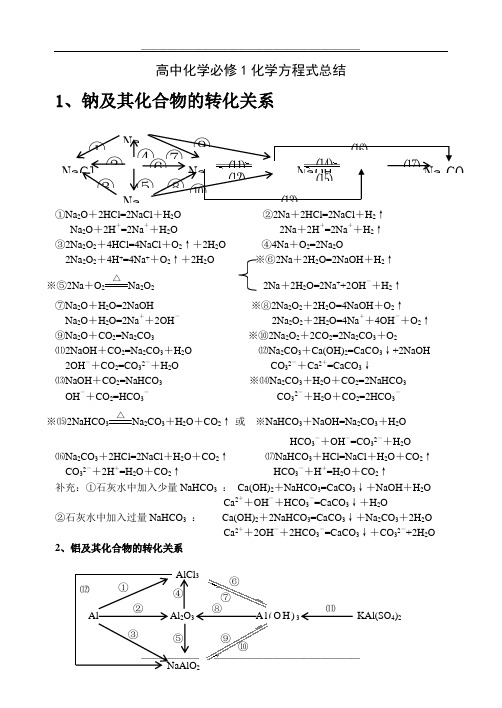
高中化学必修1化学方程式总结1、钠及其化合物的转化关系①Na 2O +2HCl=2NaCl +H 2O ②2Na +2HCl=2NaCl +H 2↑Na 2O +2H +=2Na ++H 2O 2Na +2H +=2Na ++H 2↑ ③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O ④4Na +O 2=2Na 2O2Na 2O 2+4H +=4Na ++O 2↑+2H 2O ※⑥2Na +2H 2O=2NaOH +H 2↑ ※⑤2Na +O 2△Na 2O 2 2Na +2H 2O=2Na ++2OH -+H 2↑⑦Na 2O +H 2O=2NaOH ※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑Na 2O +H 2O=2Na ++2OH - 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ ⑨Na 2O +CO 2=Na 2CO 3 ※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2⑾2NaOH +CO 2=Na 2CO 3+H 2O ⑿Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH2OH -+CO 2=CO 32-+H 2O CO 32-+Ca 2+=CaCO 3↓⒀NaOH +CO 2=NaHCO 3 ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3OH -+CO 2=HCO 3- CO 32-+H 2O +CO 2=2HCO 3-※⒂2NaHCO 3△Na 2CO 3+H 2O +CO 2↑ 或 ※NaHCO 3+NaOH=Na 2CO 3+H 2OHCO 3-+OH -=CO 32-+H 2O⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ ⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑CO 32-+2H +=H 2O +CO 2↑ HCO 3-+H +=H 2O +CO 2↑补充:①石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2OCa 2++OH -+HCO 3-=CaCO 3↓+H 2O②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2OCa 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-+2H 2O 2、铝及其化合物的转化关系NaCl Na NaOH Na 2CO 3 Na 2Na2① ② ③ ⑤ ⑥⑦⑧ ⑨ ⑩ ⑾ ⑿⒀ ⒁ ⒂ ⒃ ⒄ ④ Al Al 2O 3 A l (O H )3 KAl(SO 4)2AlCl 3 ① ② ③ ④ ⑤ ⑥⑦⑧ ⑨⑾⑿①2Al +6HCl=2AlCl 3+3H 2↑ ②4Al +3O 2△2Al 2O 32Al +6H +=2Al 3++3H 2↑※③2Al +2NaOH +2H 2O=2NaAlO 2+3H 2↑ ④Al 2O 3+6HCl=2AlCl 3+3H 2O2Al +2OH -+2H 2O=2AlO 2-+3H 2↑ Al 2O 3+6H +=2Al 3++3H 2O ※⑤Al 2O 3+2NaOH=2NaAlO 2+H 2O ⑥AlCl 3+3NH 3·H 2O=Al(OH)3↓+3NH 4ClAl 2O 3+2OH -=2AlO 2-+H 2O Al 3++3NH 3·H 2O = Al(OH)3↓+3NH 4+⑦Al(OH)3+3HCl=AlCl 3+3H 2O ⑧2Al(OH)3△Al 2O 3+3H 2OAl(OH)3+3H +=Al 3++3H 2O☆⑨NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl 或NaAlO 2+2H 2O +CO 2=Al(OH)3↓+NaHCO 3AlO 2-+H ++H 2O=Al(OH)3↓ AlO 2-+2H 2O +CO 2=Al(OH)3↓+HCO 3-※⑩Al(OH)3+NaOH = NaAlO 2+2H 2O ☆⑾Al 3++3H 2O Al(OH)3胶体+3H +Al(OH)3+OH -= AlO 2-+2H 2O 明矾净水⑿AlCl 3+4NaOH = NaAlO 2+3NaCl +2H 2O Al 3++4OH -= AlO 2-+2H 2O 3、铁及其化合物的转化关系①Fe 3O 4+4CO△3Fe +4CO 2 ※② 3Fe +4H 2O(g)高温Fe 3O 4+4H 2 ③ Fe +2HCl=FeCl 2+H 2↑ 或3Fe +2O 2点燃Fe 3O 4Fe +2H +=Fe 2++H 2↑ ④2Fe +3Cl 2点燃2FeCl 3※⑤2FeCl 2+Cl 2 = 2FeCl 3 ※⑥Fe +2FeCl 3 = 3FeCl 22Fe 2++Cl 2 = 2Fe 3++2Cl - Fe +2Fe 3+= 3Fe 2+⑦FeCl 2+2NaOH = Fe(OH)2↓+2NaCl ⑧Fe(OH)2+2HCl = FeCl 2+2H 2OFe 2++2OH -= Fe(OH)2↓ Fe(OH)2+2H += Fe 2++2H 2O※⑨4Fe(OH)2+O 2+2H 2O = 4Fe(OH)3 ⑩FeCl 3+3NaOH = Fe(OH)3↓+3NaCl白色沉淀迅速变成灰绿色,最后变成红褐色 Fe 3++3OH -= Fe(OH)3↓⑾Fe(OH)3+3HCl = FeCl 3+3H 2O Fe 3++3H 2O Fe(OH)3胶体+3H +(净水) Fe(OH)3+3H+= Fe 3++3H2O ⑿2Fe(OH)3△Fe 2O 3+3H 2O⒀Fe 2O 3+6HCl = 2FeCl 3+3H 2O ※⒁FeCl 3+3KSCN = Fe(SCN)3+3KClFe 3O 4 Fe FeCl 2 Fe(OH)2 Fe(SCN)3 FeCl 3 Fe(OH)3 Fe O 3 ①② ③ ④⑤ ⑥ ⑦ ⑧ ⑨⑩ ⑾⑿ ⒁ ⒀Fe 2O 3+6H += 2Fe 3++3H 2O Fe 3++3SCN -= Fe(SCN)3 4、硅及其化合物的转化关系①Si +O 2△SiO 2②SiO 2+2C 高温 Si +2CO ↑※③SiO 2+4HF = SiF 4↑+2H 2O (刻蚀玻璃)④Si +4HF = SiF 4↑+2H 2↑ ⑤SiO 2+CaO高温CaSiO 3※⑥SiO 2+2NaOH = Na 2SiO 3+H 2O SiO 2+CaCO 3高温CaSiO 3+CO 2↑SiO 2+2OH -= SiO 32-+H 2O ※⑦Na 2SiO 3+2HCl = H 2SiO 3↓+2NaCl SiO 2+Na 2CO 3高温Na 2SiO 3+CO 2↑ SiO 32-+2H += H 2SiO 3↓※⑦Na 2SiO 3+H 2O +CO 2=H 2SiO 3↓+Na 2CO 3或Na 2SiO 3+2H 2O +2CO 2=H 2SiO 3↓+2NaHCO 3SiO 32-+H 2O +CO 2=H 2SiO 3↓+CO 32-或SiO 32-+2H 2O +2CO 2=H 2SiO 3↓+2HCO 3-⑧H 2SiO 3+2NaOH = Na 2SiO 3+2H 2O ⑨H 2SiO 3 △H 2O +SiO 2H 2SiO 3+2OH -= SiO 32-+2H 2O 5、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3 ②Cu +Cl 2 点燃CuCl 2 ③2FeCl 3+Cu = 2FeCl 2+CuCl 22Fe 3++Cu = 2Fe 2++Cu 2+④H 2+Cl 2 2HCl※⑤MnO 2+4HCl(浓) △MnCl 2+Cl 2↑+2H 2OMnO 2+4H ++2Cl - △Mn 2++Cl 2↑+2H 2O ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑Cl 2+H 2O = H ++Cl -+HClO 2HClO 2H ++2Cl -+O 2↑※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O ※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2OCl 2+2OH -= Cl -+ClO -+H 2O 工业制漂白粉※⑩Ca(ClO)2+H 2O +CO 2 = CaCO 3↓+2HClO 或Ca(ClO)2+2HCl = CaCl 2+2HClOCa 2++2ClO -+H 2O +CO 2= CaCO 3↓+2HClO 或ClO -+H += HClO 漂白粉的漂白原理向漂白粉溶液中通入过量的CO 2:Ca(ClO)2+2H 2O +2CO 2 = Ca(HCO 3)2+2HClOClO -+H 2O +CO 2 = HCO 3-+HClONa 2SiO 3 SiF 4 Si SiO 2 H 2SiO 3 CaSiO 3 ①②③ ④ ⑤⑥ ⑦ ⑧⑨ CuCl 2 HClO HCl Cl 2 FeCl 3NaClO Ca(ClO)2① ② ③④⑤ ⑥ ⑦ ⑧ ⑨ ⑩ 点燃或光照 光照光照6、硫及其化合物的转化关系①S +O 2 点燃SO 2②2H 2S +SO 2=3S +2H 2O※③SO 2+O 2 催化剂加热 2SO 3 ④SO 3+H 2O = H 2SO 4 ⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O⑥SO 3+CaO = CaSO 4 SO 2+Ca 2++2OH -=CaSO 3↓+H 2O SO 3+Ca(OH)2 = CaSO 4+H 2O ⑦2CaSO 3+O 2△2CaSO 4※⑧SO 2+Cl 2+2H 2O = H 2SO 4+2HCl ※⑨Cu +2H 2SO 4(浓) △CuSO 4+SO 2↑+2H 2OSO 2+Cl 2+2H 2O = 4H ++SO 42-+2Cl -Cu +2H 2SO 4(浓) △Cu 2++SO 42-+SO 2↑+2H 2O※⑩C +2H 2SO 4(浓)△CO 2↑+2SO 2↑+2H 2O7、氮及其化合物的转化关系 ※①N 2+O 22NO※②2NO +O 2 = 2NO 2※③3NO 2+H 2O = 2HNO 3+NO 3NO 2+H 2O =2H ++2NO 3-+NO以上三个反应为“雷雨发庄稼”原理 扩展反应有:4NO 2+O 2+2H 2O = 4HNO 3 4NO +3O 2+2H 2O = 4HNO 3 ※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O 上面两个反应主要用于气体溶于水时的计算Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O 或 4HNO 3 4NO 2↑+ O 2↑+ 2H 2OC +4HNO 3(浓)△CO 2↑+2NO 2↑+2H 2O 浓硝酸见光易变黄的原因※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂 高温高压2NH 33Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O 合成氨反应是人工固氮的主要途径 ⑦NH 3+HCl = NH 4Cl ⑧NH 4Cl△NH 3↑+HCl ↑NH 3+H += NH 4+(水溶液中) 补充:NH 4HCO 3 △NH 3↑+H 2O+CO 2↑氨气与酸均能反应生成铵盐,且与挥发性酸 铵盐受热都易分解,但并不是所有的铵盐 (如浓HCl 、浓HNO 3)相遇时空气中有白烟 都分解出氨气,如NH 4NO 3、(NH 4)2SO 4※⑧NH 4Cl +NaOH△NaCl +NH 3↑+H 2O NH 4++OH-△NH 3↑+H 2O所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学(人教版)必修一、必修二相关化学方程式汇总必修一1、硫酸根离子的检验: BaCl2 + Na2SO4==== BaSO4↓+ 2NaCl2、碳酸根离子的检验: CaCl2 + Na2CO3 ===== CaCO3↓ + 2NaCl3、碳酸钠与盐酸反应: Na2CO3 + 2HCl ===== 2NaCl + H2O + CO2↑4、木炭还原氧化铜: 2CuO + C 高温2Cu + CO2↑5、铁片与硫酸铜溶液反应: Fe + CuSO4 ===== FeSO4 + Cu6、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 ===== CaCO3↓+ 2NaCl7、钠在空气中燃烧:2Na + O2 Na2O2钠与氧气反应:4Na + O2 ==== 2Na2O8、过氧化钠与水反应:2Na2O2 + 2H2O ==== 4NaOH + O2↑9、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 ==== 2Na2CO3 + O210、钠与水反应:2Na + 2H2O ==== 2NaOH + H2↑11、铁与水蒸气反应:3Fe + 4H2O(g) ==== Fe3O4 + 4H2↑12、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O ==== 2NaAlO2 + 3H2↑13、氧化钙与水反应:CaO + H2O ==== Ca(OH)214、氧化铁与盐酸反应:Fe2O3 + 6HCl ===== 2FeCl3 + 3H2O15、氧化铝与盐酸反应:Al2O3 + 6HCl ===== 2AlCl3 + 3H2O16、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH ===== 2NaAlO2 + H2O17、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH ===== Fe(OH)3↓+ 3NaCl18、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH ==== Fe(OH)2↓+ Na2SO419、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 ==== 4Fe(OH)320、氢氧化铁加热分解:2Fe(OH)3 Fe2O3 + 3H2O↑21、实验室制取氢氧化铝:Al2(SO4)3 + 6NH3·H2O ==== 2Al(OH)3↓ + 3(NH3)2SO422、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl ==== AlCl3 + 3H2O23、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH ==== NaAlO2 + 2H2O24、氢氧化铝加热分解:2Al(OH)3 Al2O3 + 3H2O25、三氯化铁溶液与铁粉反应:2FeCl3 + Fe ==== 3FeCl226、氯化亚铁中通入氯气:2FeCl2 + Cl2 ===== 2FeCl327、二氧化硅与氢氟酸反应:SiO2 + 4HF ==== SiF4 + 2H2O硅单质与氢氟酸反应:Si + 4HF ==== SiF4 + 2H2↑28、二氧化硅与氧化钙高温反应:SiO2 + CaO 高温CaSiO329、二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH ==== Na2SiO3 + H2O30、往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O === Na2CO3 + H2SiO3↓31、硅酸钠与盐酸反应:Na2SiO3 + 2HCl === 2NaCl + H2SiO3↓32、氯气与金属铁反应:2Fe + 3Cl2点燃2FeCl333、氯气与金属铜反应:Cu + Cl2 点燃CuCl234、氯气与金属钠反应:2Na + Cl2点燃2NaCl35、氯气与水反应:Cl2 + H2O ==== HCl + HClO36、次氯酸光照分解:2HClO 光照2HCl + O2↑37、氯气与氢氧化钠溶液反应:Cl2 + 2NaOH ===== NaCl + NaClO + H2O38、氯气与消石灰反应:2Cl2 + 2Ca(OH)2 ==== CaCl2 + Ca(ClO)2 + 2H2O39、盐酸与硝酸银溶液反应:HCl + AgNO3 ==== AgCl↓ + HNO340、漂白粉长期置露在空气中:Ca(ClO)2 + H2O + CO2 ==== CaCO3↓ + 2HClO41、二氧化硫与水反应:SO2 + H2O === H2SO342、氮气与氧气在放电下反应:N2 + O2放电2NO43、一氧化氮与氧气反应:2NO + O2 ==== 2NO244、二氧化氮与水反应:3NO2 + H2O ==== 2HNO3 + NO45、二氧化硫与氧气在催化剂的作用下反应:2SO2 + O2催化剂2SO346、三氧化硫与水反应:SO3 + H2O ==== H2SO447、浓硫酸与铜反应:Cu + 2H2SO4(浓) CuSO4 + 2H2O + SO2↑48、浓硫酸与木炭反应:C + 2H2SO4(浓) CO2↑+ 2SO2↑ + 2H2O49、浓硝酸与铜反应:Cu + 4HNO3(浓) ==== Cu(NO3)2 + 2H2O + 2NO2↑50、稀硝酸与铜反应:3Cu + 8HNO3(稀) 3Cu(NO3)2 + 4H2O + 2NO↑51、氨水受热分解:NH3·H2O NH3↑ + H2O52、氨气与氯化氢反应:NH3 + HCl ==== NH4Cl53、氯化铵受热分解:NH4Cl NH3↑ + HCl↑54、碳酸氢氨受热分解:NH4HCO3 NH3↑ + H2O↑ + CO2↑55、硝酸铵与氢氧化钠反应:NH4NO3 + NaOH NH3↑ + NaNO3 + H2O56、氨气的实验室制取:2NH4Cl + Ca(OH)2 CaCl2 + 2H2O + 2NH3↑57、氯气与氢气反应:Cl2 + H2点燃2HCl58、硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH 2NH3↑ + Na2SO4 + 2H2O59、SO2 + CaO ==== CaSO360、SO2 + 2NaOH ==== Na2SO3 + H2O61、SO2 + Ca(OH)2 ==== CaSO3↓ + H2O62、SO2 + Cl2 + 2H2O ==== 2HCl + H2SO463、SO2 + 2H2S ==== 3S + 2H2O64、NO、NO2的回收:NO2 + NO + 2NaOH ==== 2NaNO2 + H2O65、Si + 2F2 === SiF466、Si + 2NaOH + H2O ==== Na2SiO3 +2H2↑67、硅单质的实验室制法粗硅的制取:SiO2 + 2C高温电炉Si + 2CO(石英沙)(焦碳)(粗硅)粗硅转变为纯硅:Si(粗) + 2Cl2 SiCl4SiCl4 + 2H2高温Si(纯)+ 4HCl必修二第一章物质结构元素周期律1、Li与O2反应(点燃):4Li + O22Li2 ONa与O2反应(点燃):2Na+O2Na2O2Na与H2O反应:2Na+2H2O===2NaOH+H2↑K与H2O反应:2K+2H2O===2KOH+H2↑2、卤素单质F2、Cl2、Br2、I2与氢气反应:F2 + H2 === 2HF Cl2 + H2 === 2HClBr2 + H2 === 2Br I2 + H2 === 2HI3、卤素单质间的置换反应:(1)氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:①Cl2+2NaBr===Br2+2NaCl②Cl2+2NaI===I2+2NaCl(2)溴水与碘化钠溶液反应:Br2+2NaI===I2+2NaBr 4、Mg与H2O反应:Mg+2H2O === Mg(OH)2+H2↑Al与HCl反应:2Al+6HCl===2AlCl3+3H2↑Mg与HCl反应:Mg+2 HCl === MgCl2+ H2↑5、Na与Cl2反应(点燃):6、用电子式表示氯化氢的形成过程:第二章化学反应与能量1、Ba(OH)2•8H 2O 与NH 4Cl 的反应 :Ba(OH)2·8H 2O+2NH 4Cl==BaCl 2+2NH 3↑+10H 2O2、原电池原理典型的原电池(Zn-Cu 原电池)负极(锌):Zn-2e -===Zn 2+(氧化反应)正极(铜):2H ++2e -===H 2↑(还原反应)电子流动方向:由锌经过外电路流向铜。
总反应离子方程式:Zn+2H +===Zn 2++H 2↑3、H 2O 2在催化剂作用下受热分解: 2H 2O 2 催化剂 △ 2H 2O+O 2↑4、Na 2SO 4与CaCl 2反应:Na 2SO 4+CaCl 2===CaSO 4↓+Na 2CO 35、高炉炼铁:2C + O 2 === 2COFe 2O 3 + 3CO ==2Fe + 3CO 2第三章 有机化合物1、甲烷的主要化学性质(1)氧化反应(与O 2的反应):CH 4(g)+2O 2(g)−−→−点燃 CO 2(g)+2H 2O(l) (2)取代反应(与Cl 2在光照条件下的反应,生成四种不同的取代物):2、乙烯的主要化学性质(1)氧化反应(与O 2的反应):C 2H 4+3O 2 −−→−点燃 2CO 2+2H 2O(2)加成反应((与Br 2的反应):(3)乙烯还可以和氢气、氯化氢、水等发生加成反应:CH 2=CH 2 + H 2CH 3CH 3 CH 2=CH 2+HClCH 3CH 2Cl (一氯乙烷) CH 2=CH 2+H 2OCH 3CH 2OH (乙醇) (4)聚合反应: (乙烯制聚乙烯)①(氯乙烯制聚氯乙烯)②3、苯的主要化学性质:(1)氧化反应(与O 2的反应):2C 6H 6+15O 2−−→−点燃 12CO 2+6H 2O (2)取代反应:① 与Br 2的反应+ Br2−−−3F e B r + HBr ② 苯与硝酸(用HONO 2表示)发生取代反应,生成无色、不溶于水、有苦杏仁气味、密度大于水的油状液体——硝基苯。
反应方程式:+ HONO2浓硫酸△+ H2O(3)加成反应用镍做催化剂,苯与氢发生加成反应:3H2−−→−催化剂4、乙醇的重要化学性质(1)乙醇与金属钠的反应:2CH3CH2OH+2Na2CH3CH2ONa+H2↑(2)乙醇的氧化反应①乙醇的燃烧:CH3CH2OH+3O2−−→−点燃2CO2+3H2O②乙醇的催化氧化反应:2CH3CH2OH+O2−−→−AgCu或2CH3CHO+2H2O ③乙醇在常温下的氧化反应:CH3CH2OH−−−−−−−−→−或酸性重铬酸钾溶液酸性4KMnOCH3COOH 5、乙酸的重要化学性质(1)乙酸的酸性①乙酸能使紫色石蕊试液变红②乙酸能与碳酸盐反应,生成二氧化碳气体利用乙酸的酸性,可以用乙酸来除去水垢(主要成分是CaCO3):2CH3COOH+CaCO3(CH3COO)2Ca+H2O+CO2↑乙酸还可以与碳酸钠反应,也能生成二氧化碳气体:2CH3COOH+Na2CO32CH3COONa+H2O+CO2↑上述两个反应都可以证明乙酸的酸性比碳酸的酸性强。
