密置层原子堆积模型
最紧密堆积模型堆积密度
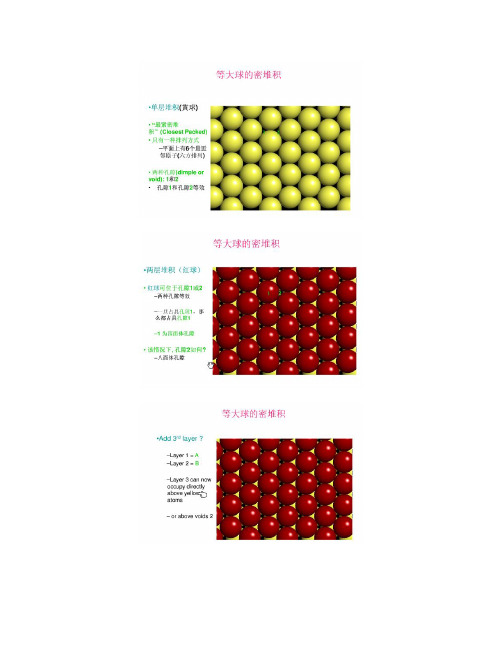
六方紧密堆积等大球体密置层堆积的两种基本型式之一。
其圆球的配位数为12,空间利用率为74.05%,晶胞内原子数为2,密置层按两层重复,即ABABAB……的方式重复堆积,其第三层的球心投影位置与第一层的重复,第四层与第二层重复,其余依此类推。
由于在这种堆积中可以划分出六方原始格子,故称为六方最密堆积。
其密置层平行于{0001}。
镁、锇、锌等的晶体结构即属此种堆积,故又称为镁型。
六方(最密)堆积空间利用率的证明晶胞参数a=b ,c=2/3 倍√6 倍a,α =β=90度γ=120度即一四棱柱,底面是以a为边长,一内角120度的菱形,高是c。
空间利用率74.05%,和立方面心最密的利用率一样。
证明 1 每个晶胞里有2个球,边长0.5a2 c是以a为边长的证四面体的高的2倍由此得出空间利用率74.05%实验5 14种布拉维格子和球体紧密堆积一、一、实验目的:加深对14种布拉维格子和球体紧密堆积原理的理解。
二、基本原理1. 布拉维格子只在单位平行六面体的八个角顶上分布有结点的空间格子,称为原始格子(Primitive lattice,符号P),在单位平行六面体的体中心还有一个结点时,则构成体心格子(Body-centered lattice,符号I)。
如果在某一对面的中心各有一个结点时,称为单面心格子(One-face-centered lattice),(001)面上有心的格子为底心格子或称C心格子(End-centered lattice, Base-centeredlattice or C-centered lattice,符号C),当(100)面或(010)面上有心时,分别称为A心格子(A-centered lattice,符号A)和B心格子(B-centered lattice,符号B)。
如果在所有三对面的中心都有结点时,称为面心格子或全面心格子(Face-centered lattice or All-face-centered lattice,符号F)。
3.1金属原子的堆积方式

镁 型
… ABAB
2
Mg、Zn、 Ti
12
74%
铜 型
…AB CABC …
4
Cu、Ag、 Au、Pb
12
74%
合金是指由两种或两种以上的金属或 金属与非金属经熔炼、烧结或其他方法组 合而成并具有金属特性的物质 。
合金一般是将各组分熔合成均匀的 液体,再经冷凝而制得的。
合金的特性:
1)具有超导性质的合金,如Nb3Ge,Nb3Al, Nh3Sn,V3Si,NbN等
非密置层
配位数:4
密置层
配位数:6
二.金属原子在三维空间的堆积方式(4种)
简单立方:Po
体心立方:钠、钾、铬、钼、钨
面心立方(最密堆积):金、银、铜、铅
六方堆积(最密堆积):锌、钛、镁
简单立方堆积
体心立方堆积
面心立方最密堆积
六方最密堆积
第二层对第一层来讲最紧密的堆积方式是将球对准 1,3,5 位。(或对准 2,4,6 位,其情形是一样的)
A
ABC ABC 形式的堆积,
为什么是面心立方堆积?
我们来加以说明。
C B A
堆积 模型
命 名
表示 符号
晶胞
每个晶 采纳这种堆积 胞所含 的典型金属 原子数
配 位 数
空间 利用 率
非 密 置 层
简单立 方堆积
—
Байду номын сангаас
—
1
Po
6
52%
体心立 方堆积
钾 型
—
2
Na、K、 Cr、Mo、W
8
68%
六方 堆积 密 置 层 面心立 方堆积
2)具有特殊电学性质的金属间化合物,如 InTe-PbSe,GaAs-ZnSe等在半导体材料用 3)具有强磁性的合金物,如稀土元素(Ce, La,Sm,Pr,Y等)和Co的化合物,具有 特别优异的永磁性能
高考化学 同步练习 3.3.1金属键、金属晶体的原子堆积模型

高考化学 3.3 金属晶体第1课时金属键、金属晶体的原子堆积模型练基础落实知识点1 金属键和金属晶体1.金属晶体的形成是因为晶体中存在( )A.脱落价电子后的金属离子间的相互作用B.金属原子间的相互作用C.脱落了价电子的金属离子与脱落的价电子间的相互作用D.金属原子与价电子间的相互作用2.下列有关化学键、氢键和范德华力的叙述中,不正确的是( )A.金属键是金属离子与“电子气”之间的较强作用,金属键无方向性和饱和性B.共价键是原子之间通过共用电子对形成的化学键,共价键有方向性和饱和性C.范德华力是分子间存在的一种作用力,分子的极性越大,范德华力越大D.氢键不是化学键,而是分子间的一种作用力,所以氢键只存在于分子与分子之间知识点2 金属晶体的物理特性3.金属晶体的特征是( )A.熔点都很高 B.熔点都很低C.都很硬 D.都有导电、导热、延展性4.某物质熔融状态可导电,固态可导电,将其投入水中,水溶液也可导电,则可推测该物质可能是( )A.金属 B.非金属C.可溶性碱 D.可溶性盐5.金属能导电的原因是( )A.金属晶体中的金属阳离子与自由电子间的作用较弱B.金属晶体中的自由电子在外加电场作用下可发生定向移动C.金属晶体中的金属阳离子在外加电场作用下可发生定向移动D.金属晶体在外加电场作用下可失去电子知识点3 金属晶体的原子堆积模型6.下列有关金属晶体的说法中不正确的是( )A.金属晶体是一种“巨分子”B.“电子气”为所有原子所共有C.简单立方堆积的空间利用率最低D.体心立方堆积的空间利用率最高7.金属原子在二维空间里的放置有如图所示的两种方式,下列说法中正确的是( )A.图a为非密置层,配位数为6B.图b为密置层,配位数为4C.图a在三堆空间里堆积可得六方最密堆积和面心立方最密堆积D.图b在三维空间里堆积仅得简单立方堆积练方法技巧金属晶体熔、沸点高低的比较方法8.要使金属晶体熔化必须破坏其中的金属键。
六方密堆积PPT课件

14
【资料】
金属之最
熔点最低---- 汞 密度最小---- 锂 硬度最小---- 铯 延性最好---- 铂 最活泼 ---- 铯
熔点最高---- 钨 密度最大---- 锇 硬度最大---- 铬 展性最好---- 金 最稳定 ---- 金
不同的金属在某些性质方面,如密度、硬 度、熔点等又表现出很大差别。这与金属原子 本身、晶体中原子的排列方式等因素有关。
11
金属的延展性
++ + +++ + + ++ +
+++ ++ + + + ++
位错
+++ + ++ + + ++ ++++ +++ + +++ +
自由电子 + 金属离子
金属原子
12
AB……的重复方式,
A
A
既镁型。
26
探究 密置层在三维空间里的紧密接触的几种堆积方式
A
A
C BC
第一层
A B A
A
C
B
第二层
A 第三层
第三层推上去时,若 在第一、二层凹隙之 上,即C的位置,就成 为ABC ABC ABC……的重复,即铜 型
27
密置层在三维空间里的紧密堆积方式
《金属晶体的原子堆积模型》名师教案

金属晶体的原子堆积模型一、核心思想学生发展核心素养倡导培养学生的科学精神和学会学习的能力,那么以课堂为载体、将核心素养的培养内化到学生学习过程中是我们每节课的追求目标。
为实现培养学生能力和突破教学重难点的双重目标,本节课通过开展活动探究式教学,让学生“动手做、动眼看、动口议、动笔写、动脑思”,加强学生自主探究活动,培养他们的理性思维能力、批判质疑精神和勇于探究精神,真正体现学生的主体地位。
二、教学内容分析1教材分析本节课是鲁科版选修三第三章第一节第二课时的内容,第三章的主题是物质的聚集状态与物质性质,旨在让学生通过本章的学习,了解四种基础晶体类型,能从晶体结构的视角认识物质的性质,进一步形成有关物质结构的概念。
2价值分析(1)学科价值:在教材中承上启下,帮助学生了解金属晶体的原子堆积模型;(2)应用价值:能够判断金属晶体的晶胞类型;(3)学生发展价值:从微观角度认识世界。
3学情分析(1)知识层面:学生已初步了解分子晶体、原子晶体的定义及结构特点。
(2)能力层面:有学习热情,有一定的探究能力、分析思维能力和自主学习能力,主动探究能力有待提升。
(3)可能遇到的问题:语言表达能力不足、不会表达或化学用语不规范;知识迁移运用能力不足,分析问题、解决问题的能力有待提高。
三、教学目标分析1课程目标(1)了解金属晶体的四种基本堆积模型:简单立方堆积、体心立方堆积、六方最密堆积和面心立方最密堆积。
(2)认识四种基本堆积模型的晶胞、能判断金属原子的配位数及四种堆积方式的空间利用率的计算。
2学生核心素养目标(1)科学精神:理性思维能力、严谨求知的态度,勇于探究的精神。
(2)自主发展:乐学善学、学习方法的习得,信息意识。
3方法目标(1)通过观察和制作堆积模型训练学生的空间想象能力和动手能力。
(2)通过小组合作培养学生的合作互助意识。
四、教学重点和难点1教学重点:金属原子在三维空间的四种堆积方式2教学难点:四种堆积方式晶胞、配位数、原子利用率的区别五、教学方法活动探究式学习六、设计思想本节课的设计思想如下,逐步开展三个思考与交流活动以及4个探究环节、梯度螺旋化上升,符合学生认知规律。
晶体结构堆积方式

▪ (3)体心立方晶胞平均占有的原子数目:
1 8
×8
+
1=
2
2、体心立方堆积
b2a2a2
a
(4r)2a2b23a2
a 4 r 3
b a
空间利用率=
2 4r3
3 a3
100%
2 4 r3
(
3 4
r)3
100
%
3
310% 0 68%
8
活动与探究3 三维空间里密置层金属原子的堆积方式
▪ 将密置层的小球在一个平面上黏合在一起, 再一层一层地堆积起来(至少堆4层),使 相邻层上的小球紧密接触,有哪些堆积方式 ?
▪ 先将两组小球以非密置层的排列方式排列在 一个平面上:
▪ 在其上方再堆积一层非密置层排列的小球, 使相邻层上的小球紧密接触,有哪些堆积方 式?
三维空间里非密置层的 金属原子的堆积方式
(1) 第二层小球的球心
正对着 第一层小球的球心
(2) 第二层小球的球心
正对着 第一层小球形成的空穴
(1)简单立方堆积 Po
64 5
64C
5
B
A
▪ 俯视图: ABAB…堆积方式 ABCABC…堆积方式
(1)ABAB…堆积方式
—— 六方最密堆积 (镁)
▪ ①配位数: 12 同层 6,上下层各 3
2
1
3
6
4
5
1278来自693
5
4
10 11 12
▪ ②六方紧密堆积晶胞平均占有的原子数目:
1 6
×12
+
1 2
×2
+
3
=6
3、s六方最2密hr sV 堆晶 积V s球 胞 s 2 22 rh 34 2 r3 3r3r 2 22 3r22 36 hr 283 62rr3
金属晶体堆积模型复习及计算

请计算:空间利用率?
以体心立方晶胞为例,计算晶胞中原子的 空间占有率。
小结:(2)钾型 (体心立方堆积)
配位数:8
(3)面心立方:在立方体顶点的微粒为8 个晶胞共有,在面心的为2个晶胞共有。
微粒数为: 8×1/8 + 6×1/2 = 4
请计算:空间利用率?
B
此种立方紧密堆积的前视图A
7 1 9
6
5
8 2
3 4
10
11
12
这种堆积晶胞空间利用率高(74%),属于 最密置层堆集,配位数为 ,许多金属(如 Mg、Zn、Ti等)采取这种堆积方式。
回顾镁型的晶胞
1200
平行六面体
找铜型的晶胞
C B A
回顾:配位数 每个小球周围距离最近的小球数
=19.36g/cm3 1nm=10-9m=10-7cm
复习1pm=10-12m
练2:
现有甲、乙、丙、丁四种晶胞,可推知甲
晶晶体体体的中化的与学化的式学粒 为式子—为E—个F——D或—数—C——F比2——E—为;或——丁—C—1—晶—2:D1——体——;的—;丙化乙晶学 式为—X—Y——2Z——。
BA
甲
DC
乙
F
E
丙
Z X
Y
丁
练3: 甲
乙
丙
上图甲、乙、丙分别为体心堆积、面心立方堆积、 六方堆积的结构单元,则甲、乙、丙三种结构单
元中,金属原子个数比为——1—:—2:—3————。
乙晶胞中所含金属原子数为8×1/8+6×1/2=4 晶胞中所含金属原子数为12×1/6+2×1/2+3=6
金属晶体的原子堆积模型ppt课件

A
21 此种立方紧密堆积的前视图
C B A
面心立方
晶胞含金属原子数: 4
2019
金属晶体的堆积方式──铜型 22
2019
-
23
总 结
堆积模 型 采纳这种堆积的典 空间利 用率 型代表 配位数 晶胞
简单 立方 钾型 镁型 铜型
Po Na K Fe Mg Zn Ti Cu Ag Au
52% 68% 74% 74%
知识回顾:两种晶体类型与性质的比较
晶体类型
概念 作用力 构成微粒 物 理 性 质 实例
2019
原子晶体
相邻原子之间以共价 键相结合而成具有空 间网状结构的晶体
分子晶体
金属晶体
分子间以范德 通过金属键形成的 华力相结合而 晶体 成的晶体
共价键 原子 很高 很大 部分为半导体)
金刚石、二氧化硅、 晶体硅、碳化硅
2019
-
28
4、最近发现一种由钛原子和碳原子构成的气 态团簇分子,如下图所示,顶角和面心的原子 是钛原子,棱的中心和体心的原子是碳原子, 它的化学式是 。
解析:由于本题团簇分子指的 是一个分子的具体结构,并不 是晶体中的最小的一个重复单 位,不能采用均摊法分析,所 以只需数出该结构内两种原子 的数目就可以了。答案为: Ti14
为什么碱金属单质的熔沸点从上到下逐渐降 低,而卤素单质的熔沸点从上到下却升高?
返回
2019 6
二、 金属晶体的原子堆积模型
2019
-
7
三、金属晶体的原子堆积模型
1、几个概念
紧密堆积:微粒之间的作用力使微粒间尽可 能的相互接近,使它们占有最小的空间 配位数:在晶体中与每个微粒紧密相邻的微 粒个数 空间利用率:晶体的空间被微粒占满的体积 百分数,用它来表示紧密堆积的程度
