全国高考化学氯及其化合物的综合高考真题汇总附答案
高考化学氯及其化合物综合经典题及答案.docx

高考化学氯及其化合物综合经典题及答案一、高中化学氯及其化合物1.现有金属单质A、 B、 C 和气体甲、乙、丙以及物质D、 E、F、G、 H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
请根据以上信息完成下列各题:(1)写出下列物质的化学式:B_______、丙 __________ 。
(2)写出黄绿色气体乙的一种用途___________,反应过程⑦可能观察到的实验现象是______。
对应的化学方程式是_______。
(3)反应③中的离子方程式是_________。
【答案】Al HCl杀菌消毒、强氧化剂、漂白白色沉淀迅速变成灰绿色,最终变成红褐色4Fe(OH)2 +O2+2H2O=4Fe(OH)3 2Al+2OH- +2H2O=2AlO2-+3H2↑【解析】【分析】金属 A 颜色反应为黄色证明 A为金属 Na, Na 与水反应生成气体甲为H2, D 为 NaOH;金属 B 和氢氧化钠溶液反应产生H2,说明 B 为金属Al,黄绿色气体乙为22Cl ,气体甲是H ,H2和 Cl2反应生成丙为 HCl, HCl 溶于水得到的物质 E 为盐酸溶液,盐酸与金属 C 反应产生F 溶液是金属氯化物,该氯化物与Cl2还可以反应产生 G,G 与 NaOH 溶液反应生成红褐色沉淀 H 为 Fe(OH)3,则 G 为 FeCl3,推断物质 F 为 FeCl2;判断 C 为 Fe,以此解答该题。
【详解】根据上述分析可知 A 是 Na, B 是 Al, C 为 Fe,气体甲是 H2,气体乙是 Cl2,气体丙是 HCl; D 是 NaOH, E 是盐酸, F 是 FeCl2, G 是 FeCl3, H 是 Fe(OH)3。
(1)根据上述分析可知,物质 B 是Al,丙是HCl;(2)黄绿色气体乙是Cl2,该物质可以与水反应产生HCl 和 HClO,HClO 具有强氧化性,可作氧化剂,氧化一些具有还原性的物质,也用于杀菌消毒或用于物质的漂白;(3)FeCl2与 NaOH 溶液发生反应:FeCl2+2NaOH=Fe(OH)2↓ +2NaCl, Fe(OH)2具有还原性,容易被溶解在溶液中的氧气氧化,发生反应:4Fe(OH)2+O2 +2H2O=4Fe(OH)3,固体由白色迅速变为灰绿色,最后变为红褐色,因此可观察到的实验现象是白色沉淀迅速变成灰绿色,最终变成红褐色;(4)反应③是 Al 与 NaOH 溶液发生反应产生22,反应的离子方程式为:2Al+2OH-NaAlO和 H22-2+2H O=2AlO +3H ↑。
全国高考化学氯及其化合物的综合高考真题分类汇总附详细答案

全国高考化学氯及其化合物的综合高考真题分类汇总附详细答案一、 高中化学氯及其化合物1.已知Cl 2在70℃的NaOH 水溶液中,能发生氧化还原反应后可生成NaClO 与NaClO 3现有63.9g Cl 2,将其通入到足量70℃的NaOH 水溶液中,反应完全后测得溶液中NaClO 与NaClO 3的物质的量比为4:1,并得到500mL 溶液。
(1)写出Cl 2在70℃的NaOH 水溶液中发生上述反应的化学方程式______。
(2)计算完全反应后溶液中NaClO 、NaClO 3物质的量浓度____、______。
【答案】9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O 0.8mol/L 0.2mol/L【解析】【分析】先通过氯元素化合价的对比判断NaClO 与NaClO 3是氧化产物,氯气得电子化合价降低的产物是还原产物,所以还原产物是氯化钠,根据氧化还原反应中得失电子数相等配平方程式,从而得出反应中被氧化的Cl 2与被还原的Cl 2的物质的量之比。
【详解】(1)该反应中NaClO 与NaClO 3是氧化产物,氯化钠是还原产物,反应完全后测得溶液中NaClO 与NaClO 3的物质的量比为4:1,根据氧化还原反应中得失电子数相等配平方程式,所以该方程式为:9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O ;(2)49.7g Cl 2的物质的量为63.9g 71g /mol=0.9mol ,根据反应9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O 可知,生成NaClO 与NaClO 3的物质的量分别为0.9mol 40.4mol 9⨯=、0.9mol 10.1mol 9⨯=,完全反应后溶液中NaClO 、NaClO 3物质的量浓度分别为0.4mol 0.8/0.5mol L L =、0.1mol 0.2/0.5mol L L=。
高考化学氯及其化合物的综合复习含答案解析

高考化学氯及其化合物的综合复习含答案解析一、 高中化学氯及其化合物1.已知Cl 2在70℃的NaOH 水溶液中,能发生氧化还原反应后可生成NaClO 与NaClO 3现有63.9g Cl 2,将其通入到足量70℃的NaOH 水溶液中,反应完全后测得溶液中NaClO 与NaClO 3的物质的量比为4:1,并得到500mL 溶液。
(1)写出Cl 2在70℃的NaOH 水溶液中发生上述反应的化学方程式______。
(2)计算完全反应后溶液中NaClO 、NaClO 3物质的量浓度____、______。
【答案】9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O 0.8mol/L 0.2mol/L【解析】【分析】先通过氯元素化合价的对比判断NaClO 与NaClO 3是氧化产物,氯气得电子化合价降低的产物是还原产物,所以还原产物是氯化钠,根据氧化还原反应中得失电子数相等配平方程式,从而得出反应中被氧化的Cl 2与被还原的Cl 2的物质的量之比。
【详解】(1)该反应中NaClO 与NaClO 3是氧化产物,氯化钠是还原产物,反应完全后测得溶液中NaClO 与NaClO 3的物质的量比为4:1,根据氧化还原反应中得失电子数相等配平方程式,所以该方程式为:9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O ;(2)49.7g Cl 2的物质的量为63.9g 71g /mol=0.9mol ,根据反应9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O 可知,生成NaClO 与NaClO 3的物质的量分别为0.9mol 40.4mol 9⨯=、0.9mol 10.1mol 9⨯=,完全反应后溶液中NaClO 、NaClO 3物质的量浓度分别为0.4mol 0.8/0.5mol L L =、0.1mol 0.2/0.5mol L L=。
高考化学专题《氯及其化合物》综合检测试卷及答案解析

高考化学专题《氯及其化合物》综合检测试卷及答案解析一、高中化学氯及其化合物1.高锰酸钾是一种典型的强氧化剂。
(1)在用 KMnO4酸性溶液处理固体 Cu2S 时,发生的反应如下:8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O①还原产物为_____。
②被氧化的元素是_____③氧化剂与还原剂的物质的量之比为_____④每生成 2.24 L(标况下)SO2,转移电子数目是_____(2)用 KMnO4酸性溶液处理固体 CuS 时,也可将 CuS 反应成 Cu2+和 SO2。
写出该离子反应方程式_____(3)15.8g KMnO4,加热分解后剩余固体 15.0 g。
该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体 A,产物中锰元素以 Mn2+存在,则气体 A 的物质的量为_____mol。
【答案】Mn2+ Cu、S 8:5 0.8N A 6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O 0.2【解析】【分析】(1)结合氧化还原反应的知识分析即可;(2)用 KMnO4酸性溶液处理固体 CuS 时,也可将 CuS 反应成 Cu2+和 SO2,同时得到还原产物Mn2+,结合电子守恒、电荷守恒和原子守恒写出发生反应的离子方程式;(3)15.8g KMnO4,加热分解后剩余固体 15.0 g,减少的质量为氧气的质量,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体为氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素失去的电子,据此分析。
【详解】(1)在8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O中Mn元素从+7价降为+2价,发生还原反应,而Cu2S中Cu元素从+1价升高为+2价,S元素从-2价升高为+4价,发生氧化反应;①由分析知,还原产物为Mn2+;②被氧化的元素是Cu2S中Cu、S两元素;③氧化剂为KMnO4,还原剂为Cu2S,两者的物质的量之比为8:5;④Cu2S中Cu元素从+1价升高为+2价,S元素从-2价升高为+4价,则1molCu2S完全被氧化,转移8mol电子;2.24 L(标况下)SO2的物质的量为2.24?L22.4?L/mol=0.1mol,反应中转移电子的物质的量为0.8mol,电子数目是0.8N A;(2)用 KMnO4酸性溶液处理固体 CuS 时,也可将 CuS 反应成 Cu2+和 SO2,同时得到还原产物Mn2+,结合守恒法得发生反应的离子方程式为6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O;(3)15.8g KMnO4,加热分解后剩余固体 15.0 g,减少的质量为氧气的质量,m(O2)=15.8g-15.0g=0.8g ,n(O 2)=0.8g 32g /mol=0.025mol ; 在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体为氯气,根据电子转移守恒,整个过程中,Mn 元素获得电子等于O 元素、Cl 元素获得的电子,则设氯气的物质的量为xmol ,n(KMnO 4)=15.8g 158g /mol=0.1mol ,电子转移守恒可得:0.1mol(7-2)=4n(O 2)+2(Cl 2),即0.1×(7-2)=4×0.025+2x ,解得:x=0.2mol 。
全国高考化学氯及其化合物的综合高考模拟和真题汇总附答案

全国高考化学氯及其化合物的综合高考模拟和真题汇总附答案一、高中化学氯及其化合物1.氯及其化合物在工农业生产和人类生活中有着重要的作用。
回答下列问题:(1)25℃时将氯气溶于水形成“氯气-氯水”体系,该体系存在多个含氯元素的平衡关系,其中之一为:Cl2(溶液)+H2O HClO+H++Cl-,体系中Cl2(溶液)、HClO和ClO-三者的物质的量分数(α)随pH(酸碱度)变化的关系如图所示。
已知HClO的杀菌能力比ClO-强,用氯气处理饮用水时,杀菌效果最强的pH范围为__(填字母)。
A.0~2 B.2~4.7 C.4.7~7.5 D.7.5~10(2)写出次氯酸光照分解的化学方程式___,如果在家中直接使用自来水养金鱼,除去其中残留的次氯酸可采取的简易措施为__。
(3)NaClO、NaClO2、ClO2等含氯化合物都是常见的消毒剂,这是因为它们都具有强氧化性。
①写出工业上用氯气和NaOH溶液生产消毒剂NaClO的化学方程式___;②84消毒液(主要成分是NaClO)与洁厕灵(主要成分是盐酸)混在一起使用会产生有毒气体Cl2,其反应的离子方程式为__;③NaClO2中Cl元素化合价为__;④ClO2的杀菌效果比Cl2好,等物质的量的ClO2杀菌效果是Cl2的__倍(杀菌效果与单位物质的量的氧化剂得电子的物质的量有关,ClO2与Cl2消毒杀菌后均被还原为Cl-)。
【答案】B 2HClO2HCl+O2↑用容器盛放,在太阳光下曝晒一段时间Cl2+2NaOH=NaCl+NaClO+H2O 2H++Cl-+ClO-=Cl2↑+H2O +3 2.5【解析】【分析】图中信息告诉我们,在氯水中,具有杀菌能力的微粒主要是Cl2和HClO,随着溶液pH的不断增大,α(Cl2)不断减小,当pH=2时,α(Cl2)接近于0;随着溶液pH的不断增大,α(HClO)不断增大,当pH=2时,α(HClO)达到最大值;当pH升高到4.7时,α(HClO)开始减小,当pH接近10时,α(HClO)=0;从pH=4.7开始,α(ClO-)开始增大,pH=10时,α(ClO-)达最大值。
2020-2021高考化学氯及其化合物综合题汇编及详细答案

2020-2021高考化学氯及其化合物综合题汇编及详细答案一、 高中化学氯及其化合物1.已知Cl 2在70℃的NaOH 水溶液中,能发生氧化还原反应后可生成NaClO 与NaClO 3现有63.9g Cl 2,将其通入到足量70℃的NaOH 水溶液中,反应完全后测得溶液中NaClO 与NaClO 3的物质的量比为4:1,并得到500mL 溶液。
(1)写出Cl 2在70℃的NaOH 水溶液中发生上述反应的化学方程式______。
(2)计算完全反应后溶液中NaClO 、NaClO 3物质的量浓度____、______。
【答案】9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O 0.8mol/L 0.2mol/L【解析】【分析】先通过氯元素化合价的对比判断NaClO 与NaClO 3是氧化产物,氯气得电子化合价降低的产物是还原产物,所以还原产物是氯化钠,根据氧化还原反应中得失电子数相等配平方程式,从而得出反应中被氧化的Cl 2与被还原的Cl 2的物质的量之比。
【详解】(1)该反应中NaClO 与NaClO 3是氧化产物,氯化钠是还原产物,反应完全后测得溶液中NaClO 与NaClO 3的物质的量比为4:1,根据氧化还原反应中得失电子数相等配平方程式,所以该方程式为:9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O ;(2)49.7g Cl 2的物质的量为63.9g 71g /mol =0.9mol ,根据反应9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O 可知,生成NaClO 与NaClO 3的物质的量分别为0.9mol 40.4mol 9⨯=、0.9mol 10.1mol 9⨯=,完全反应后溶液中NaClO 、NaClO 3物质的量浓度分别为0.4mol 0.8/0.5mol L L =、0.1mol 0.2/0.5mol L L=。
高考化学专题训练---氯及其化合物的综合题分类附答案

高考化学专题训练---氯及其化合物的综合题分类附答案一、高中化学氯及其化合物1.高锰酸钾是一种典型的强氧化剂。
(1)在用 KMnO4酸性溶液处理固体 Cu2S 时,发生的反应如下:8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O①还原产物为_____。
②被氧化的元素是_____③氧化剂与还原剂的物质的量之比为_____④每生成 2.24 L(标况下)SO2,转移电子数目是_____(2)用 KMnO4酸性溶液处理固体 CuS 时,也可将 CuS 反应成 Cu2+和 SO2。
写出该离子反应方程式_____(3)15.8g KMnO4,加热分解后剩余固体 15.0 g。
该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体 A,产物中锰元素以 Mn2+存在,则气体 A 的物质的量为_____mol。
【答案】Mn2+ Cu、S 8:5 0.8N A 6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O 0.2【解析】【分析】(1)结合氧化还原反应的知识分析即可;(2)用 KMnO4酸性溶液处理固体 CuS 时,也可将 CuS 反应成 Cu2+和 SO2,同时得到还原产物Mn2+,结合电子守恒、电荷守恒和原子守恒写出发生反应的离子方程式;(3)15.8g KMnO4,加热分解后剩余固体 15.0 g,减少的质量为氧气的质量,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体为氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素失去的电子,据此分析。
【详解】(1)在8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O中Mn元素从+7价降为+2价,发生还原反应,而Cu2S中Cu元素从+1价升高为+2价,S元素从-2价升高为+4价,发生氧化反应;①由分析知,还原产物为Mn2+;②被氧化的元素是Cu2S中Cu、S两元素;③氧化剂为KMnO4,还原剂为Cu2S,两者的物质的量之比为8:5;④Cu2S中Cu元素从+1价升高为+2价,S元素从-2价升高为+4价,则1molCu2S完全被氧化,转移8mol电子;2.24 L(标况下)SO2的物质的量为2.24?L22.4?L/mol=0.1mol,反应中转移电子的物质的量为0.8mol,电子数目是0.8N A;(2)用 KMnO4酸性溶液处理固体 CuS 时,也可将 CuS 反应成 Cu2+和 SO2,同时得到还原产物Mn2+,结合守恒法得发生反应的离子方程式为6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O;(3)15.8g KMnO4,加热分解后剩余固体 15.0 g,减少的质量为氧气的质量,m(O2)=15.8g-15.0g=0.8g,n(O2)=0.8g32g/mol=0.025mol;在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体为氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则设氯气的物质的量为xmol,n(KMnO4)=15.8g158g/mol=0.1mol,电子转移守恒可得:0.1mol(7-2)=4n(O2)+2(Cl2),即0.1×(7-2)=4×0.025+2x,解得:x=0.2mol。
全国高考化学氯及其化合物的综合高考真题汇总附答案
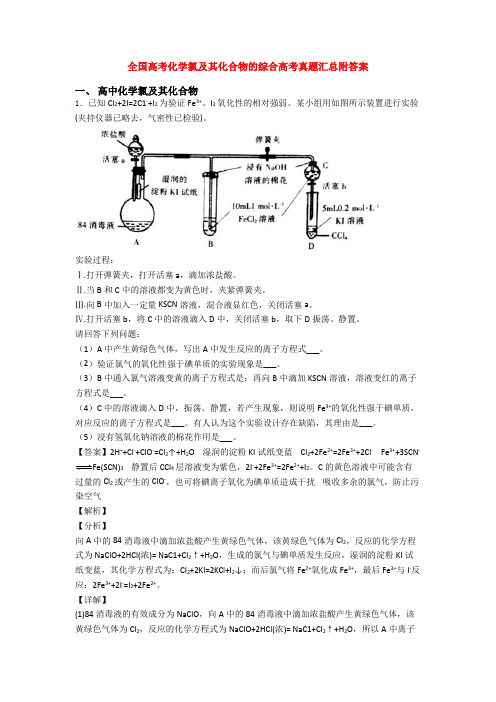
全国高考化学氯及其化合物的综合高考真题汇总附答案一、高中化学氯及其化合物1.已知Cl2+2I=2C1-+I2为验证Fe3+、I2氧化性的相对强弱。
某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.向B中加入一定量KSCN溶液,混合液显红色,关闭活塞a。
Ⅳ.打开活塞b,将C中的溶液滴入D中,关闭活塞b,取下D振荡、静置。
请回答下列问题:(1)A中产生黄绿色气体,写出A中发生反应的离子方程式___。
(2)验证氯气的氧化性强于碘单质的实验现象是___。
(3)B中通入氯气溶液变黄的离子方程式是;再向B中滴加KSCN溶液,溶液变红的离子方程式是___。
(4)C中的溶液滴入D中,振荡、静置,若产生现象,则说明Fe3+的氧化性强于碘单质,对应反应的离子方程式是___。
有人认为这个实验设计存在缺陷,其理由是___。
(5)浸有氢氧化钠溶液的棉花作用是___。
【答案】2H++Cl-+ClO-=Cl2↑+H2O 湿润的淀粉KI试纸变蓝 Cl2+2Fe2+=2Fe3++2Cl- Fe3++3SCN-Fe(SCN)3静置后CCl4层溶液变为紫色,2I-+2Fe3+=2Fe2++I2。
C的黄色溶液中可能含有过量的Cl2或产生的ClO-,也可将碘离子氧化为碘单质造成干扰吸收多余的氯气,防止污染空气【解析】【分析】向A中的84消毒液中滴加浓盐酸产生黄绿色气体,该黄绿色气体为Cl2,反应的化学方程式为NaClO+2HCl(浓)= NaC1+Cl2↑+H2O,生成的氯气与碘单质发生反应,湿润的淀粉KI试纸变蓝,其化学方程式为:CI2+2KI=2KCl+I2↓;而后氯气将Fe2+氧化成Fe3+,最后Fe3+与I-反应:2Fe3++2I-=I2+2Fe2+。
【详解】(1)84消毒液的有效成分为NaClO,向A中的84消毒液中滴加浓盐酸产生黄绿色气体,该黄绿色气体为Cl2,反应的化学方程式为NaClO+2HCl(浓)= NaC1+Cl2↑+H2O,所以A中离子方程式为:2H ++Cl -+ClO -=Cl 2↑+H 2O ;(2)根据装置图中的试剂,验证氯气的氧化性强于碘单质的实验现象是:湿润的淀粉KI 试纸变蓝,发生反应的化学方程式为:CI 2+2KI=2KCl+I 2↓;(3)B 中的溶液变为黄色,B 中反应为Cl 2将Fe 2+氧化成Fe 3+,B 中发生反应的离子方程式为Cl 2+2Fe 2+=2Cl -+2Fe 3+;再向B 中滴加KSCN 溶液,溶液变红的离子方程式是: Fe³⁺ + 3SCN⁻ =Fe(SCN)₃ (血红色);(4)将C 中溶液滴入D 中,关闭活塞b ,取下D 振荡,若产生现象:静置后CCl 4层溶液变为紫色,则说明Fe 3+的氧化性强于碘单质,反应的离子方程式为2Fe 3++2I -=I 2+2Fe 2+;但C 的黄色溶液中可能含有过量的Cl 2或产生的ClO -,也可将碘离子氧化为碘单质造成干扰,此为实验设计存在缺陷,要验证Fe 3+的氧化性强于I 2必须排除Cl 2的干扰;(5)由于Cl 2有毒会污染大气,浸有NaOH 溶液的棉花作用是:吸收氯气等有毒气体,防止污染空气,发生反应的化学方程式为Cl 2+2NaOH=NaCl+NaClO+H 2O 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
全国高考化学氯及其化合物的综合高考真题汇总附答案一、高中化学氯及其化合物1.已知Cl2+2I=2C1-+I2为验证Fe3+、I2氧化性的相对强弱。
某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.向B中加入一定量KSCN溶液,混合液显红色,关闭活塞a。
Ⅳ.打开活塞b,将C中的溶液滴入D中,关闭活塞b,取下D振荡、静置。
请回答下列问题:(1)A中产生黄绿色气体,写出A中发生反应的离子方程式___。
(2)验证氯气的氧化性强于碘单质的实验现象是___。
(3)B中通入氯气溶液变黄的离子方程式是;再向B中滴加KSCN溶液,溶液变红的离子方程式是___。
(4)C中的溶液滴入D中,振荡、静置,若产生现象,则说明Fe3+的氧化性强于碘单质,对应反应的离子方程式是___。
有人认为这个实验设计存在缺陷,其理由是___。
(5)浸有氢氧化钠溶液的棉花作用是___。
【答案】2H++Cl-+ClO-=Cl2↑+H2O 湿润的淀粉KI试纸变蓝 Cl2+2Fe2+=2Fe3++2Cl- Fe3++3SCN-Fe(SCN)3静置后CCl4层溶液变为紫色,2I-+2Fe3+=2Fe2++I2。
C的黄色溶液中可能含有过量的Cl2或产生的ClO-,也可将碘离子氧化为碘单质造成干扰吸收多余的氯气,防止污染空气【解析】【分析】向A中的84消毒液中滴加浓盐酸产生黄绿色气体,该黄绿色气体为Cl2,反应的化学方程式为NaClO+2HCl(浓)= NaC1+Cl2↑+H2O,生成的氯气与碘单质发生反应,湿润的淀粉KI试纸变蓝,其化学方程式为:CI2+2KI=2KCl+I2↓;而后氯气将Fe2+氧化成Fe3+,最后Fe3+与I-反应:2Fe3++2I-=I2+2Fe2+。
【详解】(1)84消毒液的有效成分为NaClO,向A中的84消毒液中滴加浓盐酸产生黄绿色气体,该黄绿色气体为Cl2,反应的化学方程式为NaClO+2HCl(浓)= NaC1+Cl2↑+H2O,所以A中离子方程式为:2H ++Cl -+ClO -=Cl 2↑+H 2O ;(2)根据装置图中的试剂,验证氯气的氧化性强于碘单质的实验现象是:湿润的淀粉KI 试纸变蓝,发生反应的化学方程式为:CI 2+2KI=2KCl+I 2↓;(3)B 中的溶液变为黄色,B 中反应为Cl 2将Fe 2+氧化成Fe 3+,B 中发生反应的离子方程式为Cl 2+2Fe 2+=2Cl -+2Fe 3+;再向B 中滴加KSCN 溶液,溶液变红的离子方程式是: Fe³⁺ + 3SCN⁻ =Fe(SCN)₃ (血红色);(4)将C 中溶液滴入D 中,关闭活塞b ,取下D 振荡,若产生现象:静置后CCl 4层溶液变为紫色,则说明Fe 3+的氧化性强于碘单质,反应的离子方程式为2Fe 3++2I -=I 2+2Fe 2+;但C 的黄色溶液中可能含有过量的Cl 2或产生的ClO -,也可将碘离子氧化为碘单质造成干扰,此为实验设计存在缺陷,要验证Fe 3+的氧化性强于I 2必须排除Cl 2的干扰;(5)由于Cl 2有毒会污染大气,浸有NaOH 溶液的棉花作用是:吸收氯气等有毒气体,防止污染空气,发生反应的化学方程式为Cl 2+2NaOH=NaCl+NaClO+H 2O 。
2.Cl 2及其化合物在生产、生活中具有广泛的用途.将氯气溶于水能形成氯气﹣氯水体系.完成下列填空:(1)氯原子最外层电子的电子排布式是__.与电子排布式相比,轨道表示式增加了对核外电子运动状态中__描述.(2)氢、氯、氧三种元素各能形成一种简单阴离子,按离子半径由大到小的顺序排列这些离子__.(3)氯气﹣氯水体系中,存在多个含氯元素的平衡关系,请分别用平衡方程式表示:__.已知HClO 的杀菌能力比ClO ﹣强,氯处理饮用水时,在夏季的杀菌效果比在冬季差,可能原因是__(一种原因即可).(4)在氯水中,下列关系正确的是__(选填编号).a c (HClO )+c (ClO ﹣)=c (H +)﹣c (OH ﹣)b c (H +)=c (ClO ﹣)+c (Cl ﹣)+c (OH ﹣)c c (HClO )<c (Cl ﹣)d c (Cl ﹣)<c (OH ﹣)(5)ClO 2是一种更高效、安全的消毒剂,工业上可用ClO 2与水中的MnCl 2在常温下反应,生成MnO 2和盐酸,以除去水中Mn 2+,写出该反应的化学方程式(需配平)__.有人认为产物MnO 2和盐酸会继续反应生成氯气,这种认识对吗?__(填“对”或“错”),说明理由__.【答案】3s 23p 5 自旋方向 Cl ﹣、O 2﹣、H ﹣ Cl 2(aq )+H 2O 垐?噲?HClO+H ++Cl ﹣、HClO 垐?噲?H ++ClO ﹣、Cl 2(g )垐?噲?Cl 2(aq ) 夏季温度高,HClO 易分解,杀菌效果比在冬季差 bc 2ClO 2+5MnCl 2+6H 2O=5MnO 2+12HCl 错 MnO 2和浓盐酸加热的条件下才能反应【解析】【分析】【详解】(1)氯是17号元素,其最外层电子的电子排布式为253s 3p ,若用轨道表示式来描述,则可以描述其电子的自旋方向;(2)+H 相当于光秃秃的质子,2-O 填满了前两层电子,而-Cl 填满了前三层电子,半径由大到小为-2-+Cl >O >H ;(3)首先氯气存在溶解—挥发平衡,即22Cl (g)Cl (aq)ƒ,其次氯气还能和水发生可逆反应,即22Cl +H O HCl+HClO ƒ,而HClO 是一个弱酸,存在电离平衡+-HClO H +ClO ƒ; 夏季和冬季最大的区别在温度,我们知道HClO 受热易分解,因此杀菌效果变差;(4)a.溶液中存在质子守恒---+c(OH )+c(Cl )+c(ClO )=c(H ),若要a 项成立除非-c(HClO)=c(Cl ),但是二者不可能相等,a 项错误;b.该项即溶液中存在的质子守恒,b 项正确;c.氯气和水反应得到等量的HCl 和HClO ,HCl 是强酸可以完全电离,因此溶液中-Cl 的量等于生成的HCl 的量,而HClO 是弱电解质部分电离,因此剩余的HClO 的浓度将小于-Cl 的浓度,c 项正确;d.氯水呈酸性,因此溶液中的-c(OH )极低(室温下-7<10mol/L ),因此不可能出现--c(OH )>c(Cl )的情况,d 项错误;答案选bc ;(5)2ClO 作氧化剂,2+Mn 作还原剂,二者发生氧化还原反应22222ClO +5MnCl +6H O=5MnO +12HCl ,该反应得到的盐酸较稀,且没有加热,因此不太可能被2MnO 继续氧化变成氯气,反应在这一步就停止了。
3.KClO 3和浓盐酸在不同温度下反应,发生以下两个反应。
其变化可表示为反应1:2KClO 3+4HCl (浓)=2KCl +Cl 2↑+2ClO 2↑+2H 2O反应2:KClO 3+6HCl (浓)=KCl +3Cl 2↑+3H 2O(1)已知反应1的还原产物为黄绿色的二氧化氯,该反应中被还原的是_________(填化学式),产生0.1 mol Cl 2时,转移的电子的物质的量为_____。
(2)反应2中氧化产物和还原产物的物质的量之比是_____。
(3)上述反应中浓盐酸表现的性质是(填写编号):反应1中为_________,反应2中为_________。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性(4)将少量氯气通入NaBr 溶液中,发生反应的离子方程式是Cl 2+2Br -=2Cl -+Br 2。
将少量氯气通入FeBr 2溶液中,发生反应的离子方程式是Cl 2+2Fe 2+=2Cl -+2Fe 3+,将少量氯气通入FeI 2溶液中,发生反应的离子方程式是Cl 2+2I -=2Cl -+I 2,这个事实说明上述反应中具有还原性粒子I -、Br -、Cl -、Fe 2+的还原性由强到弱的顺序是________,标况下,将22.4 LCl 2通入2 L 0.5 mol /L 的FeBr 2溶液中,发生反应的离子方程式_____________标况下,将22.4 LCl 2通入2L0.5mol/L的FeI2溶液中,发生反应的离子方程式_____________。
【答案】KClO3 0.2mol 5:1 ②② I->Fe2+>Br->Cl- 2Cl2+2Fe2++2Br-=2Fe3++4Cl-+Br2 Cl2+2I-=2Cl-+I2【解析】【分析】(1)同一元素的物质发生氧化还原反应时遵循:高高低低规律。
(2)同一元素的物质发生氧化还原反应时,产物中元素的化合价规律是:可相聚,不相交。
(3)根据HCl中Cl元素的化合价在反应前后的特点分析;(4)分析每个反应中还原剂、还原产物,利用还原性:还原剂>还原产物分析比较物质还原性的强弱,当同一溶液有多种还原性微粒时,还原性强的先发生反应;然后根据通入Cl2的物质的量与物质还原性强弱反应先后书写反应的离子方程式。
【详解】(1)在反应1:2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O中,KClO3得到电子变为ClO2,KClO3是氧化剂被还原,ClO2是还原产物;HCl失去电子变为Cl2,HCl是还原剂被氧化,Cl2是氧化产物,反应过程中每产生1mol Cl2,需转移2mol电子,则反应产生0.1mol Cl2时,转移的电子的物质的量为0.2mol;(2)在反应2:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中KClO3作氧化剂,HCl作还原剂,Cl2既是氧化产物又是还原产物,每有3mol Cl2产生,反应中消耗1mol氧化剂KClO3,5mol还原剂HCl,转移5mol电子,所以反应2中氧化产物和还原产物的物质的量之比是5:1;(3)在上述两个反应中,HCl中的Cl部分化合价升高,失去电子,被氧化,作还原剂,表现还原性,部分Cl在反应前后化合价不变,与金属阳离子结合形成盐,起酸的作用,所以两个反应中浓盐酸表现的性质是还原性和酸性,选项序号为②;(4)将少量氯气通入NaBr溶液中,发生反应的离子方程式是Cl2+2Br-=2Cl-+Br2,其中Br-作还原剂,Cl-是还原产物,说明还原性:Br->Cl-;将少量氯气通入FeBr2溶液中,发生反应的离子方程式是Cl2+2Fe2+=2Cl-+2Fe3+,其中Fe2+发生反应,而Br-未反应,说明还原性:Fe2+>Br-;将少量氯气通入FeI2溶液中,发生反应的离子方程式是Cl2+2I-=2Cl-+I2,其中I-发生反应,而Fe2+未反应,说明还原性:I->Fe2+;综上所述可知,上述反应中具有还原性粒子I-、Br-、Cl-、Fe2+的还原性由强到弱的顺序是I->Fe2+>Br->Cl-;标况下,将22.4LCl2通入2L0.5mol/L的FeBr2溶液中,n(Cl2)=1mol,n(FeBr2)=1mol,其中Fe2+为1mol,Br-2 mol,n(FeBr2):n(Cl2)=1:1,首先发生反应:Cl2+2Fe2+=2Cl-+2Fe3+,1mol Fe2+反应消耗0.5mol Cl2,还有0.5mol Cl2剩余,会再与溶液中Br-发生反应:Cl2+2Br-=2Cl-+Br2,0.5 molCl2反应消耗1mol Br-,则总反应的离子方程式2Cl2+2Fe2++2Br-=2Fe3++4Cl-+Br2;标况下,将22.4LCl2通入2L0.5mol/L的FeI2溶液中,n(Cl2)=1mol,n(FeI2)=1mol,其中Fe2+有1mol,I-有2mol,n(FeI2):n(Cl2)=1:1,首先发生反应:Cl2+2I-=2Cl-+I2,2mol I-反应消耗1mol Cl2,由于不再有Cl2剩余,因此不能进一步发生反应:Cl2+2Fe2+=2Cl-+2Fe3+,故反应的离子方程式为Cl2+2I-=2Cl-+I2。
