华附、省实、广雅、深中2021届高三四校联考化学试卷
广东省华师附中、实验中学、深圳中学、广雅中学四校21-22学年高三上学期期末联考化学试题 附解析
D.含有饱和碳原子,分子中所有碳原子不可能共平面,故D正确;
故选:C。
7.在给定条件下,下列选项所示的物质间转化均能实现的是
A.CuSO4(aq) Cu(OH)2 Cu2O
B.Ca(ClO)2 HClO(aq) Cl2
【答案】A
【解析】
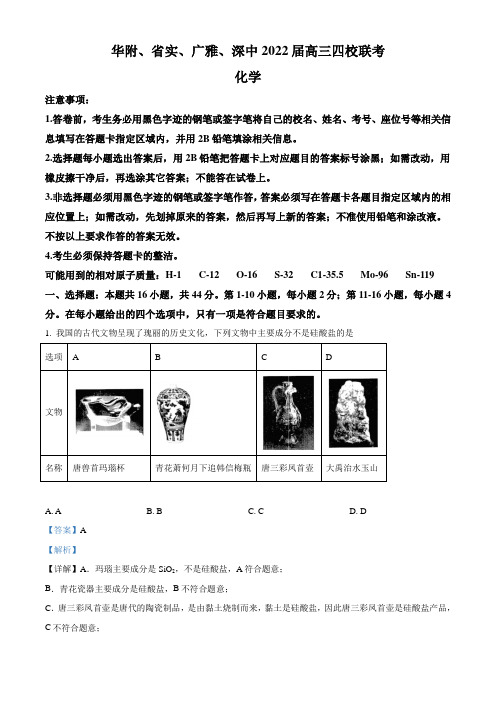
【详解】A.玛瑙主要成分是SiO2,不是硅酸盐,A符合题意;
B.青花瓷器主要成分是硅酸盐,B不符合题意;
C.唐三彩凤首壶是唐代的陶瓷制品,是由黏土烧制而来,黏土是硅酸盐,因此唐三彩凤首壶是硅酸盐产品,C不符合题意;
D.大禹治水玉山是以大禹治水为题材,用最为名贵的和田青白玉石雕刻成的大型玉雕,玉石主要成分是硅酸盐,因此大禹治水玉山属于硅酸盐产品,D不符合题意;
故答案选B。
6.下列有关物质 的叙述错误的是
A.可以发生取代反应、加成反应和氧化反应
B.核磁共振氢谱有4组峰
C.具有含苯环的同分异构体
D.分子中所有碳原子不可能共平面
【答案】C
【解析】
【详解】A.该物质含有羟基,可发生取代反应和氧化反应,含碳碳双键可发生加成反应,故A正确;
B.该物质 有4种H原子,则核磁共振氢谱有4组峰,故B正确;
B.H2O2的分子中,2个O原子形成O-O键,每个O原子再分别与H原子形成1个H-O键,使分子中各个原子都达到最外层2个或8个电子的稳定结构,其电子式为 ,B错误;
C.BaSO4难溶于水,但溶于水的部分完全电离产生自由移动的Ba2+、 ,故其电离方程式为BaSO4= +Ba2+,C正确;
D.12C与14C的质子数都是6,中子数分别是6、8,可见二者质子数相同而中子数不同,因此二者互为同位素,D错误;
广东省华南师大附中、实验中学、广雅中学、深圳中学2024届化学高二上期中综合测试试题含解析

广东省华南师大附中、实验中学、广雅中学、深圳中学2024届化学高二上期中综合测试试题注意事项1.考生要认真填写考场号和座位序号。
2.试题所有答案必须填涂或书写在答题卡上,在试卷上作答无效。
第一部分必须用2B 铅笔作答;第二部分必须用黑色字迹的签字笔作答。
3.考试结束后,考生须将试卷和答题卡放在桌面上,待监考员收回。
一、选择题(共包括22个小题。
每小题均只有一个符合题意的选项)1、等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)2Z(g)+W(s) ΔH<0,下列叙述正确的是()A.平衡常数K值越大,X的转化率越大B.达到平衡时,反应速率v正(X)=2v逆(Z)C.达到平衡后降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数D.达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动2、下列选项中的数值前者小于后者的是A.同温同浓度的NaHCO3溶液和CH3COONa溶液的pHB.同温同浓度的KHCO3和NH4HCO3溶液中的c(HCO3-)C.25℃和100℃时H2O的K WD.中和25mL 0.1mol/L NaOH溶液所需CH3COOH和HCl的物质的量3、13153I是常规核裂变产物之一,可以通过测定大气或水中13153I的含量变化来检测核电站是否发生放射性物质泄漏。
下列有关13153I的叙述中错误的是( )A.13153I的化学性质与12753I相同B.13153I的质子数为53C.13153I的原子核外电子数为78 D.13153I的原子核内中子数多于质子数4、粗铜中含有锌、铁、金、银等杂质,通过电解法将其精炼,下列说法不正确...的是A.粗铜与电源的正极相连发生氧化反应:Cu-2e-= Cu2+B.精铜作为阴极材料,不参与电极反应,电解过程中逐渐变粗C.用CuSO4作电解质溶液,电解过程中CuSO4溶液浓度略减小D.锌、铁、金、银等杂质沉积在阳极周围,成为阳极泥5、用下图所示装置检验乙烯时不需要除杂的是( )选项乙烯的制备试剂X 试剂YA CH3CH2Br与NaOH乙醇溶液共热H2O KMnO4酸性溶液B CH3CH2Br与NaOH乙醇溶液共热H2O Br2的CCl4溶液NaOHKMnO4酸性溶液C C2H5OH与浓H2SO4加热至170 ℃溶液NaOHBr2的CCl4溶液D C2H5OH与浓H2SO4加热至170 ℃溶液A.A B.B C.C D.D6、属于纯净物的物质是A.生铁B.铝热剂C.漂粉精D.胆矾7、某元素的原子核外有3个电子层,最外层有4个电子,则该原子核内的质子数为()A.14 B.15 C.16 D.178、多相催化反应是在催化剂表面通过吸附、解吸过程进行的。
广东省华附、省实、广雅、深中2021届高三四校联考四校联考化学参考答案

1 华附、省实、广雅、深中2021届高三四校联考化学参考答案及评分标准一、选择题:本题共10小题,每小题2分,共20分。
1-5:ABCDA 6-10:BCDAB二、选择题:本题共6小题,每小题4分,共24分。
11-16:DBADCC三、非选择题:本题共5小题,共56分。
17.(14分)(1)3MnO 2 + 6KOH + KClO 3 ==== 3K 2MnO 4 + KCl + 3H 2O (2分);泥三角(1分)(2)中和生成的OH —,使歧化反应充分进行(2分);KHCO 3(1分)(3)蒸发浓缩,冷却结晶(2分)(4)生成的Mn 2+起催化作用(2分);滴入最后一滴KMnO 4溶液,溶液恰好由无色变为浅紫红色,且30s 内不褪色(2分); 1580mV %(2分)18.(14分)(1)粉碎原料或适当增加空气量或搅拌等(1分)4FeWO 4+O 2+8NaOH ====2Fe 2O 3+4Na 2WO 4+4H 2O (2分)(2)强(1分)(3)静置分层,向上层清液中继续滴加盐酸,若无明显现象,则沉淀完全(2分)(4)漏斗、玻璃棒(2分) Fe 2(SO 4)3(2分)(5)MnO 2+H 2C 2O 4+2H +=Mn 2++2CO 2↑+2H 2O (2分)(6)氢氧化锰(或碱式碳酸锰) (2分)19.(14分)(1)2C(s)+2NO 2(g) == N 2(g)+2CO 2(g) ΔH 1=-854 kJ∙mol −1 (2分)(2)100 (2分);111 (2分);10a (2分)(3)向密闭容器中加入NO (2分);< (2分)(4)BD (2分)熔融 焙烧。
华附、省实、广雅、深中2021届高三四校联考化学试卷

华附、省实、广雅、深中2021届高三四校联考化学本试卷分选择题和非选择题两部分,满分100分,考试用时75分钟。
注意事项:1.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己校名、姓名、考号、座位号等信息填写在答题卡指定区域,并用2B铅笔填涂相关信息。
2.选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再填涂其他答案;答案不能答在试卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案,不准使用铅笔和涂改液。
不按以上要求作答的答案无效。
4.考生必须保持答题卡的整洁。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Cl-35.5 K-39 Mn-55 Fe-56Co-59 Cu-64 Ag-108第一部分选择题(共44分)一、选择题:本题共10小题,每小题2分,共20分。
每小题只有一个选项符合题意。
1.化学与生活密切相关,下列有关说法错误的是A.乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的B.实施“煤改气”、“煤改电”等清洁燃料改造工程,有利于保护环境C.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”D.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油2.常温下,下列各组离子在溶液中能大量共存的是A.H+、K+、CN-、Cl-B.Ba2+、K+、OH-、NO-3C.NH+4、Na+、SO2-3、ClO-D.Na+、Al3+、HCO-3、SO2-43.下列有关离子方程式正确的是A.用铜作电极电解KCl溶液:2Cl-+2H2O H2↑+Cl2↑+2OH-B.用稀硝酸洗涤试管内壁的银镜:Ag +NO-3+4H+= Ag++NO↑+2H2OC.少量Mg(OH)2溶于FeCl3溶液中:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+D.大理石溶于稀醋酸:CaCO3+2H+=Ca2+ +CO2↑+ H2O4.设N A为阿伏加德罗常数的值,下列说法正确的是A.常温下,pH=2的亚硫酸溶液中含有的H+数目为0.01 N AB.标准状况下,2.24 L CHCl3含有的共价键数为0.4 N AC.1 mol N2与4 mol H2反应生成的NH3分子数为2 N AD.14 g乙烯和环丙烷混合气体中的氢原子数为2 N A5.下列有关物质的工业制法中,正确的是A.制钠:以海水为原料制得精盐,再电解熔融的NaClB.炼铜:电解精炼黄铜矿得到纯度为99.9%的铜C.制硅:用一氧化碳还原二氧化硅得硅D.制铝:电解液态氯化铝得铝6.下列实验操作能达到实验目的的是A.用排水法收集铜粉与浓硝酸反应的NO2B.用NaOH溶液滴定未知浓度的CH3COOH溶液,选用酚酞作指示剂C.在空气中蒸干硫酸亚铁溶液可以得到绿矾(FeSO4·7H2O)D.在容量瓶中加一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸7.下列有关实验原理或操作正确的是A.分离酒精和水 B.干燥氨气C.配制0.1000 mol/L的食盐水 D.检查装置气密性8.柠檬烯的结构可表示为,关于柠檬烯下列说法错误的是A.分子中所有碳原子可能在在同一平面上B.可使溴的四氯化碳溶液褪色C.是苯乙烯的同系物D.该物质易溶于水9.NO催化O3生成O2的过程由三步基元反应构成:第一步:NO(g)+O3(g)=O2(g)+NO2(g) △H1 ;第二步:NO2(g)=O(g)+NO(g) △H2 ;第三步:O(g)+O3(g)=2O2(g) △H3 。
2021届高考化学二轮复习12题逐题专练: 元素周期律与周期表(解析版)

元素周期律与周期表【原卷】1.(湖北省部分重点中学2021届高三联考)A、B、C、D、E、F、G是短周期中原子序数依次增大的主族元素,A、B元素最高正价与最低负价之和均为0,D、F是同主族元素,F元素原子序数是D元素原子序数的2倍,E元素原子半径是短周期中最大的。
下列说法正确的是( )A.第一电离能:D>C>B B.简单离子的半径:E>D>CC.气态氢化物的还原性:G >F D.B、C、D与A均可形成含非极性键的二元化合物2.(湖北省武汉市2021届高三质量检测)现有W、X、Y、Z四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且每个甲、乙、丙分子中均含有10个电子,Y和Z化合生成丁,有关物质的转化关系如图所示。
下列说法错误的是A.W、Y、Z三种元素可能组成离子化合物B.Z的最高价氧化物对应的水化物一定为强酸C.原子半径:W<X<Y<ZD.Y与W、Z都能形成两种或两种以上的化合物3.(湖北省武汉市2021届高三质量检测)N和P为同族元素,下列说法正确的是A.N元素、P元素形成单质分子的空间结构均相同B.NH3和PH3均可和H+形成配位键C.HNO3与H3PO4均是强酸D.PCl3与PCl5中P原子的杂化方式相同4.(湖北省宜昌市2021届高三联考)下列说法正确的是( )A.Fe、Co、Ni在元素周期表中位于同一周期同一族B.离子晶体的熔点:NaCl<KCl<RbCl<CsClC.CO2为极性分子,含有σ键与π键D.金刚石和C60互称为同素异形体,两者具有相同的晶体类型5.(湖北省宜昌市2021届高三联考)E、F、G、M、Q为原子序数依次增大的短周期元素。
G元素的最高价氧化物的水化物和气态氢化物反应生成一种盐;F 元素与G、M元素相邻,且与M元素同主族;化合物F2E6共含有18个电子;Q 元素的原子最外层电子数比次外层少一个。
下列说法错误的是( )A.FE4的立体构型是正四面体形B.原子半径:F<G<MC.Q-和Ar具有相同的电子层结构D.GE4 中含有配位键6.(江苏省南京市第一中学2021届高三模拟)短周期主族元素X、Y、Z、W 原子序数依次增大。
2021届广东省华南师大附中等四校高三上期末联考理综化学试卷

【最新】广东省华南师大附中等四校高三上期末联考理综化学试卷学校:___________姓名:___________班级:___________考号:___________一、单选题1.下列说法错误的是A.液氨汽化时要吸收大量的热,常用作制冷剂B.压减燃煤、严格控车、调整产业是治理雾霾的有效措施C.手机外壳上贴的碳纤维外膜是一种新型的无机非金属材料D.铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝比铁更耐酸碱的腐蚀2.设N A表示阿伏加德罗常数的值,下列说法正确的是()A.25 ℃时,1 L pH=1的硫酸溶液中,含有H+的数目为0.2N AB.2 mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4N AC.含1 mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为N A D.2 mL 0.5 mol/L硅酸钠溶液中滴入过量盐酸制备硅酸胶体,所得胶粒数目为0.001N A 3.已知热化学方程式:2H2(g)+O2(g) =2H2O(l) ∆H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(l) ∆H= -1452 kJ·mol-1,H+(aq)+OH-(aq) =H2O(l) ∆H= -57.3 kJ·mol-1。
据此判断下列说法正确的是A.CH3OH的燃烧热∆H为-1452 kJ·mol-1B.2H2(g)+O2(g) =2H2O(g) ∆H > -571.6 kJ·mol-1C.CH3COOH(aq)+NaOH(aq)=H2O(l)+CH3COONa(aq) ∆H= -57.3 kJ·mol-1D.2CH3OH(l)+O2(g)=2CO2(g)+4H2(g) ∆H= -880.4 kJ·mol-14.A、B、C、D、E、F为原子序数依次增大的六种短周期主族元素,已知A、B、C同周期,C、E同主族。
高考化学复习广东省华附、省实、深中、广雅高三下学期四校联考化学试题(解析版).docx

高中化学学习材料唐玲出品一、单选题(每题4分,共6小题,共24分。
)7.下列说法不正确的是( )A.硅单质是将太阳能转化为电能的常用材料 B.氯气可用于自来水的杀菌消毒,说明氯气无毒 C.光线透过树叶间的缝隙形成光柱与胶体的性质有关 D.采用原煤脱硫技术,可减少燃煤时产生的SO28.水溶液中能大量共存的一组离子是( )A.Na+、Al3+、Cl-、HCO3- B.H+、Fe2+、NO3-、SO42-C.H+、 Mg2+、Cl-、NO3- D.K+、Ag+、OH-、SO42-9.设n A为阿佛加德罗常数的数值,下列说法正确的是( )A.等物质的量的H2和N2所含分子数均为n A B.标准状况下,11.2L的己烷含有分子数为0.5n A C.常温常压下,46gNO2含有原子数为3n A D.1mol SiO2晶体中含n A个SiO2分子【答案】C【解析】试题分析:A项中所给出的氢气和氮气并没有给出物质的量等微粒数,所以无法计算,A错误;标况下己烷是液体,不能用气体体积公式计算,B错误;46gNO2的物质的量为1mol,所以含有的原子数为3mol,C正确;二氧化硅是空间立体结构,不是简单的SiO2小分子,SiO2只是化学简式,所以D错误;故选C。
考点:本题考查的是阿伏伽德罗常数的计算。
10.下列离子方程式正确的是( )A.Al与NaOH溶液反应:2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑B.FeBr2溶液中通入少量Cl2:2Fe2++2Br-+Cl2=2Fe3++Br2+2Cl-C.稀硝酸除银镜:Ag+2H++NO3- =Ag++NO2↑+H2OD.烧碱溶液中通入过量SO2:2OH-+SO2=SO32-+H2O11.关于下列各实验装置的叙述中,不正确的是( )①②③④A.装置①可用于验证Na与H2O反应是否放热 B.装置②可用于干燥、收集NH3,并吸收多余的NH3 C.装置③可用于制备并收集少量NO2 D.装置④可制得金属锰考点:本题考查的是物质的性质和基础实验装置。
2022-2023学年广东省华附、省实、广雅、深中高三下学期四校开学联考化学试卷含详解

2022-2023学年度高三第二学期四校联考化学科试卷可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27一、单选题(第1~10题每题2分,第11~16题每题4分,每题只有一个选项符合题意)1.中华文明源远流长,下列文物或物品属于无机非金属材料的是A.战汉时期老青铜错金马B.春秋战国青铜鎏金活链圆壶C.两周时期曾国编钟D.潮汕陶瓷工夫茶具..A.油脂属于高分子化合物,可用于制造肥皂和油漆B.福尔马林能使蛋白质变性,可用于浸制动物标本C.天然气的主要成分是甲烷,是常用的燃料D.中国科学家在世界上首次人工合成具有生物活性的蛋白质——结晶牛胰岛素3.下列图示或化学用语错误..的是A.羟基的电子式:B.H2O的VSEPR模型:C.Mn2+的价电子的轨道表示式:D.中子数为5的铍原子:94Be4.下列有关物质性质与用途对应关系错误..的是物质性质物质用途A Na2O2吸收CO2产生O2Na2O2用作呼吸面具供氧剂B Al2O3熔融状态可电离电解熔融Al2O3制取单质AlC 铁比铜金属性强FeCl3腐蚀Cu刻制印刷电路板D HF与SiO2反应HF在玻璃器皿上刻蚀标记5A.难溶于热水,能发生消去反应 B.在人体内能发生水解反应C.分子中所有原子可能共平面 D.不能与FeCl3溶液发生显色反应6.抗疫居家期间,同学们在参与家务劳动的过程中体会到化学知识无处不在。
下列劳动与所涉及的化学知识不相..符.的是家务劳动化学知识A 用白醋除去水壶中的水垢白醋可溶解CaCO3沉淀B 用小苏打粉作膨松剂焙制糕点 NaHCO 3加热容易分解放出CO 2C 用含NaClO 的84消毒液拖地 NaClO 有还原性D用洁厕灵洗马桶洁厕灵中含有盐酸,可以与尿垢反应7..A .仪器①不可以直接在酒精灯火焰上长时间加热B .仪器②可以用于配制一定物质的量浓度的溶液C .仪器③可以用于量取酸性高锰酸钾标准溶液D .仪器④在使用时必须从b 口进水8.下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是叙述Ⅰ叙述ⅡA NH 3能使酚酞溶液变红 NH 3可用于设计喷泉实验B 1-己醇的沸点比己烷的沸点高 1-己醇和己烷可通过蒸馏初步分离C Al 2O 3熔点高,硬度大 实验室可用氧化铝坩埚熔化NaOH 固体 DNa 在Cl 2中燃烧生成离子晶体NaCl 固体可导电9.实验室从废定影液[含()232Ag S O 和Br -等]中回收Ag 和2Br 的主要步骤为:向废定影液中加入2Na S 溶液沉银,过滤、洗涤及干燥,灼烧2Ag S 制Ag ,制取2Cl 并通入滤液氧化Br -,用苯萃取分液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
华附、省实、广雅、深中2021届高三四校联考化学本试卷分选择题和非选择题两部分,满分100分,考试用时75分钟。
注意事项:1.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己校名、姓名、考号、座位号等信息填写在答题卡指定区域,并用2B铅笔填涂相关信息。
2.选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再填涂其他答案;答案不能答在试卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案,不准使用铅笔和涂改液。
不按以上要求作答的答案无效。
4.考生必须保持答题卡的整洁。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Cl-35.5 K-39 Mn-55 Fe-56Co-59 Cu-64 Ag-108第一部分选择题(共44分)一、选择题:本题共10小题,每小题2分,共20分。
每小题只有一个选项符合题意。
1.化学与生活密切相关,下列有关说法错误的是A.乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的B.实施“煤改气”、“煤改电”等清洁燃料改造工程,有利于保护环境C.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”D.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油2.常温下,下列各组离子在溶液中能大量共存的是A.H+、K+、CN-、Cl-B.Ba2+、K+、OH-、NO-3C.NH+4、Na+、SO2-3、ClO-D.Na+、Al3+、HCO-3、SO2-43.下列有关离子方程式正确的是A.用铜作电极电解KCl溶液:2Cl-+2H2O H2↑+Cl2↑+2OH-B.用稀硝酸洗涤试管内壁的银镜:Ag +NO-3+4H+= Ag++NO↑+2H2OC.少量Mg(OH)2溶于FeCl3溶液中:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+D.大理石溶于稀醋酸:CaCO3+2H+=Ca2+ +CO2↑+ H2O4.设N A为阿伏加德罗常数的值,下列说法正确的是A.常温下,pH=2的亚硫酸溶液中含有的H+数目为0.01 N AB.标准状况下,2.24 L CHCl3含有的共价键数为0.4 N AC.1 mol N2与4 mol H2反应生成的NH3分子数为2 N AD.14 g乙烯和环丙烷混合气体中的氢原子数为2 N A5.下列有关物质的工业制法中,正确的是A.制钠:以海水为原料制得精盐,再电解熔融的NaClB.炼铜:电解精炼黄铜矿得到纯度为99.9%的铜C.制硅:用一氧化碳还原二氧化硅得硅D.制铝:电解液态氯化铝得铝6.下列实验操作能达到实验目的的是A.用排水法收集铜粉与浓硝酸反应的NO2B.用NaOH溶液滴定未知浓度的CH3COOH溶液,选用酚酞作指示剂C.在空气中蒸干硫酸亚铁溶液可以得到绿矾(FeSO4·7H2O)D.在容量瓶中加一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸7.下列有关实验原理或操作正确的是A.分离酒精和水 B.干燥氨气C.配制0.1000 mol/L的食盐水 D.检查装置气密性8.柠檬烯的结构可表示为,关于柠檬烯下列说法错误的是A.分子中所有碳原子可能在在同一平面上B.可使溴的四氯化碳溶液褪色C.是苯乙烯的同系物D.该物质易溶于水9.NO催化O3生成O2的过程由三步基元反应构成:第一步:NO(g)+O3(g)=O2(g)+NO2(g) △H1 ;第二步:NO2(g)=O(g)+NO(g) △H2 ;第三步:O(g)+O3(g)=2O2(g) △H3 。
下列说法错误的是A.该反应的中间体有三种B.第二步、第三步反应均为放热反应C.总反应速率主要由第一步反应速率决定D.氮氧化物NO x的大量排放可能会严重破坏臭氧层10.实验室采用如下图所示的装置制取氯化铜(部分仪器和夹持装置已略去)下列说法正确的是A.玻璃纤维的作用是防止E装置中液体倒吸入D装置中B.E装置中液体用于吸收多余的氯气和氯化氢C.要使B装置中产生氯气,应先加热圆底烧瓶,再滴加浓盐酸D.实验中加热的先后顺序为先加热硬质玻璃管D,再加热圆底烧瓶B二、选择题:本题共6小题,每小题4分,共24分。
每小题只有一个选项符合题意。
11.短周期元素W、X、Y、Z的原子序数依次增加。
A、B、C、D分别是这些元素形成的单质,甲、乙、丙、丁、戊是由这些元素形成的二元化合物。
其中,乙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丙是一种高能燃料,其组成元素与乙相同;丁是常见的两性氧化物。
上述物质的转化关系如图所示。
下列说法正确的是A.原子半径的大小:W<X<Y<ZB.戊的沸点低于乙C.丙中只含非极性共价键D.乙可与X元素的最高价氧化物对应的水化物反应12.我国最近在太阳能光电催化—化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。
下列说法正确的是A.a极上发生的电极反应为Fe3++e-=Fe2+B.a极区Fe3+和Fe2+的浓度会影响H2S分解效率C.该装置工作时,H+由b极区流向a极区D.从工艺可知反应2Fe2++2H+=2Fe3++H2可自发进行13.某废催化剂含SiO2、ZnS、CuS及少量的Fe3O4。
某实验小组以该废催化剂为原料,回收锌和铜,设计实验流程如图:下列说法正确的是A.步骤①操作中,生成的气体可用CuSO4溶液吸收B.检验滤液1中是否含有Fe2+,可以选用KSCN和新制的氯水C.步骤②操作中,应先加6% H2O2,然后不断搅拌下缓慢加入1.0mol·L -1H2SO4D.滤渣1和滤渣2成分均含有H2SiO314.已知:N2(g)+3H2(g) ⇌ 2NH3(g) ΔH= -m kJ·mol-1。
在2 L密闭容器中通入3 mol H2和1 mol N2,测得不同温度下,NH3的产率随时间变化如图所示。
下列有关说法正确的是A.ΔH﹥0,T2﹥T1B.达到平衡时,T1温度对应反应放出热量为m kJC.平衡时,通入氩气平衡正向移动D.平衡常数,K a<K c15.O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2,下列说法正确的是A.氧气是氧化产物B.O2F2既是氧化剂又是还原剂C.还原剂与氧化剂的物质的量之比为1∶4D.若生成4.48 L HF,则转移0.8mol电子16.室温下,向H2C2O4溶液中滴加NaOH溶液,若pC= -lg c,则所得溶液中pC(H2C2O4)、pC(HC2O-4)、pC(C2O2-4)与溶液pH的关系如图所示。
下列说法正确的是A.常温下,K a2(H2C2O4)=10-1.3B.pH=x时,c(HC2O-4)<c(H2C2O4)=c(C2O2-4)C.M点时,2c(HC2O-4)+c(C2O2-4)﹥c(Na+)D.c2(HC2O-4)c(H2C2O4)·c(C2O2-4)随pH的升高而减小第二部分非选择题(共56分)三、非选择题:本题共5小题,共56分。
第17~19题为必考题,每个考题考生都必须作答。
第20~21题为选考题,考生根据要求作答。
(一)必考题:共42分。
17.(14分)某化学兴趣小组的同学拟设计实验制备KMnO4,并检验所得产品纯度。
资料:i.MnO2与强碱在强氧化剂存在下共熔生成K2MnO4;ii.K2MnO4溶于水,发生歧化反应生成KMnO4:3K2MnO4 + 2H2O = 2KMnO4 + MnO2↓+ 5KOH根据资料,该小组同学设计实验方案如下:①将KClO3和KOH固体混匀,加热至熔融,缓慢加入MnO2,继续加热,得颗粒状粗产品,提纯后,溶解得K2MnO4溶液。
②向制得的K2MnO4溶液中通入适量CO2,直至K2MnO4全部转化为KMnO4和MnO2。
抽滤,滤液转入蒸发皿中, a ,抽滤,洗涤,干燥,称量,得到m g产品。
③将m g产品溶解,配成100 mL待测液,量取25 mL标准H2C2O4溶液(0.1000 mol/L)于锥形瓶中,加入足量稀H2SO4,用配制的待测液滴定,平行滴定3次,消耗待测液的平均值为V mL。
回答下列问题:(1)写出制备K2MnO4的化学方程式:;在实验室进行该反应需用到的硅酸盐仪器有酒精灯、。
(2)进行K2MnO4的歧化反应时,通入适量CO2的目的是,如果CO2通入过多,可能会使产物不纯,混有杂质。
(3)步骤②中 a 处的操作方法为。
(4)滴定开始时,溶液紫色褪去很慢,滴入几滴KMnO4溶液后,褪色变得很快,可能的原因是,滴定终点的现象是,产品中KMnO4(M =158 g/mol)的质量分数为。
18.(14分)精制黑钨矿的主要成分为FeWO4、MnWO4,同时还含有少量Si的化合物。
工业上由黑钨矿冶炼金属钨并获取副产物的流程如下:已知:①烧结物的主要成分为Fe2O3、MnO2、Na2SiO3、Na2WO4;②上述流程中,钨的化合价只在生成钨单质的反应中发生改变;③常温下,钨酸是难溶于水的弱酸。
请回答下列问题:(1)为了提高黑钨矿焙烧速率,可以采取的措施是____________(写出一种即可),写出FeWO4在焙烧条件下与纯碱、空气反应的化学方程式____________________。
(2)从本题流程可以得出,同浓度的硅酸根离子比钨酸根离子结合质子能力________(填“强”或“弱”)。
(3)“沉钨”过程,判断钨酸已完全沉淀的方法是:_______________________________。
(4)“操作1”用到的玻璃仪器除烧杯外还有__________________,若滤渣1用稀硫酸浸泡,则固体A主要成分的化学式为__________。
(5)写出MnO2与硫酸、草酸(H2C2O4)溶液反应的离子方程式为__________________。
(6)工业“沉锰”过程中常选用NH4HCO3溶液作沉淀剂,若用碳酸盐代替NH4HCO3溶液可能产生其它固体杂质,该杂质可能为___________(填化学名称)。
19.(14分)“绿水青山就是金山银山”,研究并消除氮氧化物污染对建设美丽家乡,打造宜居环境有重要意义。
(1)已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-114 kJ∙mol−1C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ∙mol−1N2(g)+O2(g)=2NO(g) ΔH3=+181 kJ∙mol−1若某反应的平衡常数表达式为K=c(N2)c 2(CO2)c2(NO2),请写出此反应的热化学方程式________________________________________________。
(2)T o C时,存在如下平衡:2NO2(g) ⇌N2O4(g)。
