分子的转动光谱
IR

● 外部因素
1.溶剂影响 ——极性基团,如,C=O
伸缩振动波数随溶剂极性增大而减小。
如,羧酸中的νC=0 气体 1780cm-1(游离) 非极性溶剂 1760cm-1(游离) 乙醚 1735cm-1 乙醇 1720cm-1 碱溶液中 νas C=0 1610~1500cm-1 νsC=0 1400cm-1
● 红外光谱谱带强度(峰强)
● 影响红外光谱的内外因素
一、分子振动特性描述(峰位)
● 谐振子模型 —— 描述分子振动特性
力学的Hoocke定律
◆ 谐振子恢复力(f): 谐振子恢复力与质点离开平衡位置的位 移或正比,但方向则与位移的方向相反。
f = - K(dA + dB)2 / 2
式中,K为键力常数(force constant)
药物波谱解析 第二章 红外光谱(IR)
红外光谱(IR)
IR:属于分子的振转光谱 IR光谱特征:指纹性 IR谱图: 横坐标 —— 波数为( )
纵坐标 —— 透光率(T%)
IR光谱分三种
① 近红外光谱:0.8~2.5um 即1250~4000cm-1
——分子中O-H、N-H、C-H振动倍频和组频;
◆ 分子振转能级示意图:
◆ IR 能级跃迁类型: V0→V1:产生的IR谱带 —— 基频峰 V0→ niVi —— 倍频峰 V0→miVi+niVi —— 合频峰 V0→V1- V2 , 2V1- V2 等 —— 差频峰
※ 泛频峰(组频峰):倍频峰、合频
峰与差频峰的总称。
四、影响IR光谱的的其他因素
弯曲振动引起的吸收
如,C—X(X=C,N,O)
—— 指纹区域
仪器分析原理5分子振动-转动光谱

取代基相同,其三重键的对称伸缩振动没有偶极矩的 变化,不发生红外吸收。
§5.1.2 红外光谱和分子结构的关系
1. 官能团区和指纹区
△有机结构分析:分子中的不同基团在红外光谱中有不同 的吸收频率,而且基团所处的环境不同,红外吸收不同。
以拉曼位移(波数)为横坐标,强度为纵坐标,略去反斯托克 斯谱线,以激发光的波数为原点νo,便可得到类似红外光 谱的拉曼光谱图。
(4) 费米(Fermi)共振 当振动的倍频或合频与其另一基频频率相近,并且具
有相同的对称性时,由于相互作用也产生共振耦合使谱带 分裂,并使原来的倍频或合频的强度增加。
醛基在2200 cm-1和2270 cm-1出现两个强度相近的谱带是 费米共振的典型例子。
3. 主要基团的特征吸收谱带 红外光谱用于化合物的结构分析,需要对红外光谱图
0
拉曼散射:分子在受激虚态可能有两种方式回到低能级。 斯托克斯线:从受激虚态→激发态能级,放出能量为 h(ν0−∆ν)的光子,此时散射光的频率比入射光的频率相应 地减小Δν,这种散射谱线称为斯托克斯线(低频)。 反斯托克斯线:从受激虚态→基态并发射出能量为h(ν0+∆ν) 的光子,此时散射光的频率比入射光的频率相应地增加Δν, 这种散射谱线为反斯托克斯线(高频)。
在常温下,绝大多数分子处在基态,而不是处在激发态。 因此斯托克斯线比反斯托克斯线要强得多。
拉曼位移: 斯托克斯线或反斯托克斯线与入射光的频率之差Δν称
为拉曼位移。
Stokes Raman a分子的拉曼线的频率也会改 变。但是拉曼位移Δν始终保持不变,拉曼位移与入射光的 频率无关,它与物质分子的振动和转动能级有关。不同的 物质具有不同的分子结构,具有不同的振动和转动能级, 因而有不同的拉曼位移。
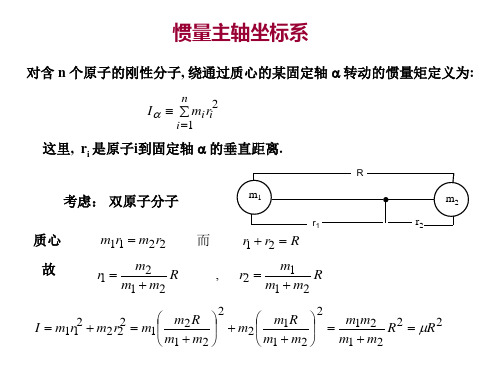
双原子分子纯转动光谱

,
YJm
,
NJm
P|m| J
cos
eim
J 0, 1, 2, m 0,1,2,,J
EJ J J 1 2 2I
EJ EJ 1 EJ
2
J 1
I
(2) 选择定则
• 两个转动态之间发生跃迁,要求相应的电偶极跃迁矩不为0,即
对HCl, a 20.79cm1, b 0.001cm1
• 非刚性转子模型:转动过程中,键长拉长
随波数增大, 间隔减小
k r r0 2r=
rL2
I2
L2
r3
r
r r0
L2
kr3
• 动能项:
T
L2 2I
L2
2r 2
L2
2
1 r02
(4) 光谱选律(选择定则)
• 两个能级间能够发生光谱跃迁的必要条件是相应的电偶极跃迁矩不 为零 光谱选律或称跃迁选择定则(电偶极跃迁)。
x
mk
y
mk
z
0
mk
禁戒
x
0
mk
or
y
0
mk
or
z
0
mk
允许
• 在很多场合,分子初态、末态的波函数的具体形式不易得到,但
波函数的对称类型相对容易得到,可利用群论的有关定理,容易
• 光场为电磁波,电场强度随时间变化:
0 cos 2t 0 cost
• 光的波长远大于分子尺度,分子在光场下受到周期变化的均匀电磁
红外光谱

傅里叶红外光谱仪的定性试验傅里叶红外光谱仪的定性试验红外光谱,又称分子振动转动光谱,属分子吸收光谱,分子光谱是四大谱学之一,红外光谱和核磁、质谱、紫外光谱一样,是确定分子组成和结构的有力工具。
红外光谱分析(Infrared spectra analysis)是利用红外光谱对物质分子进行的分析和鉴定。
将一束不同波长的红外射线照射到物质的分子上,某些特定波长的红外射线被吸收,形成这一分子的红外吸收光谱。
每种分子都有由其组成和结构决定的独有的红外吸收光谱,据此可以对分子进行结构分析和鉴定。
红外吸收光谱是由分子不停地作振动和转动运动而产生的,分子振动是指分子中各原子在平衡位置附近作相对运动,多原子分子可组成多种振动图形。
当分子中各原子以同一频率、同一相位在平衡位置附近作简谐振动时,这种振动方式称简正振动(例如伸缩振动和变角振动)。
分子振动的能量与红外射线的光量子能量正好对应,因此当分子的振动状态改变时,就可以发射红外光谱,也可以因红外辐射激发分子而振动而产生红外吸收光谱。
分子的振动和转动的能量不是连续而是量子化的。
但由于在分子的振动跃迁过程中也常常伴随转动跃迁,使振动光谱呈带状。
所以分子的红外光谱属带状光谱。
分子越大,红外谱带也越多。
红外光谱仪的种类有:①棱镜和光栅光谱仪。
属于色散型②傅里叶变换红外光谱仪[1]。
它是非色散型的,其核心部分是一台双光束干涉仪。
当仪器中的动镜移动时,经过干涉仪的两束相干光间的光程差就改变,探测器所测得的光强也随之变化,从而得到干涉图。
经过傅里叶变换的数学运算后,就可得到入射光的光谱。
这种仪器的优点:①多通道测量,使信噪比提高。
②光通量高,提高了仪器的灵敏度。
③波数值的精确度可达0.01厘米-1。
④增加动镜移动距离,可使分辨本领提高。
⑤工作波段可从可见区延伸到毫米区,可以实现远红外光谱的测定。
⑥扫描速度快。
对试样的要求[2]:①试样应为“纯物质”(>98%),通常分析前,需纯化;②试样不含水(水可产生红外吸收且可侵蚀盐窗。
分子的转动光谱

(2.55) (2.56)
E rot BhcJ (J 1) 双原子分子转动能量的大小处在微波和远红外范围内。
(2.57)
例 2-3 求出 0 , , 。 1, 2和 J , m (θ 2, m ,并且求出相应的波函数 解:已知 J=2,m=0, ±1, ±2。按式(2.51) ,有 0 ( 1 2 1 , 1 ( 1 1 i 2 e i , e i , 2 ( e , 1 ( 2 2 2 1
和 m 有关。
为了使波函数满足有限性的条件,必须有= J(J+1) ,因此转动光谱的能量 必须是量子化的,即 h2 E rot 2 J (J 1) 8 I (J = 0,1,2,…) (2.54)
式(2.53)中的 I 为转动惯量。J 为转动量子数,取从零开始的正整数。式(2.54) 也可以改写为以波数(cm-1)为单位的能量形式
例如当 J=2 时,将 m=0, ±1, ±2 分别代入(2.58)可求得 θ 约分别为 90°、 66°、-114°、35°、-145°,见图 2.9。
z z
z
z
z
m=0
m=1
m = -1
m=2
m = -2
6
图 2.9 J = 2 时双原子分子角动量在空间取向,两个不同颜色的小球代表两个原子,原 子上的箭头表示分子旋转方向。黑色箭头方向为角动量方向。
分子的转动光谱
1、分子转动的描述和能量 分子的运动方式除了平动和振动外还有转动。 振动和转动都能够影响分子的 红外谱图。 分子的振动和转动时同时进行并且不可绝然分开, 但是为了处理方便, 首先对分子的转动进行处理, 得到分子的转动光谱, 然后进一步与振动联系起来, 得到分子的振动-转动光谱。 在第一章中提到 1912 年丹麦物理化学家 Niels Bjerrum 首先提出分子的能量 由平动、转动和振动组成,转动能量量子化的理论。转动光谱的存在最先在 HCl 气体分子红外光谱的研究中得到证实。 图 2.6 中的光谱 a 是在 1893 年由 Angstrom 和 Palmaer 得到的第一幅 HCl 气体分子红外谱的大致图,当时仪器的分辨率为 256cm-1, 在波长 3.4 微米处观察到一个吸收峰。1910 年 Eva von Bahr 证实了 Angstrom 的结果。 1913 年 Burmeister 用氟化钙 (CaF2) 作为棱镜, 分辨率为 64cm-1 的仪器观察到类似图 2.6 中 b 的谱图。图 b 在 3.40 和 3.55 微米处出现两个吸收 峰。使用分辨率为 16cm-1 和石英为棱镜的仪器,Eva von Bahr 在 1913 年得到图
什么是红外光谱

什么是红外光谱
红外光谱又称分子振动转动光谱,属分子吸收光谱。
样品受到频率连续变化的红外光照射时,分子吸收其中一些频率的辐射,分子振动或转动引起偶极矩的净变化,使振-转能级从基态跃迁到激发态,相应于这些区域的透射光强减弱,记录百分透过率T%对波数或波长的曲线,即为红外光谱。
红外光谱与紫外光谱、质谱、核磁共振并称物质结构分析“四大谱”,是仪器分析中重要的分析手段之一。
通过与标准谱图比较,可以确定化合物的结构;对于未知样品,通过官能团、顺反异构、取代基位置、氢键结合以及络合物的形成等结构信息可以推测结构。
以上信息仅供参考,建议查阅专业书籍或咨询专业人士。
多原子分子转动光谱

描述分子转动能级跃迁的能量差值,由分子的总 角动量和角量子数表示。
转动光谱的测量方法
发射光谱法
通过测量分子转动能级跃迁产生的光谱线,确定分子的转动能级 和光谱项。
吸收光谱法
通过测量分子对特定波长光的吸收,确定分子的转动能级和光谱项。
共振增强法
利用特定频率的光与分子转动能级共振,增强分子对光的吸收或散 射,提高测量灵敏度。
多原子分子转动光谱
目 录
• 引言 • 多原子分子转动光谱基础知识 • 多原子分子转动光谱的特性 • 多原子分子转动光谱的应用 • 多原子分子转动光谱的未来发展
01 引言
主题简介
分子转动光谱是研究分子转动能级和转 动光谱的重要手段,对于理解分子结构 和分子间相互作用具有重要意义。
多原子分子的转动光谱研究有助于深入 理解分子振动-转动相互作用、分子内 和分子间相互作用等重要物理过程。
超快转动光谱的研究
总结词
超快转动光谱研究将有助于揭示多原子 分子在极短时间内发生的化学反应过程 。
VS
详细描述
超快转动光谱的实验技术可以在极短的时 间内对多原子分子进行探测,从而揭示多 原子分子在极短时间内发生的化学反应过 程。这种技术对于研究化学反应的动力学 过程和反应机制具有重要意义。
转动光谱与其他光谱技术的结合研究
转动光谱的线型与线强
线型
转动光谱的线型取决于分子转动能级的跃迁类型,主要有A型和E型。A型表示 能级跃迁时转动量子数变化为偶数,E型表示能级跃迁时转动量子数变化为奇 数。
线强
线强取决于分子转动能级的跃迁概率,与分子内部结构和外部环境因素有关。 跃迁概率越大,线强越强。
转动光谱的偏振特性
偏振方向
多原子分子转动光谱
修正后的跃迁频率为:
(J , K ) F(J 1, K ) F(J , K ) 2(B DJK K 2 )( J 1) 4DJ (J 1)3
把JJ+1 的跃迁分裂成(J+1)条谱线
图 SiH3NCS的微波跃迁 J= 8 - 7
(J , K ) (J , K 1) 2DJK (J 1)(( K 1)2 K 2 ) 2DJK (J 1)(2K 1)
转
子
多原子分子的转动惯量和能级
mi rAi rBi mi rBi rCi mi rCi rAi 0
i
i
i
转动惯量
I A mi rA2i
i
总角动量
IB mi rB2i
i
IC mi rC2i
i
M2
M
2 A
M
2 B
M
2 C
总转动能
Er
M
2 A
2IA
M
2 B
2IB
M
2 C
2IC
(1) 线性分子
i
i
I yz mi zi yi
i
惯量矩阵为:
I xx I xy I xz
I xyz I xy I yy I yz
I
xz
I yz
I
zz
把此对称矩阵对角化:
Lxa Lya Lza I xx I xy I xz Lxa Lxb Lxc Ia 0 0
Lxb Lyb Lzb I xy I yy I yz Lya Lyb Lyc 0 Ib 0
SiH4的远红外光谱
(非常弱)
(Rosenberg and Ozier, Can. J. Phys. 52, 575, 1974)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
d = 2π vr 为旋转角速度, 式(2.43)可写为 dt 1 2 E I(2 π v r) 2
(2.44)
可见在经典力学的描述下,分子的转动能量为连续值。而实验得到的 HCl 分子 转动光谱是分立峰。显然经典力学的描述与实验事实不符。 对分子转动的量子力学描述与上节中用量子力学对分子的振动进行描述的 步骤相同。不过要在球极坐标中对 Schrödinger 方程求解。在球极坐标下,式 1.4
22 2 2 1 (2 2 )! (1 cos )2 d 15 (cos 2 1) 2 sin 2 2 2 2 2 (2 2 )! 4 2 2! d (cos ) 2 2
2, 2 ( )
, 2, 0 ( )0 ( 2,0 (θ
例如当 J=2 时,将 m=0, ±1, ±2 分别代入(2.58)可求得 θ 约分别为 90°、 66°、-114°、35°、-145°,见图 2.9。
z z
z
z
z
m=0
m=1
m = -1
m=2
m = -2
6
图 2.9 J = 2 时双原子分子角动量在空间取向,两个不同颜色的小球代表两个原子,原 子上的箭头表示分子旋转方向。黑色箭头方向为角动量方向。
10 1 5 (3 cos 2 1) (3 cos 2 1) 4 2 4 15 1 30 i sin cos e i sin cos e 2 2 4
, 2, 1 ( ) 2, 1 (θ 1 (
其他的波函数 , , , 和 , 可用同样的方法求出。 2,1 (θ 2, 2 (θ 2, 2 (θ 双原子分子的转动存在大量的简并态而振动却没有。 所谓的简并态是指分子 处于相同的能级,但又处在不同的运动状态。例如当双原子分子处于 J 等于 2 的 能级时,双原子分子的转动有 m=0, ±1, ±2 等 5 个运动状态,分子可能处于 其中的任何一个状态,但无论处于哪一个状态,按式(2.54) ,其转动能量都等 于
( (2 ,即 cos m i sin m cos m( i sin m(
这只有当 m = 0, ±1, ±2, …,时才能成立。又因为 如果仅仅考虑式(2.48) , 式(2.51)中的 m 的取值应当是无限的。但是由于 是总波函数的一部分,在求 解波函数另一部分 时的要求使得 m 取有限值,即在求解式(2.49) 表达式时, 由于根号中的数值不能等于负值, 因此 m 最多只能等于某一个特定的与转动能量 有关的值 J。同时可以证明,m 代表双原子分子的角动量在 z 方向分量的大小。 式(2.49)的求解过程已经超出本简介的范围。以下给出有关的结果。波函 数 的具体表达式为
(2.42)
2
刚性转子没有势能只有动能,动能就是体系的总能量。在转动过程中 r 为常数, 因此有(dr/dt) = 0, HCl 的刚性转子有 mH 和 mCl 两个质点,总能量为
1 dθ d 1 dθ d 2 E (m H r12 m Cl r2 )[( ) 2 ( ) 2 sin 2 θ ] I[( ) 2 ( ) 2 sin 2 θ ](2.43) 2 dt dt 2 dt dt
和 m 有关。
为了使波函数满足有限性的条件,必须有= J(J+1) ,因此转动光谱的能量 必须是量子化的,即 h2 E rot 2 J (J 1) 8 I (J = 0,1,2,…) (2.54)
式(2.53)中的 I 为转动惯量。J 为转动量子数,取从零开始的正整数。式(2.54) 也可以改写为以波数(cm-1)为单位的能量形式
2、 红外光子与分子转动偶极矩的相互作用和光谱选律 分子转动的红外光谱来源于红外光子与分子转动偶极矩的相互作用。假定一 个具有永久偶极矩的双原子分子,例如 HCl 分子,在 xy 平面内转动(图 2.7),设 偶极矩 μ 与 x 轴的夹角为 θ ,偶极矩在 x 轴方向的分量为 μ cosθ x=μ 设 HCl 的转动频率为 ν r, 有 θ = 2π ν rt μ μ c o s (2 π ν x= rt) (2.60) (2.61) (2.59)
1
式 (2.45) 中 双原子分子的转动波函数, E 和 V 分别为分子转动的动能和势能。 I 为转动惯量。一般来说,波函数 是三个变量(r, θ , )的函数,由于是刚性转 子,径向变量 r 为常量,波函数 变成两个变量(θ , )的函数,取 r = 1, V = 0, 动能 E = Erot 为分子的总转动能量,式(2.44)可简化为
r2
质心
图2.7 HCl分子的刚性转子模型
分子转动的描述就以 HCl 分子为例。 设 HCl 分子中 H 原子和 Cl 原子为质量 分别为 mH 和 mCl 的两个质点,质点(原子核)之间的距离为 r0,H 原子和 Cl 原 子距离分子的质心的距离分别为 r1 和 r2, 有 r0 = r1 + r2。分子绕通过质心并且垂 直于质心连线(r0)的轴转动。在转动过程中原子核的距离(r0)不发生变化。 即所谓刚性转子。考虑到原子的质量实际上是集中在原子核上,核的半径是 10-12cm, 原子核之间距离的数量级为 10-8cm, 以上的近似是合理的。以后会看到 忽略核间距离的变化会带来一些微小的误差,但是这种误差很容易校正。 按照经典力学,质量为 m 的物体动能的大小为
2 (
i 2 e 2
按式(2.52)和(2.53) ,有
20 2 2 1 (2 0 )! (1 cos )2 d (cos 2 1) 2 2 2 0 2 (2 0 )! 2 2! d (cos ) 2 0
2,0 ( )
5 2! 1 d2 5 1 10 (cos 2 1) 2 (12 cos 2 4) (3 cos 2 1) 2 2 2! 8 d (cos 2 8 4 )
( )
2J 1 (J m )! m PJ (cos ) 2 (J m )!
m = 0, ±1, ±2, …, ±J
(2.52)
J = 0, 1, 2…,
m
PJ (cos ) 是 m 阶 J 次联属勒让德多项式,即
m
PJ
m
(1 cos ) (cos ) J 2 J!
分子的转动光谱
1、分子转动的描述和能量 分子的运动方式除了平动和振动外还有转动。 振动和转动都能够影响分子的 红外谱图。 分子的振动和转动时同时进行并且不可绝然分开, 但是为了处理方便, 首先对分子的转动进行处理, 得到分子的转动光谱, 然后进一步与振动联系起来, 得到分子的振动-转动光谱。 在第一章中提到 1912 年丹麦物理化学家 Niels Bjerrum 首先提出分子的能量 由平动、转动和振动组成,转动能量量子化的理论。转动光谱的存在最先在 HCl 气体分子红外光谱的研究中得到证实。 图 2.6 中的光谱 a 是在 1893 年由 Angstrom 和 Palmaer 得到的第一幅 HCl 气体分子红外谱的大致图,当时仪器的分辨率为 256cm-1, 在波长 3.4 微米处观察到一个吸收峰。1910 年 Eva von Bahr 证实了 Angstrom 的结果。 1913 年 Burmeister 用氟化钙 (CaF2) 作为棱镜, 分辨率为 64cm-1 的仪器观察到类似图 2.6 中 b 的谱图。图 b 在 3.40 和 3.55 微米处出现两个吸收 峰。使用分辨率为 16cm-1 和石英为棱镜的仪器,Eva von Bahr 在 1913 年得到图
(2.48)
1 d d m2 (sin ) ( 2 ) 0 sin d d sin
2 8 IE 2 h
(2.49)
(2.50)
式(2.48)的解为 ( e im 2 1 (2.51)
其中 m = 0, ±1, ±2, …, ±J 式(2.51)中的 J 是某一个特定整数。m 取整数是因为波函数为周期函数,有
2
2
d
J m J m
d (cos )
(cos 2 1) J
(2.53)
通常将波函数 写为 J , m 表示波函数 与常数 m 的绝对值和常数 J 有关, 同
4
时也将总波函数 (θ , 写为 , J , m ( )m ( 表示波函数 (θ , 与常数 J J, m (θ
3h 2 ,这时分子处于 5 重简并态。当分子的转动能级(J)一定时,m 可以取 2 4 I
2J+1 个值, 因此分子有 2J+1 个简并态。简并态存在是由分子转动时在空间取 向不同所造成的。如果设分子转动时其角动量的方向与 z 轴的夹角为 θ ,按式 (2.54)分子的转动能量与分子的空间取向 θ 没有关系,换句话来说,空间取向 的改变并不影响转动能级的大小。由于 m 只能取整数值,分子在空间的取向也 是量子化的。可以证明 cos m J(J 1) (2.58)
2 2 ( V) E 2m
(1.4)
为
2 2 2 Ψ 1 Ψ 1 Ψ 8π I (r ) 2 (sinθ ) 2 2 2 2 (E V)Ψ 0 (2.45) 2 r r θ θ r sin θ r r sinθ h
~ E BJ(J 1) rot hc h B 2 (cm-1) 8 I c 式(2.44)可改写为
(2.55) (2.56)
E rot BhcJ (J 1) 双原子分子转动能量的大小处在微波和远红外范围内。
(2.57)
例 2-3 求出 0 , , 。 1, 2和 J , m (θ 2, m ,并且求出相应的波函数 解:已知 J=2,m=0, ±1, ±2。按式(2.51) ,有 0 ( 1 2 1 , 1 ( 1 1 i 2 e i , e i , 2 ( e , 1 ( 2 2 2 1
