高中化学复习知识点:烷烃系统命名法
烷烃的系统命名法

2、下列有机物的命名错误的是:( B )
A 、2—甲基丁烷
B、 2—乙基戊烷
C、 2,3,5—三甲基—4—乙基庚烷
D、 2,2—二甲基戊烷
3、某学生写了六种有机物的名称: A) 1-甲基乙烷 B )4-甲基戊烷
C) 2,2-二甲基-2-乙基丙烷
D ) 2,3,4-三甲基丁烷
E) 2,2,3,3-四甲基戊烷
烷烃的命名 1、习惯命名法
(1)1-10个C原子的直链烷烃:
C5H12
C8H18
戊烷
辛烷
烷
称为 甲、乙、丙、丁、戊、己、庚、辛、壬、癸
(2)11个C原子以上的直链烷烃:如:C11H24 称为十一烷 (3)带支链的烷烃:用正、异、新表示 CH3
CH3CH2CH2CH2CH3
CH3CHCH2CH3
CH3
8
3,5—二甲基壬烷
CH2—CH3
9
[练习1]写出下列烷烃的名称
CH3 —CH—CH—CH3 CH3 CH3
2,3—二甲基丁烷
CH3 —CH2—CH—CH—CH2—CH3 CH3 CH3 CH3 —C—CH2—CH2—CH—CH3 CH3 C2H5
2,2,5—三甲基庚烷
C2H5
3—甲基— 4—乙基己烷
3)2-甲基-4-乙基庚烷
CH3–CH2–CH2–CH–CH2–CH–CH3
CH3
烷烃系统命名法原则:
① 长-----选最长碳链为主链。
② 多-----遇等长碳链时,支链最多为主链。 ③ 近-----离支链最近一端编号。
④ 简-----两取代基距离主链两端等距离时, 从简单取乙基庚烷
2、系统命名法
(1)选主链,称某烷(最长碳链) (2)编号码,定支链(支链最近原则) (3)取代基,写在前,注位置,连短线 (4)不同基,简在前,相同基,要合并 (5)同位置,简在前。 (6)支链序号的和最小 1 2 3 4 5
化学烷烃的系统命名法

化学烷烃的系统命名法化学烷烃的系统命名法可谓是一门有趣的艺术,咱们今天就来聊聊这其中的奥妙。
烷烃这个名字听起来是不是有点儿高大上?它就是指那些只含有碳和氢的饱和烃,换句话说,简单点儿就是一堆碳原子和氢原子团结在一起,形成一个个小家庭。
想象一下,这就像是一群小朋友手拉手,围成一个圈,欢快地玩耍。
嗯,烷烃就是这种团结的表现。
在命名的时候,我们得先从烷烃的碳链开始说起。
碳链的长度就是关键,越长越酷!一般来说,碳原子的数量会决定我们给它起什么名字。
比如,最简单的有一个碳的叫“甲烷”,这就像是个独自玩耍的小朋友;两个碳的叫“乙烷”,他们开始结伴了;三个碳的叫“丙烷”,四个碳的叫“丁烷”,听起来越来越热闹了,是吧?这几个名字你是不是觉得耳熟能详,没错,它们可是咱们日常生活中常见的气体,比如用来做饭的那种。
再来聊聊这些名字背后的规则。
为了让大家都能明白,咱们得用一个系统化的方法。
这个方法就像是给这些小朋友们贴上标签,先用一个前缀表示碳的个数,再加上“烷”字,哇!整个名字就出来了!所以,五个碳的叫“戊烷”,六个叫“己烷”,七个叫“庚烷”,这仿佛是在给这些小朋友们打上号码,让大家一目了然。
不过,别以为命名就这么简单。
烷烃之间有时候会发生一些变化,变得更加复杂。
就像小朋友们有时候会在游戏中换角色,形成支链烷烃。
想象一下,一个小朋友决定走开,去跟其他小朋友组队,形成一个小支队伍。
这个时候,命名规则就得升级。
支链的烷烃在命名时,需要在主链碳的基础上加上支链的名字,就像给小队起个绰号那样。
简单说,支链的存在让整个名字看起来更长更复杂,但其实就是在给我们讲一个有趣的故事。
再说说如何命名这些支链。
在命名时,我们通常先找出最长的碳链,然后再给支链一个编号。
这就像是在给每个小朋友排队,谁站在前面,谁就更重要。
就比如,如果你有一个三碳的主链,而旁边有一个支链在第二个碳上,那么我们就会叫它“2甲基丙烷”,这名字听起来是不是很厉害?其实也就是告诉你,有个小支队伍在那儿,玩得不亦乐乎。
高一化学必修二知识点烷烃

高一化学必修二知识点烷烃烷烃是有机化合物中最简单的一类,由碳元素和氢元素构成,分子结构简单、稳定,没有双键或芳香性。
烷烃中的碳原子通过共价键形成链状结构,而氢原子则与碳原子相连。
烷烃的分子式通常为CnH2n+2,其中n为烷烃的碳原子数目。
在高一化学必修二中,我们主要学习了烷烃的命名、性质和制备方法。
首先,烷烃的命名是我们学习的重点内容之一。
烷烃的命名按照碳原子数目和分子结构进行,通常采用系统命名法。
其中,碳原子数目为1的烷烃叫做甲烷,碳原子数目为2的烷烃叫做乙烷,碳原子数目为3的烷烃叫做丙烷,以此类推。
对于分子结构不规则的烷烃,可以使用取代基的命名方法。
例如,分子中有一个甲基(-CH3)取代了一个氢原子的乙烷就被称为甲基乙烷。
其次,烷烃的性质也是我们需要了解的内容。
烷烃是无色无味的气体、液体或固体,随着碳原子数目的增加,熔点和沸点逐渐升高。
烷烃具有较低的密度,不溶于水,但溶于非极性溶剂如石油醚、甲苯等。
由于烷烃分子结构稳定,烷烃通常比较难燃烧,需要提供足够的能量才能发生燃烧反应。
烷烃燃烧时产生水和二氧化碳,是常见的燃料。
此外,烷烃还可以与卤素发生取代反应,生成卤代烷烃。
最后,烷烃的制备方法是我们需要掌握的知识。
烷烃的制备可以通过以下几种方法:煤气制烷烃、石油制烷烃、天然气制烷烃和烯烃加氢制烷烃。
煤气制烷烃是指将煤燃烧生成的气体通过催化剂催化反应得到烷烃。
石油制烷烃是指通过裂解石油分子得到烷烃。
天然气制烷烃是指将天然气经过一系列处理得到烷烃。
烯烃加氢制烷烃是指将烯烃经过加氢反应得到烷烃。
这些制备方法都具有特定的应用场景和工业价值。
综上所述,高一化学必修二的烷烃知识点涵盖了烷烃的命名、性质和制备方法。
掌握烷烃的命名方法和规律,了解烷烃的性质和特点,以及熟悉烷烃的制备方法,对于学习有机化学和进一步深入研究有机化合物具有重要意义。
烷烃是有机化合物中最基础的一类,研究烷烃的性质和制备方法有助于拓宽我们的化学视野,为更深入的学习和探索打下坚实的基础。
高中化学第一章认识有机化合物重难点八烷烃及其命名人教版选修
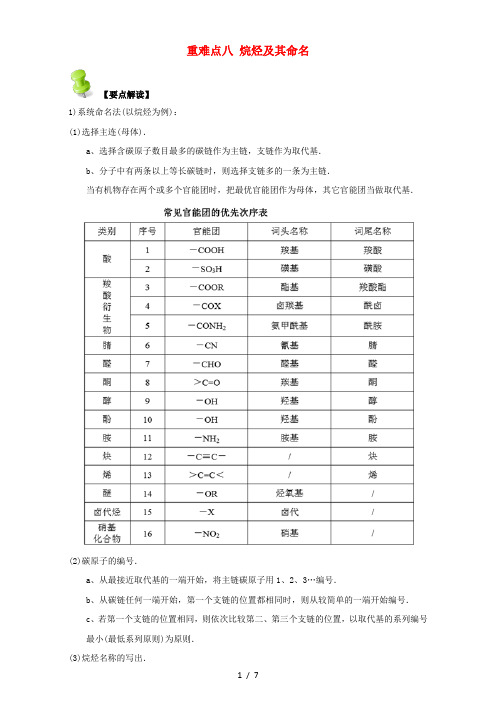
重难点八烷烃及其命名【要点解读】1)系统命名法(以烷烃为例):(1)选择主连(母体).a、选择含碳原子数目最多的碳链作为主链,支链作为取代基.b、分子中有两条以上等长碳链时,则选择支链多的一条为主链.当有机物存在两个或多个官能团时,把最优官能团作为母体,其它官能团当做取代基.(2)碳原子的编号.a、从最接近取代基的一端开始,将主链碳原子用1、2、3…编号.b、从碳链任何一端开始,第一个支链的位置都相同时,则从较简单的一端开始编号.c、若第一个支链的位置相同,则依次比较第二、第三个支链的位置,以取代基的系列编号最小(最低系列原则)为原则.(3)烷烃名称的写出.a、将支链(取代基)写在主链名称的前面.b、取代基按“次序规则”小的基团优先列出{烷基的大小次序:甲基<乙基<丙基<丁基<戊基<己基<异戊基<异丁基<异丙基}.c、相同基团合并写出,位置用2,3…标出,取代基数目用二,三…标出.d、表示位置的数字间要用逗号隔开,位次和取代基名称之间要用“半字线”隔开.例如:命名为:2,2-二甲基-4-乙基己烷步骤和原则的归纳:选主链,称某烷;编号位,定支链;取代基,写在前,标位置,连短线;不同基,简到繁,相同基,合并算.2)习惯命名法.习惯命名法又称为普通命名法,适用于结构简单的烷烃.命名方法如下:(1)用“正”表示直链的烷烃,根据碳原子数目命名为正某烷.碳原子数目为1~10个的用天干名称甲、乙、丙、丁、戊、己、庚、辛、壬、癸表示,碳原子数目在10个以上的,则用小写中文数字表示.“正”字常可省略.(2)用“异”表示末端具有(CH3)2CH-结构的烷烃.(3)用“新”表示末端具有(CH3)3C-结构的含5、6个碳原子的烷烃.【重难点指数】★★★【重难点考向一】烷烃的特点【例1】下列有关烷烃的叙述中,正确的是( )①在烷烃分子中,所有的化学键都是单键②烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去③分子通式为C n H2n+2的烃不一定是烷烃④所有的烷烃在光照条件下都能与氯气发生取代反应⑤光照条件下,乙烷通入溴水中,可使溴水褪色.A.①③⑤ B.②③ C.①④ D.①②④【答案】C【重难点点睛】考查烷烃的结构和性质,掌握物质的结构和性质是解题的关键,烷烃是饱和链烃,烷烃中只含有碳碳单键(甲烷除外),碳氢单键,不能使溴水或酸性高锰酸钾溶液褪色,易发生取代反应,分子通式为C n H2n+2,据此答题。
高中化学:烷烃及其命名知识点
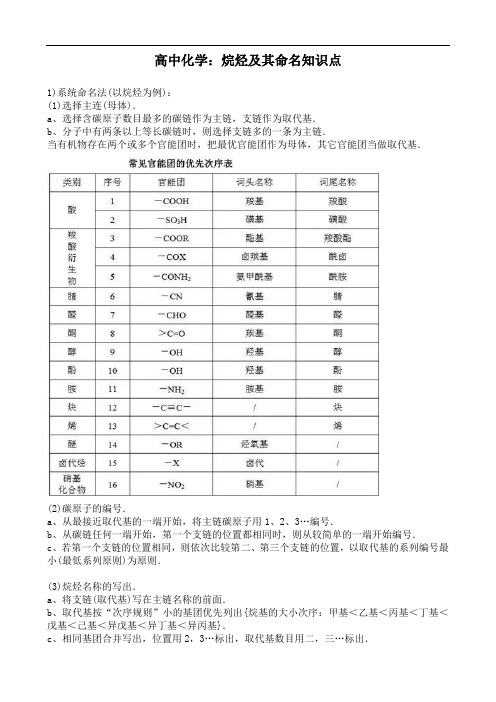
高中化学:烷烃及其命名知识点1)系统命名法(以烷烃为例):(1)选择主连(母体).a、选择含碳原子数目最多的碳链作为主链,支链作为取代基.b、分子中有两条以上等长碳链时,则选择支链多的一条为主链.当有机物存在两个或多个官能团时,把最优官能团作为母体,其它官能团当做取代基.(2)碳原子的编号.a、从最接近取代基的一端开始,将主链碳原子用1、2、3…编号.b、从碳链任何一端开始,第一个支链的位置都相同时,则从较简单的一端开始编号.c、若第一个支链的位置相同,则依次比较第二、第三个支链的位置,以取代基的系列编号最小(最低系列原则)为原则.(3)烷烃名称的写出.a、将支链(取代基)写在主链名称的前面.b、取代基按“次序规则”小的基团优先列出{烷基的大小次序:甲基<乙基<丙基<丁基<戊基<己基<异戊基<异丁基<异丙基}.c、相同基团合并写出,位置用2,3…标出,取代基数目用二,三…标出.d、表示位置的数字间要用逗号隔开,位次和取代基名称之间要用“半字线”隔开.例如:命名为:2,2-二甲基-4-乙基己烷步骤和原则的归纳:选主链,称某烷;编号位,定支链;取代基,写在前,标位置,连短线;不同基,简到繁,相同基,合并算.2) 习惯命名法.习惯命名法又称为普通命名法,适用于结构简单的烷烃.命名方法如下:(1)用“正”表示直链的烷烃,根据碳原子数目命名为正某烷.碳原子数目为1~10个的用天干名称甲、乙、丙、丁、戊、己、庚、辛、壬、癸表示,碳原子数目在10个以上的,则用小写中文数字表示.“正”字常可省略.(2)用“异”表示末端具有(CH3)2CH-结构的烷烃.(3)用“新”表示末端具有(CH3)3C-结构的含5、6个碳原子的烷烃.【重难点指数】★★★【重难点考向一】烷烃的特点【例1】下列有关烷烃的叙述中,正确的是( )①在烷烃分子中,所有的化学键都是单键②烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去③分子通式为CnH2n+2的烃不一定是烷烃④所有的烷烃在光照条件下都能与氯气发生取代反应⑤光照条件下,乙烷通入溴水中,可使溴水褪色.A.①③⑤B.②③C.①④D.①②④【答案】C【重难点点睛】考查烷烃的结构和性质,掌握物质的结构和性质是解题的关键,烷烃是饱和链烃,烷烃中只含有碳碳单键(甲烷除外),碳氢单键,不能使溴水或酸性高锰酸钾溶液褪色,易发生取代反应,分子通式为Cn H2n+2,据此答题。
烷烃系统命名法

正丁烷 异丁烷
又如:
怎 么 命 名?
(3)CH3—CH——CH2—CH3 ∣ CH3
CH3 ∣ (4) CH3—C—CH3 ∣ CH3
怎 么 命 名?
(3)CH3—CH——CH2—CH3 ∣ CH3
异戊烷
CH3 ∣ (4) CH3—C—CH3 ∣ CH3
新戊烷
下一步是什么?
3、如果含有几个不同的取代基时, 把小的取代基名称写在前面,大的写在 后面,如果含有几个相同的取代基时, 把它们合并起来,取代基的数目用一、 二、三┉等来表示,写在取代基的前面, 其位次必须逐个注明,位次的数字之间 要用“,”隔开。
例三
CH3 ∣ CH3 — CH2 — C—— CH — CH2— CH3 ∣∣
CH3
2. 2,2,3-三甲基丁 烷
CH2–CH3
H3C CH3
CH3–C–CH–CH3
CH3
3. 2-甲基-4-乙基庚烷
CH3
CH2
CH3–CH2–CH2–CH–CH2–CH–CH3
CH3
在选定主链以后,就要进行主链的位 次编号,也就是确定取代基的位次,主链 从一端向另一端编号,号数用1,2,3┉ 等表示,读成1位,2位,3位等。
确定主链位次的原则是:
在有几种编号的可能时,应当选定 使取代基的位次为最小。
对简单的烷烃从距离支链最近的一端 开始编号,位次和取代基名词之间要用 “—”半字线连接起来。
例一
CH3 — CH — CH2 — CH2— CH2 — CH3 ∣ CH3
母体是什么?
四、教学内容
CH3 — CH — CH2 — CH2— CH2 — CH3 ∣ CH3
烷烃的命名

烷烃的命名烷烃常用的命名法有普通命名法和系统命名法两种。
1. 普通命名法(习惯命名法)一般只适用于简单、含碳较少的烷烃,基本原则是:(1)根据分子中碳原子的数目称“某烷”。
碳原子数在十以内时,用天干字甲、乙、丙、丁、戊、已、庚、辛、壬、癸表示;碳原子数在十个以上时,则以十一、十二、十三、……表示。
例如:(2)为了区别异构体,直链烷烃称“正”某烷;在链端第二个碳原子上连有一个甲基且无其它支链的烷烃,称“异”某烷;在链端第二个碳原子上连有两个甲基且无其它支链的烷烃,称“新”某烷。
例如:戊烷的三种异构体,分别称为正戊烷、异戊烷、新戊烷。
2.烷基的命名烷烃分子中去掉一个氢原子形成的一价基团叫烷基。
烷基的名称由相应的烷烃命名。
常见烷基如下:CH3— CH3CH2— CH3CH2CH2—(CH3)2CH— CH3CH2CH2CH2—甲基乙基丙基异丙基丁基(CH3)3C—(CH3)2CHCH2—CH3CH2CH(CH3)—(CH3)3CCH2—(CH3)2CHCH2CH2—叔丁基异丁基仲丁基新戊基异戊基烷基通式为C n H2n+1,通常用R-表示,所以烷烃也可用RH表示。
对于结构比较复杂的烷烃,应使用系统命名法。
3.系统命名法直链烷烃的系统命名法与普通命名法相同,只是把“正”字取消。
对于结构复杂的烷烃,则按以下原则命名。
(1)在分子中选择一个最长的碳链作主链,根据主链所含的碳原子数叫做某烷。
主链以外的其它烷基看做主链上的取代基,同一分子中若有两条以上等长的主链时,则应选取分支最多的碳链作主链。
例如:正确的选择是2,不是1(2)由距离支链最近的一端开始,将主链上的碳原子用阿拉伯数字编号。
将支链的位置和名称写在母体名称的前面,阿拉伯数字和汉字之间必须加一半字线隔开。
例如:3-甲基丁烷(3)如果含有几个相同的取代基时,要把它们合并起来。
取代基的数目用二、三、四……表示,写在取代基的前面,其位次必须逐个注明,位次的数字之间要用逗号隔开。
烷烃系统命名法

1烷烃系统命名法一、普通命名法:1、通常把烷烃泛称“某烷”,某是指烷烃中碳原子的数目。
由一到十用 表示,自十一起用汉字数字表示。
例如:(1)CH 4 ,CH 3CH 3 ,CH 3CH 2CH 3 ; C 15H 32 。
2、为了区别异构体,用“正”、“异”和“新”来表示。
正丁烷: , 异丁烷正戊烷: 异戊烷 新戊烷二、系统命名法:在系统命名法中,对于支链烷烃,把它看作直链烷烃的烷基取代基衍生物。
烃分子失去一个氢原子所剩余的部分叫做烃基;烷烃分子失去一个氢原子所剩余的部分叫做烷基。
通式:C n H 2n+1 (n ≥1),通常用“R —”表示。
常见的烷基:甲基 乙基 正丙基 异丙基系统命名法法:烷烃的命名是各类烃命名的基础,命名时应注意以下几点:1)选主链称某烷。
Ⅰ.主链要长Ⅱ.支链要多2)编号位,定支链。
Ⅰ.支链要近 Ⅱ.简单在前 Ⅲ.和数要小3)取代基,写在前;编号位,短线连。
4)不同基,简到繁;相同基,合并算。
即“一长”是主链要长,“一近”是编号起点离支链最近,“一多”是支链数目要多,“一小”是支链位置号码之和要小。
例如: CH 3∣CH 3 —CH — CH — CH — CH — CH 2 — CH 3∣ ∣ ∣CH 3 CH 2 CH 3∣CH 2CH 3一、烷烃的命名随堂练习题1、 2、 3、4、 6、C ︱ C —C —C —C —C —C —C ︱ C —CC —C —C —C —C —C —C ︱ ︱ ︱ ︱ C C C C ︱ C C ︱ C —C —C —C —C —C ︱ C —C —C ︱C —CC ︱ C —C —C —C —C —C ︱ C —C —C ︱ C —C C —C —C —C —C —C —C ︱ ︱ ︱ ︱ C C C C27、 8、 9、10、 11、二、题型练习1、给出名称,写出结构简式⑴2,3-二甲基戊烷 ⑵2-甲基-3-乙基戊烷⑶2,2,6-三甲基-3-乙基庚烷 ⑷2,5,-二甲基-3-乙基-4-丙基辛烷2、给出名称,判读正误,并给出正确名称⑴2-乙基丙烷 ⑵2,4-二乙基戊烷 ⑶5-甲基-3-乙基戊烷⑷3-甲基-5-乙基己烷 ⑸2-甲基-5-丙基己烷 ⑹3,4-二甲基戊烷三、烷烃同分异构体练习1.下列化学式只表示一种纯净物的是( )A. C 3H 8B. C 4H 10C. C 3H 7ClD. C 2H 4Cl 22.从理论上分析,碳原子为10或小于10的烷烃分子中,其一卤代物不存在同分异构体的烷烃分子的种类共有A. 2B. 3C. 4D. 53.一氯代物的同分异构体有2种,二氯代物的同分异构体有4种的烷烃是( )A. 乙烷B. 丙烷C. 正丁烷D. 新戊烷4.某烃的一氯代物只有两种,二氯代物有四种,则该烃是( )A .甲烷 B. 异戊烷 C. 2-甲基丙烷 D. 丙烷5. 2,2,6,6-四甲基庚烷的一氯代物的同分异构体共有( )A. 2种B. 3种C. 4种D. 5种6.相对分子质量为100的烷烃,主链上有5个碳原子的同分异构体有( )A. 3种B. 4种C. 5种D. 6种7.乙烷在光照条件下与氯气混合,最多可能得到几种物质( )A. 7种B.8种C. 9种D. 10种8.分子式为C 7H 16,主链上有5个碳原子的有机物共有( )A. 3种B. 2种C. 5种D. 7种9.某烃或某烃的一种同分异构体只能生成一种一氯代物,下列组合包括了所有这些烃的分子式的组合()C —C —C —C —C —C ︱ ︱ ︱ ︱ C C C C ︱ C —C —CC ︱ C —C —C —C —C —C ︱ ︱ ︱ C C C —C —C C C ︱ ︱C —C —C —C —C —C︱ ︱ ︱C 2 C CCH 3—CH 2—CH —CH 2—CH 2—CH 3 ︱CH 3—CH —CH —CH 2—CH 3︱CH 2— CH 3CH 3 CH 3 CH 3 ︱ ︱ ︱ CH 3—C—CH—CH —C —CH 3 ︱︱︱CH 3 CH 3 CH 3①CH4②C2H6③C3H8④C4H10⑤C5H12⑥C8H18A.①②⑤B. ①②C. ⑤⑥D. ①②⑤⑥10.某烷烃对相同条件下的氢气的相对密度为43,这种烷烃的同分异构体是()A. 8种B. 6种C. 5种D. 4种11.相对分子量为72的烷烃,其同分异构体有()A. 2种B. 3种C. 4种D. 5种12.相对分子质量为86的且只有一个支链的烷烃有()A. 2种B. 3种C. 3种D. 4种13.进行一氯取代后,只生成三种沸点不同的有机物的烷烃是()A.(CH3)2CHCH2CH2CH3B. (CH3CH2)2CHCH3C. (CH3)2CHCH(CH3)2D.(CH3)3CCH2CH314.某烃的一种同分异构体只能生成一种一氯代物,此种烃的分子式可以是()A. C6H14B. C3H8C. C4H10D. C5H1215.已知正丁烷的二氯代物有六种同分异构体,则它的八氯代物的同分异构体的种类是( )A. 6种B. 8种C. 10种 D .12种16.已知异丁烷的三氯代物有5种,则它的七氯代物的同分异构体有()A. 3种B. 4种C. 5种D. 6种17.某烷烃的相对分子质量为114,则该烷烃的同分异构体中,主链由5个碳原子的同分异构体有A. 7种B. 4种C. 5种D. 6种18.某烷烃的相对分子质量为114,则该烷烃的同分异构体中,主链有6个碳原子的同分异构体有 A. 4种B. 5种 C. 6种 D. 7种19.下列烷烃中,一氯代物的同分异构体有2种,二氯代物的同分异构体有3种的是()A.甲烷B.乙烷C. 异丁烷D. 丙烷20.分子式为C7H16的烷烃的同分异构体有多种,其中分子结构中含有4个甲基的同分异构体有()A. 3种B. 4种 C . 5种 D. 6种21.分子式为C8H18的烷烃的同分异构体有多种,其中分子结构中含有4个甲基的同分异构体有( )A. 5种B. 6种C. 7种D. 8种22、下列烷烃的一氯代物有二种结构,二氯代物有三种结构的是()A.B. C.D.23.某烷烃一个分子里含9个碳原子,其一氯取代物只有两种,这种烷烃的名称是( )A. 正壬烷B. 2,6—二甲基己烷C. 2,2,4,4—四甲基戊烷D. 2,3,4—三甲基己烷24.分子式为C5H12的一种烃,它的一氯取代物若只有一种结构,此烃的结构简式为___________, 此烃的系统名称为______________;若它的一氯取代物有三种结构,此烃的结构简式为____________________;系统名称是若它的一氯取代物有四种结构,此烃的结构简式为________________.系统名称是25.C5H11Cl分子中有2个-CH3,2个-CH2—,1 个,1个-Cl,他的可能的结构只有四种,请写出结构简式:3。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ⅰ.(1) 为烷烃,最长碳链含有8个C,主链为辛烷,编号从距离甲基最近的一端开始,在2号C和6号C上各含有2个、1个甲基,在4号C含有1个乙基,该有机物名称为:2,2,6-三甲基-4-乙基辛烷,故答案为:2,2,6-三甲基-4-乙基辛烷;
(2)某烃的分子式为 ,核磁共振氢谱图中显示4个峰,为异戊烷,分子中含四种氢原子,生成的一氯代物四种,该烃结构简式为:CH3CH(CH3)CH2CH3,故答案为:4;CH3CH(CH3)CH2CH3;
11.1,3-二溴丙烷Br-CH2-CH2-CH2-Br+2NaOH HO-CH2-CH2-CH2-OH+2NaBr氧化反应C2H5OH 碳碳双键、酯基 +C2H5OOC-CH2-COOC2H5 +H2O
【解析】
【分析】
E属于烃,E与水反应生成 ,则E为 ;F发生催化氧化生成G为 ,由H的结构可知D为二元酯,C到D为酯化反应,可知C为二元酸、X为C2H5OH,故A为BrCH2CH2CH2Br、B为HOCH2CH2CH2OH、C为HOOCCH2COOH,则D为C2H5OOCCH2COOC2H5。
D.2,2,3,3-四甲基丁烷,分子中含有8个碳原子,D不合题意;
故选B。
8.C
【解析】该有机物可写成以下形式:
系统命名名称为3-甲基-5-乙基庚烷,分子式为C10H22,该有机物属于饱和链烃;A、B 均正确;C项中的有机物分子式也为C10H22,但是结构不一样,二者应为同分异构体而不是同系物,C错误;该有机物核磁共振氢谱有8种峰,所以该有机物的一氯取代产物共有8种,D正确;正确选项C。
C.4-甲基-2-乙基己烷D.3,5-二甲基庚烷
10.下列有机物的系统命名正确的是
A. : 3—甲基—2—乙基戊烷B. :3—甲基—2—丁烯
C. : 2—甲基丁酸D. :1,5—二甲苯
二、综合题
11.有机物K是某药物的中间体,合成路线如图所示:
已知:i.R-CN R-CH2-NH2
ii.R1-NH2+R2COOC2H5 +C2H5OH
4.D
【解析】
【分析】
【详解】
,选取含有碳原子数最多的碳链为主链,该有机物中最长的碳链含有7个C,主链为庚烷,含有7个C的碳链有两条,选取含有支链最多的碳链为主链,编号从距离取代基最近的一端开始,从左边开始,满足取代基编号之和最小,在3、4号C上各有一个甲基,在4号C上有一个乙基,该有机物的命名为:3,4﹣二甲基﹣4﹣乙基庚烷,
9.D
【解析】
【详解】
根据烷烃命名原则:长,最长碳链为主链,故乙基不能在2号碳位,则
A.2,4-二乙基戊烷,命名中出现2号碳位连接乙基,正确的名称应该是3.5-二甲基庚烷,故A命名错误;
B.3-甲基-5-乙基己烷,由名称可知主链碳有6个碳原子,故5号碳位不能存在乙基,正确的名称应该是3.5-二甲基庚烷,故B错误;
7.B
【解析】
【分析】
互为同分异构体的烷烃,分子式相同,碳原子数相同,但结构不同。 分子中含有7个碳原子、1个甲基取代基。
【详解】
A.2,3-二甲基丁烷,分子中含有6个碳原子,A不合题意;
B.2,2,3-三甲基丁烷,分子中含有7个碳原子,3个甲基取代基,B符合题意;
C.2-甲基丁烷,分子中含有5个碳原子,C不合题意;
答案选D。
【点睛】
本题考查了考查有机物的命名,该题注重了基础性试题的考查,侧重对学生基础知识的检验和训练,该题的关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可。
5.A
【解析】
【分析】
【详解】
A. 该有机物中苯环上含有1个乙基,其命名为乙苯,故A正确;
B. 烯烃的编号应该从距离碳碳双键最近的一端开始,碳碳双键在1号C,该有机物正确命名为:3-甲基-1-丁烯,故B错误;
C. 烷烃的命名中出现2-乙基,说明选取的主链不是最长碳链,该有机物正确命名为:2-甲基丁烷,故C错误;
D. 选取含有羟基的最长碳链为主链,该有机物最长碳链含有3个C,主链为丙醇,羟基在2号C,该有机物正确命名为:2-丙醇,故D错误;
故答案为A。
6.C
【解析】
【分析】
根据有机物的系统命名法分析。
【详解】
与麻黄素互为同分异构体的是_________(填字母,下同),互为同系物的是___________(填字母)。
Ⅱ.有机物C常用于食品行业。已知 在足量 中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重 和 ,经检验剩余气体为 。
(1)C分子的质谱图如图所示,从图中可知其相对分子质量是________,则C的分子式是_______。
3.某烷烃的结构如图,下列命名正确的是
A.2,4-二甲基-3-乙基己烷
B.3-异丙基-4-甲基已烷
C.2-甲基-3,4-二乙基戊烷
D.3-甲基-4-异丙基已烷
4.对于烃 的命名正确的是()
A.4—甲基—4,5—二乙基己烷B.3—甲基—2,3—二乙基己烷
C.4,5—二甲基—4—乙基庚烷D.3,4—二甲基—4—乙基庚烷
C.4-甲基-2-乙基己烷,2号碳位连接乙基,正确的名称应该是3.5-二甲基庚烷,故C选项命名错误;
D.3,5-二甲基庚烷,符合命名规则,结构简式为 ;
故正确答案为D。
10.C
【解析】A.根据系统命名, 为3,4—二甲基己烷,故A错误;B.根据系统命名, 为2—甲基—2—丁烯,故B错误;C.根据系统命名, 为2—甲基丁酸,故C正确;D.根据系统命名, 为1,3—二甲苯,故D错误;答案为C。
(3)含有官能团的有机物命名时,要选含(或带)官能团的最长碳链作为主链,官能团的位次最小。
3.A
【解析】ቤተ መጻሕፍቲ ባይዱ
试题分析:A、根据烷烃的系统命名法,选择最长碳链为主链,当主链有多条时,以取代基简单的为主链;称某烷;编号位,定支链,所以该烃的名称是2,4 -二甲基-3-乙基己烷,答案选A。
考点:考查烷烃的命名
C.2-甲基丁烷D.2,2,3,3-四甲基丁烷
8.某有机物的结构简式为 。下说法中不正确的是( )
A.该有机物属于饱和链烃B.该有机物的名称是3-甲基-5-乙基庚烷
C.该有机物与2,5-二甲基-3-乙基己烷互为同系物D.该有机物的一氯取代产物共有8种
9.某烷烃系统命名法正确的是( )
A.2,4-二乙基戊烷B.3-甲基-5-乙基己烷
回答下列问题
(1)A的名称是_______。
(2)反应①的化学方程式是_____。
(3)反应②的类型是_____。
(4)反应③中的试剂X是_____。
(5)E属于烃,其结构简式是_____。
(6)H中所含的官能团是_____。
(7)反应⑥的化学方程式是_____。
(8)H经三步反应合成K:H I→J→K,写出中间产物I和J的结构简式_____。
12.Ⅰ.回答下列问题:
(1)烃A的结构简式为 ,用系统命名法命名烃A:____________。
(2)某烃的分子式为 ,核磁共振氢谱图中显示4个峰,则该烃的一氯代物有_______种,该烃的结构简式为____________。
(3)麻黄素又称黄碱,是我国特定中药材麻黄中所含有的一种生物碱。经科学家研究发现其结构为: ,下列各物质:A. B. C. D. E.
A.主链的选择错误,应该选择最长的碳链为主链,主链是6个碳,正确的名称为3,4-二甲基己烷,A项错误;
B.主链编号起点错误,应该从离双键最近的一端开始编号,正确的名称为2,3-二甲基-1-丁烯,B项错误;
C.符合系统命名法原则,结构简式和名称相符,C项正确;
D.不符合侧链位次之和最小的原则,正确的名称为1-甲基-2-乙基苯,D项错误;答案选C。
5.下列有机物的命名正确的是
A. 乙苯B. 2-甲基-3-丁烯
C. 2-乙基丙烷D.1-甲基乙醇
6.下列有机物的结构简式和名称相符的是
A. 3—甲基—2—乙基戊烷
B. 2,3—二甲基—3—丁烯
C. 4,4—二甲基—2—戊炔
D. 1—甲基—5—乙基苯
7.下列烷烃中,与 互为同分异构体的是
A.2,3-二甲基丁烷B.2,2,3-三甲基丁烷
(2)核磁共振氢谱图中显示4个峰,说明结构存在四种氢原子,据此分析解答;
(3)根据同分异构体和同系物的概念分析判断;
Ⅱ.根据最大质荷比可确定相对分子质量为90,根据生成的水和二氧化碳的计算含有的H和C的物质的量及质量,判断有机物中含有O元素的质量,再根据n(C)∶n(H)∶n(O)确定C的实验式和化学式,据此分析解答。
(3)分子式相同而结构不同的有机物互称同分异构体,题中D、E与麻黄素分子式相同,而结构不同,互为同分异构体,其中C与麻黄素的结构相似,分子组成上相差1个CH2原子团,互为同系物,故答案为:DE;C;
Ⅱ.(1)由图中最大质荷比可确定相对分子质量为90,5.4g水的物质的量为 =0.3mol,n(H)=0.6 mol,13.2g二氧化碳的物质的量为 =0.3mol,n(C)=n(CO2)=0.3 mol,此有机物9.0g含O元素质量为9.0g-0.6g-0.3×12 g=4.8 g,n(O)= =0.3 mol,故n(C)∶n(H)∶n(O)=0.3mol∶0.6mol∶0.3mol=1∶2∶1,因此实验式为CH2O,设分子式为(CH2O)n,A的相对分子质量为90,可得30n=90,解得:n=3,故有机物A为C3H6O3,故答案为:90;C3H6O3;
(7)根据D的结构简式和G的结构简式可知反应⑥的化学方程式是: ;
(8)对比H与K的结构,H与HCN发生加成反应生成I为 ,然后还原生成J为 ,最后发生取代反应脱去1分子C2H5OH生成K。
12.2,2,6-三甲基-4-乙基辛烷4 DEC90 羧基或 100
