链霉菌操作手册
生物链霉菌的生产及其在农业上的应用

生物链霉菌的生产及其在农业上的应用链霉菌是一种重要的土壤微生物,对于农业生产起到了重要的作用。
作为一种产生土壤杀菌物质的细菌,它可以在农业生产中发挥重要的生态作用。
生物链霉菌的生产及其在农业上的应用是农业发展的一个重要方向,对于推动农业生产方式的转变和提升农业生产效率有着重要意义。
一、链霉菌的生产1、链霉菌的分离与鉴定生物链霉菌的生产需要首先从土壤中将其分离与培养,经过鉴定后,才能进行后续的操作。
在分离链霉菌时需要注意避免细菌的污染,同时要选择培养基、温度、pH值等等因素。
2、链霉菌的培养与发酵种植链霉菌需要进行发酵操作,选定培养基成分和浓度后,进行发酵操作,通常需要进行氧气调节、加入生长因子等等,使得链霉菌的生长繁殖达到最佳。
3、链霉菌代谢产物的提取和纯化链霉菌的代谢物质是其重要的生物活性物质。
在产物提取时需要注意避免对链霉菌造成不良影响,同时要使用特定的提取剂来进行萃取,并进行纯化处理。
二、链霉菌在农业上的应用1、农药链霉菌能够产生一系列的生物杀菌物质,这些杀菌物质对土壤中的病原菌具有很强的杀灭作用,可以用于制备农药。
与传统化学农药相比,使用链霉菌制备的农药具有无毒、可降解、对人体和环境影响小等优点,可以在农业生产中起到安全、高效的杀菌作用。
2、生物肥料链霉菌还可以促进植物的生长,可以应用于生物肥料的制备中。
链霉菌发酵液中含有多种微量元素、氨基酸等生长因子,可以在植物生长时促进植物生长,提高作物的产量和品质。
3、生物调节剂链霉菌中还产生一些激素类物质,这些激素可以促进植物在晚期生长时的代谢和发育,可以应用于生物调节剂的制备中。
4、减少化肥使用量链霉菌可以固定空气中的氮,使得土壤中氮的含量增多,从而减少了对化肥的依赖。
同时在使用化肥时,也可以考虑使用链霉菌作为化肥的引子。
总之,生物链霉菌是一种重要的土壤微生物,对于农业生产起到了重要的作用。
链霉菌可以应用于农药制备、生物肥料、生物调节剂等多个领域,可以推动农业生产方式的转变,提升农业生产效率。
链霉菌亚甲蓝染色法实验报告

链霉菌亚甲蓝染色法实验报告实验:链霉菌亚甲蓝染色法实验一、实验目的:1.了解链霉菌的形态特征;2.掌握链霉菌亚甲蓝染色法的操作步骤;3.观察链霉菌在显微镜下的染色效果。
二、实验原理:链霉菌是一种常见的革兰氏阳性细菌,其形态特征为在培养基上形成长而曲折的链状菌丝。
链霉菌亚甲蓝染色法是一种常用的染色方法,用于观察链霉菌的形态结构。
该方法利用亚甲蓝染料,将链霉菌染色后,在显微镜下观察其形态特征。
三、实验材料与方法:1.实验材料:(1)链霉菌培养基;(2)链霉菌培养物;(3)亚甲蓝溶液(0.5%);(4)显微镜;(5)玻璃片。
2.实验步骤:(1)取链霉菌培养物,加入适量的生理盐水进行稀释,制备菌液。
(2)取一片玻璃片,用酒精消毒并晾干。
(3)滴取一滴链霉菌菌液于玻璃片上,用火焰消毒的针头将滴液均匀涂抹于玻璃片上。
(4)将涂有链霉菌菌液的玻璃片,放置在亚甲蓝溶液中浸泡5分钟。
(5)取出玻璃片,用水冲洗干净。
(6)将玻璃片放在显微镜下,使用100倍的镜头观察链霉菌的形态结构。
四、实验结果:在显微镜下观察到的链霉菌呈现为一条条长而曲折的链状菌丝,菌丝之间相互交织,形成复杂的网络状结构。
链霉菌染色后呈现为蓝色,菌丝清晰可见。
五、实验讨论:链霉菌亚甲蓝染色法是一种简单而有效的染色方法。
亚甲蓝是一种碱性染料,具有较强的亲和力,能够与链霉菌细胞壁上的负电荷结合,使菌丝呈现出蓝色。
这种染色方法可以清晰地显示链霉菌的形态结构,有助于对其生长特征和菌株的鉴定。
在本实验中,我们观察到链霉菌在显微镜下的形态结构,即长而曲折的链状菌丝。
链霉菌的菌丝之间交织在一起,形成了复杂的网络状结构。
这种形态特征是链霉菌的重要鉴定特征之一,可以用于区分链霉菌和其他细菌。
六、实验总结:通过本次实验,我们了解了链霉菌的形态特征,并掌握了链霉菌亚甲蓝染色法的操作步骤。
链霉菌亚甲蓝染色法是一种常用的染色方法,能够清晰地显示链霉菌的形态结构。
通过染色后的链霉菌菌丝呈现出蓝色,使其在显微镜下更容易观察和鉴定。
实验室常用生化试剂配方

实验室常用生化试剂配方1.常用抗生素配制以及使用说明(参考链霉菌室操作手册2019版)抗生素英文名称及缩写抗性基因贮藏液浓度(mg/ml) 10025(无水乙醇配) 50 25 50 50 25(DMSO配) 100 50 3525(0.15M NaOH配) 50(DMSO配)50 50MM使用终浓度(μg/ml)链霉菌2CMYEME大肠杆菌LA或LB氨苄青霉素氯霉素潮霉素卡那霉素壮观霉素链霉素硫链丝菌素红霉素阿泊拉霉素紫霉素萘锭酮酸 TMPAmpicillin, Amp bla Chloramphenicol, Cml Hygromycin, Hyg Kanamycin, Km Spectinomycin, Spc Streptomycin, Str Thiostrepton, Thio Erythomycin, Ery Apramycin, Am Viomycin,Vio Nalidixic acid Trimethoprimcat hyg aac/aph aadA str tsr ermE aac(3)IV vph-* 10 10 2 5 10 5 100 10-- 25 25 20 25 10 - 50------ 2.5 - 550-100 25 - 25 50 25 25 20 10-30注意事项:(1) –表示无记录或不能使用,贮存液除特别说明外均用无菌水配制,配制过程请确保抗生素粉末充分溶解混匀后再分装;(2)Km 和Am有交叉抗性,同时具有这两种抗性基因时应适当提高抗生素的量,并设置阴性对照;(3)Hyg、Vio易见光分解,配制好后应用锡箔纸包好,使用过程中建议避光操作。
有些抗生素需要在低盐的环境(如DNA培养基)下筛选效率较高,如Hyg, Km, Vio(4)用无菌水配制的抗生素需在超净工作台内用0.22 μm一次性过滤器过滤除菌并分装;氯霉素、TMP、硫链丝菌素可以在超净工作台外配制分装,无需过滤除菌,但需确保配制贮存液所用溶剂(无水乙醇、DMSO)未遭受污染,建议配制氯霉素时使用新的无水乙醇,不要使用抽提质粒或总DNA时用的无水乙醇,以防止污染;DMSO,即二甲亚砜,易挥发,有剧毒;(5)长期不用的抗生素请置于-20℃保存,抗生素粉末按照使用说明一般置于4℃保存,经常使用时可以暂置于4℃保存;(6)抗生素的实际使用浓度请结合实验经验进行适当调整;(7)配制抗生素时应尽量一次性称取抗生素粉末,配制过程中建议穿工作服,戴一次性橡胶手套及口罩,及时清理称量配制抗生素时使用的台面及器具,以避免抗生素及溶剂对自身的损伤及对工作环境的污染。
链霉菌总DNA提取
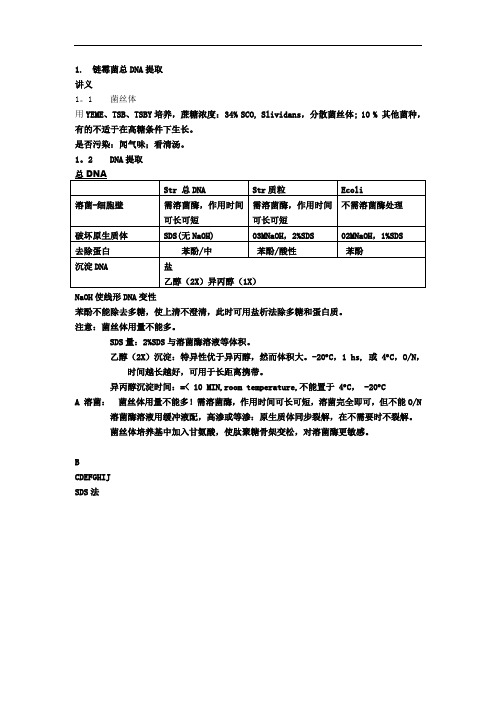
1. 链霉菌总DNA提取讲义1。
1 菌丝体用YEME、TSB、TSBY培养,蔗糖浓度:34% SCO, Slividans,分散菌丝体; 10 % 其他菌种,有的不适于在高糖条件下生长。
是否污染:闻气味;看清汤。
1。
2 DNA提取NaOH使线形DNA变性苯酚不能除去多糖,使上清不澄清,此时可用盐析法除多糖和蛋白质。
注意:菌丝体用量不能多。
SDS量:2%SDS与溶菌酶溶液等体积。
乙醇(2X)沉淀:特异性优于异丙醇,然而体积大。
-20︒C,1 hs, 或 4︒C,O/N,时间越长越好,可用于长距离携带。
异丙醇沉淀时间:=< 10 MIN,room temperature,不能置于 4︒C, -20︒CA 溶菌:菌丝体用量不能多!需溶菌酶,作用时间可长可短,溶菌完全即可,但不能O/N溶菌酶溶液用缓冲液配,高渗或等渗:原生质体同步裂解,在不需要时不裂解。
菌丝体培养基中加入甘氨酸,使肽聚糖骨架变松,对溶菌酶更敏感。
BCDEFGHIJSDS法2.9.1 链霉菌总DNA少量快速提取收集链霉菌菌丝体并用10.3%蔗糖洗涤1次,将100ul菌丝体在eppendorf离心管中用TE洗涤1次, 于菌体沉淀块中加入500ul溶菌酶溶液, 用自动移液器吸管头快速、强烈抽吸以悬浮和裂解细胞直到溶液变粘稠。
加入50ul 20% SDS,(或100ul 10% SDS)混匀, 37℃保温10分钟后, 加入0.5倍体积的中性苯酚/氯仿, 混匀后离心, 向上清液加入0.1倍体积NaAC(pH4.8)和等体积异丙醇, 颠倒混匀, 将白色絮状沉淀挑出到70%乙醇中洗涤, 离心, DNA沉淀块再分别用70%乙醇和无水乙醇洗涤后溶解在适量TE缓冲液中。
2.9.2 大片段链霉菌总DNA提取(用于构建基因文库)适量的菌丝体(50ml液体培养物), 溶于10ml含2mg/ml溶菌酶的LRTE溶液(2mg/ml溶菌酶, 25mM Tris-HCl pH8.0), 100mM EDTA (pH8.07, RNase 50ug/ml)中, 37℃溶菌至溶液清澈透亮。
链霉素诱变育种的方案

• 2.将菌悬液放入巳灭菌的装有玻璃珠的三角瓶内用手 摇动,以打散菌体。将菌液通过滤纸过滤,单细胞滤液 装入试管内,使细胞数约为108个/ml,作为待处理菌悬 液。
• 3.取2~4ml制备的菌液加到直径7cm培养皿内,放入
一无菌磁力搅拌子,然后置磁力搅拌器上、15W
紫外线下30cm处。在正式照射前,应先开紫外
• 选择物理诱变剂中非电离辐射即紫外线。
•
因为紫外线是一种使用时间长、效果好、
设备简单、值得推广的诱变剂,大约有80%的高产抗
生素产生菌都曾经用过紫外线这一诱变方法。
• 紫外线的诱变育种
•
紫外线的作用机制是使两个嘧啶之间聚合,形成
嘧啶二聚体,碱基不能正常配对。
紫外线诱变一般采用15W紫外线杀菌灯,
波长为253.7nm,灯与处理物的距离为
15~30cm,照射时间依菌种而异,一般
为几秒至几十分钟。
精选课件
9
最适诱变剂量的选择
• 在诱变育种中有两条重要的实验曲线:
•
①剂量-存活率曲线
•
②剂量-诱变率曲线
•
通过比较以上两曲线,可找到剂量-存活率-诱变
率三者的最佳结合点。在实际工作中,突变率往往随剂
量的增加而提高,但到达一定程度后,再提高剂量反而
链霉菌诱变育种方案
11级生物技术班 第二组
精选课件
1
元芳!此 事你怎么 看?
精选课件
2
看目录
一、诱发突变 (一)、出发菌株选择 (二)、诱变剂及诱变剂量的
选择 (三)、影响诱变效果的因素 (四)、平板分离
二、突变株的筛选 (一)、初筛 (二)、复筛 (三)、产物活性测定
农用细黄链霉菌使用说明书

农用细黄链霉菌使用说明书
农用细黄链霉菌(Bacillus subtilis)使用说明书
1. 产品介绍
农用细黄链霉菌是一种对多种病原菌有抑制作用的微生物制剂,广泛应用于农业生产中的病害防治。
2. 使用方法
2.1 喷雾
将适量的农用细黄链霉菌制剂溶解于适量的水中,按照农作物叶面的湿度和药液浓度的要求进行喷雾处理。
2.2 种植基质处理
在种植基质中添加适量的农用细黄链霉菌制剂,并与基质充分混合,确保农作物根系与制剂接触。
3. 使用剂量
根据不同的作物病害发生程度和作物生长阶段,以及制剂浓度可能的误差等因素进行适量的剂量调整。
4. 注意事项
4.1 使用前请先进行小范围试验,确保农用细黄链霉菌对目标
病原菌有有效的抑制作用,并不对作物产生明显的伤害。
4.2 适量使用,避免过量喷洒或过度浓度的种植基质处理,以
免对作物产生不良影响。
4.3 储存于阴凉、干燥的地方,避免阳光直射和高温环境,以
免降低制剂活性。
4.4 使用过程中请佩戴防护手套、口罩等个人防护装备,避免
直接接触制剂。
5. 包装和保存
农用细黄链霉菌制剂按照标准包装,密封保存,避免潮湿和温度过高的环境。
请在保质期内使用,并在开封后尽快使用完毕。
6. 效果评估
为了评估产品的效果,请在施用后一定时间内观察农作物的生长和病害的发展情况,根据实际情况进行调整并进行效果评估。
7. 技术咨询
如需了解更多关于农用细黄链霉菌的技术信息和应用建议,请咨询相关专业人士或联系产品供应商。
链霉菌基因组DNA提取
链霉菌基因组DNA提取
1.刮取孢子接种于TSB中,培养菌体4-5d,吸取2ml的菌液于
2.0ml离心管中,3000rpm
离心15min收集菌体;
2.加入ddH2O洗涤菌体两次;
3.用500μl溶菌酶溶液(加RNaseA)重新悬浮菌丝体,于37℃温育约50min至细胞成为
半透明状(中途取出涡旋混匀几次);
4.加入500μl 2%SDS,混合振荡约lmin直到溶液的粘度显著下降,打开盖子,于55℃温育
30min;
5.冷却至室温,然后加入1/10体积3M醋酸钠和200μl氯仿/异戊醇(24:1),涡旋振荡约
1min后,4℃12000rpm离心5min;
6.小心地吸取上清液,弃去白色中间层。
(不要吸到中间白色物质),用氯仿/异戊醇(24:1)
重复二次抽提直至看不见(或非常少)中间层为止;
7.取上清,加入预冷的2倍体积的无水乙醇,反复颠倒,-20℃放置30min.置絮状DNA沉
淀出现;
8.离心倾去上清液,DNA沉淀块分别经70%乙醇洗涤,用枪头吸去液体,晾干数分钟;
9.后溶解在适量的ddH2O中,用分光光度计测浓度及纯度后,-20℃保存。
肺炎链球菌分型技术-多位点序列分型 MLST Typing
多位点序列分型(Multi Locus Sequence Typing)试验开始前,请准备:冰浴。
扩增体系配制及样品添加过程需在冰浴上操作。
将冷冻保存的试剂取出,室温放置融化后冰浴上备用;Taq酶直接放置在冰浴上。
1.5%琼脂糖凝胶(含DNA染料4µl/100ml)。
试验步骤:1.待测样品的DNA制备;冷冻保存的DNA室温下自然融化后,冰浴放置备用。
2.扩增体系配置(50µl/reaction):成分名称体积(µl)10Xbuffer(含MgCl2) 5dNTP(10mM) 1Primer F(20µM) 0.5Primer R(20µM) 0.5Taq(5U/µl) 1DNA 5H2O 373.扩增条件:步骤温度时间预变性 94℃ 3min循环-1 94℃ 30s循环-2 56℃ 30s循环-3 72℃ 30s30个循环延伸 72℃ 5min保存4℃4.扩增产物验证:将扩增产物于1.5%琼脂糖凝胶(含DNA染料4µl/100ml),100V,电泳40min;片段长度600-800bp。
5.产物纯化后,连同相应的测序引物送交测序公司测序(每个样品配5µl上、下游测序引物,引物浓度10µM)。
6.得到序列信息后,递交到相关网站进行序列比对,确定ST,/sql/singlelocus.asp;将分型结果及时添加至Streptococcus pneumoniae isolates data bank。
Reference*/misc/info.asp。
链霉菌RNA提取
5.5.10 转录谱的测定5.5.10.1 链霉菌总RNA的提取①液体培养基中生长的菌体经离心收集并用吸水纸洗干(固体培养时,应在培养基表面铺上玻璃纸,刮取生长在玻璃纸表面的菌体),迅速放入用液氮预冷的研钵中,研磨至粉末状;②取50-100 mg菌体放入预冷的无RNase污染的离心管中(15磅灭菌1小时),迅速加入1 ml Trizol试剂,用微量移液器吹匀并在振荡器上振荡2分钟,室温放置5分钟后12,000 g,4°C离心10 min;③将上清转移至一新的离心管中,加入200 μl氯仿,充分混匀,室温放3分钟后于12,000 g,4°C离心15 min;④将上清转移至一新的离心管中,再加入200 μl氯仿抽提一次,12,000 g,4°C离心10 min;⑤将上清转移至一新的离心管中,加入500 μl异丙醇,-20°C或-70°C沉淀30 min,12,000 g,4°C离心10 min;⑥弃上清,加入1 ml 70%乙醇洗两次,室温干燥后加入适当体积的DEPC处理过的H2O溶解,-70°C冻存,或用甲酰胺溶解RNA沉淀贮存于-20°C。
5.5.10.2 DNase处理RNA样品RNA样品用RQ-RNase free DNase(50 μl体系加1 μl 酶)处理1 h,加水至500 μl,酚、氯仿抽提后,加1/10体积的3 M醋酸钠(pH 5.0),2倍体积的无水乙醇沉淀,最后溶解于适量的水中。
PCR是否有DNA污染。
5.5.10.3 RNA浓度和纯度的检测①利用紫外分光光度计测定所提取RNA在260和280 nm的光吸收值,确定RNA的纯度和浓度。
纯净RNA样品的OD260/OD280比值应介于1.9和2.05之间,比值小于1.8表明蛋白污染,大于2.1可能是降解严重。
根据OD260为1相当于40 μg/ml RNA来计算浓度。
链霉菌表达系统作业
DNase印记法 印记法
DNA 结合 蛋白
45bp 与原核生物典型启动子-10和 区相类似 与原核生物典型启动子 和-35区相类似
硫链丝菌素
Hg2+
MerR蛋白 蛋白
tipAL
N端 端 螺旋—转角 螺旋 螺旋 转角—螺旋 转角
SoxR蛋白 蛋白
同源性
TipAL具有DNA结合蛋白活性 具有 结合蛋白活性
不产生黑色素, 不产生黑色素,重组菌落变为白色
五、链霉菌作为表达系统的特点
• 优点: 优点:
1.链霉菌工业化发展成熟,适于大规模产业化。 链霉菌工业化发展成熟,适于大规模产业化。 链霉菌工业化发展成熟 2.链霉菌基本为非致病菌,不产生内毒素。 链霉菌基本为非致病菌, 链霉菌基本为非致病菌 不产生内毒素。 3.可以进行高密度培养,并能在相当长的一段时间保持其代 可以进行高密度培养, 可以进行高密度培养 谢活性。在稳定期,细胞仍能合成次级代谢产物。 谢活性。在稳定期,细胞仍能合成次级代谢产物。 4.可分泌胞外酶,可将分泌信号肽序列纳入载体,使外源蛋 可分泌胞外酶, 可分泌胞外酶 可将分泌信号肽序列纳入载体, 白可以分泌到胞外。 白可以分泌到胞外。在胞外分泌的异源蛋白能正确折叠的 可能性大,且易被纯化。 可能性大,且易被纯化。 5.链霉菌中有许多可利用的转录起始信号,利用来自链霉菌 链霉菌中有许多可利用的转录起始信号, 链霉菌中有许多可利用的转录起始信号 的能充分产生及分泌蛋白的转录和分泌信号肽基因, 的能充分产生及分泌蛋白的转录和分泌信号肽基因,可以 轻易地在链霉菌中进行基因产物的高表达。 轻易地在链霉菌中进行基因产物的高表达。
链霉菌表达系统与方法
主要内容: 主要内容:
一、生物学特性以及目前应用简介 二、链霉菌表达系统的组成 三、表达的一般步骤 四、应用实例 五、链霉菌表达系统特点及前景展望
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
链霉菌室实验操作手册(2003年)第一章培养基抗生素生长因子 (3)常用抗生素及其使用浓度 (3)LB(Luria-Bertani)培养基 (3)LA (3)基本培养基(MM) (3)R5(1L)链霉菌原生质体转化时用 (4)YEME(酵母膏-麦芽膏培养基) 1L(液体培养链霉菌) (4)TSBY (1L)(液体培养链霉菌) (4)MS培养基 (5)2CMY培养基(用于井岗的接合转移) (5)YMS培养基(阿维,井岗产孢) (5)YD培养基 (5)生长因子补充物的使用浓度 (6)第二章DNA基本操作 (7)大肠杆菌质粒的抽提 (7)酶连反应 (7)DNA片段凝胶回收 (8)DNA纯化 (9)E.coil总DNA的提取 (9)链霉菌质粒DNA的小量提取(还需改进) (10)去磷酸化处理(详见分子克隆实验指南以及Takara的CIAP使用说明) (10)AT克隆(详见说明书) (10)Southern Blot (11)第三章PCR及相关技术 (13)PCR (13)PCR重组(详见《PCR技术实验指南》p429 重叠延伸技术) (14)PCR定点诱变(DpnI法) (14)第四章基因片段转移技术 (15)大肠杆菌CaCl2法制备感受态细胞及DNA转化 (15)DNA转化 (15)大肠杆菌质粒的快速检测 (15)接合转移(详见英文《手册》249页) (16)链霉菌原生质体的制备 (16)链霉菌原生质体的转化 (17)PCR-Targeting技术中E.coli电转化感受态的制备及电转化 (17)第五章RNA操作技术 (19)链霉菌总RNA的抽提 (19)链霉菌的RT-PCR(promega RT kit) (19)第六章蛋白质基本操作技术 (21)SDS-PAGE,考马斯亮蓝染色 (21)大肠杆菌可溶性蛋白表达及抽提(用于由IPTG诱导的表达体系): (21)链霉菌总蛋白抽提: (22)大肠杆菌目标蛋白的诱导及总蛋白检测(含T7表达系统如BL21菌株中的pET系列表达体系): (22)Western Blot (23)第七章遗传作图相关技术 (25)链霉菌孢子悬液的制备 (25)链霉菌中NF的证明 (25)孢子杂交 (25)在遗传图谱上两个标记基因之间定位新的基因 (25)第八章其他技术 (27)链霉菌菌种保藏 (27)检测链霉菌淀粉酶的活性 (27)第一章培养基抗生素生长因子常用抗生素及其使用浓度抗生素英文名称及缩写抗性基因贮藏液浓度(mg/ml)使用终浓度(μg/ml)链霉菌大肠杆菌M M2CM Y E M E L A或L B氨苄青霉素氯霉素潮霉素卡那霉素壮观霉素链霉素硫链丝菌素红霉素阿泊拉霉素Ampicillin, AmpChloramphenicol, CmlHygromycin, HygKanamycin, KmSpectinomycin, SpcStreptomycin, StrThiostrepton, ThioErythomycin, EryApramycin, Amblacathygaac或aphaadAstrtsrerm Eaac(3)IV10025(无水乙醇配)5025505025(DMSO配)10050R10102?5010510010R-2550502510-50R---50-2.5-5050-1002550505025不敏感2030-50*–表示无记录或不能使用,贮存液除特别说明外均用无菌水配制*此表仅供参考!!!*R表示不敏感*Km 和Am有交叉抗性,所以同时具有这两种抗性基因时应适当提高抗生素的量,并作好对照。
*Hyg易见光分解,应用锡箔纸包好。
*有些抗生素需要在低盐的环境(如DNA培养基)下筛选效率较高,如Hyg, Km, VioLB(Luria-Bertani)培养基胰蛋白胨10g,酵母抽提物5g,NaCl 5g,葡萄糖1g,蒸馏水加至1000ml,pH7.3左右(灭菌后第一次用时还要调一次)LALB中加入终浓度为 1.5-2%的琼脂粉(不同的琼脂加的量不同,如青岛琼脂大概需1.5%,而华美的需要2%)。
*做蓝白斑筛选时不加葡萄糖基本培养基(MM)溶液:L-天冬酰胺0.5g,K2HPO4 0.5g,MgSO4·7H2O 0.2g,FeSO4·7H2O 0.01g,蒸馏水至1000ml将每250ml溶液分装到装有2.5g琼脂的500ml三角瓶中,灭菌,使用时每瓶加入50%葡萄糖(8磅灭菌)5ml,调pH7.0。
配置MM的琼脂有lab agar、Ice agar(IA)R5(1L)链霉菌原生质体转化时用蔗糖103gK2SO4 0.25gMgCl2·6H2O 10.12g葡萄糖10gDifco酪蛋白氨基酸0.1g微量元素溶液2mlOxoid酵母提取物5gTES 5.73g加蒸馏水至1000ml称取5.5g Difco琼脂放入500ml三角瓶中,倒入250ml上述溶液,然后塞上塞子后8磅灭菌(114度15分种)。
使用时,将培养基融化,每瓶中加入:KH2PO4(0.5%) 2.5mlCaCl2·2H2O(5M) 1mlL-脯氨酸(20%) 3.75mlNaOH(1M)调pH至7.3对营养缺陷型菌株加入适当的营养因子(请参考《手册》)YEME(酵母膏-麦芽膏培养基) 1L(液体培养链霉菌)Oxoid酵母提取物3gOxoid蛋白胨Tryptone 5g麦芽提取物(BD公司原Difco公司218630)3g葡萄糖10g蔗糖*340g蒸馏水至1000ml高压灭菌后加入:(8磅灭菌,113-114゜C,15min,自动灭菌锅一次不能灭过多东西,否则会灭不彻底。
)MgCl2·6H2O(2.5M) 2ml/L制备原生质体时,还要加入:甘氨酸(20%)*25ml/L*蔗糖的主要作用是维持链霉菌生长时的渗透压。
*甘氨酸被认为能干扰链霉菌细胞壁的形成,使菌丝体片段更短,利于溶菌,有利于外源DNA的导入。
TSBY (1L)(液体培养链霉菌)Oxoid胰胨豆汤粉(TSB)30g蔗糖*340gOxoid酵母抽提物5g蒸馏水至1000ml*不同菌株培养需要不同浓度的蔗糖,蔗糖的主要作用是维持链霉菌生长时的渗透压。
MS培养基将黄豆饼粉加蒸馏水煮2到3小时,用纱布过滤得到滤液,将每250ml滤液分装到装有5g 琼脂,5g 甘露醇的500ml三角瓶中,10磅灭菌,使用时调pH7.2-7.3。
2CMY培养基(用于井岗的接合转移)可溶性淀粉10g胰蛋白胨2gNaCl 1g(NH4 )2SO4 2gK2 HPO4 1gCaCO3 2g无机盐溶液* 1 ml琼脂20g蒸镏水1000 mlPH7.2无机盐溶液(每升)FeSO4 .7H2 O 1gMgCl.6 H2 O 1gZnSO4. 7H2 O 1gYMS培养基(阿维,井岗产孢)酵母抽提物4g可溶性淀粉4g麦芽糖10gCoCl. .6 H2 O 5mg琼脂20g蒸镏水1000 mlPH7.2YD培养基酵母抽提物4g麦芽糖10g葡萄糖4gMgCl 2gCaCl 1.5g琼脂15g蒸镏水1000 mlPH7.2生长因子补充物的使用浓度天蓝色链霉菌1258 、J1501等都是营养缺陷型菌株,培养这些菌株时一般需向培养基中补加营养因子,使用浓度如表生长因子补充物的使用浓度表化合物储存液(mg/ml)1终作用浓度(μg/ml)组氨酸(Histidine)10 50其它氨基酸27.5 371.5 7.5腺嘌呤,鸟嘌呤,胸腺嘧啶,尿嘧啶维生素0.1 0.51.储存液用无菌去离子水配置,8磅灭菌后4o C保存。
2.对于半胱氨酸营养缺陷型菌株,补充光氨酸。
第二章DNA基本操作大肠杆菌质粒的抽提苯酚/氯仿溶液抽提法1.接种5ml LB,37℃摇床过夜培养(12小时)2.离心,3000rpm,5min去上清3.振荡混匀沉淀,分装在2个离心管中,spin一下,吸去上清,加入150μl的溶液I(50mmol/L葡萄糖, 25mmol/L Tris·Cl(PH8.0), 10mmol/L EDTA(PH8.0) 在10lbf/in2(6.895×104Pa)高压蒸气下灭菌15min(8磅),贮存于4℃),剧烈振荡5分钟打散菌体(菌体不打散容易在产物中出现较多蛋白)。
4.加入300μl溶液II(0.2mol/LnaOH, 1%SDS, 用2倍的溶液现配现用)后立即振荡混合均匀,处理2分钟后加入225μl溶液III(5mol/L乙酸钾60ml,冰乙酸11.5ml,水28.5ml)混合均匀,12000rpm离心5min,取上清液中于新的离心管。
5.加120μl酸性苯酚/氯仿溶液,振荡混匀,12000rpm离心5min,再取上清液中于新的离心管中。
6.用120ul氯仿重复操作5。
7.加等体积的异丙醇或2倍体积的乙醇,混匀,12000rpm离心7min。
8.沉淀用70%乙醇洗涤两次,每次10min。
50℃烘干后加适量无菌去离子水(ddH2O)溶解,-20℃保存。
氯化锂抽提法1.前四部同苯酚/氯仿溶液抽提法(用Solution I II III处理)2.加等体积的异丙醇,混匀,沉淀DNA,12000rpm离心7min。
去上清,尽量去干净。
3.用少量70%乙醇洗一下(洗去异丙醇),离心去尽酒精,50℃烘干沉淀,用适量ddH2O(100ul)充分溶解(可在50度水浴中助溶)后加入4/5体积的氯化锂溶液(浓度约10mol/L)处理1min沉淀RNA和蛋白。
4.12000rpm离心5min,取上清液于新的离心管中,用等体积的异丙醇混匀,12000rpm离心8min,去上清。
5.将沉淀用70%乙醇洗涤两次,每次10min。
50℃烘干后加一定量的无菌去离子水(ddH2O)溶解,-20℃保存。
酶连反应一般采用10μl反应体系:T4连接酶1μl ,连接酶缓冲液1μl ,外源片段与载体按DNA 摩尔含量3:1加入即可。
如果是粘端连接,则需把外源片段和载体的混合物在50度处理10分钟使粘端变性,然后立即放入冰中5分钟。
平端连接采用14度,粘端连接采用16度,连接4小时以上(一般可过夜)。
*外源片段与载体按DNA 摩尔含量为3:1或外源更多。
DNA片段凝胶回收1试剂盒回收 (离心法)(详见说明书)(1)在长波紫外灯下切下含有目标DNA的琼脂糖凝胶,用纸巾吸干凝胶表面的液体并切小.计算凝胶的重量,该重量作为一个凝胶体积(如1oomg=1ooul)(2)根据凝胶的浓度,加DE-A 液凝胶浓度DE-A溶液体积≤1.0% 3个凝胶体积≤1.5% 4 个凝胶体积≤2.0% 5 个凝胶体积混匀后于75o C加热,(低熔点琼脂糖凝胶于45o C加热),间断混合,直到凝胶熔化(6-8分钟). (3)加0.5个DE-A体积的DE-B溶液,混匀(是否需调整PH值,见注意事项1);当分离的DNA片段小与400bp 时,加入异丙醇至终浓度为20%;(4)吸3中的混合液,转移到DNA制备管,3600rpm离心1分钟.如制备管中有残留,适当提高速度,再离心1分钟,去滤液;(5)将制备管置回离心管,加0.5ml W1溶液,3600rpm离心30,弃滤液;(6)将制备管置回离心管,加0.7ml W2溶液,3600rpm离心30,弃滤液,重复一次; (W2中含有酒精,应保证瓶子密封。
