新苏教版必修1专题5第3单元第2课时不同类型晶体课件(33张)
合集下载
化学课件《不同类型的晶体》优秀ppt3 苏教版

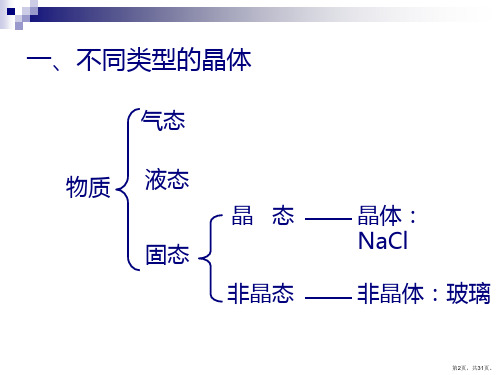
不同类型的晶体
2019年5月18日星期六 2019年5月18日星期六
晶体的概念
◆什么叫晶体?
●通过结晶过程形成的具有规则 几何外形的固体叫晶体。
●晶体中的微粒(分子、原子或 离子)按一定的规则排列。
构成晶体的基本微粒和作用力
◆阴阳离子 ●阴阳离子间以离子键结合,形成离子晶体。
◆分子 ●分子间以分子间作用力(又称范德华力)结 合,形成 分子晶体。
――[阿萨·赫尔帕斯爵士] 115.旅行的精神在于其自由,完全能够随心所欲地去思考.去感觉.去行动的自由。――[威廉·海兹利特]
116.昨天是张退票的支票,明天是张信用卡,只有今天才是现金;要善加利用。――[凯·里昂] 117.所有的财富都是建立在健康之上。浪费金钱是愚蠢的事,浪费健康则是二级的谋杀罪。――[B·C·福比斯] 118.明知不可而为之的干劲可能会加速走向油尽灯枯的境地,努力挑战自己的极限固然是令人激奋的经验,但适度的休息绝不可少,否则迟早会崩溃。――[迈可·汉默] 119.进步不是一条笔直的过程,而是螺旋形的路径,时而前进,时而折回,停滞后又前进,有失有得,有付出也有收获。――[奥古斯汀] 120.无论那个时代,能量之所以能够带来奇迹,主要源于一股活力,而活力的核心元素乃是意志。无论何处,活力皆是所谓“人格力量”的原动力,也是让一切伟大行动得以持续的力量。――[史迈尔斯] 121.有两种人是没有什么价值可言的:一种人无法做被吩咐去做的事,另一种人只能做被吩咐去做的事。――[C·H·K·寇蒂斯] 122.对于不会利用机会的人而言,机会就像波浪般奔向茫茫的大海,或是成为不会孵化的蛋。――[乔治桑] 123.未来不是固定在那里等你趋近的,而是要靠你创造。未来的路不会静待被发现,而是需要开拓,开路的过程,便同时改变了你和未来。――[约翰·夏尔] 124.一个人的年纪就像他的鞋子的大小那样不重要。如果他对生活的兴趣不受到伤害,如果他很慈悲,如果时间使他成熟而没有了偏见。――[道格拉斯·米尔多] 125.大凡宇宙万物,都存在着正、反两面,所以要养成由后面.里面,甚至是由相反的一面,来观看事物的态度――。[老子]
2019年5月18日星期六 2019年5月18日星期六
晶体的概念
◆什么叫晶体?
●通过结晶过程形成的具有规则 几何外形的固体叫晶体。
●晶体中的微粒(分子、原子或 离子)按一定的规则排列。
构成晶体的基本微粒和作用力
◆阴阳离子 ●阴阳离子间以离子键结合,形成离子晶体。
◆分子 ●分子间以分子间作用力(又称范德华力)结 合,形成 分子晶体。
――[阿萨·赫尔帕斯爵士] 115.旅行的精神在于其自由,完全能够随心所欲地去思考.去感觉.去行动的自由。――[威廉·海兹利特]
116.昨天是张退票的支票,明天是张信用卡,只有今天才是现金;要善加利用。――[凯·里昂] 117.所有的财富都是建立在健康之上。浪费金钱是愚蠢的事,浪费健康则是二级的谋杀罪。――[B·C·福比斯] 118.明知不可而为之的干劲可能会加速走向油尽灯枯的境地,努力挑战自己的极限固然是令人激奋的经验,但适度的休息绝不可少,否则迟早会崩溃。――[迈可·汉默] 119.进步不是一条笔直的过程,而是螺旋形的路径,时而前进,时而折回,停滞后又前进,有失有得,有付出也有收获。――[奥古斯汀] 120.无论那个时代,能量之所以能够带来奇迹,主要源于一股活力,而活力的核心元素乃是意志。无论何处,活力皆是所谓“人格力量”的原动力,也是让一切伟大行动得以持续的力量。――[史迈尔斯] 121.有两种人是没有什么价值可言的:一种人无法做被吩咐去做的事,另一种人只能做被吩咐去做的事。――[C·H·K·寇蒂斯] 122.对于不会利用机会的人而言,机会就像波浪般奔向茫茫的大海,或是成为不会孵化的蛋。――[乔治桑] 123.未来不是固定在那里等你趋近的,而是要靠你创造。未来的路不会静待被发现,而是需要开拓,开路的过程,便同时改变了你和未来。――[约翰·夏尔] 124.一个人的年纪就像他的鞋子的大小那样不重要。如果他对生活的兴趣不受到伤害,如果他很慈悲,如果时间使他成熟而没有了偏见。――[道格拉斯·米尔多] 125.大凡宇宙万物,都存在着正、反两面,所以要养成由后面.里面,甚至是由相反的一面,来观看事物的态度――。[老子]
2019_2020年高中化学专题1第3单元第2课时不同类型的晶体课件苏教版必修2

[答案] (1)⑤⑥ ② (2)①③④ ① (3)
核心突 破 攻重难
晶体性质的比较
1.几种常见晶体比较 晶体类型 离子晶体 组成晶 阳离子和 体的微粒 阴离子 组成晶体微粒
离子键 间的相互作用
原子晶体 原子 共价键
分子晶体 金属晶体
分子
阳离子和 自由电子
范德华力(有 金属键
的还有氢键)
典型实例
NaCl
金刚石、晶体 冰(H2O)、干 铜、金、银、
硅、SiO2、SiC 冰(CO2)
镁
晶体 的物 理特 性
熔点较 熔点、
高、沸点 沸点
高
熔、沸点高
熔、沸点低
熔沸点较 高(个别例
外)
晶体 的物 理特
性
导热性 不良
良好
差
好
晶体 的 物 机械加
专题1 微观结构与物质的多样性
第三单元 从微观结构看物质的多样性
第2课时 不同类型的晶体
目标与素养:1.熟知晶体的类型及其分类依据,学会判断晶体类 型的方法。(宏观辨识与微观探析)2.知道晶体类型与物质性质的关系, 会比较晶体的熔、沸点。(宏观辨识与微观探析)
自主预 习 探新知
一、晶体
规则的几何外形 规则的重复排列
①原子晶体 一般来说,原子半径越小,共价键越牢固,晶体的熔沸点越高。 如熔点:金刚石(C)>水晶(SiO2)>晶体硅(Si)。
②离子晶体 一般来说,阴、阳离子电荷数越多,离子半径越小,则熔沸点 越高。如熔点:MgO>MgCl2,NaCl>CsCl。 ③分子晶体 组成和结构相似的物质,相对分子质量越大,熔沸点越高。
④金属晶体 金属单质晶体内,金属离子半径越小,价电子数越多,则金属 离子与自由电子之间的作用力越强,即金属键越强,物质的熔沸点 越高。如:熔点:Li>Na>K>Rb>Cs。
高中教育化学必修第一册苏教版《5.3.2 晶体与非晶体》教学课件

2.下表列出的对晶体的说明中,错误的是( )
选项
A
B
C
D
晶体名称
碘化钾
干冰
石墨
碘
晶体中的粒子 阴、阳离子
分子
原子
分子
粒子间的作用力 离子键 分子间作用力 共价键 分子间作用力
答案:C
解析:碘化钾为离子晶体,组成微粒为离子,组成晶体微粒间的作用力为离子键;干冰和碘都是分子晶 体,熔化时克服分子间作用力;石墨是混合型晶体,呈层状结构,层与层之间为分子间作用力,碳原子与碳 原子之间形成共价键,熔化时两种作用力都需克服,故C错误。
提升点2 晶体熔、沸点高低比较
例2 下列化合物,按其晶体的熔点由高到低排列正确的是( )
A.SiO2 CsCl I2 Br2 B.SiO2 CsCl Br2 I2 C.CsCl SiO2 I2 Br2 D.Br2 I2 CsCl SiO2
一般规律:共价晶体>离子晶体>分子晶体
【答案】 A
【解析】 先区分各选项中各物质的晶体类型,共价晶体的熔点>离子晶体的熔点>分子晶体的熔点。其 中I2的熔点高于Br2的熔点。
学考评价
1.下列叙述不正确的是( ) A.含有共价键的固态物质不一定是分子晶体 B.离子晶体中一定含有离子键 C.共价晶体中只含有共价键 D.金属晶体的熔点和沸点都很高
答案:D
解析:氢氧化钠是离子晶体,既含有离子键又含有共价键,石英是共价晶体,只含有共价键,故A、B、 C项正确;金属晶体的熔沸点相差很大,故D错误。
2.分子晶体 (1)含义: ___分_子_____之间依靠分子间作用力按一定规则排列形成的晶体。 ①构成微粒:___分_子_____; ②微粒间作用力:_分_子_间__作_用_力____。 (2)实例——干冰晶体的结构:
高中化学 1.3.2 各种类型的晶体课件 苏教版必修2

晶体 熔点/℃ 硬度 导电性
3、原子晶体
金刚石 大于3550 很硬 不导电
二氧化硅 1723 硬而脆 不导电
原子晶体性质特点:熔、沸点高,硬度大、 不导电
3、原子晶体总结
微粒
物质 作用力
晶体性 质特点
原子 共价化合物或单质 共价键 熔、沸点高,硬度大、 不导电
实例
金刚石、金刚砂(SiC)、 晶体硅、石英(SiO2)、 氮化硅(Si3N4 )、氮化硼(BN)
4、金属晶体总结
微粒 金属离子与自由电子
作用力 金属键
导电性 导电
硬度和 熔点
差异大
晶体性 有金属光泽、能导电导热、有 质特点 延展性。不同的金属的熔点、
硬度差异大
随堂练习
判断下列物质的晶体类型 氧化钠晶体、二氧化硫晶体、三氧化硫晶体、冰、
氢氧化钠晶体、硫酸晶体、铁、硫磺
如何判断晶体类型?
1.分子晶体判断法:熔、沸点低、硬度 小;常温下为气态、液态的
返回
一、离子晶体
晶体
氯化钠
氯化钡
熔点/℃
801
1560
硬度
较硬
较硬
导电性
固态不导电, 固态不导电,
溶于水或熔融 溶于水或熔融
状态导电
状态导电
离子晶体性质特点:①熔沸点较高,②硬而脆, ③固态不导电,在熔融状态或水溶液中能导电, ④大多数离子晶体易溶于水
微粒 物质 作用力 晶体性 质特点
判断方 法
构成物质的微粒:原子、分子、离子
由离子构成的晶体 由分子构成的晶体
由原子构成的晶体
离子晶体
离子化合物
分子晶体
共价化合物或单质
原子晶体
共价化合物或单质
5.3.2不同类型的晶体课件 课件【新教材】苏教版(2019)高中化学必修第一册

• 哪些物质属于离子晶体?
➢ 部分金属氧化物、强碱、大部分盐类 (一般由金属+非金属构成的物质,除了AlCl3等)。
二、分子晶体
1、干冰及其二氧化碳分子的排列方式
【交流与讨论2】观察干冰晶胞模型,思考下列问题:
①干冰晶体中是否存在单独的CO2分子? 能说干冰的分子式为“CO2”吗?
②干冰晶体中除了分子间作用力, 还存在其他的作用力吗?
每个O原子与几个Si原子以共价键结合? ④能否说二氧化硅的分子式为“SiO2”呢?
化学式“SiO2”中的1:2表示什么含义?
石英晶体中的硅、氧原子的排列方式
Si
O
180º
109º28´
SiO2平面结构
共价键
[小结]:在SiO2晶体中, 不存在 (填存在或不存在)分子, 存在许多 Si原子 和 氧原子 ,以 共价键 相结合。
金刚石的结构
构成金刚石的微粒是C原子, 每个C原子与另外4个C原子 以共价键相连,C原子间以 共价键结合成空间网状结 构,最小的碳环上有6个C 原子且6个C原子不在同一 平面。金刚石的基本结构 单元是正四面体。
三、原子晶体
1、什么叫原子晶体? 原子间通过共价键结合成的具有空间网状结构的晶体。
2、原子晶体的特点? 熔沸点很高,硬度很大。 不导电。 3、哪些物质属于原子晶体? ➢ 金刚石、单晶硅、碳化硅SiC、二氧化硅等 (中学范围内常见的原子晶体)
晶体 离子 离子 原子 原子 分子 分子 金属 金属 类型 晶体 晶体 晶体 晶体 晶体 晶体 晶体 晶体
不同类型晶体熔 沸点、硬度高低
顺序
一般情况下:
原子 晶体 > 离子 晶体 > 分子 晶体 ( 金属 晶体的熔沸点和硬度差别很大)
➢ 部分金属氧化物、强碱、大部分盐类 (一般由金属+非金属构成的物质,除了AlCl3等)。
二、分子晶体
1、干冰及其二氧化碳分子的排列方式
【交流与讨论2】观察干冰晶胞模型,思考下列问题:
①干冰晶体中是否存在单独的CO2分子? 能说干冰的分子式为“CO2”吗?
②干冰晶体中除了分子间作用力, 还存在其他的作用力吗?
每个O原子与几个Si原子以共价键结合? ④能否说二氧化硅的分子式为“SiO2”呢?
化学式“SiO2”中的1:2表示什么含义?
石英晶体中的硅、氧原子的排列方式
Si
O
180º
109º28´
SiO2平面结构
共价键
[小结]:在SiO2晶体中, 不存在 (填存在或不存在)分子, 存在许多 Si原子 和 氧原子 ,以 共价键 相结合。
金刚石的结构
构成金刚石的微粒是C原子, 每个C原子与另外4个C原子 以共价键相连,C原子间以 共价键结合成空间网状结 构,最小的碳环上有6个C 原子且6个C原子不在同一 平面。金刚石的基本结构 单元是正四面体。
三、原子晶体
1、什么叫原子晶体? 原子间通过共价键结合成的具有空间网状结构的晶体。
2、原子晶体的特点? 熔沸点很高,硬度很大。 不导电。 3、哪些物质属于原子晶体? ➢ 金刚石、单晶硅、碳化硅SiC、二氧化硅等 (中学范围内常见的原子晶体)
晶体 离子 离子 原子 原子 分子 分子 金属 金属 类型 晶体 晶体 晶体 晶体 晶体 晶体 晶体 晶体
不同类型晶体熔 沸点、硬度高低
顺序
一般情况下:
原子 晶体 > 离子 晶体 > 分子 晶体 ( 金属 晶体的熔沸点和硬度差别很大)
不同类型的晶体教学课件苏教版
第14页,共31页。
第15页,共31页。
在NaCl晶体中:
①以Na+为中心,与它最近的等距离的Cl-有6个! ②以Cl ̄为中心,与它最近的等距离的Na+有6个! ③以上构成正八面体形! ④以Na+为中心,与它最近的等距离的Na+有12个! ⑤以Cl ̄为中心,与它最近的等距离的Cl ̄有12个! ⑥NaCl晶体中每个晶胞中有4个Na+、4个Cl ̄ !
第16页,共31页。
离子晶体的主要性质:王后雄P34-35
第17页,共31页。
分子晶体
分子间通过分子间作用力按一定规则排列而成 的晶体。 例如:CO2
第18页,共31页。
共价键
范德华力
第19页,共31页。
问题(对照书P22图)
①一个CO2晶胞中有多少CO2分子?4个 ②与CO2相邻的等距离的CO2有多少个1?2个
在金刚石晶体中, ①每个C与多少个C行成共价键?4个 ②形成怎样的空间结构? 正四面体型 ③金刚石最小碳环由多少个C原子 ?6个
第25页,共31页。
Si O
180º 109º28´
共价键
第26页,共31页。
SiO2
①构成SiO2的晶体的微粒是什么? ②SiO2晶体中有无单个分子存在? ③每个Si原子与几个O原子以共价键相结合? ④每个O原子与几个Si原子以共价键相结合? ⑤SiO2的化学式1﹕2代表什么含义? ⑥SiO2中最小环中有多少原子?
第20页,共31页。
干冰晶体结构示意
由此可见,每个二氧化碳分子周围有12个二氧化碳分子。
第21页,共31页。
分子晶体的主要性质:王后雄P35
第22页,共31页。
原子晶体
相邻原子通过共价键结合而形成空间网状结构 的晶体。
第15页,共31页。
在NaCl晶体中:
①以Na+为中心,与它最近的等距离的Cl-有6个! ②以Cl ̄为中心,与它最近的等距离的Na+有6个! ③以上构成正八面体形! ④以Na+为中心,与它最近的等距离的Na+有12个! ⑤以Cl ̄为中心,与它最近的等距离的Cl ̄有12个! ⑥NaCl晶体中每个晶胞中有4个Na+、4个Cl ̄ !
第16页,共31页。
离子晶体的主要性质:王后雄P34-35
第17页,共31页。
分子晶体
分子间通过分子间作用力按一定规则排列而成 的晶体。 例如:CO2
第18页,共31页。
共价键
范德华力
第19页,共31页。
问题(对照书P22图)
①一个CO2晶胞中有多少CO2分子?4个 ②与CO2相邻的等距离的CO2有多少个1?2个
在金刚石晶体中, ①每个C与多少个C行成共价键?4个 ②形成怎样的空间结构? 正四面体型 ③金刚石最小碳环由多少个C原子 ?6个
第25页,共31页。
Si O
180º 109º28´
共价键
第26页,共31页。
SiO2
①构成SiO2的晶体的微粒是什么? ②SiO2晶体中有无单个分子存在? ③每个Si原子与几个O原子以共价键相结合? ④每个O原子与几个Si原子以共价键相结合? ⑤SiO2的化学式1﹕2代表什么含义? ⑥SiO2中最小环中有多少原子?
第20页,共31页。
干冰晶体结构示意
由此可见,每个二氧化碳分子周围有12个二氧化碳分子。
第21页,共31页。
分子晶体的主要性质:王后雄P35
第22页,共31页。
原子晶体
相邻原子通过共价键结合而形成空间网状结构 的晶体。
专题一§3-2不同类型的晶体-福建省长乐高级中学苏教版高一化学必修二课件(共19张PPT)

不同类型的晶体
活学活用 1 2
-9-
二、不同类型的晶体结构
1.下列有关晶体的叙述中,错误的是 ( C ) A.离子晶体中一定含有离子键 B.原子晶体中,只存在共价键 C.构成分子晶体的物质中不存在共价键 D.稀有气体的原子易形成分子晶体
A项:离子晶体中一定含有离子键, A正确; B项:原子晶体中,只存在共价键, B正确; C项:分子晶体的物质中可能存在共价键, C错误; D项:稀有气体的原子易形成分子晶体, D正确;
苏教版《化学必修二》
专题一§3-2不同类型的晶体
福建省长乐高级中学 黄炳生 2020年3月18日
不同类型的晶体
-2-
学习目标与核心素养
➢ 学习目标 1.熟知晶体的类型及其分类依据,学会判断晶体类型的方法。 2.知道晶体类型与物质性质的关系,会比较晶体的熔、沸点。 ➢ 核心素养 1.宏观辨识与微观探析:能从宏观与微观结合的视角对物质进 行分类。 2.证据推理与模型认知:能依据构成微粒及微粒间作用,判断 晶体类型,并解决相应问题。
-6-
二、不同类型的晶体结构
3.分子晶体(分子晶体才有分子式)
右图为干冰晶体结构示意图。回答下列问题:
(1)构成干冰晶体的微粒是 CO2分子 ,微粒间的相互作用 力是 分子间作用力 , 晶体类型是 分子晶体 。
(2)干冰汽化时只需克服 分子间作用力 分子内的共价键 无影响 。
,对其
不同类型的晶体
-7-
(4)在石英晶体中,不存在 SiO2 分子,SiO2表示的意义是晶体 中硅原子与氧原子的个数比为 1∶2 。
不同类型的晶体
-8-
归纳总结
二、不同类型的晶体结构
1.根据晶体结构判断晶体类型 (1)先看晶体结构微粒种类: 离子 、 分子 、 原子 。 (2)再看微粒间的相互作用力:
不同类型的晶体PPT课件6 苏教版优质课件

• (2)处于立方体棱上的微粒同时为4个 晶胞所共有,每个微粒有1/4属于该晶 胞
• (3)处于立方体面上的微粒同时为2个 晶胞所共有,每个微粒有1/2属于该晶 胞
1 、勇敢的人不是天生的,需要你经过很多的磨炼。但是在磨炼的过程中你能不能变得勇敢,那就取决于你的决心了。 8 、拼一分高一分,一分成就终生。 19 、每个人都有潜在的能量,只是很容易:被习惯所掩盖,被时间所迷离,被惰性所消磨。 7 、面对人生的磨难,请用你的毅力创造生命的奇迹吧! 6 、低调是永恒的美德,缺心眼的话就要学会沉默。 9 、要寻找与自己有共同价值观的人,爱自己的人,好好珍惜,好好保护,终了一生。 19 、很多人找女朋友或者男朋友,把学历当作指标之一,既希望对方能够给他/她伴侣的温暖与浪漫,又希望他/她知识丰富、学历相当或更高,在事业上能蒸蒸日上;我想说,你找的是伴侣,不是 合作伙伴,更不是同事,生活就是生活,这个人适合你,即使你是博士他/她斗大字不识一个,那也无所谓,适合就会和谐融洽,人比文凭更重要 5 、雄鹰可以飞得晚,但一定要飞得高。 2 、人生就是一个历程,我们既要追求结果的成功,更要注重过程的精彩。 17 、人生伟业的建立,不在能知,乃在能行。 5 、雄鹰可以飞得晚,但一定要飞得高。 12 、失败并不可怕,只要我们怀着一颗不服输的心,勇往直前,那么胜利将不会离我们太远。 2 、人生就是一个历程,我们既要追求结果的成功,更要注重过程的精彩。 4 、昔之得一者:天得一以清;地得一以宁;神得一以灵;谷得一以生;侯得一以为天下正。 1 、世上诸般美好事物中,有两者最公平,那就是青春与梦想,它不分尊卑,人人都可享有。 10 、如果你岁之后,花的钱还是伸手向父母要的,那么你的满身名牌只能衬托出你的无能。 7 、居善地,心善渊,与善仁,言善信,政善治,事善能,动善时。夫唯不争,故无尤。
• (3)处于立方体面上的微粒同时为2个 晶胞所共有,每个微粒有1/2属于该晶 胞
1 、勇敢的人不是天生的,需要你经过很多的磨炼。但是在磨炼的过程中你能不能变得勇敢,那就取决于你的决心了。 8 、拼一分高一分,一分成就终生。 19 、每个人都有潜在的能量,只是很容易:被习惯所掩盖,被时间所迷离,被惰性所消磨。 7 、面对人生的磨难,请用你的毅力创造生命的奇迹吧! 6 、低调是永恒的美德,缺心眼的话就要学会沉默。 9 、要寻找与自己有共同价值观的人,爱自己的人,好好珍惜,好好保护,终了一生。 19 、很多人找女朋友或者男朋友,把学历当作指标之一,既希望对方能够给他/她伴侣的温暖与浪漫,又希望他/她知识丰富、学历相当或更高,在事业上能蒸蒸日上;我想说,你找的是伴侣,不是 合作伙伴,更不是同事,生活就是生活,这个人适合你,即使你是博士他/她斗大字不识一个,那也无所谓,适合就会和谐融洽,人比文凭更重要 5 、雄鹰可以飞得晚,但一定要飞得高。 2 、人生就是一个历程,我们既要追求结果的成功,更要注重过程的精彩。 17 、人生伟业的建立,不在能知,乃在能行。 5 、雄鹰可以飞得晚,但一定要飞得高。 12 、失败并不可怕,只要我们怀着一颗不服输的心,勇往直前,那么胜利将不会离我们太远。 2 、人生就是一个历程,我们既要追求结果的成功,更要注重过程的精彩。 4 、昔之得一者:天得一以清;地得一以宁;神得一以灵;谷得一以生;侯得一以为天下正。 1 、世上诸般美好事物中,有两者最公平,那就是青春与梦想,它不分尊卑,人人都可享有。 10 、如果你岁之后,花的钱还是伸手向父母要的,那么你的满身名牌只能衬托出你的无能。 7 、居善地,心善渊,与善仁,言善信,政善治,事善能,动善时。夫唯不争,故无尤。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
②大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、气 态氢化物、非金属氧化物(除 SiO2 外)、酸、绝大多数有机物(除有机盐 外)都是分子晶体。
③常见的原子晶体单质有金刚石、晶体硅、晶体硼等;常见的原 子晶体化合物有碳化硅、二氧化硅等。
④金属单质(汞常温下为液体)与合金是金属晶体。
(3)依据晶体的熔点判断 ①离子晶体一般熔点较高,常在几百至 1 000 多度。 ②原子晶体一般熔点高,常在 1 000 度部分较低,如汞常温下为液体。 (4)依据导电性判断 ①离子晶体固态时不导电,熔融状态能够导电。 ②分子晶体固态或熔融状态均不导电。 ③原子晶体固态时不导电。 ④金属晶体固态或熔融状态均导电。
2.分子晶体 (1)含义: 由 分子 构成的物质所形成的晶体。 ①构成微粒:□10___分__子___; ②微粒间作用力:□11_____分__子__间__作__用__力__________。 (2)实例——干冰晶体的结构:
晶体中微粒是CO2分子,且 微粒位于立方体的8个顶点 和6个面心。
3.原子晶体 (1)含义: 原子间通过1□2____共__价__键________结合形成的空间网状结构的晶 体。 ①构成微粒:□ 13__原 __子____;②微粒间作用力:1□4__共__价__键__。
A.液溴和己烷分别受热变为气体 B.干冰和氯化铵分别受热变为气体 C.硅和铁分别受热熔化 D.氯化氢和蔗糖分别溶解于水
解析:液溴和己烷都能形成分子晶体,受热变为气体时克服的是分子间 作用力,A 正确;干冰是分子晶体,其受热变为气体时克服分子间作用力; 氯化铵是离子晶体,其受热分解为氨气和氯化氢两种气体,破坏了离子键和 部分共价键,B 不正确;硅是原子晶体,其受热熔化时破坏共价键;铁是金 属晶体,其受热熔化时破坏金属键,所以 C 不正确;氯化氢是电解质,其溶 于水时破坏共价键,蔗糖是非电解质,其溶解于水时破坏分子间作用力,D 不正确。
二、几种常见的晶体类型 1.离子晶体 (1)含义: 离子化合物中的 阴、阳离子按一定的方式有规则地排列形成的晶 体。 ①构成微粒: 阴、阳离子;②微粒间作用力: 离子键 。 (2)实例——NaCl 的晶体结构:
每每个个NCla-+周周围围等等距距紧紧邻邻的的NCal+-有有66个个,, 晶体中Na+与Cl-的个数比为1:1。
2.下列不属于晶体的特点的是( )
A.具有规则的几何外形 B.具有固定的沸点
C.具有固定的熔点
D.一定是无色透明的固体
解析:晶体有规则的几何外形,有固定的熔、沸点,但却不一定是无 色的,如紫黑色晶体碘及蓝色的硫酸铜晶体。
答案:D
3.下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是 ()
A.铝的化合物的晶体中有的是离子晶体
B.表中只有 BCl3、干冰和 I2 是分子晶体 C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的பைடு நூலகம்体
【解析】 AlF3 是离子晶体,A 项正确;AlCl3 的熔点与分子晶体 I2 的熔点比较接近,而远低于离子晶体 Na2O、NaCl、AlF3 的熔点,可推知, AlCl3 是分子晶体,B 项错误;C、Si 是同主族元素,但 CO2 是分子晶体, 而 SiO2 是原子晶体,C 项正确;Na 和 Al 是不同主族元素,但它们的氧 化物 Na2O、Al2O3 均为离子晶体,D 项正确。
第2课时 不同类型晶体
课程目标 1.了解晶体的特点和分类。 2.知道几种重要的晶体及主要特征。 3.能够判断常见晶体所属的类型。 图说考点
基 础 知 识[新知预习]
一、晶体 1.晶体
规则几何外形
离子、分子、原子
规则的重复排列
分子晶体 原子晶体
2. 晶体的结构与性质特点
3.液晶的结构与性质特点 液晶是一种介于晶体状态和液态之间的中间态物质,它兼有液体 和晶体的某些特点,表现出一些独特的性质,通常只有那些分子较大, 分子形状呈长形或蝶形的物质,才形成液晶态。
1.判断正误,正确的打“√”,错误的打“×” (1)58.5 g NaCl 晶体中含 6.02×1023 个 NaCl 分子。( × ) (2)晶体中微粒间一定存在化学键。( × ) (3)晶体一定是无色透明固体。( × ) (4)晶体具有固定的熔点。( √ ) (5)分子晶体由分子构成。( √ ) (6)原子晶体熔、沸点高,硬度大。( √ ) (7)熔化时能导电的一定是离子晶体。( × )
[关键能力]
四种依据巧判晶体类型 (1)依据晶体的组成微粒及其相互作用力判断 ①阴、阳离子―→离子键―→离子晶体。 ②原子―→共价键―→原子晶体。 ③分子―→分子间作用力―→分子晶体。 ④金属阳离子、自由电子―→金属键―→金属晶体。
(2)依据物质的类别判断 ①金属氧化物(如 K2O 等)、强碱(如 NaOH、KOH 等)和绝大多数 的盐类是离子晶体。
(2)实例——石英晶体结构
晶体中每个Si原子周围 有□15 4 个O,每个O原 子周围有□16 2 个Si,晶体 中Si、O原子个数比为 □17 1:2 。
4.金属晶体 (1)含义:由金属单质或合金形成的晶体是金属晶体。 (2)构成微粒:金属阳离子和自由电子。 (3)微粒间的作用力:金属键。
[即时性自测]
答案:A
技能素养 提升点一 晶体类型与化学键及其判断
[例 1] 下表中是几种物质的熔点。
物质 Na2O NaCl AlF3 AlCl3 BCl3 Al2O3 CO2 SiO2 I2
熔点 /℃ 920
801 1 291 190 -107 2 073 -57 1 723 113.5
据此作出的下列判断中错误的是( )
【答案】 B
[提升 1] (1)指出下列物质的晶体类型: 金刚石_原__子__晶__体___,氯化氢_分__子__晶__体___,冰__分_子__晶__体___,二氧化 硅__原__子__晶__体__,铜_金 __属__晶__体___,固态氧_分__子__晶__体___,氯化钠__离__子__晶_体 ___, 硫酸铜__离__子__晶__体__。 (2)在以上物质中,熔点最高的是 __金__刚__石____,硬度最大的是 ___金__刚__石___ , 常 温 下 能 导 电 的 是 ____铜______ , 水 溶 液 能 导 电 的 是 _氯__化__钠__、__硫__酸__铜__、__氯__化_氢__。
③常见的原子晶体单质有金刚石、晶体硅、晶体硼等;常见的原 子晶体化合物有碳化硅、二氧化硅等。
④金属单质(汞常温下为液体)与合金是金属晶体。
(3)依据晶体的熔点判断 ①离子晶体一般熔点较高,常在几百至 1 000 多度。 ②原子晶体一般熔点高,常在 1 000 度部分较低,如汞常温下为液体。 (4)依据导电性判断 ①离子晶体固态时不导电,熔融状态能够导电。 ②分子晶体固态或熔融状态均不导电。 ③原子晶体固态时不导电。 ④金属晶体固态或熔融状态均导电。
2.分子晶体 (1)含义: 由 分子 构成的物质所形成的晶体。 ①构成微粒:□10___分__子___; ②微粒间作用力:□11_____分__子__间__作__用__力__________。 (2)实例——干冰晶体的结构:
晶体中微粒是CO2分子,且 微粒位于立方体的8个顶点 和6个面心。
3.原子晶体 (1)含义: 原子间通过1□2____共__价__键________结合形成的空间网状结构的晶 体。 ①构成微粒:□ 13__原 __子____;②微粒间作用力:1□4__共__价__键__。
A.液溴和己烷分别受热变为气体 B.干冰和氯化铵分别受热变为气体 C.硅和铁分别受热熔化 D.氯化氢和蔗糖分别溶解于水
解析:液溴和己烷都能形成分子晶体,受热变为气体时克服的是分子间 作用力,A 正确;干冰是分子晶体,其受热变为气体时克服分子间作用力; 氯化铵是离子晶体,其受热分解为氨气和氯化氢两种气体,破坏了离子键和 部分共价键,B 不正确;硅是原子晶体,其受热熔化时破坏共价键;铁是金 属晶体,其受热熔化时破坏金属键,所以 C 不正确;氯化氢是电解质,其溶 于水时破坏共价键,蔗糖是非电解质,其溶解于水时破坏分子间作用力,D 不正确。
二、几种常见的晶体类型 1.离子晶体 (1)含义: 离子化合物中的 阴、阳离子按一定的方式有规则地排列形成的晶 体。 ①构成微粒: 阴、阳离子;②微粒间作用力: 离子键 。 (2)实例——NaCl 的晶体结构:
每每个个NCla-+周周围围等等距距紧紧邻邻的的NCal+-有有66个个,, 晶体中Na+与Cl-的个数比为1:1。
2.下列不属于晶体的特点的是( )
A.具有规则的几何外形 B.具有固定的沸点
C.具有固定的熔点
D.一定是无色透明的固体
解析:晶体有规则的几何外形,有固定的熔、沸点,但却不一定是无 色的,如紫黑色晶体碘及蓝色的硫酸铜晶体。
答案:D
3.下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是 ()
A.铝的化合物的晶体中有的是离子晶体
B.表中只有 BCl3、干冰和 I2 是分子晶体 C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的பைடு நூலகம்体
【解析】 AlF3 是离子晶体,A 项正确;AlCl3 的熔点与分子晶体 I2 的熔点比较接近,而远低于离子晶体 Na2O、NaCl、AlF3 的熔点,可推知, AlCl3 是分子晶体,B 项错误;C、Si 是同主族元素,但 CO2 是分子晶体, 而 SiO2 是原子晶体,C 项正确;Na 和 Al 是不同主族元素,但它们的氧 化物 Na2O、Al2O3 均为离子晶体,D 项正确。
第2课时 不同类型晶体
课程目标 1.了解晶体的特点和分类。 2.知道几种重要的晶体及主要特征。 3.能够判断常见晶体所属的类型。 图说考点
基 础 知 识[新知预习]
一、晶体 1.晶体
规则几何外形
离子、分子、原子
规则的重复排列
分子晶体 原子晶体
2. 晶体的结构与性质特点
3.液晶的结构与性质特点 液晶是一种介于晶体状态和液态之间的中间态物质,它兼有液体 和晶体的某些特点,表现出一些独特的性质,通常只有那些分子较大, 分子形状呈长形或蝶形的物质,才形成液晶态。
1.判断正误,正确的打“√”,错误的打“×” (1)58.5 g NaCl 晶体中含 6.02×1023 个 NaCl 分子。( × ) (2)晶体中微粒间一定存在化学键。( × ) (3)晶体一定是无色透明固体。( × ) (4)晶体具有固定的熔点。( √ ) (5)分子晶体由分子构成。( √ ) (6)原子晶体熔、沸点高,硬度大。( √ ) (7)熔化时能导电的一定是离子晶体。( × )
[关键能力]
四种依据巧判晶体类型 (1)依据晶体的组成微粒及其相互作用力判断 ①阴、阳离子―→离子键―→离子晶体。 ②原子―→共价键―→原子晶体。 ③分子―→分子间作用力―→分子晶体。 ④金属阳离子、自由电子―→金属键―→金属晶体。
(2)依据物质的类别判断 ①金属氧化物(如 K2O 等)、强碱(如 NaOH、KOH 等)和绝大多数 的盐类是离子晶体。
(2)实例——石英晶体结构
晶体中每个Si原子周围 有□15 4 个O,每个O原 子周围有□16 2 个Si,晶体 中Si、O原子个数比为 □17 1:2 。
4.金属晶体 (1)含义:由金属单质或合金形成的晶体是金属晶体。 (2)构成微粒:金属阳离子和自由电子。 (3)微粒间的作用力:金属键。
[即时性自测]
答案:A
技能素养 提升点一 晶体类型与化学键及其判断
[例 1] 下表中是几种物质的熔点。
物质 Na2O NaCl AlF3 AlCl3 BCl3 Al2O3 CO2 SiO2 I2
熔点 /℃ 920
801 1 291 190 -107 2 073 -57 1 723 113.5
据此作出的下列判断中错误的是( )
【答案】 B
[提升 1] (1)指出下列物质的晶体类型: 金刚石_原__子__晶__体___,氯化氢_分__子__晶__体___,冰__分_子__晶__体___,二氧化 硅__原__子__晶__体__,铜_金 __属__晶__体___,固态氧_分__子__晶__体___,氯化钠__离__子__晶_体 ___, 硫酸铜__离__子__晶__体__。 (2)在以上物质中,熔点最高的是 __金__刚__石____,硬度最大的是 ___金__刚__石___ , 常 温 下 能 导 电 的 是 ____铜______ , 水 溶 液 能 导 电 的 是 _氯__化__钠__、__硫__酸__铜__、__氯__化_氢__。
