高中化学课后提升作业二十一4.3电解池1新人教版
人教版高中化学选修四配套练习:4.3电解池 Word版含解析

(本栏目内容,在学生用书中以独立形式分册装订!)一、选择题1.如图所示的装置能够组成电解池的是( )解析: 电解池有外接电源,而且构成闭合回路。
答案: D2.用惰性电极电解水时为了增强其导电性不应加入的电解质是( ) A .NaOH B .CuSO 4 C .H 2SO 4D .KNO 3解析: 用惰性电极电解NaOH 、KNO 3、H 2SO 4溶液时,实质是电解水,因此向水中加入这三种物质,只起到增强溶液导电性的作用;用惰性电极电解CuSO 4溶液时,电解方程式为2CuSO 4+2H 2O=====通电2Cu +O 2↑+2H 2SO 4,因此电解水时不应加入CuSO 4。
答案: B3.下列图示中关于铜电极的连接错误的是( )解析: 铜锌原电池中锌作负极,铜作正极,A 正确;电解精炼铜时,粗铜作阳极,精铜作阴极,B 正确;镀件上镀铜时,铜作阳极,镀件作阴极,C 错误;电解氯化铜溶液时,石墨作阳极,铜作阴极,D 正确。
答案: C4.(2016·衡水高二检测)某同学按图所示的装置进行电解实验。
下列说法正确的是( ) A .石墨是电解池的负极,Cu 是电解池的正极 B .电解过程中,铜电极上自身没什么变化 C .电解一定时间后,石墨电极上有铜析出D .整个电解过程中,石墨电极上发生的反应为2H ++2e -===H 2↑解析: Cu 接电源的正极,作阳极,石墨接电源负极,作阴极,A 错;Cu 是活泼电极,直接放电:Cu -2e -===Cu 2+,电极本身逐渐溶解,B 错;电解刚开始时,溶液中无Cu 2+,H +在阴极放电,但随着电解的进行,阳极产生的Cu 2+越来越多,因得电子能力Cu 2+>H +,故在阴极放电的离子逐渐由H +转向Cu 2+,D 错C 对。
答案: C5.用惰性电极电解物质的量浓度相同、体积比为1∶3的CuSO 4和NaCl 的混合溶液,可能发生的反应有( )①2Cu 2++2H 2O=====电解2Cu +4H ++O 2↑②Cu 2++2Cl -=====电解Cu +Cl 2↑③2Cl -+2H 2O=====电解2OH -+H 2↑+Cl 2↑ ④2H 2O=====电解2H 2↑+O 2↑ A .①②③ B .①②④ C .②③④D .②④解析: 混合溶液中CuSO 4和NaCl 物质的量之比为1∶3,即发生电解的溶质离子Cu 2+和Cl -物质的量之比为1∶3。
最新人教版高中化学《电解池》课后训练

课后训练基础巩固1.能用电解原理说明的问题是( )①电解是把电能转化为化学能②电解把化学能转化为电能③电解质溶液导电是化学变化,金属导电是物理变化④不能自发的氧化还原反应,通过电解原理可以实现⑤溶液被电解时,必然导致氧化还原反应的发生A.①②③④ B.②③⑤C.③④ D.①③④⑤2.如图是电解CuCl2溶液的装置,其中c、d为石墨电极。
则以下有关此电解池的判断正确的是( )A.a为负极,b为正极B.a为阳极,b为阴极C.电解过程中,d电极质量增加D.电解过程中,氯离子浓度保持不变3.在某电解质溶液里,用M和N作电极,通电一段时间后,发现M极的质量减小,N 极的质量增大,符合这一情况的是( )A.电解质溶液是稀硫酸B.金属M是阳极,N是阴极C.M和N是石墨电极D.M是阴极,N是阳极4.欲在金属表面镀银,应把镀件挂在电镀池的阴极。
下列各组中,选用的阳极金属和电镀液均正确的是( )A.Ag和AgCl溶液B.Ag和AgNO3溶液C.Fe和AgNO3溶液D.Pt和Ag2SO4溶液5.在以下电解槽中,随着电解的进行,溶液的pH会减小的是( )A.铜为阳极,铁为阴极,电解液为CuSO4溶液B.石墨为阳极,铁为阴极,电解液为CuSO4溶液C.铁为阳极,铜为阴极,电解液为AgNO3溶液D.石墨为阳极,铁为阴极,电解液为NaCl溶液6.按下图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )①c(Ag+) ②c(NO-3) ③a棒的质量④b棒的质量⑤溶液的pHA.①③ B.③④ C.①②④ D.①②⑤7.下列说法中不正确的是( )A.在冶金工业上,常用电解法得到钠、镁、铝等金属B.在金属冶炼时,除电解法外,还有热分解、热还原等方法C.工业上用电解氯化钠溶液的方法制钠单质D.电解法制钠时,钠在阴极上生成8.下图为直流电源电解稀Na2SO4水溶液的装置,通电后在石墨电极a和b附近分别滴加石蕊溶液,下列实验现象正确的是( )A.逸出气体的体积:a电极的小于b电极的B.电极逸出无味气体,另一电极逸出刺激性气味气体C.a电极附近呈红色,b电极附近呈蓝色D.a电极附近呈蓝色,b电极附近呈红色9.pH=a的某电解质溶液中,插入两支惰性电极,通直流电一段时间后,溶液的pH>a,则该电解质可能是( )A.NaOH B.H2SO4 C.AgNO3 D.Na2SO410.如图所示A为一张浸透淀粉碘化钾溶液并滴有酚酞试剂的滤纸,a、b为两张紧贴在滤纸上的铂片,并用导线和直流电源M、N两极相连接,通电后,在a周围观察到无色溶液变为蓝色。
高考化学总复习 课时作业27 电解池 人教版

1.下列描述中,不符合生产实际的是( )A.电解熔融的氧化铝制取金属铝,用铁作阳极B.电解法精炼粗铜,用纯铜作阴极C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极D.在镀件上电镀锌,用锌作阳极3.(2011上海高考)用电解法提取氯化铜废液中的铜,方案正确的是( ) A.用铜片连接电源的正极,另一电极用铂片B.用碳棒连接电源的正极,另一电极用铜片C.用氢氧化钠溶液吸收阴极产物D.用带火星的木条检验阳极产物解析:用电解法提取氯化铜废液中的铜时,铜必须作阴极,阳极是惰性电极,阴极的反应式为:Cu2++2e-===Cu。
答案:B4.某研究性学习小组进行电化学实验,研究装置如图所示。
有关说法不.正确的是( )A.镁为负极B .原电池中碳极的电极反应式为Fe 3++e -===Fe 2+C .电解池中阳极处先变红D .电解池中阴极的电极反应式为2H ++2e -===H 2↑解析:左池为原电池,活泼金属Mg 为负极,A 项对;C 为正极,电极反应为Fe 3++e -===Fe 2+,B 项对;右池为电解池,阳极:2I --2e -===I 2,使淀粉变蓝,C 项错,阴极:2H ++2e -===H 2↑,D 项对。
答案:C5.Cu 2O 是一种半导体材料,可用电解的方法制取。
电解示意图如图,电解总反应为2Cu +H 2O=====电解Cu 2O +H 2↑。
下列说法错误的是( )A .铜电极接直流电源的负极B .石墨电极上有氢气产生C .阳极上发生的反应为2Cu -2e -+2OH -===Cu 2O +H 2OD .当有0.2 mol 电子转移时,有0.1 mol Cu 2O 生成解析:铜的化合价升高,失去电子作电解池的阳极,与直流电源的正极相连,生成氧化亚铜。
石墨作阴极发生还原反应生成氢气。
每转移2 mol 电子有1 mol 氧化亚铜生成,故转移0.2 mol 电子时,有0.1 mol 氧化亚铜生成。
答案:A6.按如图所示装置进行实验(其中C 1、C 2均是石墨电极),下列说法中错误的是( )A .在标准状况下,Zn 极减轻3.25 g 时,C 2极上放出气体体积约为1.12 LB .发现a 点附近显红色C .在相同条件下,C 1、C 2电极所产生气体的体积比为2∶1D .乙池溶液的pH 减小解析:甲装置是原电池,Zn 为负极,Cu 为正极,则a 点为阴极,b 点为阳极,C 1为电解池阳极,C 2为阴极。
人教版高中化学选修四课时提升作业 二十 4.3 电解池4.3.1 Word版含解析

课时提升作业二十电解原理(40分钟70分)一、选择题(本题包括11小题,每小题5分,共55分)1.下列有关电解池说法正确的是( )A.可将电能完全转化为化学能B.接电源正极的电极一定是阳极C.阴极上发生的是氧化反应D.阳极上可能会生成金属单质【解析】选B。
A中电解池的能量转化低于100%。
C中阴极是得到电子发生还原反应。
D中阳极发生氧化反应,错误。
2.(2018·汕头高二检测)某同学为了使反应2HCl+2Ag2AgCl+H 2↑能进行,设计了下列四个实验,如图所示,你认为可行的方案是( )【解析】选C。
此反应为非自发的氧化还原反应,需设计成电解池,且Ag失电子作阳极,电解质溶液中的H+得电子生成H2。
3.某溶液中含有Cu2+、Fe2+、K+、Cl-、N,用石墨作电极进行电解时,肯定得不到的产物是( )A.Cl2B.KC.CuD.H2【解析】选B。
在阴极上,溶液中的H+的得电子能力强于K+而弱于Cu2+,所以阴极上无法得到单质K但可以得到铜和氢气。
阳极上Cl-失电子能力强于溶液中的OH-,所以可以得到氯气。
4.500 mL NaNO3和Cu(NO3)2的混合溶液中c(N)=6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到气体22.4 L(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是( )A.原混合溶液中c(Na+)=6 mol·L-1B.电解后溶液中c(H+)=4 mol·L-1C.上述电解过程中共转移8 mol电子D.电解后得到的Cu的物质的量为2 mol【解析】选B。
经过计算,c(Cu2+)=2 mol·L-1,由电荷守恒可知,原混合溶液中c(Na+)为6 mol·L-1-2 mol·L-1×2=2 mol·L-1,故A错误;B.电解后溶液中c(H+)为=4 mol·L-1,故B正确;C.由上述分析可知,电解过程中转移电子总数为4N A,故C错误;电解得到的Cu的物质的量为1 mol,故D错误。
人教版高中化学选修四第三节 电解池同步练习.docx

高中化学学习材料唐玲出品第三节电解池同步练习1.蓄电池是一种可反复充电、放电的装置。
它放电时起原电池的作用,将化学能转变为电能;而充电时电解池的作用,将电能转变为化学能贮存起来。
某蓄电池充电和放电时发生的反应为:Fe + NiO2 + 2H2O→ Fe(OH)2 + Ni(OH)2关于此蓄电池有下列说法:①放电时,NiO2为正极;②充电时,阳极反应式为:Fe(OH)2+2e-=Fe+2OH-;③放电时,电解质溶液中的阳离子向正极方向移动;④充电时,Ni(OH)2的反应式为:Ni(OH)2-2e-=NiO2+2H+;⑤蓄电池的电极必须浸在碱性电解质溶液中;错误的是 ( )A③ B ② C①③⑤ D ②和④2.用石墨电极电解硝酸银溶液,在阳极收集到0.40克氧气,中和电解时生成的酸需250 毫升氢氧化钠溶液,则氢氧化钠溶液的浓度是 ( )A 0.20 摩/升B 0.15 摩/升C 0.10 摩/升D 0.05 摩/升3.下列关于电解精炼铜的说法不正确...的是()A.粗铜作阳极B.用CuSO4溶液作电解液C.阴极的电极反应式:Cu2++2e—= Cu D.当阳极质量减少ag时,阴极质量增加ag4.下列描述中,不符合生产实际的是()A.电解熔融的氧化铝制取金属铝,用铁作阳极B.电解法精炼粗铜,用纯铜作阴极C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极D.在镀件上电镀锌,用锌作阳极5.在一定温度下用铂电极电解饱和Na2SO4溶液,对电解液判断正确的是()A.会有晶体析出B.浓度变大C.浓度变小D.溶质微粒数目不变6.下列关于实验现象的描述不正确的是 ( ) A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快7. 用阳极甲、阴极乙、电解质溶液丙,在电解过程中补充加入丁物质(纯),可以使电解液的组成保持恒定。
高中化学总复习:电解池(一)—电解原理和规律(提高)知识点巩固练习

高考总复习 电解原理和规律编稿:柏兴增 审稿:武小煊【考纲要求】1.了解电解池的工作原理,结合原电池工作原理,加深对化学能与电能相互转化的理解。
2.掌握离子的放电顺序,能写出电极反应式和电解池总反应方程式。
3.掌握电解产物的判断和计算。
【考点梳理】考点一:电解原理1.电解的定义:使电流通过电解质溶液(或熔融的电解质)而在阴、阳两极引起氧化还原反应的过程叫电解。
电解是最强有力的氧化还原手段,可将不能自发进行的氧化还原反应得以发生。
2.电解池的装置特点:有外接电源,将电能转化为化学能。
3.形成条件:(1)与电源两个电极相连;(2)电解质溶液(或熔融的电解质);(3)形成闭合回路。
4.阴阳极的判断及反应:考点二:原电池与电解池的比较原电池 电解池 能量转化 化学能→电能 电能→化学能 反应特征自发进行非自发进行装置举例电极电池的正、负极由电极材料决定 负极:较活泼的金属正极:较不活泼的金属、金属氧化物、非金属导体阴、阳极由所连电源决定阴极:接直流电源负极 阳极:接直接电源正极电极反应 负极:失去电子、发生氧化反应 正极:得到电子、发生还原反应阳极:阴离子或金属单质失电子发生氧化反应 阴极:阳离子得电子发生还原反应 电子流向负极e -−−−−→外电路正极考点三:电解规律1.电极材料(1)活性电极:既导电又能反应(针对阳极,指金属活动顺序表Ag 及Ag 以前的金属。
)(2)惰性电极:只导电不溶解(惰性电极一般指金、铂、石墨电极,而银、铜等均是活性电极。
) 2.离子放电顺序(1)阳极:阴离子放电顺序(活性金属)> S 2—>I —>Br —>Cl —>OH —>含氧酸根>F —(实际上在水溶液中的电解,OH —后面的离子是不可能放电的,因为水提供OH —的会放电) (2)阴极:阳离子放电顺序阴极本身被保护,直接根据阳离子放电顺序进行判断,阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+(酸中)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水中)>Al3+>Mg2+>Na+>Ca2+>K+。
高中化学 第四章 电化学基础 4.3 电解池教案 新人教版选修4-新人教版高二选修4化学教案
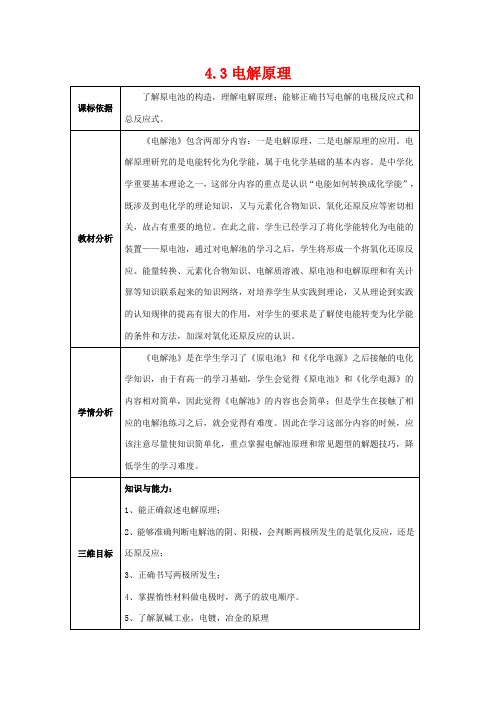
4.3电解原理CuCl 2溶液中两根碳棒,分别跟直流电源的正极和负极相连接,接通一段时间后,观察两极上的现象并用湿润的KI-淀粉试纸检验所生成的气体。
【质疑】1.通电前溶液中存在哪些离子?这些离子是如何运动的?【分析】接通直流电后,原来的离子运动发生了这样的变化?有关离子在两极发生了什么样的反应?【观看】动画实验【提问】两极产物是什现,与电源负极相连的一端的碳棒上有红色固体物质析出,与电源正极相连的一端碳棒上有使湿润的淀粉-KI试纸变蓝的气体生成。
分析整理作出判断,红色物质为铜,黄绿色的气体为氯气。
回答:通电前溶液力及口头表达能力。
调动学生思维,分层次思考,有利于激发学习兴趣。
分析方法在教学中潜移默化的渗透。
实现感性认识到理性认识的过程。
么?【讲解】电解CuC12溶液的原理可表示为:阳极:2C1- -2e- == C12↑(氧化反应)阴极:Cu2+ + 2e- == Cu (还原反应)总反应:CuC12 Cu + C12↑【概括】通俗记法,利用谐音。
阳(极)--氧(化反应)【思考与交流】1、如何判断电解池的阴阳极?2、在CuCI2溶液中有自由移动的Cu2+、CI-、H+、OH-,为什么只有Cu2+、CI-得失电子,而H+、却不能在两极上得失电子呢?二、离子放电顺序【讲解】阳离子得到电子或阴离子失去电子的过中Cu2+、CI-、H+、OH-自由移动讨论分析,回答:通电后带正电的Cu2+、H+向阴极移动;带负电的CI-、OH-向阳极移动。
Cu2+在阴极得电子变成了单质Cu,CI-在阳极失电子变成了CI2。
回答阳极产物—氯气(CI2)阴极产物—铜(Cu)加深记忆,培养兴趣。
调动学生处于积极思考状态,培养思维能力。
培养阅读能力及自学能力、分析问题的能力。
创设问题情境激发学生求知欲望,培养自学能力。
[讲]电解饱和食盐水以制备烧碱、氢气和氯气,电解饱和食盐水的工业生产叫氯碱工业。
[板书]1、电解饱和食盐水制烧碱、氢气和氯气[投影]实验装置及原理按上图装置,在U形管里倒入饱和食盐水,插入一根石墨棒做阳极,一根铁棒做阴极。
高中化学第四章电化学基础31电解原理课件新人教版选修4

程
式:
2CuSO4+
电解 2H2O=====
2Cu
+
O2↑
+
2H2SO4
2021/4/17
高中化学第四章电化学基础31电解原
29
理课件新人教版选修4
3.电解后溶液的变化及恢复原组成的措施
2021/4/17
高中化学第四章电化学基础31电解原
30
理课件新人教版选修4
2021/4/17
高中化学第四章电化学基础31电解原
高中化学第四章电化学基础31电解原
16
理课件新人教版选修4
休息时间到啦
同学们,下课休息十分钟。现在是休息时间,你们休息一下眼睛, 看看远处,要保护好眼睛哦~站起来动一动,久坐对身体不好哦~
2021/4/17
高中化学第四章电化学基础31电解原
17
理课件新人教版选修4
2.用铁电极电解氯化钠溶液,在阳极产生的是黄绿色气体 吗?
(4)电解后溶液 pH 的变化规律 ①电极区域:a.阴极 H+放电产生 H2,阴极区 pH 变大;b. 阳极 OH-放电产生 O2,阳极区 pH 变小。
2021/4/17
高中化学第四章电化学基础31电解原
33
理课件新人教版选修4
②电解质溶液:a.电解过程中,既产生 H2,又产生 O2,实 质是电解水,溶液浓度增大,因而原溶液呈酸性的 pH 变小,原 溶液呈碱性的 pH 变大,原溶液呈中性的 pH 不变。b.电解过程 中,无 H2 和 O2 产生,pH 几乎不变。③电解过程中,只产生 H2,溶液中 OH-浓度增大,pH 变大。④电解过程中,只产生 O2,溶液中 H+浓度增大,pH 变小。
2021/4/17
高中化学第四章电化学基础31电解原
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课后提升作业二十一电解原理(45分钟100分)一、选择题(本题包括8小题,每小题6分,共48分)1.(2016·济宁高二检测)下列说法不正确的是( )A.不能自发进行的氧化还原反应一般可以通过电解实现B.电解质溶液导电是化学变化,金属导电是物理变化C.电解池和原电池中均发生氧化还原反应D.电解、电离、原电池均需要通电【解析】选D。
电离不需要通电,而是在溶于水或熔化状态下发生的。
2.(2016·广州高二检测)现用Pt电极电解1 L浓度均为0.1 mol·L-1的HCl、CuSO4的混合溶液,装置如图,下列说法正确的是( )A.电解开始时阴极有H2放出B.电解开始时阳极上发生:Cu2++2e-CuC.当电路中通过电子的量超过0.1 mol时,此时阴极放电的离子发生了变化D.整个电解过程中,S不参与电极反应【解析】选D。
依据放电顺序阴极先放电的是Cu2+,故阴极开始析出的是Cu,阳极先放电的是Cl-,故阳极开始产生的是Cl2。
故A、B错;由阴极反应Cu2++2e- Cu,n(Cu2+)=0.1 mol,当电路中通过电子的量达到0.2 mol时,此时Cu2+消耗完毕,阴极放电离子变为H+,所以C错;阳极先是Cl-放电,当Cl-消耗完毕,此时H2O电离产生的OH-开始在阳极放电,S不参与电极反应。
3.(2016·淄博高二检测)用惰性电极电解某溶液时,发现两极只有H2和O2生成,则电解一段时间后,下列有关该溶液(与电解前同温度)的说法中正确的有( ) ①该溶液的pH可能增大;②该溶液的pH可能减小;③该溶液的pH可能不变;④该溶液的浓度可能增大;⑤该溶液的浓度可能不变;⑥该溶液的浓度可能减小A.仅①②③B.仅①②③④C.仅①②③④⑤D.全部【解析】选C。
用惰性电极电解时,两极只有H2和O2,则实质上电解的是水,电解质不参与反应。
该电解质有3种可能,如电解硫酸溶液时,水被电解,硫酸浓度变大,pH减小;电解NaOH 溶液时,水被电解,NaOH浓度变大,pH增大;电解Na2SO4溶液时,水被电解,Na2SO4浓度变大,pH 不变,但若NaOH溶液、Na2SO4溶液是饱和溶液则浓度不变,故①、②、③、④、⑤正确,⑥不可能。
4.(2016·徐州高二检测)用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。
欲使溶液恢复到起始状态,可向溶液中加入( )A.0.1 mol CuOB.0.1 mol CuCO3C.0.1 mol Cu(OH)2D.0.05 mol Cu2(OH)2CO3【解析】选D。
根据图象和电解原理,O~P段电解反应的化学方程式为:2CuSO4+2H2O2Cu+O2↑+2H2SO4,P~Q段电解反应的化学方程式为:2H2O2H2↑+O2↑,所以溶液中应加入CuO:=0.1 mol,H2O:=0.05 mol,分析四个选项,加入0.05 mol Cu2(OH)2CO3合适。
5.(2016·衡水高二检测)将H2S通入FeCl3溶液中,过滤后将反应液加入电解槽中电解(如图所示),电解后的溶液还可以循环利用。
该方法可用于处理石油炼制过程中产生的H2S废气。
下列有关说法正确的是( )A.过滤得到的沉淀可能是FeS和SB.若有0.20 mol的电子转移,一定能得到2.24 L的氢气C.可以用Fe与外接电源的a极相连D.与a极相连的电极反应为Fe2+-e-Fe3+【解析】选D。
H2S与FeCl3反应生成S、盐酸和氯化亚铁,A错误;没有给出氢气所处的条件,不能求氢气的体积,B错误;根据右边生成氢气知b是负极,a是正极,若此时铁是阳极,则被溶解,C错误,D正确。
6.(2016·大连高二检测)如图甲是CO2电催化还原为碳氢化合物的工作原理示意图,用一种钾盐水溶液作电解液;图乙是用H2还原CO2制备甲醇的工作原理示意图,硫酸为电解质溶液。
下列说法不正确的是( )A.甲中铜片作阴极,K+向铜片电极移动B.乙中正极发生的电极反应为CO2+6e-+6H+CH3OH+H2OC.乙中H2SO4可以增强溶液的导电性D.甲中若C x H y为C2H4,则生成1 mol C2H4的同时生成2 mol O2【解析】选D。
根据图甲电子的移动方向知铜片作阴极,K+向铜片电极移动,故A正确;根据图乙通CO2一极的产物判断,通CO2的一极为正极,电极反应为CO2+6e-+6H+CH3OH+H2O,故B正确;由于图乙中的质子膜只允许H+通过,所以H2SO4可增强溶液的导电性,故C正确;甲中若C x H y为C2H4,则铜片上的电极反应为:2CO2+12e-+12H+C2H4+4H2O,根据得失电子守恒,铂片生成O2:=3 mol,故D错误。
7.(2016·衡水高二检测)把物质的量均为0.1 mol的CuCl2和H2SO4溶于水制成100 mL的混合溶液,用石墨作电极电解混合溶液,并收集两电极所产生的气体,通电一段时间后在两极收集到的气体在相同条件下体积相同,则下列叙述正确的是( )A.电路中共转移0.6N A个电子B.阳极得到的气体中O2的物质的量为0.2 molC.阳极质量增加3.2 gD.电解后剩余溶液中硫酸的浓度为1 mol·L-1【解析】选A。
根据两极均产生气体知,阴极电极反应有:Cu2++2e-Cu和2H++2e-H2↑,阳极电极反应有:2Cl--2e-Cl2↑和4OH--4e-O2↑+2H2O,设阴极生成xmol H2,结合n(CuCl2)=0.1 mol和电子守恒得:x=0.1+,解得x=0.2。
电路中共转移电子:(0.1×2+0.2×2)mol=0.6 mol,A正确;阳极得到的气体中含O2:=0.1 mol,B错误;阳极的质量不变,C 错误;电解后溶质和水均减少,且水的减少量较多,故c(H2SO4)>1 mol·L-1,D错误。
8.(2016·北京高考)用石墨电极完成下列电解实验。
下列对实验现象的解释或推测不合理的是( )A.a、d处:2H2O+2e-H2↑+2OH-B.b处:2Cl--2e-Cl2↑C.c处发生了反应:Fe-2e-Fe2+D.根据实验一的原理,实验二中m处能析出铜【解题指南】解答本题时应明确以下两点:(1)由实验一的现象,推理可知a、b、c、d分别为阴极、阳极、阳极、阴极。
(2)利用实验一的原理,分析出实验二中的m、n极都为阴极。
【解析】选B。
a、d处试纸变蓝,说明溶液显碱性,是溶液中的氢离子得到电子生成氢气,氢氧根离子剩余造成的,故A正确;b处变红,局部褪色,说明是溶液中的氢氧根和氯离子同时放电,分别产生氧气和氯气,氢离子浓度增大,酸性增强,氯气与水反应生成的次氯酸具有漂白性,故B错误;c处为阳极,铁失去电子生成亚铁离子,故C正确;实验一中a、c形成电解池,d、b形成电解池,所以实验二中相当于形成三个电解池(一个球两面为不同的两极),m为电解池的阴极,另一球朝m的一面为阳极(n的背面),相当于电镀,即m上有铜析出,故D项正确。
二、非选择题(本题包括3小题,共52分)9.(16分)用石墨棒作电极,在Na+、Cu2+、Cl-、S中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:(1)当阴极放出H2,阳极放出O2时,电解质是_____________________________。
(2)当阴极析出金属,阳极放出O2时,电解质是___________________________。
(3)当阴极放出H2,阳极放出Cl2时,电解质是___________________________。
(4)通过电子的物质的量与阴极析出的金属的物质的量、阳极放出的气体的物质的量之比为4∶2∶1时,电解质是_______________________________。
【解析】(1)当阴极放出H2,阳极放出O2时,则电解时放电离子分别为H+、OH-,实际被电解的物质为H2O,电解质为活泼金属含氧酸盐Na2SO4。
(2)当阴极析出金属,阳极放出O2时,电解时放电离子为金属离子、OH-,实际被电解的物质为H2O和电解质,应为CuSO4。
(3)当阴极放出H2,阳极放出Cl2时,放电离子为H+、Cl-,则电解质应为NaCl。
(4)由题所给离子及离子的放电顺序可知,阴极析出的金属为Cu,阳极放出的气体为O2,其电极反应为阴极2Cu2++4e-2Cu,阳极4OH--4e-2H2O+O2↑,此时电极产物的物质的量之比为2∶1,符合题意,电解质为CuSO4。
答案:(1)Na2SO4(2)CuSO4(3)NaCl (4)CuSO4【延伸探究】(1)四种溶液的pH分别如何变化?提示:分别是不变、变小、变大、变小。
(2)若两极产物的物质的量之比为1∶1,应是哪种电解质溶液?提示:应是CuCl2溶液。
10.(18分)(2016·日照高二检测)如图,p、q为直流电源两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡。
试回答:(1)p为________极,A极发生了________反应。
(2)C试管里收集到的气体是____________,电极方程式是______________。
(3)在电解过程中,测得的C、D两极上产生的气体的实验数据如下:仔细分析以上实验数据,请说出可能的原因: __________________________。
(4)当反应进行一段时间后,A、B电极附近溶液的pH______(填“增大”“减小”或“不变”)。
(5)当电路中通过0.004 mol电子时,B电极上沉积金属X为0.128 g,则此金属的摩尔质量为________。
【解析】根据金属X沉积于B极知,B为阴极,则:A为阳极、C为阳极、D为阴极,p为正极,q 为负极;A极为阳极,故发生的反应为金属X失电子被氧化;由上面的分析知,C为阳极,其电极反应式为:4OH--4e-O2↑+2H2O;1~4 min C、D两极产生的气体体积比小于1∶2,4~10 min 产生的气体体积之比等于1∶2,说明氧气在硫酸溶液中的溶解度比氢气大;n(X2+)==0.002 mol,所以此金属的摩尔质量==64 g·mol-1。
答案:(1)正氧化(2)氧气4OH--4e-O2↑+2H2O(3)1~4 min C、D两极产生气体体积之比小于1∶2,4~10 min产生的气体体积之比等于1∶2,说明氧气在硫酸溶液中的溶解度比氢气大(4)不变(5)64 g·mol-111.(18分)(能力挑战题)(2016·长沙高二检测)甲醇是一种重要的化工原料和新型燃料。
