武汉大学物理化学PPT习题整理简洁版资料
物理化学课件

(2)对状态性质的影响:
仅当系统处于平衡状态时,各种状态性质才有唯一的值。
(3) 系统处于平衡状态应满足的条件:
① 热平衡。系统内部各处温度均相等。
② 力平衡。系统内部各处力均相等。
③ 相平衡。无论系统内部有几个相,要求各相组成均 匀,即各相内部不存在扩散现象。 ④ 化学平衡。系统内部没有化学变化发生,组成不随 时间变化。
4、过程与途径
(1)过程:
系统由一个状态向另一个状态转化的经过。 唯一性
(2)途径:
实现某一过程的具体转化步骤(方式)。 可变性
例1 (状态一)
1mol O2 25℃,5atm 1mol O2 100℃,1atm
(状态二) 1mol O2 100℃,5atm
1mol O2 25℃,1atm
例2
青岛
7、内能 (热力学能)
(1)能量:
① 定义:对系统运动所做的最一般的量度。 (物质所具有的能量是指物质中各种运动的总度量。)
② 特点:能量是物质运动状态的单值函数。
(状态一定,能量一定;状态改变,能量改变。) ③ 分类:整体系统的平动能;系统在外场中的位能;
系统内部的能量。
(2)内能:
① 定义:系统由其内部状态所决定的能量,即系统内所 有离子除整体势能及整体动能外的全部能量的总和。 (包括动能、位能等)
3、焦耳实验:
P20
图1.7
结论:理想气体单纯 PVT 变化,U= ƒ ( T )。
§1.3 定容热、定压热及焓
1、定容热 QV
(1)定义:系统进行定容且不做非体积功的过程中与环
物理化学课件及考试习题 试卷 答案第四次习题课(第九章化学动力学基础)

t=1/k(a-b) ㏑[b(a-x)/a(b-x)] 将k=39.1,a=0.005,b=0.004,x=0.004×0.9代入
可得t=26.3min
9
2.乙烯转化反应C2H4 C2H2+H2为一级反应。在1073K 时,要使50%的乙烯分解,需要10小时,已知该反应的活化能 E=250.6kJ· mol-1。要求在1.136×10-3小时内同样有50%乙烯转 化,反应温度应控制在多少? 解:对一级反应,在不同温度下有相同的转化率 因 k=(1/t) ㏑(c0/c) ㏑(c0/c)=k1t1 ∵(c0/c)T1=(c0/c)T2 ∴k1t1=k2t2 ㏑(k2/k1)= ㏑(t1/t2)=E(T2-T1)/RT2T1 ㏑(10/1.136×10-3)=250.6×103× (T2-1073)/8.314×1073×T2 解出T2=1527K
与阿伦尼乌斯方程
ln k C(常数)
进行对比有:
Ea RT
Ea 2.303 3163 8.314 =60.6kJ· mol-1
2
2. 某化合物的分解反应是一级反应,设反应的活化能 Ea=14.43×104J· mol-1,已知557K时该反应的速率常数 k=3.3×10-2 s-1,现要控制反应在10min内转化率达到90%,则 应控制该反应的温度为多少? 答:一级反应的动力学方程为
物理化学 第四次习题课 (化学动力学基础)
一、简答题 二、计算题 三、综合题
2011-05-18
1
一、简答题
1、硝酸异丙烷在水溶液中被碱中和,其反应 速率常数可表示为lgk=11.899-3163/T,该反应的 表观活化能为多少? 答:上式可写成:
2.303 3163 ln k 2.303 11.899 T
物理化学简明教程第四版

(2) H2(g)I2(g)2HI(gK)f,2 (Kf,1)2
例如,求 C (s ) 1 2 O 2 (g ) C O (g )的平衡常数
( 1 ) C ( s ) O 2 ( g ) C O 2 ( g )
rG m ( 1 )
只是T的函数,无量纲
Kp
PB B
B
只是T的函数,单位Pa△υ
Kx
xB B
B
是T和P的函数,无量纲
K K pP K xpp
§4.3 平衡常数的各种表示法
非理想气体反响
K
B
fB P
B
BB RlTnfB P
只是T的函数,无量纲
Kf
fB B
B
只是T的函数,单位Pa△υ
RT(1)ln(1) ln G
0
B
eq
GGniG x
GG
G会在某ζ值时出现极小值,相应的ζ就是反响的 极限进度ζeq, ζeq越大,平衡产物越多, ζeq越小, 平衡产物越少。在一定温度和压力条件下,总吉布斯 函数最低的状态就是反响系统的平衡态。
§4.1 化学反响的方向和限度
3. 化学反响的平衡常数和等温方程
rGm BfGm 'B
3. 反应的 rGm 和 K 的求算
rG m 的几种计算方法
〔1〕热化学的方法 rG m rH mT rSm 利用热力学数据表或测定反响热效应,先
计算反响的焓变和熵变
(2)用易于测定的平衡常数,计算 rGm
再利用Hess定律计算所需的 rGm
rGm RT l nK
不能向右进展,必须使下式成立
物理化学课件及考试习题 试卷 答案第二次习题课(多组分系统热力学、化学平衡、相平衡)

P229习题6-2 甲苯(A)苯(B)两液体形成理想液态混合物。已知 甲苯、苯在90℃下纯液体的饱和蒸汽压分别为54.22kPa和136.12KPa。将 200g甲苯和200g苯的液态混合物在90℃下逐渐降低压力,问: (1)压力降到多少时,开始产生气相,此气相的组成如何? (2)压力降到多少时,液相开始消失,最后一滴液相的组成如何? (3)压力为92.00 kPa时,系统内气液两相平衡,两相的组成如何? 两相的物质的量为多少?
即(∂G /∂ξ)T,P等于零,反应达到平衡。
6. 为什么反应平衡体系中充入惰性气体与
减低体系的压力等效? 答:在平衡体系中一旦充入惰性气体,则 必然减低反应体系各组分的分压力。于是也减 低了反应体系的总压(各组分分压之和)。因 此与减低体系的压力对平衡的影响等效。
7. 有水气变成液态水,是否一定要经过两相平衡态,是否还有其它途径。 答:从水的相图可知,将水汽升温超过647.2K后,在加压超过2.2×107Pa, 然后再降温降压,可不经过两相平衡态将水汽转变成液态水。
解:该二元液系在90℃时的 P-x平衡图如右所示。 根据题给条件可得物系点组成为x (本)=0.54。 (1)当压力降到98kPa时,开始 产生气相,如图所示,此时气相组成 为y(本)=0.75; (2)从相图可知,当压力降到 80kPa时,液相开始消失,最后一滴 液相的组成为x(本)=0.3; (3)当压力为92kPa时,气液两 相平衡,相点、物系点的组成如图所 示,根据杠杆规则,可求出n(l)=3mol, n(g)=1.7mol。
物理化学 第二次习题课
(多组分系统热力学、化学平衡、相平衡)
一、简答题 二、计算题 三、相图分析
一、简答题 1.为什么稀溶液的沸点升高、冰点下降、 渗透压以及溶剂蒸汽压下降称为依数性。引 起依数性的最基本原因是什么? 答:上述四种性质的数值只与溶于溶剂 中溶质的粒子数有关与不同溶质本身的性质 无关,故成为依数性。依数性的主要原由是 由于溶质的溶入而引起容剂化学势的降低。
物理化学(武汉大学) 第一第二定律
∵U=QV ∵H=Qp
热力学第二定律
小 球
热能
在连续的弹跳过程中, 小球的重力势能转变为动能, 并不断地 经碰撞转化为热能而传递给地面和小球本身. 最后,小球完全 失去势能, 静止地停留在地面上, 其机械能完全转变为热能. 此过程是不可逆转的, 或者所逆转的几率几乎为零.
状态函数口诀: 殊途同归,值变相等; 周而复始,值变为零。
A
Ⅰ
Ⅱ
B
V
如图:体系分别沿途径1和途径2 从始态A到达末态B,体系的任 一状态函数Z,有: Z1=Z2=ZB-ZA
1 mol单原子分子理想气体经历如下途径从300 K ,10po膨胀至300 K , 1po,求各途径的Q,W, U, H, S (1)恒温可逆膨胀; (2)等温反抗 恒外压1po膨胀;(3)向真空膨胀。 始态 末态
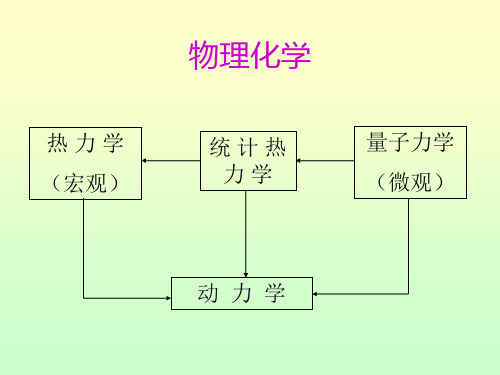
2. 不关心粒子的微观行为,只关心他们表现出来的宏观 统计平均行为
基本概念
1. 体系( system): 被研究的对象 环境(surrouding): 与体系相关联的事物
严格地说: 体系 + 环境 = 宇宙 实际处理:
与体系相互作用的部分称为环境。
3
如图:体系和环境可划分为:
(1)体系:电源+容器+加热器+水 环境: 其它
常见过程
(1)恒温过程: T始=………=T终=T环境 (dT=0) 等温过程: T始=T终=T环境 (2)恒压过程: p始=………=p终=p环境 (dp=0)
等压过程: p始=p终=p环境
恒外压过程: p外不变 (3)恒容过程:dV=0 (4)绝热过程:Q=0
W=-dU
W=-U
(5) 可逆过程(reversible process): 体系从A态经历某一过程到达B态,若能使体系状态完全还原的 同时,环境的状态也完全还原,则体系从A到B所经历的过程为 可逆过程. 可逆过程的特点: 1 可逆过程的进程是由无数个无限小的过程所组成,体系 在整个可逆过程中,始终无限接近平衡态; 2 可逆过程进行无限缓慢; 3 可逆过程效率最高
武大物理化学练习题

武⼤物理化学练习题⼀、(45分)填空及单项选择1.18℃时在厚度为1 cm的惰性多孔板两边,放置扩散系数为1.19×10-9 m2 ★ s-1的NaCl稀⽔溶液,⼀边浓度为0.4 mol★dm-3,另⼀边为0.2 mol★dm-3。
两边溶液量很⼤,且⼀直在搅拌。
则溶质NaCl的物质通量为 NaCl的浓度在板内的分布为2.反应A─→2B在温度T时的速率⽅程为 d[B]/d t=k B[A],则此反应的半衰期为:( )(A) ln 2/k B(B) 2ln 2/k B (C) k B ln2 (D) 2k B ln23.True or false(a)Elementary reactions with molecularity greater than 3 generally don't occur;(b)Knowledge of the rate law of a reaction allows us decide unambiguously what the mechanismis;(c)Activation energies are never negative;(d)For an elementary reaction, the partial orders are determined by the reaction stoichiometry;4. 简单碰撞理论属基元反应速率理论,以下说法不正确的是:( )(A) 反应物分⼦是⽆相互作⽤的刚性硬球(B) 反应速率与分⼦的有效碰撞频率成正⽐(C) 从理论上完全解决了速率常数的计算问题(D) 反应的判据之⼀是联线上的相对平动能⼤于某临界值5. 反应 A + B AB AB + C D (决速步) 其表观活化能与基元反应活化能的关系为 ________________ ,因为 ___________ 。
6. 在300 K时, 鲜⽜奶5 h后即变酸, 但在275 K的冰箱⾥,可保存50 h, ⽜奶变酸反应的活化能是______________________________________。
物理化学热力学部分习题及解答.ppt

将373K 及50663Pa 的水蒸气100dm3 恒温可逆 作业 101325Pa 下部分 压缩到101325Pa,再继续在 液化到体积为10dm3 为止(此时气液平衡共存 )。试计算此过程的Q、W、ΔU 和ΔH。假定 凝结水的体积可忽略不计,水蒸气可视作理想 气体。已知水的气化热为2259kJ· Kg-1。 甲苯正常沸点(383K)下气化热为3619J•g-1, 现将1mol 甲苯在383K 等温等压完全气化,求 该过程Q,W;并求甲苯的△Um,△Hm, △Sm,△Am,△Gm。若甲苯向真空气化(终 态同上),上述各量又是什么?(甲苯的分子 量为92)
选择题
2.“压强”,即物理化学中通常称为“压力”的物理量,其 量纲应该是什么? (A)动量/(面积·时间) (B)力/(面积·时间) (C)动能/(面积·时间) (D)加速度/(面积·时间) 3.对于理想气体的内能有下述四种理解,其中正确的是? (A)状态一定,内能也一定; (B)对应于某一状态的内能是可以直接测定的; (C)对应于某一状态,内能只有一个数值,不可能有两个或 两个以上的数值; (D)状态改变时,内能一定跟着改变。
材料物理化学
——热力学部分习题及解答 武汉科技大学材控系
熊九郎
2009年9月
选择题
1.下列陈述中,正确的是:
(A)虽然Q和W是过是状态函数,所以QV和Qp是状态函 数。 (B)热量是由于温度差而传递的能量,它总是倾向 于从含热量较多的高温物体流向含热量较少的低温 物体。 (C)封闭系统与环境之间交换能量的形式非功即热 。 (D)两物体之间只有存在温差,才可传递能量,反 过来系统与环境间发生热量传递后,必然要引起系 统温度变化。
选择题
6.理想气体绝热向真空膨胀,则 (A)ΔS=0,W=0 (B) ΔH=0, ΔU=0 (C)ΔG=0,ΔH=0 (D) ΔU=0, ΔG=0 7.求任一不可逆绝热过程的熵变,可以通过 以下哪个途径求得? (A)始终态相同的可逆绝热过程, (B)始终态相同的可逆等温过程, (C)始终态相同的可逆非绝热过程, (D) (B)和(C)均可
物理化学知识点及练习题(含答案)

第二章 热力学第一定律内容摘要⏹热力学第一定律表述⏹热力学第一定律在简单变化中的应用 ⏹热力学第一定律在相变化中的应用 ⏹热力学第一定律在化学变化中的应用 一、热力学第一定律表述U Q W ∆=+ dU Q W δδ=+适用条件:封闭系统的任何热力学过程 说明:1、amb W p dV W '=-+⎰2、U 是状态函数,是广度量W 、Q 是途径函数 二、热力学第一定律在简单变化中的应用----常用公式及基础公式2、基础公式热容 C p .m =a+bT+cT 2 (附录八) ● 液固系统----Cp.m=Cv.m ● 理想气体----Cp.m-Cv.m=R ● 单原子: Cp.m=5R/2 ● 双原子: Cp.m=7R/2● Cp.m / Cv.m=γ理想气体• 状态方程 pV=nRT• 过程方程 恒温:1122p V p V = • 恒压: 1122//V T V T = • 恒容: 1122/ / p T p T =• 绝热可逆: 1122 p V p V γγ= 111122 T p T p γγγγ--=111122 TV T V γγ--= 三、热力学第一定律在相变化中的应用----可逆相变化与不可逆相变化过程1、 可逆相变化 Q p =n Δ相变H m W = -p ΔV无气体存在: W = 0有气体相,只需考虑气体,且视为理想气体ΔU = n Δ相变H m - p ΔV2、相变焓基础数据及相互关系 Δ冷凝H m (T) = -Δ蒸发H m (T)Δ凝固H m (T) = -Δ熔化H m (T) Δ凝华H m (T) = -Δ升华H m (T)(有关手册提供的通常为可逆相变焓)3、不可逆相变化 Δ相变H m (T 2) = Δ相变H m (T 1) +∫Σ(νB C p.m )dT 解题要点: 1.判断过程是否可逆;2.过程设计,必须包含能获得摩尔相变焓的可逆相变化步骤;3.除可逆相变化,其余步骤均为简单变化计算.4.逐步计算后加和。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
U3
T2 T1
nCV
dT
1 25.25(406 373)
833.3J
H3
T2 T1
nC
p
dT
133.56(406 373) 1107.5J
• 4)物理变化
U4 0, H4 0
U U1 U2 U3 U4 5648.3 37494833.3 0 43975.6J
H H1 H2 H3 H4
II
解:途径I,Q = -100 J,W = +50 J
(1) ΔUA-B = Q + W = -100 + 50 = -50 J
A
I
B
∴Q = ΔUA-B-W = -50-(-80) = 30 J
(2) ΔUB-A = -ΔUA-B = 50 J
III
∴Q = ΔUB-A –W = 50 – 50 = 0
• 解:此过程是等温等压下的可逆相变过程,且Wf=0 W= – p(Vg – Vl)≈ – pVg = – nRT= – 172.2 kJ • 此过程等压且不做有用功 H=Qp= 2257 kJ U=Qp + W = 2257 –172.2 =2085 kJ
• 例:将常压下25 ℃、1 mol水,制成3 atm的饱和蒸汽,
U U1 U2 U3 U4 H H1 H2 H3 H4
•
1)物理变化
U
T2 T1
nCV
dT;
H
T2 T1
nCpdT
对液体有 CV Cp,Cp (H2O,l) 75.31J mol K1
U1 H1
T2 T1
nCpdT
175.31(373 298) 5648.3J
• 2)相变化
H2 摩尔气化热 40595 J U2 H2 pV H2 RT
405958.314373 37494J
• 3)物理变化:3 atm下水蒸气的终态温度T2=406 K。
Cp (H2O, g) 33.56J mol K1
CV Cp R 33.56 8.314 25.25J mol K1
• 例:在300K下,分别经历下列恒定外压途径将1mol理想气体从
5atm膨胀到1atm。 A:外压为1atm;B:外压为0.5atm。 求不同途径的功?
• 解:A:W1= -∫p外dV =-101325(V2 - V1)
=-RT(1 - 0.2)=-0.8RT=-1995.4 J
B:W2 = - ∫p外dV= -50662.5(V2 - V1)
计算此过程的 U及H 。蒸汽视为理想气体。
初态 1 mol水1 atm,298K
恒压升温
U, H
1 mol水1 atm,373K
平衡相变化 恒压升温
1 mol水气1 atm,373K
终态 1 mol水汽3 atm,T2
恒温升压
1 mol水气1 atm,T2
• 状态函数的特点:变化只决定于过程的始终态,而与过 程的变化途径无关。
(3) C2H6(g, 1p)+3.5O2(g, 1p) → CO2(g, 1p) +3H2O(l)
rH3= – 1560.0 kJ.mol-1
• 解: 题给反应可以由已知条件中所列的三个反应组合得到, 反应 的总热效应便可由此三个反应的热效应求出。
• 将(1)×2+(2)×3-(3)即得题给的反应,故有: rH=rH1×2+ rH2×3- rH3 =2×(-393.15) + 3×(-286)-(-1560) =-85 kJ.mol-1
5648.3 405951107.5 0 47350.8J
例:1 mol单原子分子理想气体,从298 K,2 p经(1)等温可
逆和(2)绝热可逆膨胀至体积加倍, 求各过程的Q,W,U和 H?
解: (1) 理想气体等温过程 NhomakorabeaU = 0; H = 0
Q = -W = nRTln(V2/V1) = 1717.3 J (2) 绝热过程: Q=0 =5/3 有绝热过程方程式:
• 例:1 kg的液态水在373.15 K,101325 kPa外压下蒸发为水蒸气,
计算该过程的W、Q、 U 、H。
1 kg H2O (l) 101.325 kPa 373.15 K
p外=101.325 kPa T=373.15 K
1 kg H2O (g) 101.325 kPa 373.15 K
• 常用的热量单位是卡(cal):
一克纯水从14.5 0C升至15.5 0C所需的热量
• 热力学所采用的热功当量为: 1 cal = 4.184 J
• 例:一体系由A态变化到B态,沿途径Ⅰ放热100 J,对体系做功
50 J,问:1、由A态沿途径Ⅱ到B态,体系做功80 J,则过程Q值为 多少?2、如果体系再由B态沿途径Ⅲ回到A态,得到50 J的功,体 系是吸热还是放热,Q值是多少?
C(石墨,1p) +O2 (g,1p) (298.15K, 1p)CO2(g,1p) rHm(298.15K)= –393.5 kJ.mol-1
焓的变化
反应物和生成物都处于标准态
r Hm (T )
任意温度T, 标准压力p 反应温度
反应(reaction)
反应进度为1 mol
• 用盖斯定律可以求算许多难以直接测定的化学反 应的热效应。
= - 0.4RT = -997.7 J
• 此题的结果说明虽然体系的始末态相同,但途径不同, 过程的功不同,故功为过程量。
• 1840年,英国科学家Joule做了一系列实验,证明了热量 就是能量。并从实验数据得出了热功当量:Joule发现把 一磅水提高一华氏度,需消耗772 英尺·磅的机械能,相当 于1 cal = 4.157 J。
• 例:求下列化学反应的热效应,即反应的rH?
2C(石墨)+3H2(g, 1p) 298K
C2H6(g, 1p)
已知如下反应在298 K下的热效应:
(1) C(石墨)+O2(g, 1p) →CO2(g, 1p) rH1= – 393.15 kJ.mol-1
(2) H2(g, 1p)+0.5O2(g, 1p) →H2O(l) rH2= – 286.0 kJ.mol-1
p1V1 = p2V2 V2=24.452 dm3
p1=2p
V1=12.226 dm3
p2=p1V1/V2=0.63 p T2=p2V2/nR=187.7 K
U=CV(T2-T1)=3/2R(187.7-298)=-1375 J
W=U=-1375 J
H=Cp(T2-T1)=-2292 J
• 例:石墨与氧反应生成二氧化碳的热化学方程式为:
