(整理)3卤素的氧化物、含氧酸及其盐.
第十四章卤素

14-3-1 卤化氢和氢氟酸
3、非金属卤化物的水解:此法适用于HBr和HI 的制备,以水滴到非金属卤化物上,卤化氢即源 源不断地发生:
14-3 氟氯溴碘的化合物
14-3-1 卤化氢和氢氟酸 一℃ /(kJ·mol-1)
键能/(kJ·mol-1)
/(kJ·mol-1)
分子偶极矩μ(10-30cm)
表观解离度 (0.1mol·L-1,18℃)/% 溶解度/g·(100gH2O)-1
HF -83.1 19.54 -271.1 568.6 30.31 6.40
1、氟化氢的氢键 氟化氢这些独特性质与其分子间存在氢键
形成缔合分子有关。实验证明,氟化氢在气态、
液态和固态时都有不同程度的缔合。在360K以 上它的蒸气密度相当于HF,在299K时相当于 (HF)2和(HF)3的混合物。在固态时,氟化氢由未 限长的锯齿形长链组成。
H
H
H
H
F
F
F
F
14-3-1 卤化氢和氢氟酸
14-3-2 卤化物 卤素互化物 多卤化物
阳极反应:2Cl- === Cl2 + 2e阴极反应:2H2O + 2e- === H2 + 2OH总的反应:2Cl- + 2H2O === 2OH- + H2 + Cl2
14-2-2 卤素的制备和用途
14-2-2 卤素的制备和用途
3-卤素-氧族元素-1
卤素的氧化物:几种酸酐Cl2O, ClO2, Cl2O7, I2O5 颜色、状态、气味、结构、性质、制备、应用 制备:2Cl2 + 2HgO(干燥) = HgCl2·HgO + Cl2O↑ 573K
亚氯酸HClO2:酸性、不稳定性、氧化性 3NaClO2 = 2NaClO3 + NaCl 卤酸HXO3: 酸性、不稳定性、氧化性 HClO3----HBrO3----HIO3 酸性递减、稳定性增强 I2 + 10HNO3 2HIO3 + 10NO2 + 4H2O I- + 3Cl2 + 6OH- IO3- + 6Cl- + 3H2O 高卤酸HXO4: 酸性、氧化性 高碘酸能定量地氧化Mn2+为MnO4-: 2Mn2+ + 5H5IO6 = 2MnO4- + 5IO3- + 11H+ + 7H2O 2Mn2+ + 5IO4- + 3H2O = 2MnO4- + 5IO3- + 6H+ 拟卤素和拟卤化物
MnO BrO
4 4
(2)R—O键的强度 R—O键越强,需断裂的R—O键数目越多,则酸愈稳定,氧化性愈弱 R—O键的强度与R的电子层结构、成键情况及H+的反极化作用有关 通常R—O键包括 键 d—p 键 3d < 4d < 5d
Cr2 O
2 7
SeO
2 4
(5)同一元素不同氧化态含氧酸中,低氧化态>高氧化态
4、从海水中提取溴时,海水的酸碱性必须控制在以下哪个范围( A )
5、下列物质中,还原能力最强的是( C ) A. NaCl B. NaBr C. NaI D. NaF
卤素的含氧酸及其盐

卤素的含氧酸及其盐Cl、Br、I具有不同价态的含氧酸。
X: 采取SP3杂化:O的2P电子与卤素3d空轨道间形成d-pπ键。
由于稳定性原因,只有常见的氯的含氧酸研究得多。
一、次卤酸1. 化学性质(1) 酸性因为随半径增大,分子中 H— O—X,X—O 结合力减小,X 对 H+斥力变小,导致酸性减小。
(2) 热稳定性HXO都不稳定,仅存在于水溶液中,从Cl到I稳定性减小,分解方式:脱水分解:由上式可知,ClO是HClO的酸酐。
BrO-室温下发生歧化分解,只有在273K2-盐。
可见XO-的歧时才有BrO- 存在, 323 ~ 353K时,BrO-完全转变成BrO3化速率与温度有关,温度升高,歧化速率增大。
IO-歧化速率更快,溶液中不存在次碘酸盐,HIO几乎不存在。
(3) 氧化性HXO不稳定,表明HXO的氧化性很强。
XO-盐比HXO酸稳定性高,所以经常用其盐在酸性介质中做氧化剂。
2.HXO的制备1)次氯酸酐Cl2O溶于水制得HClO步骤:将Cl2通到新制干燥的HgO表面,加热制得Cl2O从体系中除去HCl可使平衡右移,可采用下法。
在Cl2水中加入新生成的HgO或碳酸盐减压蒸馏得到HClO。
工业上采用电解冷的稀NaCl溶液的方法。
同时搅拌电解液,使产生的氯气与NaOH充分反应制得次氯酸钠减压蒸馏得HClO。
将阳极产生的Cl2通入阴极区NaOH中。
二、亚卤酸及其盐1.性质亚卤酸中仅存在HClO2,酸性大于HClO,Ka=5.0HClO2不稳定,ClO2-在溶液中较稳定,具有强氧化性,NaClO2盐较稳定,加热,撞击爆炸分解,在溶液中受热分解。
2. 制备方法1)过滤除去BaSO4可制得纯净HClO2,但HClO2不稳定,很快分解。
可见ClO2不是HClO2的酸酐,ClO2冷凝时为红色液体。
2) ClO2与碱作用可得到亚氯酸盐和氯酸盐。
首先制取ClO2,其方法用SO2还原NaClO33) Na2O2(H2O2)与ClO2作用制备纯NaClO2。
卤素的含氧化合物

实验室 2ClO3- +C2O42-+4H+=2ClO2↑+2CO2↑+2H2O 工业上2NaClO2+Cl2==2ClO2+2NaCl
卤素含氧酸及盐的性质
• 1. 热稳定性:一般 含氧酸<含氧酸盐 • 2. 含氧酸酸性 对于同一卤素的含氧酸, 随卤素氧化数的增加,卤素含氧酸的酸性 迅速增加 • HXO4 > HXO3 > HXO2 > HXO(X=Cl, Br, I) • • 对于同一氧化态的含氧酸, • 由于从Cl-I的原子半径增大,酸性减弱。 •
O || O=Cl—F = || O
同浓度卤酸的氧化性强弱关系比较
HBrO3、HClO3和HIO3 、 Br与Cl相比,外层 电子的 吸引电子的能力大于 电子的 ;Br与 与 相比 外层18电子的 吸引电子的能力大于8电子的 相比, 电子的Br吸引电子的能力大于 电子的Cl; 与 I的最外层都是 电子但 的半径 小于 ,所以 的得电子能力也大 的最外层都是18电子但 的半径r小于 的最外层都是 电子但Br的半径 小于I,所以Br的得电子能力也大 种卤酸氧化性顺序为: 于I。故3种卤酸氧化性顺序为:HBrO3>HClO3>HIO3 。 种卤酸氧化性顺序为
模板提供者
500,000 个可下载的 PowerPoint 模板、 动态剪贴画、背景和视频
谢谢观赏
制作者:华乐舟 赵志刚 万宣宣 谢 星星 杨祥龙 应化1101
WPS Office
Make Presentation much more fun
• 4.高氯酸(perchloric acid) • 化学式:HClO4 结构式: • 最强单一无机酸(Ka = 108 ) • 约为100% H2SO4的10倍
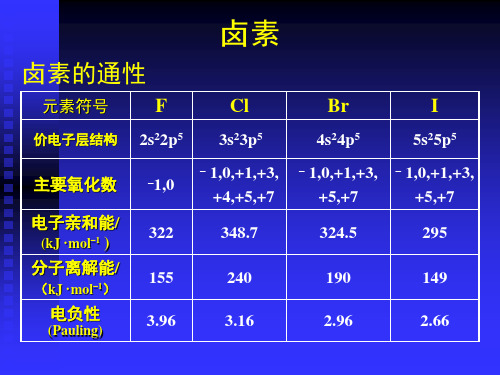
卤素
(b)
K2MnF6+2SbF5
423K
2KSbF5+MnF4
MnF3+1/2F2 ↑
2. 氯的制备:
工业上利用离子交换膜法电解NaCl水溶液生产Cl2
2Cl-(aq) 2H2O(l) + 2eCl2(g) + 2e2OH-(aq) + H2(g)
实验室用氧化剂MnO2、KMnO4
与浓盐酸反应制取Cl2 。
空气驱出的 Br2 被碳酸钠溶液吸收后歧 化生成溴化钠和溴酸钠,用 H2SO4 酸 化时发生反歧化反应重新生成 Br2:
3 Br2 + 3 Na2CO3 5 HBr + HBrO3 5 NaBr + NaBrO3 + 3 CO2 3 Br2 + 3 H2O
2Br-(aq) + Cl2(g) → Br2(l) + 2Cl-(aq)
ZrO2 (s) + 2 CCl4 (g)
高温
TiCl4(l) + 2 CO (g)
ZrCl4 (s) + 2 COCl2 (g)
● 以水合金属氯化物为起始物的脱水反应:
FeCl3· 6H2O + 6 SOCl2 (l)
FeCl3· 6H2O
△,干燥HCl气流
回流
FeCl3 (s) + 6 SO2 (g) + 12 HCl (g)
3 卤素单质的制备
卤素在自然界中主要以氧化数为-1的卤化物存在。因 此,制备卤素单质都是用氧化其相应卤化物的方法。
1. 氟的制备: 电解法
1886年 Moissan 采用溶有少量 KF 的HF 液体做 电解液,电解槽用 Pt-In 合金, U 形管中装有 NaF 吸收 HF: 阳极(无定型炭)
无机化学——卤素

4.成键特征
(1)单质 Px-Px (2)化合物
离子键 共价键(与非金属作用)PX3 NH3 配位键(在配合物中)FeF63(3)氯到碘有变价 +1 +3 +5 +7
在含氧化合物中 HClO4
在互化物中 IF3
二. 单质
1.物理性质: (1)决定因素:色散力 (2)颜色和状态:
氟(淡黄色气体) 氯(黄绿色气体) 溴(棕红色液体) 碘(紫黑色固体)(易升华) 原因是由于吸收光波长不同而产生不同颜色。
F2+Xe=XeF2(520K) F2+H2=2HF(低温和黑暗)
氯与大多数非金属化合,比较剧烈。 与磷硫碘氟氢等生成氯化物。 I2+3Cl2=2ICl3(光照) 溴和碘单质氧化能力较弱,反应活性不如氯, 需高温。 3Br2+2P=2PBr3(点燃,无色发烟液体) 3I2+2P=2PI3(红色固体)
(3)与水作用 i氧化水放出氧气:X2+H2O=2HX+1/2O2 ii歧化反应:在OH-易发生
Cl2+H2O=HCl+HClO Br2+H2O=HBr+HBrO I2+6OH- = 5I- +IO3- +3H2O
热或浓碱 3X2+6OH-=5X-+XO3-+3H2O(X=Cl Br I) F2与其它卤素不同:
2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O
☆结构:sp3杂化 V形
☆用途:制备次氯酸
(3) ClO2 ☆ 性质:黄绿色气体,冷却红色液体
mp bp低,顺磁性, 很高化学活性,强氧化剂漂白剂 ☆ 结构 思考:化学键是怎样形成的?
高一化学竞赛培训讲义2(主族元素)-3卤

OF2分子中, O原子采取sp3杂化方式,有两对孤电子对, 分子呈V形结构。
F
~100。 F
OO
90。
O
OO
90。
OO
F
F
F
F
OF2
O2F2
O4F2
制备: 2F2 + 2NaOH (2%)= 2NaF + H2O + OF2↑
溶解性:OF2溶于水可得到中性溶液,溶解在NaOH溶液中
得到F-和氧气,它不是酸酐。
分子间力 小
Cl2
Br2
I2
g
ls
大
***./℃ -188 -34.5 59 183 ***/℃ -220 -101 -7.3 113 颜色 浅黄 黄绿 红棕 紫
半径依次增大,分子量也增大,导致色散力也增大,所以分别以气 体—液体—固体状态存在。
显色原因:分子中π*和σ*反键轨道能差不同,吸收的可见光波长度不同。
还原能力为: I-> Br-> Cl-> F-
卤化氢的制备
(1) HF
CaF2 H2SO4(浓)CaSO 4 2HF 复分解反应
(2) HCl
Cl 2 H2 hv 2HCl 直接合成法(工业) NaCl H2SO 4 (浓) HCl NaHSO 4 复分解反应
2NaCl H2SO4 (浓) 500O C2HCl Na2SO4
海藻灰中提取碘 2NaI + 3H2SO4 + MnO2 = 2NaHSO4 + MnSO4 + 2H2O + I2
大量的碘还来源于自然界的碘酸钠 2IO3- +5HSO3- = 5SO42- + H2O + 3H+ + I2
元素化学02氯的氧化物和含氧酸及盐

元素化学02氯的氧化物和含氧酸及盐氯是一种常见的元素,具有丰富的化合态。
在化学反应中,氯常常会与氧化物、含氧酸和盐反应,形成不同的化合物。
氯的氧化物包括三种不同的氯氧化物,分别是亚氯酸盐(Cl2O)、次氯酸盐(ClO2)和高氯酸盐(ClO3)。
亚氯酸盐(Cl2O)是由氯和氧直接反应而成的氯氧化物。
它是无色气体,有刺激性气味。
亚氯酸盐与水反应生成亚氯酸(HClO)和次氯酸(HClO2):Cl2O+H2O→2HClO+HClO2次氯酸盐(ClO2)是一种黄色气体,具有强烈的漂白能力。
它与水反应生成次氯酸(HClO2)和酸性氯酸盐(HClO3):ClO2+H2O→HClO2+HClO3高氯酸盐(ClO3)是一种无色晶体,可溶于水。
它与水反应生成高氯酸(HClO3)和高氯酸盐酸(HClO4)。
氯的含氧酸包括次氯酸(HClO)、氯酸(HClO3)和高氯酸(HClO4)。
次氯酸(HClO),也被称为次氯酸,是一种弱酸。
它是一种无色液体,在水中呈弱酸性。
次氯酸具有很强的氧化性,可用作漂白剂、消毒剂和氯化剂。
氯酸(HClO3)是一种无色液体,在水中呈酸性。
氯酸可通过氯气与浓硝酸反应制备。
它是一种强氧化剂,在实验室中被用作制备其他化合物的中间体。
高氯酸(HClO4),也被称为高氯酸,是一种无色液体,在水中呈酸性。
它是一种强氧化剂,具有强烈的腐蚀性。
高氯酸广泛用于有机合成和分析化学中。
氯的盐包括氯化物和高氯酸盐。
氯化物是由氯和其他金属或非金属元素形成的盐类。
常见的氯化物包括氯化钠(NaCl)、氯化钾(KCl)、氯化铜(CuCl2)等。
氯化物具有广泛的应用,包括食盐、水处理和工业冶金等。
高氯酸盐是由高氯酸与其他金属或非金属元素形成的盐类。
高氯酸盐具有很强的氧化性,广泛应用于化学反应和实验室试剂中。
总之,氯的氧化物、含氧酸和盐具有丰富的化合态和多样的应用。
这些化合物在日常生活中具有广泛的用途,例如漂白剂、消毒剂、配制染料等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
卤素的氧化物、含氧酸及其盐(2010.3)王振山一、卤素的氧化物概述:卤素与电负性比它大的氧化合时,除氟外都能形成氧化数为正值的氧化物、含氧酸及其盐。
卤素的氧化物显著特点:大多数是不稳定的,受到撞击或光照即可发生爆炸性分解。
所以不能用直接法,只能用间接法制取。
稳定性:在已知的卤素氧化物中,碘的氧化物是最稳定的;碘氧化物>氯氧化物>溴氧化物;氯和溴的氧化物在高温下明显分解,溴的氧化物特别不稳定,低于室温也分解。
高价态的卤素氧化物比低价态的卤素氧化物稳定。
卤素氧化物中氯的较重要:Cl2O、Cl2O6 、Cl2O7、ClO2均为强氧化剂,不稳定易爆炸。
⑴、氧的氟化物:由于氟的电负性(3.98)大于氧的电负性(3.44),所以氟与氧生成的二元化合物是氧的氟化物(OF2),而不是氟的氧化物,而其它卤素与氧化合生成的二元化合物都是卤素的氧化物。
OF2的O原子sp3杂化。
⑵、二氟化氧(OF2)熔点49 K,沸点128 K,为无色气体,是比较稳定的氟氧二元化合物。
可由单质氟与2%氢氧化钠水溶液反应制备:2 F2(g)+ 2 NaOH-(aq) ═ OF2(g) + 2 NaF(aq) + H2O(l)OF2是一种强的氧化剂和氟化剂,但氟化能力弱于F2。
由于OF2中,氧为+2氧化数,所以它是比氧气更强的氧化剂它能与金属、硫、磷、卤素等剧烈反应生成氟化物和氧化物。
在OF2分子中,氧的氧化数是+2,氟的氧化数是-1,其构型为角型分子。
⑶、近年来由于合成技术的发展,已合成了一系列氟氧化合物,如O2F2、O3F2、O4F2、O5F2、O6F2等。
这些化合物都具有较低的熔点和沸点,并仅能在很低的温度下稳定存在,它们在很低的温度(低于83K)下都是比单质氟更加活泼的氟化剂。
二氟化二氧(O2F2 ):不与玻璃起反应,是个强的氧化剂和氟化剂,但弱于F2本身:比OF2、ClF3有更强的氟化作用,能在OF2、ClF3不能完成的反应中将金属钚和钚的化合物氧化:Pu(s) + 3O2F2(g) →PuF6(g) + 3O2(g) 该反应用来从废核燃料中以挥发性PuF6的形式除去强放射性的金属Pu。
2、氯的氧化物卤素氧化物中以氯的氧化物较重要,氯的氧化物主要有Cl2O、ClO2、Cl2O6(ClO3)和Cl2O7,都是强氧化剂,其中ClO2和Cl2O6氧化性最强。
当这些氧化物与还原剂接触,或受热以及撞击时,立即发生爆炸,分解为氯气和氧气。
氯的氧化物的某些物理性质见表。
22Cl2O + H2O ═ HClO用新制得的黄色HgO和Cl2(用干燥空气稀释或溶解在CCl4中)反应即可制得Cl2O:2 Cl2 + 2 HgO ═ HgCl2·HgO + Cl2O(g)另一种制备方法是Cl2和潮湿的Na2CO3反应:2 Cl2 + 2 Na2CO3 + H2O ═ 2 NaHCO3 + 2 NaCl + Cl2O在Cl2O分子中,O原子采取sp3杂化方式,有两对孤电子对,分子成V型结构。
Cl2O主要用来制备次氯酸盐。
⑵、ClO2分子也具有V形结构:特殊氧化态(IV、VI氧化态)化合物①、ClO2分子结构的确定:Cl中心原子价电子对数目= 7/2 = 3.5 → sp2?sp3? 结构确定:结合键角、键长、磁性、是否双聚等分析。
Ⅰ、键角∠OClO = 117.6°→sp2 ,排除sp3。
sp2两种可能的结构(a)、(b)(a):::OCl::O.:,(b):::O:::O:Ⅱ、键长:Cl-O 147.3 pm < Cl-O单键(170 pm)表明Cl-O键级大于1→有离域∏键,肯定(a),排除(b);Ⅲ、是否双聚:ClO2不双聚→进一步肯定(a),排除(b);Ⅳ、顺磁:确定(a)。
影响键角因素:杂化态,孤对电子,电负性,大π键。
:::OCl::O.:sp2杂化,ClO2不双聚:ClO2有单电子,顺磁性;ClO2分子总成键:2 σ + 1 ∏35②、Cl2O4的实际结构为Cl(I)—O—Cl(VII)O3,所以Cl2O4不是ClO2的双聚物。
③、ClO2的性质:Ⅰ、物理性质:在常温下是黄绿色气体,冷凝时为红色液体,熔点214 K。
Ⅱ、化学性质:ⅰ、歧化反应:ClO2与碱作用发生歧化反应,生成亚氯酸盐和氯酸盐,这是ClO2的歧化反应,因此它是亚氯酸和氯酸两种酸的混合酸酐:2 ClO2 + 2 NaOH ═ NaClO2 + NaClO3 + H2O歧化ⅱ、强氧化性:ClO2分子中含有成单电子,因此具有顺磁性。
含有奇数电子的分子通常具有很高的化学活性,所以ClO2是强氧化剂和氯化剂。
无论是气态还是液态的ClO2,见光分解,受热爆炸,遇到还原剂或加热浓缩时都会发生爆炸分解为氯气和氧气。
只有在稀溶液时或加入一定的稳定剂才可安全存在。
通常只在生产现场就地消耗,甚至要以不活泼气体(如N2或CO2)将其稀释后使用。
强氧化剂,PbO + 2ClO2 + 2NaOH = PbO2+ 2NaClO2+ H2OⅢ、制取:工业上制备ClO2较安全的方法是在强酸性溶液中用NaCl、HCl或SO2还原ClO3-:2NaClO3 + 4HCl=2ClO2 + Cl2 + 2NaCl + 2H2OClO3- + Cl- + 2 H+→ClO2 + 1/2Cl2 + H2O或 2 ClO3-(aq) + SO2 (g)酸 2 ClO2 (g) + SO42-(aq)2H2C2O4+2NaClO3=Na2C2O4+2ClO2+2CO2+2H2O2 ClO3-(aq) + SO2 (g)+H2SO4→ 2 ClO2 (g) +2HSO4-(aq)3KClO3+2H2SO4=KClO4+2KHSO4+2ClO2+H2OⅣ、应用:ClO2主要用于纸张、纤维、纺织品的漂白,污水及饮用水杀菌处理,对水的净化。
ClO2作漂白剂时,漂白效果是氯气的30倍。
二氧化氯是目前国际上公认的最新一代高效、广谱、安全的消毒杀菌剂,是氯制剂最理想的替代品,在世界上发达国家中已得到了广泛的应用。
为控制饮用水中“三致物质”(致畸、致癌、致突变)的产生,欧美发达国家已广泛应用二氧化氯替代氯气进行饮用水的消毒。
如果以氯气的氧化能力为100%的话,二氧化氯的理论氧化能力是氯气的2.6倍,次氯酸钠的2.8倍,双氧水的1.3倍。
⑶、Cl2O6暗红色液体,可由臭氧与ClO2在273 K条件下反应制得:ClO2+O3═ ClO3 + O2↑在液态和固态下,ClO3和Cl2O6共存,只有在蒸气状态时全部转化为ClO3。
固态的存在形式则为[ClO2]+[ClO4]-。
Cl2O6,实际结构式为:O2Cl(V)—O—Cl(VII)O3,因为VI氧化态只能是表观氧化态,而不是实际氧化态。
所以C2O6不稳定,是强氧化剂,易歧化:Cl2O6 + H2O = HClO4+HClO3⑷、Cl2O7是高氯酸酐,在低温(263 K)下,将HClO4小心地加入P4O10中进行脱水后蒸馏即可得到Cl2O7无色油状液体:6HClO4 + P2O5 = 3Cl2O7 + 2H3PO4,4 HClO4 + P4O10═ 4 HPO3 + 2 Cl2O7⑴、溴的氧化物有Br2O、BrO2、BrO3或Br3O8等,它们对热均不稳定。
⑵、碘的氧化物有I2O4或IO+IO3-、I4O9或I(IO3)3、I2O5和I2O7。
I2O4和I4O9是离子化合物,可以看成是碘酸盐,即IO+IO3-和I3+(IO3-)3。
碘的氧化物是卤素中较稳定的,而I2O5是氧化物中最稳定的。
I2O5是碘酸的酸酐,是一种易吸潮的非挥发性的白色粉末,548K以下稳定。
它可由碘酸在干燥空气中加热至443 K脱水制得:2 HIO3443KI2O5 + H2O↑继续加热至573 K时分解为单质I2和O2:2 I2O5573K 2 I2 + 5 O2↑I2O5用作氧化剂,可氧化H2S、C2H4、CO、NO等:I2O5 + 5 CO343K 5 CO2↑+ I2 此反应可用来定量地测定大气或混合气体中CO的含量。
二、卤素的含氧酸及其盐1、概述:⑴、氟的含氧酸仅限于次氟酸(HFO,氟氧酸HOF),氯、溴、碘均应有四种类型的的含氧酸,它们是次卤酸、亚卤酸、卤酸和高卤酸,卤原子的氧化态为+1、+3、+5和+7。
这些含氧酸根中,除IO65-离子中碘采取sp3d2杂化外,其它含氧酸根离子中的卤原子均采取sp3杂化方式,电子构型均为四面体构型,分子构型为:次卤酸(HXO)为直线形,亚卤酸(HXO2)为V字形,卤酸(HXO3)为三角锥形,高卤酸(HXO4)为四面体形。
〔HFO叫氟氧酸,这里氟为-1价,氧为0价,只有F与H形成共用电对。
HFO的真实架构是HOF,即氧通过单键分别和氢以及氟相连。
但是正负化合价的规定对于共价键来说,看共用的电子对偏向哪边。
偏向的那个原子算带负电多一些算负价。
氧吸引电子的能力比氢强,和氢结合的时候算-1,而又比不过氟,和氟结合算+1,所以,在这里O是0价,所以写成HFO。
〕⑵、卤素含氧酸简介*IO5- 6高碘酸根离子sp3d2杂化,一缩高碘酸IO(OH)5,H5IOX :采取SP 3杂化: O 的2P 电子与卤素3d 空轨道间形成d-p π键。
问题:F 与O 能形成d -p π键吗?答:氟原子没有可用的d 轨道因此不能形成d-pπ 键。
由于稳定性原因,只有常见的氯的含氧酸研究得多。
③、含氧酸的酸性..比较 Ⅰ、同一氧化数不同卤素的含氧酸,其酸性按氯、溴、碘依次减弱 。
(同一主族中,氧化数相同的不同元素的含氧酸的酸性,自上而下逐渐减弱。
)Ⅱ、同一元素形成的几种不同氧化数的含氧酸,其酸性随氧化数的增加而增强.。
Ⅲ、同一周期中,不同元素的最高氧化数的含氧酸的酸性,从左至右逐渐增强:H 2SiO 3,θ1a K =1.7×10-10;H 3PO 4,θ1a K =7.5×10-3;H 2SO 4,θ1a K ≈103;HClO 4,θa K ≈109。
Ⅰ、同一元素形成的几种不同氧化数的含氧酸及其盐,其热稳定性随氧化数的增加而增强;盐比相应的酸稳定。
HClO NaClO HClO 2 NaClO 2 HClO 3 NaClO 3 HClO 4 NaClO 4 热稳定性增大 热稳定性增大热稳定性增大Ⅱ、同一主族中,氧化数相同的不同元素的含氧酸及其盐的热稳定性:HClO 2和HBrO 2最不稳定。
(HClO 2不稳定,分解释出ClO 2。
)HClO 3,HBrO 3,HIO 3 HClO ,HBrO ,HIO热稳定性增强氧化性增强⑤、氧化性:在稀溶液中,HClO >HClO 3>HClO 4。
