20140819-2 连接产物的转化(电转)
《连接产物的转化》课件

在某些情况下,低温 可能更有利于获得期 望的产物。
升高温度通常会加快 反应速率,但可能导 致产物选择性的降低 。
压力的影响
压力对反应速率和产物有一定影 响,尤其在涉及气体或高压的条
件下。
高压可以促进某些化学键的断裂 或形成,从而影响产物的形成。
压力对反应选择性的影响因反应 类型而异,需根据具体反应进行
连接产物转化的过程
01
02
03
反应条件
连接产物转化通常需要在 特定的反应条件下进行, 如温度、压力、催化剂等 。
反应机制
连接产物转化的机制涉及 多种化学或生物化学反应 ,如氧化、还原、水解、 酯化等。
产物纯化
转化后的产物需要进行分 离和纯化,以获得高纯度 的目标化合物。
连接产物转化的应用领域
化学工业
提高实验水平。
05
连接产物转化的未来发展与挑战
新技术的应用与挑战
人工智能与机器学习
在预测反应路径、优化反应条件和设计催化剂方面具有巨大潜力 ,但数据质量和算法模型的可靠性仍需提高。
基因编辑技术
可用于设计和优化酶促反应,但目前对酶的改造仍受限于可用的酶 资源。
纳米技术
可用于提高反应效率和选择性,但纳米材料的安全性和稳定性仍需 进一步研究。
安全注意事项
防护措施
实验操作人员必须佩戴个人防护装备,如实验服、化学防护眼镜、化 学防护手套等,以防止化学品的直接接触和吸入。
废弃物处理
实验过程中产生的废弃物必须按照实验室规定进行分类和处理,避免 对环境和人体造成危害。
防火防爆
实验室内必须配备灭火器和灭火器材,并定期进行检查和维护。在实 验过程中应避免产生火花和高温,以防引发火灾和爆炸。
实验十六DNA的连接与转化

实验十六DNA的连接与转化DNA的连接与转化是基因工程领域中常用的技术手段之一,通常用于将外源DNA导入到细胞中,以实现特定的需求。
本实验的研究目的是了解DNA连接和转化的基本原理,以及实验过程中的操作技巧和可能的问题。
一、实验原理1. DNA的连接DNA的连接是指将两条DNA分子连接起来形成一条较长的DNA分子。
DNA连接的方法主要有三种:(1)限制性内切酶连接方法,(2)TA Clone技术连接方法,(3)DNA接头连接方法。
(1)限制性内切酶连接方法:限制性内切酶能够识别并切割DNA分子的特定序列,因此,如果两条DNA分子的末端含有相同的限制性内切酶切割位点,在加入连接酶(如DNA连酶)的条件下,这两条DNA分子可以连成一条较长的DNA分子。
(2)TA Clone技术连接方法:TA Clone技术是通过向PCR反应体系中添加polymerase 链特异性的核苷酸,使其在末端添加一定数量的A或T碱基,然后将PCR产物直接连接至非脱氧末端载体上,从而实现DNA连接。
DNA的转化是将外源DNA导入到细胞内部的过程,进而使细胞表达出外源DNA所编码的蛋白质,从而达到特定目的。
在实验室中,常用的DNA转化方法有两种:(1)化学转化法,(2)电转发法。
(1)化学转化法:这种方法是在化学方法的帮助下,使细胞发生化学的通道,从而使外源DNA进入细胞。
化学转化法的缺点是效率较低,很难实现高效转化。
(2)电转发法:电转发法是将DNA与细胞一起转换,在低电压下应用瞬间高压电场使细胞壁产生通道,使DNA穿过细胞壁进入细胞质。
瞬间高压电场使这些通道持续时间较小,一旦DNA穿过细胞壁进入细胞质,并且在某些情况下,该细胞将接受DNA并将其整合进其基因组。
二、实验方法(1)准备连接反应首先,根据需要连接的DNA分子确定使用的连接方法和所需的酶,例如,如果需要使用限制性内切酶连接方法,则需要购买相应的酶,同时设计酶切位点。
2014届高考化学总复习 热点专题 常见无机物间的转化关系(19张PPT)

本章热点专题
常见无机物间的转化关系
2.下表所列各组物质中,物质之间通过一步反应就能 实现如图所示转化的是
物质
(
)
a
选项
b
AlCl3 NO SiO2
c
Al(OH)3 NO2 H2SiO3
A B C
Al HNO3 Si
D
CH2===CH2 CH3CH2OH CH3CHO
人教版化学
本章热点专题
人教版化学
本章热点专题
常见无机物间的转化关系
化铝,氢氧化铝与盐酸反应生成氯化铝,②正确;铜在
空气中加热生成氧化铜,氧化铜不能直接转化成氢氧化
铜,③错误;钠与水反应生成氢氧化钠,氢氧化钠与少 量二氧化碳反应生成碳酸钠,碳酸钠与氢氧化钡反应生 成氢氧化钠,碳酸钠与足量二氧化碳反应生成碳酸氢钠, 碳酸氢钠与氢氧化钠反应(或碳酸氢钠固体加热)得到碳 酸钠,碳酸氢钠与足量氢氧化钙反应生成氢氧化钠,④ 正确。 答案:D
常见无机物间的转化关系
2.三角型转化关系
(1)铁三角: (2)碳三角: (3)铝三角: (4)氯三角:
(5)硅三角:
人教版化学
本章热点专题
常见无机物间的转化关系
3.交叉型转化关系 (1)硫及其重要化合物间的转化:
(2)氮及其重要化合物间的转化:
(3)钠及其重要化合物间的转化:
人教版化学
本章热点专题
OH- OH- + - ③Al3 ――→Al(OH)3――→AlO2 Al3+ Al3+ 变形:OH-――→H+ - + ④AlO2 ――→Al(OH)3――→Al3
+ AlO2 3+ AlO2 变形:H ――→Al ――→Al(OH)3 - -
人教版化学
连接转化步骤

1.10 连接产物的转化1.10.1 大肠杆菌(E. coli DH5α)感受态的制备(1)将-70℃保存的DH5α甘油菌活化于LB培养基,37℃过夜培养。
挑取DH5α单菌落至20 mL LB液体培养基中,37℃条件下,180 rpm振荡过夜培养;(2)吸取200 μL上述菌液按1%接种量加至20 mL的LB液体培养基中,37℃,180rpm,振荡培养1-2 hr,直到菌液浓度达到OD600=0.2-0.5;(3)吸取培养好的菌液移至50 mL的灭菌离心管中,5,000 rpm,4℃离心10 min,弃尽上清;(4)用5 mL冰浴的0.1 M CaCl2轻轻悬浮菌体,在冰上放置10 min;(5)5,000 rpm,4℃离心10 min,弃上清,收集菌体;(6)用2 mL冰浴的含10%甘油的0.1 M CaCl2重新悬浮菌体,并分装于冰浴的1.5 mL离心管中(每管装入100 μL),在4℃放置(48 hr内进行转化效率最高),或者置于-70℃保存备用。
注:感受态的制备必须保证在低温条件下进行,操作过程尽量轻柔。
可在制作完后,转工具性质粒,以验证感受态效率。
1.10.2 连接产物的热激转化(1)吸取连接产物(体积≤10 μL)于50-100 µL感受态细胞中,轻轻混合均匀,在冰上放置30 min;(2)将离心管放到42℃水浴中,热激90 s(严格控制热击时间),取出后迅速放于冰上,冷却1-2 min;(3)向离心管中加入5倍体积的SOB(或LB)液体培养基,37℃振荡培养45-60 min;(4)8,000 rpm离心30 s,去部分上清,留100 μL左右培养液,移液枪吸打均匀后,用三角涂布器涂布在选择性LB平板(含相应抗生素)上;(5)倒置培养皿于37℃培养12-16 hr,待单菌落长出后,挑取单菌落于已加入相应抗生素的LB液体培养基中,37℃条件下,180 rpm振荡过夜培养,提取质粒并进行酶切验证。
转化连接实验报告

一、实验目的1. 了解转化连接的原理和过程;2. 掌握转化连接的操作步骤;3. 学习检测转化连接结果的方法。
二、实验原理转化连接是指将目的基因与载体连接,并将重组质粒导入受体细胞中,使其在受体细胞内表达目的基因的过程。
转化连接包括DNA连接和转化两个步骤。
1. DNA连接:利用DNA连接酶将目的基因与载体连接,形成重组质粒。
DNA连接酶能够催化两个DNA分子的末端以磷酸二酯键相连,形成完整的DNA分子。
2. 转化:将重组质粒导入受体细胞中,使其在受体细胞内表达目的基因。
转化方法有多种,如电转化、化学转化等。
三、实验材料1. 试剂:DNA连接酶、T4 DNA连接酶缓冲液、dNTPs、DNA分子量标准、限制性内切酶、琼脂糖凝胶电泳试剂等;2. 仪器:PCR仪、凝胶成像系统、紫外可见分光光度计、离心机、移液器等;3. 培养基:LB培养基、氨苄西林等。
四、实验步骤1. 目的基因和载体的制备:利用限制性内切酶分别切割目的基因和载体,获得具有相同黏性末端的DNA片段。
2. DNA连接:将目的基因和载体片段按照一定比例混合,加入DNA连接酶、T4 DNA连接酶缓冲液和dNTPs,在适当的温度下进行连接反应。
3. 重组质粒的制备:将连接反应产物进行PCR扩增,获得目的基因和载体的重组质粒。
4. 重组质粒的鉴定:利用琼脂糖凝胶电泳检测PCR产物,观察重组质粒的分子量是否与预期相符。
5. 转化:将重组质粒转化至受体细胞中,如大肠杆菌。
常用的转化方法有电转化、化学转化等。
6. 转化细胞的培养:将转化后的细胞在含有氨苄西林的LB培养基中培养,以便筛选含有重组质粒的转化细胞。
7. 阳性克隆的筛选:通过PCR或DNA测序等方法,检测转化细胞中是否含有目的基因,筛选出阳性克隆。
五、实验结果与分析1. 重组质粒的制备:通过PCR扩增获得重组质粒,琼脂糖凝胶电泳结果显示,PCR 产物与预期分子量相符。
2. 转化细胞培养:在含有氨苄西林的LB培养基中培养转化细胞,观察细胞生长情况。
【江苏省自然科学基金】_间质细胞_期刊发文热词逐年推荐_20140819
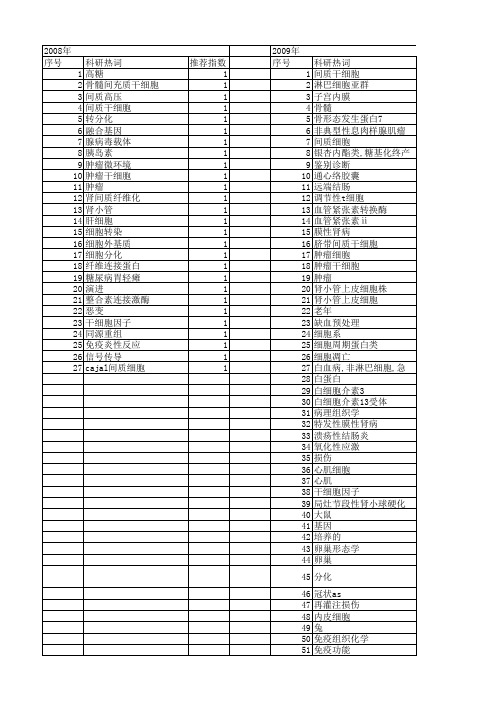
53 54 55 56 57 58
nucleostemin cd133 cajal间质细胞 b淋巴细胞 apoe(-/-)小鼠 @补肾助孕方/药理学
推荐指数 3 2 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
推荐指数 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
2011年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52
Hale Waihona Puke 2010年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32
科研热词 间质干细胞 雌激素 间质干细胞移植 通心络胶囊 血脂 蜕膜化 腺病毒载体 脓毒症 肿瘤微环境 肿瘤 肾包膜下测定 肺 肝细胞生长因子 细胞增殖 细胞分化 组织重组 红斑狼疮,系统性 移植,异种 病理组织学 环氧化酶2 炎症反应 核因子κ b 小鼠 子宫内膜息肉 前列腺肿瘤 冠状运脉粥样硬化 人脐带间质干细胞 人子宫内膜间质细胞 中脑前体细胞 一氧化碳 oaz信号通路 mst1
推荐指数 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
连接产物的转化
连接产物的转化实验原理:< 转化反应>1、即受体菌在低温下(0℃)被置于低渗的CaCl2溶液中,细菌在低渗环境中菌体膨胀成球形。
2、转化体系中的DNA与Ca2+形成羟基钙磷酸复合物黏附于细胞表面,之后使细菌经42℃短时间热冲击处理(热休克),此时受体菌可大量吸收其表面黏附的DNA复合物,完成转化。
继而在培养基上生长一定时间(数小时)后,菌体恢复原状,并可以分裂增殖。
3、由于载体上含有氨苄青霉素抗性基因和LacZ基因的部分片段,所以可以利用抗性和蓝白斑进行含有重组质粒的大肠杆菌菌落的筛选。
< 显色反应原理>1、α互补:指E.coli β-半乳糖苷酶的两个无活性的片段组合而成为功能完整的酶的过程。
pGEM-T载体上的T位点位于可产生α肽段的基因片段之内。
若有外源基因插入此则破坏编码读框产生没有活性的α肽段。
2、宿主菌为缺失产生α肽段的突变体,但能产生酶的其它肽段(ω肽段)。
2、载体与宿主菌两者之间进行基因内互补就产生有活性的β-半乳糖苷酶。
在IPTG的诱导下,载体产生的α肽段与宿主菌产生的ω肽段结合成有活性的β-半乳糖苷酶,此酶能使显色底物X-gal分解成不溶于水的蓝色化合物,从而使菌落变蓝。
若有外源片段插入此位点,则使载体的β-半乳糖苷酶基因失活,不能产生α肽,也就不能形成有活性的β-半乳糖苷全酶,X-gal不能被分解,菌落为白色。
实验步骤:1、从-80℃冰箱中取出感受态细胞放于冰上,使其缓慢融化。
2、分装感受态细胞,每个小管30μL。
分别加入连接产物3μL,轻轻混匀,冰上30min。
3、42℃1min。
4、冰上2.5min,加入SOC培养基470μL。
5、37℃摇床摇动1小时。
6、将培养液分成等份后涂于LB培养基上,液体全干后,将平板过夜、倒置培养于37℃恒温箱中。
7、第二天早上观察培养结果。
培养基配制:一、LB/Amp/X-Gal/IPTG 培养基:加ddH 2O 搅拌溶解,滴加5M NaOH ,调节PH 值至7.0。
连接产物的转化
段并实现其转化的一种生理状态,它是由受体菌的遗传性状所决定 的,同时也受菌龄、外界环境因子的影响。细胞的感受态一般出现 在对数生长期,新鲜幼嫩的细胞是制备感受态细胞和进行成功转化 的关键。
•
Ca2+处理的感受态细胞,其转化率一般能达到5x106~2x107 转
化子/ug质粒DNA,可以满足一般的基因克隆实验。如在Ca2+ 的基
组DNA导入细菌体内,使之获得新的遗传特性的一种方法。它是微生 物遗传、分子遗传、基因工程等研究领域的基本实验技术之一。使受 体细菌从周围介质中吸收外来DNA分子,从而获得新的遗传物质的过 程就是转化。
通常所用的受体是大肠杆菌。
用于转化的细菌被称为感受态细胞。
•
所谓的感受态,即指受体(或者宿主)最易接受外源DNA片
础上,联合其它的二价金属离子(如Mn2+ 、Co2+ )、DMSO或还 原剂等物质处理细菌,则可使转化率提高100~1000倍。
大肠杆菌的转化常用热激法,该法最先是由 Cohen 于 1972 年发现的。其原理是细菌处于 0℃ , CaCl2 的低渗溶 液中,菌细胞膨胀成球形,转化混合物中的 DNA形成抗 DNase 的羟基 -钙磷酸复合物粘附于细胞表面,经 42℃ 短 时间热冲击处理,促使细胞吸收 DNA复合物,在丰富培 养基上生长数小时后,球状细胞复原并分裂增值,被转 化的细菌中,重组子中基因得到表达,在选择性培养基 平板上,可选出所需的转化子。
3. 自稳--外源质粒DNA分子在细胞内复制成双链;
4. 表达一供体基因随同复制子同时复制,分裂, 转录翻 译
重组子的筛选
抗生素标记法:菌株为某种抗生缺陷型, 而质粒上带有该抗性基因 (如氨苄青霉素, 卡那霉素等)这样只有转化子才能在含该抗生素
分子生物学-实验二 PCR产物T-A连接及连接产物转化-精选文档
实验结束: • 整理实验台; • 值日生值日;
• 写实验报告。
2. 42oC,45秒。然后迅速放回冰中 5 分钟;
6. 将上述菌液涂匀于含有Amp的LB琼脂培养板;
7. 待菌液被平板吸收后,将平皿倒置于37oC孵箱中培养12-16h。
思考题:
1. 影响T-A连接效率的因素有哪些? 2. 感受态细胞制备、转化过程中的主要注意事项是 什么?转化后的平皿为什么需要倒置培养?
GAPDH gene 片段 (746bp)
实验第二部分 PCR产物与T载体的连接
T-A 连接原理:
1. Taq DNA聚合酶:PCR产物 的3’端突出一个A
A-3
2. 商业化的T载体:在3’端多 出一个T
5
T -3
3- T
5
3 -A
T - Vector
3. 两者的互补碱基先退火结合(粘 性末端连接),然后连接酶在 缺口形成磷酸二酯键。
T-A连接的步骤:
1. 按下列配方进行连接反应: 回收的PCR产物(DNA片段) T-载体 10 X Ligation buffer T4 DNA ligase 终体积 7 1 l l 1 l 1 l 10 l
注:最后加入工具酶(T4 DNA ligase ) 2. 轻弹管底混合,离心机甩一下。 3. 将连接反应管置25℃水浴20min。
实验第一部分pcr产物的电泳及回收gapdhgene片段746bp750bp2000bp1000bp500bp250bp100bpmarkerpcr产物的电泳结果观察及分析gapdhgene片段746bp750bp2000bp1000bp500bp250bp100bpmarker1在uv灯下用手术刀片将含dna片段的琼脂糖凝胶切下放入封口膜中
连接产物的转化
连接产物的转化一、器械冰盒,酒精灯,镊子,彩色笔,酒精棉,打火机,移液枪(1000μL)及其吸头,平皿(装废液)、计时器,水浴箱,氨苄平板,1.5mL离心管二、试剂及其样品冰块,SOC液体培养基,连接产物,三、步骤1、把冰块装于冰盒中,取-70℃冻存的感受态细胞于冰盒中,待感受态细胞融化后,低速离心一会,再放回冰盒中,样品也作低速的离心,放在离心管架上;2、把感受态和样品放进无菌操作台上;3、用酒精棉擦试手,点燃酒精灯;4、调好刻度(>100μL),装好枪头5、用烧过的镊子打开反应管的盖子和离心管的盖子,从而把感受态细胞移取到样品中,然后盖实管盖,做好标记,再放于冰盒中;6、待所有样品加完后,轻轻混匀,冰浴30min(放于4℃冰箱中)7、42℃水浴热冲击90-120s,再迅速放回冰上2min;8、在无菌操作台上,夹取相应数量空1.5Ep管于架子上,加上750μLSOC液体培养基(操作时双手不要放在管口正上方),然后把样品中的液体移进该离心管中,再用一定量的SOC液体冲洗管底再把它移取干净,标记好之后150r/min振荡培养45mins,9、离心(5min,5000rpm)10、在无菌操作台上移弃550μL上清液,再用枪吹打沉积物成混浊状(混匀),然后把它涂在氨苄平板上(尽量均匀的涂),11、在操作台里平皿正放并半开朝向酒精灯让其菌液吸收完全,再将平皿倒置培养约12—16h;四、注意事项1、质粒的浓度:转化效率与外源DNA的浓度在一定范围内成正比,但当加入的外源DNA的量过多或体积过大时,转化效率就会降低,一般情况下,DNA溶液的体积不应超过感受态细胞体积的5%2、在连接产物中加入感受态细胞后应轻轻混匀,避免细胞破裂;在移取感受态细胞时,枪头不能在管内进行吹打;3、同时应做两个对照,以检验氨苄青霉素的抗性和感受态细胞的质量:对照组1:以同体积的无菌双蒸水代替DNA溶液,其它操作同上,此组正常情况下在含抗生素的LB 平板上应没有菌落出现;对照组2:以质粒代替DNA溶液,其它操作同上,此组正常情况下在含蓄地抗生素的LB平板上应出现大量菌落;4、SOC培养液务必保证无菌,用时烧瓶口,盖子侧放,用完也要浇瓶口;5、用100μL量程的枪把混合物加到SOC培养液中,加入后再吸取一定量的SOC再冲洗一下混合物,再把它们吸取干净;。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
连接产物的转化
感受态细胞的制备
准备:
1、LB培养基(无抗生素)(200 ml,分装为两瓶,每瓶100 ml):(先不加NaCl,稀释5倍用于GYT制备。
)
NaCL 2.0 g
Trytone 2.0 g
Yeast extract 1.0 g
2、GYT培养基(20 ml):(取1中培养基4 ml加水至18 ml,加入2ml 甘油)
Glycerol 10% (V/V)
Trytone 0. 25%(m/V)
Yeast extract 0.125%(m/V)
3、10% 的甘油 60 ml
4、纯水 110 ml
5、枪头、EP管(全部放入高压灭菌锅灭菌)
步骤:
1、从-80℃冰箱中取出感受态细胞Trans 5α放于冰上,使其缓慢融化。
2、将感受态细胞Trans 5α加入25 ml LB培养基(无抗生素),过夜培养。
3、接种25 mL的过夜培养物加到100mL预热LB培养基(无抗生素)的锥形瓶中,于37℃摇动(300r/min)培养,每隔1 h测量一次OD600值,当OD600>0.1后每隔15min测量一次OD600值,当OD600值达到0.35时就应收集细胞。
4、当OD600值达到0.4时,迅速将培养物置于冰浴中15-30min.不时缓慢摇匀以保证内容物充分冷却。
将离心管置于冰上预冷,为下一步做准备。
为获得最大效率的转化,在整个操作过程中细菌的温度不超过4℃是关健。
5、超净工作台内,将细菌转移至两个冰冷的离心管(50 ml)中,4 ℃、2500 rpm、离心15 min,以回收细胞。
倒去培养液,每管50 ml
冰冷的纯水重悬沉淀。
6、4℃、2500 rpm、离心20 min, 以回收细胞。
倒去培养液,每管25 ml冰冷的10%甘油重悬沉淀。
倾倒培养液时要小心,10%甘油中的细菌沉淀附着力降低。
7、4℃、2500rpm、离心20min, 以回收细胞。
倒去培养液,用2ml 冰冷的10%甘油重悬沉淀。
并将两管菌合并为一管。
8、4℃、2500rpm、离心20min, 以回收细胞。
小心倒掉上清液,再用连在真空器上的巴斯德吸管吸去管壁上的残留液体。
加1ml冰冷的GYT培养液重悬沉淀。
这一步最好用轻柔振动完成,不要用吸管吹打或振荡。
9、取2 μl稀释100倍上述悬液后测量OD600值。
用冰冷的GYT培养液将其稀释至浓度为2×1010~3×1010个细胞/ml。
(1.0 OD600=~2.5×108个细胞/ml)。
10、将悬液按100μl/份分装到冷却的无菌0.5 ml微量离心管中,封紧管口,贮存于-80℃备用。
电转化
1.冻存的感受态细胞Trans 5α,先于冰上溶解;分装感受态细胞,
每个小管100 μl。
2.加入用于转化的连接产物DNA 4 μl,对照质粒加了0.1μl;冰上静置5 min。
3.转入电击杯(0.2 cm electrode),冰上静置2 min;
4.(将表面的水擦干)插入电击仪(BTX细胞电穿孔仪ECM630),(调节电击仪,使电容为25μF,电压2.5kV,电阻200Ω),电击;5.加入300 μl LB液体培养基(无抗生素),放入摇床37℃、200 rpm、1 h 30 min;
6. 然后用加样枪将菌液加到LB平板上,用推棒涂平,等液体全部吸收了,倒置培养过夜(14~16 h)。
诱导表达
1、取15 ml的离心管编号,并依次加入1 ml的LB broth(Amp+)。
在培养细菌的LB Plate用10 µl枪头挑取1个菌落加入离心管,放入恒温震荡器,37℃、150-200 rpm过夜培养。
2、过夜培养的菌:500 µl菌液+500 µl 30%甘油冻存于-20℃。
50 µl菌液+5 ml LB broth 37℃、150-200 rpm培养3-4 h,取200 µl 测OD600的值,剩余菌液再加入IPTG(终浓度为0.1mM),培养过夜,取200 µl测OD600的值。
3、离心:取200 µl菌液于1.5 ml的EP管中,3000 rpm、5 min,弃去上清液,收集沉淀。
4、沉淀+16 µl1 × PBS(枪头打散)+4 µl5×Protein Loading Buffer 或3.2 µl 6×Protein Loading Buffer置于100℃空气浴加热5-10 min。
(15 ml的离心管中剩余的菌液离心弃去上清液,置于-20℃保存,用于蛋白电泳为阳性结果的蛋白纯化)
5、验证后需-80℃保存。
