免疫亲和纯化以及免疫沉淀技术
获得纯净细胞膜的方法

获得纯净细胞膜的方法全文共四篇示例,供读者参考第一篇示例:获得纯净的细胞膜对于许多生物研究至关重要。
细胞膜是细胞的保护屏障,决定了细胞的大小,形状和功能。
通过提取纯净的细胞膜,科学家可以进一步研究细胞的生理和生化过程,从而更深入地了解生命的奥秘。
下面将介绍一些常用的获得纯净细胞膜的方法。
一、超声破碎法超声破碎法是一种常用的制备纯净细胞膜的方法。
在超声波的作用下,细胞膜会发生破裂,释放出细胞膜内部的成分。
随后,可以通过离心等手段将细胞膜分离出来,并进一步纯化。
这种方法操作简单,效率高,适用于各种类型的细胞。
二、质膜溶解法质膜溶解法是另一种常用的获得纯净细胞膜的方法。
在这种方法中,细胞经过离心等步骤分离后,可以使用有机溶剂如乙醚,氯仿等将细胞膜中的脂质成分溶解出来。
随后再通过离心和洗涤等步骤去除杂质,最终得到纯净的细胞膜。
三、离心法四、膜蛋白免疫沉淀法膜蛋白免疫沉淀法是一种通过特异性蛋白抗体识别并沉淀出膜蛋白的方法。
将蛋白抗体与蛋白样品混合后,可以使用磁珠等载体来实现膜蛋白的沉淀。
随后通过洗涤和离心等步骤去除杂质,最终得到纯净的细胞膜。
五、膜蛋白结合亲和纯化法膜蛋白结合亲和纯化法是一种根据膜蛋白与其识别分子的亲和性来实现膜蛋白的沉淀的方法。
可以使用具有亲和性的物质如亲和树脂来实现膜蛋白的结合和纯化。
这种方法操作简单,效率高,适用于大规模膜蛋白的纯化。
获得纯净的细胞膜是一项复杂的过程,需要仔细的实验设计和操作。
通过不同的方法和技术,科学家们可以获得高纯度的细胞膜,并进一步探索细胞的结构和功能。
希望以上介绍的方法对您有所帮助,让您在研究细胞生物学和生命科学中取得更多的进展。
【2000字】第二篇示例:纯净的细胞膜是细胞正常功能的基础,它不仅保护了细胞内部的各种结构和分子,还通过选择性通道调节物质的进出,维持了细胞内外环境的稳定。
保持细胞膜的健康和纯净对于细胞的正常运作至关重要。
那么,如何获得纯净的细胞膜呢?下面我们就来介绍一些方法。
免疫共沉淀原理图解

免疫共沉淀原理图解免疫共沉淀(immunoprecipitation,IP)是一种用于分离和富集特定蛋白质的技术。
基于特异性抗体与目标蛋白质的结合,IP可以用于检测蛋白质-蛋白质和蛋白质-核酸相互作用、蛋白质修饰和定位等方面的研究。
下面将介绍免疫共沉淀的原理和流程。
原理:免疫共沉淀是通过特异性抗体与目标蛋白质的结合,来沉淀出目标蛋白质及其相关蛋白质、DNA或RNA等分子的方法。
具体来说,IP通过以下步骤实现:1. 将细胞裂解,使蛋白质溶于缓冲液中。
2. 加入特异性抗体,并使其与目标蛋白质结合。
3. 加入亲和素(一种与抗体结合的蛋白质),再将亲和素固定在磁珠上。
4. 加入磁珠后,亲和素与抗体结合,并沉淀下含有目标蛋白质及其相关分子的复合物。
5. 用洗涤缓冲液洗涤磁珠,并用洗涤液去除非特异性结合的蛋白质。
6. 用洗涤缓冲液或热水溶液将目标蛋白质及其相关分子从磁珠上去除。
7. 最后,用Western blot或其他方法检测目标蛋白质及其相关分子。
流程:IP的具体实验流程如下:1. 细胞溶解:将含有目标蛋白质的细胞或组织裂解并使蛋白质溶于缓冲液中。
2. 抗体结合:加入经过验证的特异性抗体,使其与目标蛋白质结合。
3. 亲和素结合:加入亲和素,使其与抗体结合,并将其固定到具有磁性的磁珠上。
4. 免疫共沉淀:将磁珠加入到蛋白质混合物中,使亲和素与抗体结合并沉淀出目标蛋白质及其相关分子。
5. 洗涤:用洗涤缓冲液将非特异性结合的蛋白质去除,保留目标蛋白质及其相关分子。
6. 去除磁性珠:用洗涤缓冲液或热水溶液将目标蛋白质及其相关分子从磁珠上去除。
7. 分析:用Western blot、质谱等多种技术检测目标蛋白质及其相关分子。
总结:免疫共沉淀是一种非常有用的技术,可以帮助研究者了解蛋白质相互作用、蛋白质修饰及其定位等方面的信息。
虽然技术流程复杂,但只要按照正确的方法进行操作,就能够产生非常有意义的结果。
免疫沉淀(IP)技术
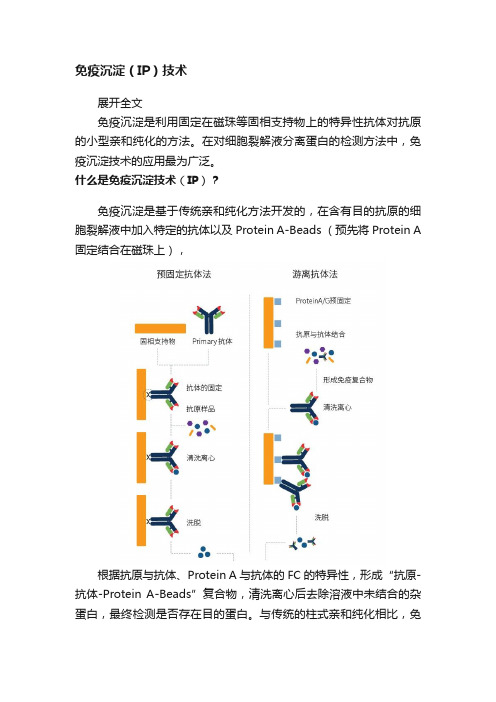
免疫沉淀(IP)技术展开全文免疫沉淀是利用固定在磁珠等固相支持物上的特异性抗体对抗原的小型亲和纯化的方法。
在对细胞裂解液分离蛋白的检测方法中,免疫沉淀技术的应用最为广泛。
什么是免疫沉淀技术(IP)?免疫沉淀是基于传统亲和纯化方法开发的,在含有目的抗原的细胞裂解液中加入特定的抗体以及Protein A-Beads (预先将Protein A 固定结合在磁珠上),根据抗原与抗体、Protein A与抗体的FC的特异性,形成“抗原-抗体-Protein A-Beads”复合物,清洗离心后去除溶液中未结合的杂蛋白,最终检测是否存在目的蛋白。
与传统的柱式亲和纯化相比,免疫沉淀的目标是仅分离足够用于Western Blot或其他检测方法检测的蛋白质。
通常可以将已处理和未处理的样品进行比较,从而评估目标蛋白的相对量。
在免疫沉淀实验中,用于检测的抗体可以是预固定的,或者是游离的。
通常,预固定抗体法更适用于IP,但是,当目标蛋白浓度较低、抗体与抗原的结合亲和力较弱的情况下,可以使用游离的抗体形成免疫复合物,效果会比较好。
免疫沉淀固相物质的选择对于小型特定蛋白和蛋白复合物的分离,磁珠可实现结合能力、得率、可重复性、纯度和成本节约之间的平衡。
当进行手动和自动化标准IP、Co-IP、ChIP、ChIP-Seq、RIP和pull-down反应并立即用于后续检测分析时,磁珠是最佳选择。
利用强力磁力架可将磁珠定位到孵育管的侧壁,使其不阻碍细胞裂解物抽吸。
磁性分离不需要离心,所以不会导致抗体-抗原结合破坏和目标蛋白损失现象。
当需要纯化大量目标蛋白用于下游分析,且特异性抗体较易获得,琼脂糖树脂纯化较为适用。
表1:琼脂糖树脂和磁珠的比较对比指标琼脂糖树脂(Agarose Resin)磁珠(Magnetic Beads)结合能力多孔海绵状结构,表面积-体积比大,抗体结合率高磁珠直径小,表面光滑无孔,结合率偏低得率抗体在洗涤过程中易流失温和洗涤条件,抗体不易流失可重复性完全移除缓冲液可能破坏树脂磁珠可以完全吸附在分离管壁,不会被破坏纯度孵育时间较长,需要预纯化相互作用完全发生在磁珠外表面,不需预纯化操作性存在大量手动操作,时间长分离不需要离心,可同时操作多个样本免疫沉淀的类型最简单的免疫沉淀可用于分离单个蛋白(抗体的靶抗原)以研究其特性、结果、表达、活化或修饰状态。
SPR技术体外转录和翻译GST融合蛋白免疫共沉淀串联亲和纯化等鉴定分析蛋白质之间相互作用介绍(精品)

Inhibitory by-products
•T7 RNA polymerase •Translation machinery E. coli •Energy regenerating system
Inhibitory by-products
microtiterplate 96x RTS 100
PCR tubes 4x12 RTS 100
continuous exchange cell-free (CECF) principle
持续交换和非细胞体系的原理
偶联的转录和翻译过程
T7-RNA polymerase
gene
gene
E.coli lysate
DNA
coupled transcription / translation
protein
原子力显微镜检测蛋白质相互作用;
计算机方法; 化学交联技术鉴定蛋白质相
GST PULL-DOWN:通过与GST融合蛋白质 探针蛋白质相互作用从可溶性蛋白质库中亲 和纯化一个未知蛋白质,再通过GST与谷光 苷肽偶联球珠的结合收集相互作用蛋白质, 从而分离出蛋白质复合物。
GST融合蛋白纯化基本程序
1 含有表达质粒的细菌培养; 2 诱导表达; 3 收集菌体; 4 加蛋白酶抑制剂,冰上破碎细胞; 5 离心取上清,按1:1的比例加谷光苷肽琼脂糖球珠,在4C, 温和混匀30分钟; 6 离心收集琼脂糖球珠,用PBS轻轻混匀悬浮,反复三次; 7 将混合物装柱,让PBS流出; 8 加还原性的GSH将融合蛋白洗脱; 9 SDS-PAGE检测蛋白质纯化情况。
持续交换和非细胞体系的原理
供给腔 反应腔
DNA template Protein
供给腔
In vitro pull down

Pull-Down技术是通过蛋白相互作用来研究细胞通路的有力工具。
Pull-Down实验是确定两种或更多蛋白之间相互作用的体外方法。
Pull-Down实验可用来检测已知蛋白的表达和相互作用条件,并且可用来筛选未知的蛋白相互作用。
Pull-Down实验至少需要一种纯化的标签蛋白(诱饵)用来捕获和“pull-down”靶蛋白(猎物)。
Pull-Down vs.免疫沉淀Pull-Down实验是亲和纯化的一种形式,其与免疫沉淀十分类似,不同之处在于使用诱饵蛋白代替了抗体。
在Pull-Down实验中,带有标签的诱饵蛋白被特异结合该标签的固相化亲和配基捕获,产生“次级亲和支持物”,用于纯化与诱饵蛋白相互作用的其他蛋白。
含有固相化诱饵蛋白的次级亲和支持物可以与含有推测猎物蛋白的各种蛋白样品相互孵育。
如果缓冲液及样品条件与靶结合相互作用兼容,且诱饵蛋白在带有标签和被固相化时仍然可以行使功能,那么存在于样品中的猎物蛋白就会结合到亲和支持物上。
如果特异结合相互作用的亲和性足够强,那么非结合的样品成分可以被洗涤掉,进而纯化形式的猎物或诱饵-猎物复合体可被从支持物上洗脱下来。
诱饵蛋白固相化策略1.依赖固相化抗体结合蛋白(例如蛋白A或蛋白G琼脂糖)的免疫沉淀形式显然对pull-down实验不是很有效。
必须使用其他亲和系统固相化诱饵蛋白(例如‘bait the hook’)。
如果有纯化的天然的诱饵蛋白,可将其用生物素进行标记或偶联一些其他小的标签,以适用于现成的亲和树脂。
即用型生物素化试剂及标记试剂盒(见目录第九节,281页),可实现使用链亲和素琼脂糖树脂进行pull-down实验。
2. 如果被用作诱饵的蛋白是重组蛋白,那么其很可能会含有一个用于纯化的亲和标签。
这个融合标签就会成为该诱饵蛋白用于pull-down实验的基础。
最常见的标签为谷胱甘肽S-转移酶(GST)和多组氨酸(6×His),其分别使用固相化的谷胱甘肽和固相化的金属螯合物亲和配体。
抗体的纯化原理

抗体的纯化原理抗体的纯化是指从混合溶液中将目标抗体分离出来,并获得高纯度和高活性的过程。
纯化抗体的目的是为了获得足够纯度的抗体以进行进一步的研究和应用。
抗体的纯化过程通常包括以下几个步骤:1. 前处理:在样品中去除杂质物质,例如细胞碎片、核酸、亲和素等。
常用的方法包括离心、过滤和沉淀等。
2. 离子交换层析:采用离子交换树脂分离抗体。
离子交换树脂上带有正电荷或负电荷,可以与抗体的电荷相互作用,使抗体与其他组分分离。
常见的离子交换树脂有DEAE(二乙氨基乙基)和CM(羧甲基)等。
3. 亲和层析:利用特定配体与抗体之间的高亲和力进行分离。
常见的亲和层析方法包括免疫亲和层析和亲和素层析。
免疫亲和层析是将抗体与特定配对抗原或抗原类似物结合,再通过洗脱实现抗体的分离纯化。
亲和素层析则是通过特异性结合分离靶抗体,例如蛋白A层析可以专一地结合某些抗体的Fc区。
4. 凝胶层析:根据抗体的分子量和电荷进行分离。
常用的凝胶层析方法包括凝胶过滤层析、凝胶电泳等。
凝胶层析可通过分子筛效应实现抗体的分离纯化。
5. 毒物素标记抗体净化:通过毒物素结合蛋白(例如A链)与抗体上Fc区的亲和作用,实现抗体的纯化。
6. 逆流层析:通过逆向液流使混合物在固相材料中逆流,根据成分的亲和力进行分离。
逆流层析可与其他纯化方法结合使用,提高纯化效果。
7. 高效液相色谱(HPLC):利用高速流动液相通过固定相分离抗体。
常见的HPLC 方法包括离子交换HPLC、亲和HPLC、尺寸排除(分子筛)HPLC和亲和逆相(含酸)HPLC等。
8. 超滤和浓缩:通过膜过滤器来去除小分子物质,实现抗体的纯化。
在进行抗体纯化过程中,可以根据特定的抗体特性和目标纯化效果的要求选择合适的方法,也可以结合多种方法进行联合纯化,提高纯化效果和纯化收率。
总而言之,抗体的纯化过程是通过利用抗体与其他成分之间的相互作用进行分离,包括物理性质(如电荷、分子量)、结构特异性(如亲和力)和化学亲和力(如特定配体结合)等。
蛋白互作的检测方法

蛋白互作的检测方法全文共四篇示例,供读者参考第一篇示例:蛋白互作是指两个或多个蛋白质相互作用形成复合物的过程。
在细胞内,蛋白质互作是非常常见的,因为蛋白质之间的相互作用对于细胞功能的调控至关重要。
研究蛋白质之间的互作关系对于理解细胞功能和疾病的发病机制具有重要意义。
为了检测和研究蛋白质的互作关系,科学家们发展了多种方法和技术。
一、酵母双杂交酵母双杂交是一种常用的方法,用于检测蛋白质之间的相互作用关系。
该方法利用酵母菌中的转录因子进行蛋白质互作的筛选。
通过将感兴趣的蛋白质与一个已知的转录因子的DNA结合域结合,构建一个"鱼钩"。
然后,将这个"鱼钩"与一个另一个已知的转录因子的激活域结合,构建一个"鱼饵"。
将这两个构建好的蛋白质构建载入酵母细胞中,观察是否有染色反应,从而判断两蛋白质之间是否相互作用。
二、共沉淀法共沉淀法是另一种常用的方法,用于检测蛋白质之间的相互作用关系。
该方法利用蛋白质之间的物理相互作用在溶液中形成复合物,通过添加沉淀剂将复合物沉淀下来,最后通过蛋白质生化分析技术检测复合物的成分。
这种方法可以用于检测蛋白质之间的直接相互作用或间接相互作用。
三、共定位法共定位法是用来检测蛋白质之间的相互作用关系的一种方法。
该方法通过检测蛋白质在细胞中的亚细胞定位来判断蛋白质之间是否有相互作用。
如果两个蛋白质在细胞内定位在同一位置,则可以判断它们之间可能存在相互作用关系。
这种方法可以通过共荧光定位或共标记等技术来实现。
四、蛋白质片段互作检测法要想检测蛋白质之间的互作关系,需要综合运用多种方法和技术。
不同的方法有不同的优缺点,可以根据具体研究目的来选择合适的方法。
通过研究蛋白质之间的互作关系,可以更深入地理解细胞功能和疾病发病机制,为进一步研究和治疗疾病提供重要依据。
【这里是否可以添加一些具体的案例以及最新研究进展,来使文章更加生动和有说服力】。
赛默飞世尔科技免疫沉淀技术指南和实验方案说明书

赛默飞世尔科技 www.thermo /proteinbiology 服务热线: 800 810 5118 400 650 5118 客服信箱:LifeScience-CNTS@thermo
1
IP、Co-IP 和 Pull-Down 实验的通用介绍
A. 免疫沉淀 (IP)
最早的免疫沉淀方法,是将放射性前体 ( 如氨基酸 ) 加入细胞培养基中,使得细胞在生长的过程中,总蛋白可以直接 被标记。裂解细胞后,利用固定在微珠支持物上的特异抗体,从蛋白混合物中纯化获得抗原。纯化所得抗原用 SDSPAGE 分离后,再通过放射自显影,将凝胶上的放射性信号显示到胶片上。
这种放射性免疫检测方法仍在使用,但有关放射性材料使用的安全性、监管和成本问题促进了非同位素方法的开 发。不同于预先标记抗原,现在更常见的方法是从裂解物中纯化抗原,采用 SDS-PAGE 分离,然后转印至膜上进行 Western Blotting 检测。灵敏的化学发光底物的问世,意味着该方法可以轻松达到与放射性技术相当的灵敏度,在抗 体亲和力一致的条件下,提供了更高的特异性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
免疫亲和纯化的关键:高亲和力与容易洗脱的优 化组合。
常见错误是将低亲和力和容易洗脱等同看待。
加入浓酸和浓碱是不行的,苛性的环境将使蛋白质变性。
凝胶过滤和离子交换层析
凝胶过滤又称凝胶柱层析、分子筛层析,利用微孔凝 胶,将不同分子量的成分分离。离子交换层析是利用一 些带离子基团的纤维素或凝胶,吸附带相反电荷的蛋白 质,将蛋白质按带电荷不同或量的差异分成不同的组分。 这两种层析如能共同应用或者反复应用其中的一种,皆 可将某一蛋白质从一复杂的组分中纯化出来。
蛋白质分离纯化的意义
①从生物材料中分离制备蛋白质,研究其结构与功能,对 于了解生命活动的规律,阐明生命现象的本质有重大意 义。
②工业生产的需要:食品、发酵、纺织、制革等工业,需 要大量的高活性的酶制剂。如用淀粉酶制造葡萄糖、麦 芽糖、糊精以及糖浆等。
③ 医疗的需要:如用猪胰岛素治疗糖尿病。 ④ 基因工程的需要:DNA合成酶、RNA逆转录酶等。
7、不能用于定量测定。
免疫亲和纯化技术发展历史:最早是将抗体作为一种结合剂 用于免疫亲和纯化,根据其自身交联产生大量多聚体和不 溶性基质原理收集抗原。随后利用抗体与惰性微珠共价结 合,虽然这是一种简单的结合,但抗体的许多反应性因缺 乏定位作用或抗体的过量结合而丧失。通过研究发现,抗 体与蛋白A和蛋白G微珠共价连接后更容易与抗原结合。将 具有良好抗原结合特性且来源广泛的各种单克隆抗体制成 免疫亲和层析柱,已成为一种最适用和有效的纯化方法。 亲和层析技术最先是由Cuatrecasas等人建立(1968年)。 BCX2003P2.PPT
ቤተ መጻሕፍቲ ባይዱ
盐析沉淀法 是最古老而又经典的蛋白质纯化 分离技术。由于方法简便、有效、不损害蛋白 抗原活性等优点,至今仍被广泛应用。
盐 析 法 原 理
盐析沉淀法的原理
因为蛋白质是亲水性大分子,所以在水溶液中有双电 层结构的水合膜,来保证分子的溶解度平衡并稳定存在。 当加入盐时,盐会电离成离子态,离子的电性破坏了蛋白 质的双电层的水合膜结构,从而使其沉降,析出。
生物工程下游技术:一般包括产物(一般为蛋白质) 的预处理及分离纯化;产品的成型加工和质量监控等一 系列单元操作和过程中的主要技术,其中生化产物及发 酵产物的分离纯化是其核心内容。下游技术是生物工程 重要组成部分,是生物高科技技术实现产业化的关键, 如:酶工程 , 发酵工程等(提取干扰素、胰岛素和酶 等)。
免疫亲和纯化技术
亲和纯化(affinity purification)是基 于目标分子与固定化配体的特异性 相互作用(如:抗原-抗体)。亲和技 术可用来从混和物中分离特定分子。 捕获目标分子用于相互作用研究, 或 从反应体系中去除某一成分。
免疫亲和纯化原理
免疫亲和纯化是一种分离各种生物大分子最有效的方法
凝胶过滤(分子筛层析)图示1
凝胶过滤(分子筛层析)图示2
离子交换层析柱
亲和层析
是利用生物大分子的生物学特异性,即生物分子 间所具有的专一性亲和力而设计的层析技术。 例如抗 原和抗体(免疫亲和层析)、 酶和酶抑制剂(或配 体)、酶蛋白和辅酶、激素和受体等之间有一种特殊 的亲和力,在一定条件下,它们能紧密地结合成复合 物。如果将复合物的一方固定在不溶性载体或共价结 合在一种惰性的微珠上,则可从溶液中专一地分离和 提纯另一方。与上述其他纯化方法相比,亲和层析能 产生相当高的纯化作用。另外,此法的优点是迅速, 有时仅一步即可达到纯化的目的。
超速离心 是分离亚细胞及蛋白质大分子的有效手
段,往往是进一步纯化的第一次过筛。超速离心又分 差速离心和梯度离心。用超速离心或梯度离心分离和 纯化抗原只是一种根据蛋白的比重特点分离的方法, 除个别成分外,极难将某一抗原成分分离出来。目前 仅用于少部分大分子抗原,如IgM、C1q、甲状腺球蛋 白等,以及一些比重较轻的抗原蛋白如载脂蛋白A、B 等。对于大量的中、小分子量蛋白质,多不适宜用超 速及梯度密度离心作为纯化手段。
影响免疫亲和层析纯化效果的因素
抗原初始相对浓度(即纯度):是决定最终产物纯度 极为重要的因素。
抗原与抗体的亲和力:是免疫亲和纯化层析过程中最 麻烦的问题。高亲和力抗体(>10-8 mol/L)能在1 h以内 达到有效的分离,而低亲和力的抗体(﹤10-6 mol/L)即 使在高浓度时也不能结合溶液中的全部抗原。使用针 对同一抗原多个表位的多克隆抗体以增强亲和力的方 法固然可结合较多的抗原,但增加了洗脱的困难性。 只有当所需的最终产物为变性蛋白时,才选用识别多 个表位的抗体。
蛋白质分离纯化
蛋白质分离纯化是用生物工程下游技术从混 合物之中分离纯化出所需要得到的目的蛋白质的 方法。蛋白质分离纯化技术是当代生物产业和生 命科学研究当中的核心技术。该技术难度和成本 均高;例如一个生物药品的成本75%都花在下游 蛋白质分离纯化当中。
生物工程上游技术:是理论的研究, 技术的开发等, 如:基因工程、蛋白质结构和功能研究等。
特点: 1、高纯化率,通常为常规纯化的1,000-10,000倍以上。 2、由于内在的背景限制,如目标抗原量非常稀少,需与其他方法结 合才能获得均质性产物。 3、快速纯化抗原,层析柱常可重复使用。可按照不同规模进行,半 天内即可完成。 4、不仅适用于纯化抗原,也可用来分离经过初步纯化的抗体,乃至 所有能与相应配体有效结合的生物分子。 5、抗体与其相应抗原结合具有高度亲和力和特异性,能大量分离天 然状态或近似天然状态的抗原。 6、需要适当纯化的抗体,不是所有的抗体都适用于免疫亲和层析, 但一旦获得一种性能良好的抗体,纯化过程就简单、快速、可靠 。
免疫亲和纯化以及免疫沉淀技术
亲和层析及沉淀的用途
亲和层析及沉淀被认为是分离纯化酶及 蛋白质的强有力的技术手段,这种方法可 以较经济有效地使用配基,能够大规模、 快速、特异性地分离、纯化酶及蛋白质。
蛋白质的功能
蛋白质(酶)存在于一切生物体中,是 非常重要的生物大分子。蛋白质是生物功能 的执行者,担负着生物催化、物质运输、运 动、防御、调控及记忆、识别等多种生理功 能。
