生活中常用的含氯消毒剂
含氯消毒剂的适用范围及注意事项

含氯消毒剂的适用范围及注意事项下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!随着人们生活水平提高,我们对家居清洁和卫生的要求不断增加。
含氯消毒剂常用浓度及配制方法

含氯消毒剂常用浓度及配制方法含氯消毒剂是一种常见且有效的消毒剂,广泛应用于卫生和公共场所,以及家庭日常清洁。
正确的配制和使用浓度对于保障消毒效果至关重要。
本文将介绍一些常用的含氯消毒剂浓度及其配制方法,以供参考。
一、常用的含氯消毒剂及其用途1. 次氯酸钠(NaClO):常见于家庭中使用的漂白水,主要用于消毒水龙头、厨房用具、医疗设备、餐具等物品的消毒。
2. 氯己定(DCCNa):常用于医疗、实验室和公共卫生场所的消毒,如医疗器械、公共交通工具等。
二、含氯消毒剂的常用浓度1. 次氯酸钠(NaClO)的常用浓度:- 家庭常用漂白水的浓度通常为2%至6%,可根据实际需要在桶装漂白水中配制出理想的浓度。
- 医疗和实验室用途的次氯酸钠浓度通常为0.1%至1%,需严格按照使用说明书的要求进行配制。
2. 氯己定(DCCNa)的常用浓度:- 一般情况下,氯己定的浓度为0.2%至0.5%。
- 在需要高度消毒力的场合,如紧急消毒、感染控制等,可增加浓度至0.5%以上,但需谨慎使用,并按照使用说明进行稀释。
三、含氯消毒剂的配制方法1. 次氯酸钠(NaClO)的配制方法:- 家庭漂白水的配制方法:a. 将1份标准漂白水浓度(一般为百分之5.25或百分之6,可以在商品包装上找到)的漂白水与4份清水混合,即可得到百分之1的漂白水。
b. 将1份百分之1的漂白水与9份清水混合,可得到百分之0.1的漂白水,适用于日常清洁和消毒。
- 医疗和实验室用途的次氯酸钠配制方法:a. 根据产品说明书,按照要求配制出所需的浓度。
b. 在实验室管理下,严格按照规定的配比和操作步骤进行稀释。
2. 氯己定(DCCNa)的配制方法:- 将氯己定药片或粉末加入一定量的水中,按比例溶解即可。
一般情况下,依据实际需要和产品说明书的要求,溶解2克至5克氯己定即可得到0.2%至0.5%的稀释液。
四、注意事项与安全措施1. 使用含氯消毒剂时,应佩戴适当的防护用品,如手套、护目镜等,以防止对皮肤和眼睛造成伤害。
详解含氯消毒剂,含氯消毒剂的使用和注意事项

(二)含氯消毒剂含氯消毒剂是指能溶于水产生次氯酸的消毒剂。
用“有效氯”这一指标衡量其氧化能力。
常见含氯消毒剂包括次氯酸钠、次氯酸钙、次氯酸、二氯异氰尿酸钠、三氯异氰尿酸、二氯海因等。
含氯消毒剂是常见消毒剂之一,因为方便、价廉,也是应对新发呼吸道传染病时应用最广泛的消毒剂之一。
属于高水平消毒剂,可杀灭包括细菌芽孢在内的各种微生物。
但有刺激性气味、腐蚀性、漂白作用和对消毒物品的损害性等缺点,过量使用还会对环境造成污染。
1.种类(1)次氯酸钠:能与水相混溶,稀释液不稳定,有效氯降低很快,84消毒液依据产品说明书,常见为2%-5%。
(2)次氯酸钙:又称漂白粉、漂白粉精,漂白粉有效氯含量为≥20%、漂白粉精有效氯含量为56%-60%。
能溶于水,溶液易浑浊,有大量残渣。
水溶液稳定性差,遇日光、热、潮湿等分解加快。
(3)次氯酸水:指原液中含有稳定次氯酸分子的水溶液,是一种新型、高水平消毒剂,气味较淡,有效氯含量一般在50-200mg/L,pH为4.0~6.8,氧化还原电位在1040mV 以上。
在室温、密闭、避光的环境中稳定性较好。
(4)二氯异氰尿酸钠:有效氯含量≥55%,常用于预防性消毒和疫源地消毒,在医院内主要用于环境和诊疗用品的消毒。
剂型有片剂、粉剂和颗粒剂。
固体制剂较稳定,水溶液的稳定性差。
(5)三氯异氰尿酸:常用于游泳池水和医院污水的消毒。
剂型有片剂泡腾片和缓释片、粉剂和颗粒剂。
泡腾片每片含有效氯量为250mg、500mg或1000mg,最常用的为500mg;缓释片剂通常有效氯含量占88%;粉剂和颗粒剂的有效氯含量占10%-90%,常见的占20%。
(6)二氯海因:白色结晶或结晶体粉末,有类似漂白粉气味。
可溶于大部分有机溶剂与浓硫酸,在水中溶解度较小。
有效氯含量为60%-70%,干燥结晶储存较稳定。
2。
常规消毒对象及使用浓度对新发呼吸道传染病消毒时,一般含氯消毒剂适用于医疗卫生机构、公共场所和家庭的一般物体表面(如桌椅、床头柜、卫生洁具、门窗把手、楼梯扶手、公交车座椅、把手和玩具等表面)医疗器械、医疗废物、食饮具、织物、果蔬和水等的消毒,也适用于疫源地各种污染物,如分泌物、排泄物、垃圾等的消毒处理。
常见含氯消毒剂

常见含氯消毒剂常见含氯消毒剂篇一一、含氯消毒剂什么是含氯消毒剂?1、是指溶于水中能产生次氯酸的消毒剂。
如:漂白粉、84消毒液(次氯酸钠)、二氯异氰尿酸钠、三氯异氰尿酸等2、有效氯能反映含氯消毒剂氧化能力的大小,有效氯越高,消毒剂消毒能力越强,反之,消毒能力越弱。
含氯消毒剂特点:1、优点:杀菌范围广;作用迅速;性能稳定;水溶性好;使用方便;货源丰富等;2、缺点:有效氯容易丧失;氯味大,刺激性大(易引起使用者流泪、结膜充血、咳嗽,并刺激皮肤和粘膜。
);金属腐蚀性强(如持物钳浸泡生锈,器械预处理浸泡生锈,消毒衣物引起洗衣机腐蚀。
);有漂白作用;有难闻的氯味。
二、选用含氯消毒剂的基本原则:价格低廉、高效方便、安全环保三、常见含氯消毒剂1、什么是84消毒液?以次氯酸钠为主要成份的无机含氯消毒剂。
次氯酸钠单分子状态下的含氯量为10%,因此有效氯的含量较低,消毒能力较弱。
常见产品:中光84消毒液2、84消毒液的特点:2.1、优点:杀菌广泛、快速,使用方便,无毒性,价格低廉。
2.2、不稳定,遇光和热都会分解,因此,避光密封保存有利于其稳定性。
对棉布和纸张有漂白作用,对金属表现出腐蚀作用,浓度高时对皮肤有刺激作用。
3、常见84消毒产品的临床实际操作临床实际操作以及在销售和临床使用过程中的问题分析。
1、二氯异氰尿酸钠是什么?二氯异氰尿酸钠又名优氯净,属于氯化异氰尿酸类消毒剂。
有效氯含量为60%-64%,杀菌能力较强。
常见产品:中光消毒片、顺发消毒片、万福金安消毒片等等2、二氯异氰尿酸钠的特点:2.1、优点:杀菌范围广,杀菌力强,储存稳定,易于运输,水溶性好,使用方便,适用范围广,2.2、缺点:水溶性不稳定(20度左右时,1周内有效氯约丧失20%;30度左右时,可丧失50%);有刺激性气味,对金属有腐蚀性和对纺织品有损坏作用,低浓度下的杀菌作用不及次氯酸钠3、常见二氯产品的临床实际操作以及在销售和临床使用过程中的问题分析。
常用的化学消毒剂-基础护理学【优质推荐】

常用的化学消毒剂-基础护理学【优质推荐】常用的化学消毒剂-基础:(1)高效类消毒剂:能杀灭一切微生物,包括芽胞。
1)过氧乙酸:0.2%溶液用于手的消毒,浸泡2min;0.5%溶液用于餐具消毒,浸泡30~60min;1%~2%溶液用于室内空气消毒;l%溶液用于体温表消毒,浸泡30min.过氧乙酸对金属有腐蚀性,不能浸泡金属类物品。
应现配现用并放于阴凉处,以防高温引起爆炸。
2)戊二醛:2%戊二醛常用于浸泡金属器械及内镜等,消毒时间需30~60min,灭菌时间需10h.应现配现用。
3)甲醛:40%甲醛熏蒸消毒空气和某些物品;4%~l0%甲醛用于浸泡器械及内镜。
甲醛蒸汽穿透力弱,消毒的物品须悬挂或抖散。
熏蒸消毒要求室温在18℃以上,相对湿度在70%~90%.4)含氯消毒剂:常用的有氯胺T、漂白粉、二氯异氰脲酸钠(优氯净)。
0.5%漂白粉溶液或0.5%~l%氯胺溶液用于消毒餐具、便器等,浸泡30min.1%~3%漂白粉,溶液或0.5%~3%氯胺溶液用于喷洒或擦拭地面、墙壁及物品表面。
干粉用于消毒排泄物。
漂白粉与粪便1:5用量搅拌后,放置2h,尿液每lOOml加漂白粉lg,放置lh.消毒剂应现配现用,保存在密闭容器内,置于干燥、阴凉、通风处。
因有褪色和腐蚀作用,不宜用于金属制品、有色衣物及油漆家具的消毒。
5)过氧化氢6)碘酊:2%碘酊用于皮肤消毒和一般皮肤感染,涂擦后20s,再用75%乙醇脱碘。
碘酊不能用于黏膜消毒。
皮肤过敏者禁用。
碘对金属有腐蚀作用,不能浸泡金属器械。
用后需加盖保存。
(2)中效类消毒剂:杀灭细菌繁殖体、病毒,不能杀灭芽胞。
1)乙醇:75%乙醇用于皮肤消毒,也可用于浸泡锐利金属器械及体温计。
95%乙醇可用于燃烧灭菌。
乙醇易挥发,故应加盖保存并定期测试,以保持有效浓度。
乙醇有刺激性,不宜用于黏膜及创面消毒。
应存放于阴凉、避火处。
2)碘伏:5%碘伏溶液用于皮肤消毒;20%溶液用于消毒体温计,应连续浸泡2次,每次30min.碘伏稀释后稳定性差,故宜现配现用,还应密闭、避光、置阴凉处保存。
含氯消毒剂配置方法

含氯消毒剂配置方法含氯消毒剂配置方法泡腾片是一种常见的含氯消毒剂,可用于消毒各种物品和表面。
其配制浓度可根据需要选择500mg/L、1000mg/L或2000mg/L。
配制方法如下:500mg/L浓度:将1片泡腾片加入1000ml水中;1000mg/L浓度:将2片泡腾片加入1000ml水中;2000mg/L浓度:将4片泡腾片加入1000ml水中。
另一种常见的含氯消毒剂是84消毒剂。
其配制浓度也可根据需要选择500mg/L、1000mg/L或2000mg/L。
配制方法如下:500mg/L浓度:将10ml原液加入1000ml水中;1000mg/L浓度:将20ml原液加入1000ml水中;2000mg/L浓度:将40ml原液加入1000ml水中。
医院中常用的消毒浓度及浸泡时间如下表所示:消毒物品名称。
| 有效氯含量(mg/L) | 浸泡时间(min)|湿化瓶、压脉带、血压计袖带、压舌板、呼吸机、雾化面罩 | 500.| 30.|抹布。
| 500.| 30.|拖把。
| 1000.| 30.|桌子、椅子、床头柜、门窗、各种物表和地面。
| 500.| 擦拭。
|病历、门把手、水龙头。
| 500.| 擦拭。
|洗手池、卫生间、便池。
| 1000.| 擦拭或喷雾。
|各种物表及地面明显污染。
| 1000.| 擦拭或拖洗。
|墙面。
| 500 或 1000.| 擦拭。
|以上资料仅供参考。
我们致力于为企业和个人提供合同协议、策划案计划书、研究资料等服务,打造全网一站式需求平台。
欢迎您的下载。
含氯,臭氧,乙醇消毒剂的优缺点和使用方法

各种消毒剂的优缺点2020.02 本文对1、含氯消毒剂2、臭氧3、乙醇消毒剂的优缺点做一说明。
文章转自网络。
1、含氯消毒剂凡是能溶于水,产生次氯酸的消毒剂统称含氯消毒剂。
它是一种古老的消毒剂,但至今仍然是一种优良的消毒剂。
通常所说的含氯消毒剂中的有效氯,并非指氯的含量,而是消毒剂的氧化能力,相当于多少氯的氧化能力。
该消毒剂分为以氯胺类为主的有机氯和以次氯酸为主的无机氯。
前者杀菌作用慢,但性能稳定,后者杀菌作用快速,但性能不稳定。
常见消毒剂型:①液氯,含氯量大于99.5%(V/V);②漂白粉:含有效氯25%(W/W);③漂白粉精:含有效氯80%(W/W);④三合二,含有效氯56%(W/W);⑤次氯酸钠,工业制备的含有效氯10%(W/W);⑥二氯异氰尿酸钠,含有效氯60%(W/W);⑦三氯异氰尿酸,含有效氯85-90%(W/W);⑧氯化磷酸三钠,含有效氯2.6%(W/W)。
杀菌原理:含氯消毒剂的杀菌机理有3点:①次氯酸的氧化作用:次氯酸为很小的中性分子,它能通过扩散到带负电荷的菌体表面,并通过细胞壁穿透到菌体内部起氧化作用,破坏细菌的磷酸脱氢酶,使糖代谢失衡而致细菌死亡;②新生态氧的作用,由次氯酸分解形成新生态氧,将菌体蛋白质氧化;③氯化作用,氯通过与细胞膜蛋白质结合,形成氮氯化合物,从而干扰细胞的代谢,最后引起细菌的死亡。
主要优缺点:优点:①杀菌谱广、作用迅速、杀菌效果可靠;②毒性低;③③使用方便、价格低廉。
缺点:①不稳定,有效氯易丧失;②对织物有漂白作用;③有腐蚀性;④易受机物,pH等的影响。
杀菌作用通常能杀灭细菌繁体、病毒、真菌孢子及细菌芽胞。
使用方法常用的消毒灭菌方法有浸泡、擦拭、喷洒与干粉消毒等方法。
①浸泡法:将待消毒或灭菌的物品放入装有含氯消毒剂溶液的容器中,加盖。
对细菌繁殖体污染物品的消毒,用含有效氯200mg/L的消毒液浸泡10分钟以上;对肝炎病毒和结核杆菌污染物品的消毒,用含有效氯2000mg/L 的消毒液浸泡30分钟以上;对细菌芽胞污染物品的消毒,用含有效氯2000mg/L的消毒液浸泡30分钟。
含氯消毒剂的配制及应用
≥15
擦拭
一般物品
40 ml:100 ml
10000
≥15
浸泡
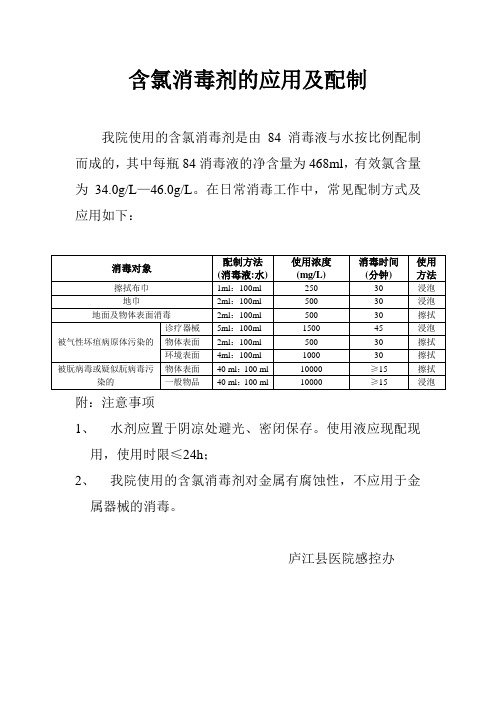
附:注意事项
1、水剂应置于阴凉处避光、密闭保存。使用液应现配现用,使用时限≤24h;
2、我院使用的含氯消毒剂对金属有腐蚀性,不应用于金属器械的消毒。
庐江县医院感控办
250
30
浸泡
地面及物体表面消毒
2ml:100ml
500
30
擦拭
被气性坏疽病原体污染的
诊疗器械
5ml:100ml
1500
45
浸泡
物体表面
2ml:100ml
500
30
擦拭
环境表面
4ml:100ml
1000
30
擦拭
被朊病毒或疑似朊病毒污染的
物体表面
40 ml:100 ml
含氯消毒剂的应用及配制
我院使用的含氯消毒剂是由84消毒液与水按比例配制而成的,其中每瓶84消毒液的净含量为468ml,有效氯含量为34.0g/L—46.0g/L。在日常消毒工作中,常见配制方式及应用如下:
消毒对象
配制方法
(消毒液:水)
使用浓度(mg/L)
消毒时间
(分钟)
使用方法
擦拭布巾
1ml:100ml
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
V煅●烧实,验得基到本固操体作 已 I中●知,计:加在算足热量水的中铁分屑解出除废液中的,该反应的离子方
程式是
研究高考试题
从高考试题看 考试内容的变化
单纯考查元素化合物知识的试题减少, 考查元素化合物知识应用的能力要求提高 考查元素化合物的知识方式发生变化
电化学总反应方
程式书写
(4)高铁酸盐是比高锰酸盐更强的氧化剂,研究 证明它是一种“绿色环保高效”净水剂,比目前国 内 质 的外:杀广 如 菌泛 漂 效使 白 果用 粉 ,的 、 但含氯不氯气能饮和将用二水水氧中消化的毒氯悬剂等浮(,杂物用它 质均质及们 除为的 水具 去含实 解有 ,氯际 平很 为的应 衡好 了物 除去水中的细微悬浮物,还需另外添加絮凝剂,如 聚合铝的氯化物。)的性能更为优良,为什么说它 作为净水剂是“绿色环保高效”的?
中发生的特征变化,不仅能够实现物质或能量的转化,还用
于化学的定性或定量研究。
+2
①
+3
②
+6
Fe
④
Fe
③
Fe
已知FeO42-只能在强碱性介质中稳定存在,在酸性介质或水
中不稳定:
4FeO42-+20 H+ ==4Fe3+ + 3O2 +10 H2O; 4FeO42-+10 H2O== 4Fe(OH)3 +3O2 +8 OH-
请利用下列用品:FeCl2溶液(浅绿色)、FeCl3溶液 (黄色)、Na2FeO4溶液(紫红色)、铁粉、KSCN 溶液、NaOH溶液、NaClO溶液、盐酸、金属锌片、
惰性电极(或放电物质做电极)材料、蒸馏水及必
要的实验仪器。
简单实验设计
完成下列任务:
(1)设计一个实现上述转化①或者④的实验方案(要求产
水解
氧化还原反应
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学
方程物式质为结_构_和。 答案元:素S周O期2+律Cl2+2H2O==H2SO4+2HCl
(5)比较Y、Z气态氢化物的稳定性__>__(用分子式表 示)
答案: HCl>H2S
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的 顺序是:__>__>__>__。
答案:该净水剂在杀菌消毒的过程中被还原为+3价 的铁,形成具有强吸附性的氢氧化铁,通过吸附与 水中的细微悬浮物共同聚沉,对环境和生命体都不 会构成危害。
研究高考试题
元素周期律及离
(2008年天津26) W、X、Y、Z是原子序子数方依程次式增书大写的同一
短同期元素,W、X是金属元素,Y、Z是非金属元素。
研读考试说明
与《考试大纲(课标版)》 作对比(考核目标和要求)
考试大纲 了解常见金属的活动顺序
考试说明
能应用金属活动顺序表解释某些现象和判断 反应
了解常见金属及其重要化合物的 根据研究物质性质的思路和方法,掌握常见
主要性质及其应用
金属及其重要化合物的主要性质及其应用
了解常见非金属及其重要化合物 根据研究物质性质的思路和方法,掌握常见
物纯净),写出简要的实验步骤。
答案:④:在三氯化铁溶液中加入过量的铁粉,充分
反应后,过滤,滤液在氯化氢的蒸气中蒸干,可得
氯化亚铁固体。
(2)在浓碱中,用NaClO可以实现转化②,这一反应
的离子方程式为(不必配
平):
。
答案:
3ClO-+ 2Fe(OH)3+4OH- = 2FeO42-+ 3Cl-+5H2O
研读考试说明
考试说明的变化 (对化学思想方法的要求)
化学思想方法是首化次学提知出识考在更高层次上的抽象 和概括,它蕴含在化查学考知生识化发学生、发展和应用的过 程中,因此,对化学思思想想方方法法的考查必须与化学知 识的考查结合进行。
化学思想方法包括学科特有的思想方法如:物 质变化是有条件的、结构与性质、宏观和微观、假 说、模型和实验等,也包括一些哲学思想方法在化 学学科中的应用,如定性与定量、分类与比较、量 变与质变、一般与特殊等。
* 化学基础的考试 * 以能力立意命题
研究高考试题
考查的微粒在教材中
找不到踪迹,陌生度
极高,形成强烈的心
(铁重2盐要00、的7年高角铁色山酸。东盐这29等些)铁铁化合的合金重物是要之金化间属合可材物以料也相王在互国理取识不转的干的才同化霸预 信 能领,主。息作域利,只结答中用亚有合。个转铁利已扮化盐用有演过、获知着程
的主要性质及其应用
非金属及其重要化合物的主要性质及其应用
研读考试说明
与《考试大纲(课标版)》 作对比(考核目标和要求)
新增点的理由: (1)课程标准:
必备的基础
(2)教材和教学: 渗透化学思想方法的教育
(3)化学高考:
“化学的基础知识和基本 技能”、“基本的化学思 想”、“研究物质和认识 化学的基本方法”和“化 学观念”
(2009北京26) 以富含硫酸亚铁的工业废液为原料生
●产变氧化价铁铁的相工互艺转如化下((熟部悉分的操作氧和化条还件原略反)应;) III从●将废硫溶液液酸中与对提稍F纯e过2并+量水结的解晶溶平处液衡F混e的S合O,影4·得7响H到(2O含平的衡浊原液理) IV●将2浊个液陌过生滤反,应用,90其°中C热一水个洗氧涤化沉还淀,原干反燥应后得
答(案7:)ZS的2-最>高C价l->氧N化a物+>为无Al色3液+ 体,0.2化5学m反ol该应物与质能与量一
定量水混合得到一种稀溶 液,并放出Q Kj的热量。写出该反 应的热化学方程式:________。
答案: Cl2O7(l)+H2O(l)==2HClO4(aq);ΔH=- 4QkJ/mol
研究高考试题
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐
和水,该反应的离子方程式为__。
答案: Al(OH)3+OH-==AlO2 - +2H2O
(2)W与Y 可形成化合物W2Y,该化合物的电子式为__。
答案:
物质结构
(3)X的硝酸盐水溶 液显__性,用离子方程式解释原因
__。
答案:酸 Al3++3 H2O ==Al(OH)3+3H+
离子反应及陌生 化学方程式书写
(3)一种新型高能碱性电池利用了转化③将化学能 转化为电能,该电池由电解质(KOH水溶液)、 K2FeO4、金属锌及必要的填充材料构成。该电池放 电时发生反应的化学方程式为(不必配平):
。
答案:
2K2FeO4 + 3Zn + 6H2O == 2Fe(OH)3 +
3Zn (OH)2
