实验室里研究不同价态硫元素间的转化
不同价态硫元素间的转化

《第三节硫的转化》导学案实验室里研究不同价态硫元素间的转化学习目标1、通过在实验室探究不同价态硫元素之间的相互转化,能够运用氧化还原反应寻找合适的氧化剂和还原剂,实现不同价态硫元素之间的相互转化。
2、二氧化硫是酸性氧化物,具有酸性氧化物的通性,还具有氧化性和还原性,能够与氧气、氯水、硫化氢等物质发生反应,另外还具有漂白性,能使品红等有色物质褪色。
3、通过硫元素在生产、生活中转化的实例,了解酸雨的危害,能够提出减少向大气中排放二氧化硫的措施。
实验报告☆实验目的:探究硫元素不同价态间的转化关系。
☆实验预测:硫元素常见的化合价有,不同价态间的硫元素可以相互转化,寻求合适的氧化剂或还原剂来实现0价、+4价、+6价硫元素之间的转化。
☆知识准备:1、选择下列三种价态S元素的代表物质0价:+4价:+6价:2.研究该转化的理论依据。
3.SO2气体可以由亚硫酸钠和浓硫酸反应来制备。
4.SO2能使品红溶液褪色,可以用这一性质来检验SO2。
5.常见的氧化剂有:酸性高锰酸钾溶液,氯水,溴(Br2)水、硝酸、浓硫酸、氧气等。
常见的还原剂有:C、CO、H2、H2S,KI,金属单质(Cu、Fe…)等。
☆设计要求:1.方案设计时先个人思考,然后小组讨论形成。
2.设计方案时要先明确用什么试剂来实现该转化。
再考虑如何操作还要考虑如何才能判断是否实现了这一转化。
3.设计的方案尽量减少环境污染(二氧化硫,硫化氢有毒)要考虑尾气处理。
提供试剂:硫黄,亚硫酸钠,浓硫酸,氢硫酸,氢氧化钠溶液。
酸性高锰酸钾,KI溶液,酚酞,氯化钡溶液,碘水,品红溶液,铜片,溴水。
1、二氧化硫的性质⑴物理性质:通常状况下,二氧化硫是一种色,味毒的气体,易溶于水(1:40),容易液化(沸点-10℃)密度比空气大。
⑵化学性质:①酸性氧化物的通性:与碱溶液(如氢氧化钠溶液)反应,化学方程式与水反应化学方程式②氧化性:如与H2S气体反应。
化学方程式③还原性:如与氧气反应。
硫的转化

硫的转化第2课时不同价态硫元素间的转化酸雨及其防治【学习内容】一.实验室里研究不同价态硫元素间的转化(一)预测不同价态硫元素的性质价态性质-2价的S0价的S+4价的S+6价的S(二)硫的几种常见的化合物1、SO2的性质A:物理性质:二氧化硫是一种色气味的毒气体,易溶于水且生成,说明二氧化硫是一种氧化物。
B化学性质:(1)酸性氧化物(与CO2性质相似)SO2+H2O===(是它的酸酐)SO2+NaOH===+(SO2少量)SO2+NaOH===(SO2过量)(2)氧化性:SO2→S(3)还原性:SO2→SO42-(4)漂白性:现象:将SO2通入品红溶液后,品红溶液很快变为溶液。
再加热后,无色溶液又重新恢复为色。
原理:。
总结]总结学过的有漂白性的物质,并分析它们的漂白原理有何不同?迁移应用]①将SO2通入到紫色石蕊试液中,褪色,而将Cl2通入到紫色石蕊试液中,先,后。
②将等物质的量的SO2和Cl2的混合气体通入到品红试液中,发现品红并不褪色。
解释其原理。
2、浓H2SO4的性质A:物理性质:通常浓硫酸是无色油状液体,难挥发,与水以任意比混溶,溶解时放出大量热。
(稀释浓硫酸时应将浓硫酸沿容器内壁缓缓注入水或溶液中,并用玻璃棒不断搅拌。
)B:化学性质:(1)强氧化性①与金属的反应浓H2SO4+Cu△++思考](1)此反应中表现了浓H2SO4的什么性质?氧化剂与还原剂的物质的量之比是多少?(2)反应规律:浓H2SO4+金属△++合作探究]常温下,为何盛浓H2SO4的容器可以用铁(铝)制品?②与非金属的反应浓H2SO4+C△++思考]1.在此反应中浓H2SO4表现了什么性质?2.浓H2SO4、稀H2SO4的氧化性有何不同?(2)吸水性将浓H2SO4放置在空气中,其质量会。
所以,可以用浓H2SO4来干燥、气体。
(3)脱水性浓硫酸把蔗糖、木屑、纸屑和棉花等物质中的有机物按水分子中氢氧原子数的比(2∶1)夺取被脱水物中的氢原子和氧原子。
研究不同价态硫元素间的转化

2SO3
二氧化硫 可使品红 褪色
3、浓硫酸有强氧化性 、 S+2H2SO4 = 3SO2+2H2O Cu+2H2SO4 = SO2+2H2O+CuSO4
加热 加热
说明
不同价态的硫的相互转化, 不同价态的硫的相互转化,在工农业 生产中有重要用途。 生产中有重要用途。 化学与技术—硫酸的工业生产 化学与技术 硫酸的工业生产
预测与假设: 预测与假设: 只有氧化性的物质是: 只有氧化性的物质是:H2SO4 只有还原性的物质是: 只有还原性的物质是: 两者都有的物质是: 、 两者都有的物质是: S、SO2
研究方案: 研究方案:
1、0价硫的转化(见硫的性质实验) 、 价硫的转化 见硫的性质实验) 价硫的转化( 2、+4价硫的转化 、 价硫的转化 A、将H2S和SO2混合 、 和 B、向BaCl2溶液中通入SO2,在加入 、 溶液中通入 氯水或硝酸 3、+6价硫的转化 、 价硫的转化 A、在试管中加入少量的硫粉,再加 、在试管中加入少量的硫粉, 入浓硫酸,并加热, 入浓硫酸,并加热,用湿润的品红试 纸,放于管口 B、将上述硫粉改为铜实验 、
品红试 纸变红 品红试 纸变红
S+2H2SO4 = 3SO2+2H2O
加热
有+4价S产生 价 产生
浓硫酸与铜
加热 Cu+2H2SO4 = SO2+2H2O+CuSO4
小结 1、S有氧化性,也有还原性 、 有氧化性 有氧化性, 2、SO2既有氧化性,又有还原性 、 既有氧化性, SO2+2H2S=3S+2H2O 2SO2+O2
硫酸生产反应式
实验室里不同价态硫元素的转化

生成淡黄色浑浊
+4价的硫被还原为0价
SO2与NaOH的酚酞溶液 SO2与品红溶液
溶液的红色褪去 溶液的红色褪去
具有酸性氧化物的通性 SO2有漂白性
4、SO2的漂白性
能够漂白品红等有色物质,在一定条件下会恢复原来的颜色。 可应用于鉴别SO2
实验中的“异常”现象
加热SO2漂白后的品红溶液会恢复红色, 但冷却之后过一段时间又褪色了。
1、SO2酸性氧化物的通性 2、SO2的氧化性 3、SO2的还原性
实验验证
实验药品:Na2SO3固体,浓硫酸,Na2S溶液,NaOH溶液,酚酞试液、 酸性KMnO4溶液,FeCl3溶液,石蕊试液,品红溶液、溴水
思考:实验室中如何制得SO2? 注意:由于SO2有毒,因此我们做实验时要注意什么问题?
创意:3个微项目、微胶囊技术P35-微实验
分类
•三 •四 •五 •六 •七
• 语文 • 数学 • 英语 • 物理 • 化学 • 生物
方法很重要
根据元素组成对物质进行分类,课本P44 研究物质性质的基本程序,课本P13
研究物质性质的基本方法 观察 、 实验 、 分类 、 比较 等 课本P9
硫及其化合物的“价-类”二维图
+6
SO3 H2SO4 Na2SO4
三、SO2的用途:
食品添加剂,可用作漂白剂、防腐剂、抗氧化剂P98
谈谈你对高中生活的体会:
小试身手
1、下列关于二氧化硫的说法中,不正确的是( B )
A、能使某些有色物质褪色
B、无色,有刺激性气味,无毒 C、既具有氧化性,又具有还原性SO2
D、既可溶于水,又可与水反应
2、下列物质中,能用于鉴别二氧化硫和二氧化碳的是( AB )
实验活动2——不同价态含硫物质的转化

实验现象
混合物保持红热,冷却后得到黑色固体
实验结论
单质硫被还原为S2-
转化反应的化学方程式
S+Fe FeS
[实验拓展]不同价态含硫物质的转化
(1)实现不同价态含硫物质的转化,首先要明确有哪些不同价态的含硫物质,其次是用什么方法实现这些物质间的转化。下面是不同价态的含硫物质。
C.Na2SO3+Na2SO4D.SO2+Na2SO3
(4)工业制硫酸中,转化②是在________(填设备名称)进行的。进行转化③时,不用水而用98.3%的浓H2SO4吸收SO3,原因是_________________________。
(5)NaHSO4溶液显强酸性,向NaHSO4溶液中滴入Ba(OH)2溶液,恰好使溶液呈中性,则发生反应的离子方程式为_________________________________________________________
(3)整个装置设计有一处不合理是____________________________________________。
Ⅱ.探究SO2的性质
在装置C中先后四次加入同浓度同体积不同情况的钡盐溶液,控制食用油油层厚度一致、通入SO2流速一致。四次实验现象如下表:
A.燃煤时为减少X的排放,可在煤中添加石灰石
B.X有漂白性,可使石蕊溶液先变红后褪色
C.Z与铁反应时,Z的浓度越大,反应速度越快
D.N可由其相应单质直接化合生成
答案A
2..如图所示为硫元素的单质及其化合物的价类二维图,其X、Y、Z、W为含硫化合物,下列说法正确的是()
实验室里研究不同价态硫元素间的转化

0
点燃 +4
S+O2 === SO2
+4 氧化剂 +6
S
S
实验2:二氧化硫与氯水反应
+4
+6
SO2+Cl2+2H2O=H2SO4+2HCl
BaCl2+H2SO4=BaSO4↓+2HCl
-- 精品--
小结:①S0
氧化剂
+4 氧化剂+6
S
S
催化剂
②SO2,Na2SO3也可以被O2氧化:2SO2+O2 =△==2SO3
浓H2SO4的化学性:强氧化性
△
①与金属单质反应:Cu+2H2SO4(浓) CuSO4+SO2 ↑+2H2O ②与非金属单质反应:C+2H2SO4(浓) △ CO2↑+2SO2 ↑+2H2O ③冷的浓H2SO4将Fe、Al钝化
[工业制H2SO4的流程]
点燃
第一步:制取SO2:S+O2 === SO2
通过本节课的学习,强化了氧化还原反应的有关理论。
-- 精品--
二、说教学目标
1.知识目标
通过探究学习掌握0、+4、+6硫元素间的相互转化,初步 了解SO2的性质
2.能力目标
培养学生思维能力,观察能力,分析和解决问题的能力, 渗透并培养学生的探究意识。
3 .情感目标
培养学生严谨的科学态度和合作精神。
其次,实现不同价态硫元素间的相互转化,依据的主要是氧 化还原反应规律,需要寻找合适的氧化剂,还原剂。
实验室里备有的试剂:硫黄,Na2SO3,较浓的硫酸,氯水, 酸性KMnO4溶液,BaCl2溶液、氢硫酸,铜片等。
高二化学精品课件 研究不同价态硫元素间的转化

第二步:
催化剂
2SO2 + O2 加 热 2SO3
第三步: SO3 + H2O
H2SO4
8
(3)生产流程
硫酸的工业生产 硫酸工业生产流程动画
沸腾炉
接触室
吸收塔
净 化
冷却
9
阅读 化学与技术—硫酸的工业生产
练习 P88 1(2)、(4)、(5)
作业 P88 2、4、5
7
硫酸的工业制法——接触 硫酸生产反应式 法制硫酸
(1)主要原料:硫铁矿(又称黄铁矿,主
要成分是FeS2)、空气、98.3٪浓硫酸。
(2) 生产e2O3 + 8SO2
研究方案:
1、0价硫的转化(见硫的性质实验) 2、+4价硫的转化 A、将H2S和SO2混合 B、向BaCl2溶液中通入SO2,在加入 氯水或硝酸 3、+6价硫的转化
A、在试管中加入少量的硫粉,再加 入浓硫酸,并加热,用湿润的品红试 纸,放于管口
B、将上述硫粉改为铜实验
3
2A 2B 3A
3B
有S产生 硫酸与Na2SO3、 两种气体混合 SO2+2H2S= 盐酸与FeS 有黄色固体 3S+2H2O
SO2转化为SO42有+4价S产生
硫酸与Na2SO3、 加氯水后有 BaCl2、氯水 白色沉淀
浓硫酸与硫
品红试 纸变红
SBOa22+++CSlO2+422-H2O= 2HCl2+=HB2aSSOO44
加热
S+2H2SO4 = 3SO2+2H2O
有+4价S产生 浓硫酸与铜
品红试 纸变红
加热 Cu+2H2SO4 = SO2+2H2O+CuSO4
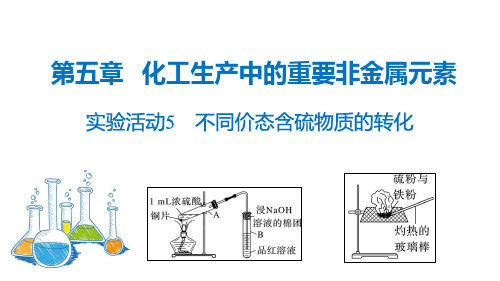
实验活动5 不同价态含硫物质的转化(人教版2019化学必修第二册)
2.硫及其化合物的“价—类”二维图体现了化学变化之美。下列有关说 法正确的是( B )
A.硫在氧气中燃烧直接生成Y B.Z与Cu反应,体现了Z的酸性和强氧化性 C.硫化氢与X反应的氧化产物和还原产物的物质的量之比为1:2 D.N可由其相应单质直接化合生成
3.我国科学家被遴选为“全球青年化学家元素周期表硫元素代言人”。
【实验步骤】 1.硫化钠转化为单质硫 (1)实验操作
(2)实验现象 甲:有_淡__黄__色__沉__淀__生成;乙:紫红色_褪__色__,产生_淡__黄__色__沉__淀__。 (3)实验结论 S2-能被H2SO3溶液及酸性KMnO4溶液_氧__化__生成_单__质__S_。
2.浓硫酸转化为二氧化硫 (1)实验装置及操作
4.已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转 化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法 正确的是( D )
A.X使蔗糖变黑的现象主要体现了X的强氧化性 B.若A为铁,则足量A与X在室温下即可完全反应 C.若A为碳单质,则将C通入少量的澄清石灰水中,最后有白色沉淀 产生
转化前的含硫物质 Na2S H2SO3 H2SO4 S
转化后的含硫物质 S S
SO2 FeS
价态变化 -2→0 +4→0 +6→+4团塞住试管口的作用是什么?
【答案】吸收实验过程中可能产生的有毒气体硫化氢和二氧化硫。 3.铁粉与硫粉在空气中混合燃烧时,可能发生哪些反应?
(3)将SO2通入以下溶液,均会发生颜色变化,其中体现SO2还原 性的是__A___(填序号)。 A.使溴水褪色 B.使品红溶液褪 色有机硫 C.使滴有酚酞的氢氧化钠溶液褪色 D.使氢硫 酸溶液中出现淡黄色浑浊
(4)硫元素的部分转化如图所示。过程①可利用克劳斯法实现,该 法先将部分H2S通过燃烧转化为SO2,再将SO2与剩余的H2S混合。为实 现硫的最大回收,燃烧的H2S和剩余的H2S物质的量之比应为_1_:__2_。过 程②宜在土壤的_富__氧__区实现(填“富氧”或“缺氧”)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[探究课题]
↓
↑
S
0
+4
S
+6
S
[探究准备]探究不同价态硫元素间的相互转化,实际上是探究含 有不同价态硫元素的物质间的相互转化。
0 +4
首先,选择含有这三种价态硫元素的物质,如硫黄(S)SO2(或
Na2SO3)、H2SO4。 其次,实现不同价态硫元素间的相互转化,依据的主要是氧 化还原反应规律,需要寻找合适的氧化剂,还原剂。 实验室里备有的试剂:硫黄,Na2SO3,较浓的硫酸,氯水,
+6
0 小结:①S
氧化剂
+4 S
氧化剂+6
S
②SO2,Na2SO3也可以被O2氧化: 2SO2+O2 ===2SO3
△
催化剂
+4 还原剂 0 S S 实验3:二氧化硫与氢硫酸反应
+4 -2 0
SO2 +2H2S==3S↓+2H2O
+6 S
还原剂
+4 S
+6 △ +4
实验4:铜与浓硫酸反应(需要加热) 原理: Cu +2H2SO4(浓)==CuSO4+SO2↑+2H2O
二、说教学目标
1.知识目标
通过探究学习掌握0、+4、+6硫元素间的相互转化,初步 了解SO2的性质
2.能力目标
培养学生思维能力,观察能力,分析和解决问题的能力, 渗透并培养学生的探究意识。
3 .情感目标
培养学生严谨的科学态度和合作精神。
三、说重点、难点
本节重点难点: 探究不同价态硫元素间的转化的方法, 二氧化硫的化学性质。
四、说 教 法
本节采用实验引导探究法,即:提出探究课题—探 究准备—探究方案的设计与实施—归纳总结。
教学过程中利用现代技术多媒体辅助教学。
五、说学法
探究式方法:充分体现以教师为主导、学生为主体的
原则,引导学生分析→设计→观察→讨论→归纳,使
学生学会观察问题分析问题的方法。
六、说教学过程
[复习提问]1.氧化还原反应:在反应过程中有元素化合 价变化的化学反应。
硫的转化(第二课时)
实验室里研究不同价态 硫元素间的转化
说课者: 李 瑞 娟
单 位: 明湖中学
说教材
说教学目标
说重点、难点 说教法
说学法
说教学过程
一、说 教 材
“实验室里研究不同价态硫元素间的转化”,是必修1
第3章第3节第2课时的内容。
教材已经介绍了《碳的多样性》,《氮的循环》之后
引入该节内容。因此,学生对于研究物质性质的方法和 程序已有一定的基础,可以进行简单的实验探究活动。 通过本节课的学习,强化了氧化还原反应的有关理论。
小结:0 S
还原剂
+4 S
还原剂
+6 S
归纳总结
1.不同价态硫元素之间的相互转化关系:
强氧化剂
强还原剂
2.含有不同价态硫元素的物质间的转化与氧化还原反应有关,只要选 择合适的氧化剂、还原剂就可以实现其他含有不同价态硫元素物质间 的相互转化。 3.SO2和浓H2SO4的化学性质
SO2的化学性质 氧化性:SO2 +2H2S==3S↓+2H2O
+4 +6
酸性KMnO4溶液,BaCl2溶液、氢硫酸,铜片等。
[探究设计与实施]
0 氧化剂 +4 S S 实验1:硫在空气中燃烧(SO2有毒,妥善处理有毒气体)。
0
S+O2 === SO2 +4 氧化剂 +6 S S 实验2:二氧化硫与氯水反应
+4
点燃 +4
SO2+Cl2+2H2O=H2SO4+2HCl BaCl2+H2SO4=BaSO4↓+SO2+O2 ===2SO3 △ 酸性氧化物:SO2+2NaOH =Na2SO3+H2O
浓H2SO4的化学性:强氧化性 ①与金属单质反应:Cu+2H2SO4(浓) ③冷的浓H2SO4将Fe、Al钝化
[工业制H2SO4的流程]
△
CuSO4+SO2 ↑+2H2O
②与非金属单质反应:C+2H2SO4(浓) △ CO2↑+2SO2 ↑+2H2O
2.常用的氧化剂:有酸性KMnO4溶液、氯水、硝酸、
氧气等; 常用的还原剂:有硫化氢、碘化钾、金属单质、氢 气、一氧化碳等。 3.标出硫黄(S)、SO2、H2SO4中硫元素的价态。
0 +4 +6
[引入新课]含硫元素的物质在自然界中依靠大自然的作
用进行相互转化,这节课我们自己设计实验,探究在实验 室里O、+4、+6价这三种价态硫元素间的转化。
第一步:制取SO2: S+O2 === SO2 第二步:SO2的催化氧化:2SO2+O2 ===2SO3
△
催化剂
点燃
第三步:SO3的吸收:SO3+H2O=H2SO4
[随堂练习]整理探究过程中涉及到的化学方程式:
[板书设计]
[布置作业]:课后习题第5题
