实验室不同价态硫元素之间的转化
不同价态硫元素间的转化

《第三节硫的转化》导学案实验室里研究不同价态硫元素间的转化学习目标1、通过在实验室探究不同价态硫元素之间的相互转化,能够运用氧化还原反应寻找合适的氧化剂和还原剂,实现不同价态硫元素之间的相互转化。
2、二氧化硫是酸性氧化物,具有酸性氧化物的通性,还具有氧化性和还原性,能够与氧气、氯水、硫化氢等物质发生反应,另外还具有漂白性,能使品红等有色物质褪色。
3、通过硫元素在生产、生活中转化的实例,了解酸雨的危害,能够提出减少向大气中排放二氧化硫的措施。
实验报告☆实验目的:探究硫元素不同价态间的转化关系。
☆实验预测:硫元素常见的化合价有,不同价态间的硫元素可以相互转化,寻求合适的氧化剂或还原剂来实现0价、+4价、+6价硫元素之间的转化。
☆知识准备:1、选择下列三种价态S元素的代表物质0价:+4价:+6价:2.研究该转化的理论依据。
3.SO2气体可以由亚硫酸钠和浓硫酸反应来制备。
4.SO2能使品红溶液褪色,可以用这一性质来检验SO2。
5.常见的氧化剂有:酸性高锰酸钾溶液,氯水,溴(Br2)水、硝酸、浓硫酸、氧气等。
常见的还原剂有:C、CO、H2、H2S,KI,金属单质(Cu、Fe…)等。
☆设计要求:1.方案设计时先个人思考,然后小组讨论形成。
2.设计方案时要先明确用什么试剂来实现该转化。
再考虑如何操作还要考虑如何才能判断是否实现了这一转化。
3.设计的方案尽量减少环境污染(二氧化硫,硫化氢有毒)要考虑尾气处理。
提供试剂:硫黄,亚硫酸钠,浓硫酸,氢硫酸,氢氧化钠溶液。
酸性高锰酸钾,KI溶液,酚酞,氯化钡溶液,碘水,品红溶液,铜片,溴水。
1、二氧化硫的性质⑴物理性质:通常状况下,二氧化硫是一种色,味毒的气体,易溶于水(1:40),容易液化(沸点-10℃)密度比空气大。
⑵化学性质:①酸性氧化物的通性:与碱溶液(如氢氧化钠溶液)反应,化学方程式与水反应化学方程式②氧化性:如与H2S气体反应。
化学方程式③还原性:如与氧气反应。
研究不同价态硫元素间的转化

2SO3
二氧化硫 可使品红 褪色
3、浓硫酸有强氧化性 、 S+2H2SO4 = 3SO2+2H2O Cu+2H2SO4 = SO2+2H2O+CuSO4
加热 加热
说明
不同价态的硫的相互转化, 不同价态的硫的相互转化,在工农业 生产中有重要用途。 生产中有重要用途。 化学与技术—硫酸的工业生产 化学与技术 硫酸的工业生产
预测与假设: 预测与假设: 只有氧化性的物质是: 只有氧化性的物质是:H2SO4 只有还原性的物质是: 只有还原性的物质是: 两者都有的物质是: 、 两者都有的物质是: S、SO2
研究方案: 研究方案:
1、0价硫的转化(见硫的性质实验) 、 价硫的转化 见硫的性质实验) 价硫的转化( 2、+4价硫的转化 、 价硫的转化 A、将H2S和SO2混合 、 和 B、向BaCl2溶液中通入SO2,在加入 、 溶液中通入 氯水或硝酸 3、+6价硫的转化 、 价硫的转化 A、在试管中加入少量的硫粉,再加 、在试管中加入少量的硫粉, 入浓硫酸,并加热, 入浓硫酸,并加热,用湿润的品红试 纸,放于管口 B、将上述硫粉改为铜实验 、
品红试 纸变红 品红试 纸变红
S+2H2SO4 = 3SO2+2H2O
加热
有+4价S产生 价 产生
浓硫酸与铜
加热 Cu+2H2SO4 = SO2+2H2O+CuSO4
小结 1、S有氧化性,也有还原性 、 有氧化性 有氧化性, 2、SO2既有氧化性,又有还原性 、 既有氧化性, SO2+2H2S=3S+2H2O 2SO2+O2
硫酸生产反应式
实验室里不同价态硫元素的转化

生成淡黄色浑浊
+4价的硫被还原为0价
SO2与NaOH的酚酞溶液 SO2与品红溶液
溶液的红色褪去 溶液的红色褪去
具有酸性氧化物的通性 SO2有漂白性
4、SO2的漂白性
能够漂白品红等有色物质,在一定条件下会恢复原来的颜色。 可应用于鉴别SO2
实验中的“异常”现象
加热SO2漂白后的品红溶液会恢复红色, 但冷却之后过一段时间又褪色了。
1、SO2酸性氧化物的通性 2、SO2的氧化性 3、SO2的还原性
实验验证
实验药品:Na2SO3固体,浓硫酸,Na2S溶液,NaOH溶液,酚酞试液、 酸性KMnO4溶液,FeCl3溶液,石蕊试液,品红溶液、溴水
思考:实验室中如何制得SO2? 注意:由于SO2有毒,因此我们做实验时要注意什么问题?
创意:3个微项目、微胶囊技术P35-微实验
分类
•三 •四 •五 •六 •七
• 语文 • 数学 • 英语 • 物理 • 化学 • 生物
方法很重要
根据元素组成对物质进行分类,课本P44 研究物质性质的基本程序,课本P13
研究物质性质的基本方法 观察 、 实验 、 分类 、 比较 等 课本P9
硫及其化合物的“价-类”二维图
+6
SO3 H2SO4 Na2SO4
三、SO2的用途:
食品添加剂,可用作漂白剂、防腐剂、抗氧化剂P98
谈谈你对高中生活的体会:
小试身手
1、下列关于二氧化硫的说法中,不正确的是( B )
A、能使某些有色物质褪色
B、无色,有刺激性气味,无毒 C、既具有氧化性,又具有还原性SO2
D、既可溶于水,又可与水反应
2、下列物质中,能用于鉴别二氧化硫和二氧化碳的是( AB )
实验活动2——不同价态含硫物质的转化

实验现象
混合物保持红热,冷却后得到黑色固体
实验结论
单质硫被还原为S2-
转化反应的化学方程式
S+Fe FeS
[实验拓展]不同价态含硫物质的转化
(1)实现不同价态含硫物质的转化,首先要明确有哪些不同价态的含硫物质,其次是用什么方法实现这些物质间的转化。下面是不同价态的含硫物质。
C.Na2SO3+Na2SO4D.SO2+Na2SO3
(4)工业制硫酸中,转化②是在________(填设备名称)进行的。进行转化③时,不用水而用98.3%的浓H2SO4吸收SO3,原因是_________________________。
(5)NaHSO4溶液显强酸性,向NaHSO4溶液中滴入Ba(OH)2溶液,恰好使溶液呈中性,则发生反应的离子方程式为_________________________________________________________
(3)整个装置设计有一处不合理是____________________________________________。
Ⅱ.探究SO2的性质
在装置C中先后四次加入同浓度同体积不同情况的钡盐溶液,控制食用油油层厚度一致、通入SO2流速一致。四次实验现象如下表:
A.燃煤时为减少X的排放,可在煤中添加石灰石
B.X有漂白性,可使石蕊溶液先变红后褪色
C.Z与铁反应时,Z的浓度越大,反应速度越快
D.N可由其相应单质直接化合生成
答案A
2..如图所示为硫元素的单质及其化合物的价类二维图,其X、Y、Z、W为含硫化合物,下列说法正确的是()
实验室里研究不同价态硫元素间的转化

0
点燃 +4
S+O2 === SO2
+4 氧化剂 +6
S
S
实验2:二氧化硫与氯水反应
+4
+6
SO2+Cl2+2H2O=H2SO4+2HCl
BaCl2+H2SO4=BaSO4↓+2HCl
-- 精品--
小结:①S0
氧化剂
+4 氧化剂+6
S
S
催化剂
②SO2,Na2SO3也可以被O2氧化:2SO2+O2 =△==2SO3
浓H2SO4的化学性:强氧化性
△
①与金属单质反应:Cu+2H2SO4(浓) CuSO4+SO2 ↑+2H2O ②与非金属单质反应:C+2H2SO4(浓) △ CO2↑+2SO2 ↑+2H2O ③冷的浓H2SO4将Fe、Al钝化
[工业制H2SO4的流程]
点燃
第一步:制取SO2:S+O2 === SO2
通过本节课的学习,强化了氧化还原反应的有关理论。
-- 精品--
二、说教学目标
1.知识目标
通过探究学习掌握0、+4、+6硫元素间的相互转化,初步 了解SO2的性质
2.能力目标
培养学生思维能力,观察能力,分析和解决问题的能力, 渗透并培养学生的探究意识。
3 .情感目标
培养学生严谨的科学态度和合作精神。
其次,实现不同价态硫元素间的相互转化,依据的主要是氧 化还原反应规律,需要寻找合适的氧化剂,还原剂。
实验室里备有的试剂:硫黄,Na2SO3,较浓的硫酸,氯水, 酸性KMnO4溶液,BaCl2溶液、氢硫酸,铜片等。
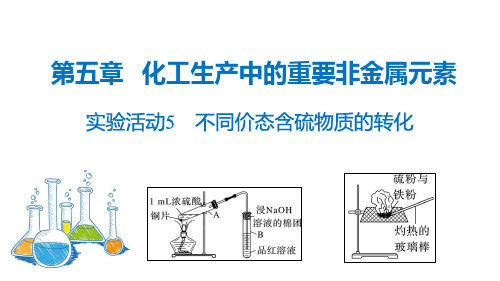
实验活动5 不同价态含硫物质的转化(人教版2019化学必修第二册)
2.硫及其化合物的“价—类”二维图体现了化学变化之美。下列有关说 法正确的是( B )
A.硫在氧气中燃烧直接生成Y B.Z与Cu反应,体现了Z的酸性和强氧化性 C.硫化氢与X反应的氧化产物和还原产物的物质的量之比为1:2 D.N可由其相应单质直接化合生成
3.我国科学家被遴选为“全球青年化学家元素周期表硫元素代言人”。
【实验步骤】 1.硫化钠转化为单质硫 (1)实验操作
(2)实验现象 甲:有_淡__黄__色__沉__淀__生成;乙:紫红色_褪__色__,产生_淡__黄__色__沉__淀__。 (3)实验结论 S2-能被H2SO3溶液及酸性KMnO4溶液_氧__化__生成_单__质__S_。
2.浓硫酸转化为二氧化硫 (1)实验装置及操作
4.已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转 化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法 正确的是( D )
A.X使蔗糖变黑的现象主要体现了X的强氧化性 B.若A为铁,则足量A与X在室温下即可完全反应 C.若A为碳单质,则将C通入少量的澄清石灰水中,最后有白色沉淀 产生
转化前的含硫物质 Na2S H2SO3 H2SO4 S
转化后的含硫物质 S S
SO2 FeS
价态变化 -2→0 +4→0 +6→+4团塞住试管口的作用是什么?
【答案】吸收实验过程中可能产生的有毒气体硫化氢和二氧化硫。 3.铁粉与硫粉在空气中混合燃烧时,可能发生哪些反应?
(3)将SO2通入以下溶液,均会发生颜色变化,其中体现SO2还原 性的是__A___(填序号)。 A.使溴水褪色 B.使品红溶液褪 色有机硫 C.使滴有酚酞的氢氧化钠溶液褪色 D.使氢硫 酸溶液中出现淡黄色浑浊
(4)硫元素的部分转化如图所示。过程①可利用克劳斯法实现,该 法先将部分H2S通过燃烧转化为SO2,再将SO2与剩余的H2S混合。为实 现硫的最大回收,燃烧的H2S和剩余的H2S物质的量之比应为_1_:__2_。过 程②宜在土壤的_富__氧__区实现(填“富氧”或“缺氧”)。
硫的价态转化及方程式

硫的价态转化及方程式
以《硫的价态转化及方程式》为标题,本文将详细介绍硫的价态转化及其表示方法。
硫元素可以以多种价态存在,它们之间可以通过一系列的反应进行转变。
除了原子态外,硫还可以呈现出-2、0、+2、+4、+6的价态,且这些价态都可以通过多种反应实现转化,以及用于许多实验中。
硫在0价态下可以与氢气或水反应,形成亚硫酸根和升硫酸根,这一反应的方程式可以表示如下:
2HS- + H2 2H2S
2HS- + H2O S + 2OH- + H2
硫在-2价态下可以与氧气反应,形成硫酸,该反应的方程式可以表示如下:
2S2- + O2 2SO4-
硫在+2价态下可以与氧气反应,形成硫酸根,该反应的方程式如下:
2S2+ + O2 2SO3
硫在+4价态下可以与氯气反应,形成硫酰氯,这一反应的方程式可以表示为:
2S2+ + Cl2 2SO2Cl
此外,硫以+6价态存在时,可同氧气反应,生成亚硫酸,其方程式为:
2S2+ + O2 2SO3-
以上就是硫的几种价态转化及相应的方程式。
从以上可以看出,硫的价态转换是由不同的反应和反应条件来决定的,这些反应方程式也为进一步研究硫的性能提供了基础。
硫元素的价态转换是物理和化学方面研究的重要课题,从不同价态可以观察出硫的毒性、腐蚀性以及生物作用能力。
在环境污染领域也有重要的意义。
比如,硫的价态转换可以检测污染源的种类和浓度,以及有效地控制污染物的活性状态。
综上所述,硫的价态转换是物理、化学和生态方面的重要内容,对于提高环境保护和检测污染源也有重要的意义。
此外,硫的价态转换及方程式是有效地研究硫性质和功能的基础。
不同价态硫元素间的转化PPT课件

的曹 心刘 数曹 故操 理备 十操
课
事为 ?何
故
变在 化前 过往
人请 前刘 往备
文 分
意 程、 ?为
提 是会
何
析
及 怎见
派
“ 样曹 望 的操 梅 ?过
许 禇 张
之 二
止
程
辽
渴
中
带
”
整体感知
(一)刘备行韬晦之计 (二)曹操煮酒论英雄
1.派兵请刘备 2.煮酒论英雄
精读 赏析
曹操 着意发问 步步逼问 说破英雄
风。一壶浊酒喜相逢。古今多少事,都付谈笑中。
《三国演义》,原名《三国志通俗演义》,是我 国第一部长篇章回体小说,也是我国历史演义小说中 成就最高、影响最大、最有代表性的一部作品。小说 以魏、蜀、吴三国的历史为题材,又依据《三国志》、 《三国志平话》和有关传说资料,经过作者的综合加
工、再创作而成。
二、实验室里研究不同价态硫元素间的 转化
复习思考: 1、硫单质有哪些物理性质和化学性
质? 2、请你举出你说知道的硫的化合物,
并说明硫的价态? 3、不同价态的硫元素间能否转化?
问 实验室里如何实现不同价态的硫元素 题: 间的转化?
预测与假设: 只有氧化性的物质是:H2SO4 只有还原性的物质是: 两者都有的物质是: S、SO2
的关系。成功塑造了一系列家喻户晓的艺术形象。
罗贯中(约1330—约1400):元末
明初小说家。名本,字贯中,号湖海散人, 一说山西太原人,一说钱塘人。生平不详, 据记载,他是“有志图王者”,并作过张 士诚的僚幕;明统一后,从事“稗史”的 编写工作。今署名罗贯中的小说有《三国 演义》、《隋唐志传》、《残唐五代史演 义》、《三遂平妖传》和杂剧《赵太祖龙 虎风云会》。且有记载说他是施耐庵的弟
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
不同价态硫元素的转化
课前预习学案
【预习目标】
1.以价态变化为主线,初步了解不同价态硫元素之间的转化关系
2.运用氧化还原反应原理寻找合适的氧化剂和还原剂,预测不同价态硫元素之间的相互转化。
3.从物质分类的角度认识二氧化硫的性质
【预习过程】解决下列问题
一.硫的常见化合价及其所对应的物质
☆实验目的:探究硫元素不同价态间的转化关系。
☆知识准备:
1、选择下列三种价态S元素的代表物质
0价: +4价: +6价:
2.研究该转化的理论依据。
3.常见的氧化剂:________________________________________ 常见的还原剂:_____________________________________________
4.SO
2能使品红溶液褪色,可以用这一性质来检验SO
2。
5.SO
2
气体可以由亚硫酸钠和浓硫酸反应来制备。
☆设计要求:
a.方案设计时先个人思考,然后小组讨论形成。
b.设计方案时要先明确用什么试剂来实现该转化。
再考虑如何操作还要考虑如何才能判断是否实现了这一转化。
c.设计的方案尽量减少环境污染(二氧化硫,硫化氢有毒)要考虑尾气处理。
☆提供试剂:硫化钠,亚硫酸钠,浓硫酸,稀盐酸,氢硫酸,氢氧化钠溶液,酸性高锰酸钾,氯水,酚酞,氯化钡溶液。
☆实验设计及预测:不同价态间的硫元素可以相互转化,寻求合适的氧化剂或还原剂来实现0价、+4价、+6价硫元素之间的转化并预测现象。
三.从物质分类的角度解决下列问题
1.在物质的分类中SO2属于什么类型?根据其所属有哪些化学性质
2.稀硫酸有哪些化学性质?写出下列反应的离子方程式
不同价态硫元素的转化
课堂探究学案
【学习目标】
1.以价态变化为主线,了解不同价态硫元素之间的转化关系
2.学会从价态的角度认识物质的化学性质
3.掌握代表物质二氧化硫、浓硫酸的性质
【过程与方法】:
以价态变化为主线,了解不同价态硫元素之间的转化关系
【情感态度与价值观】
能力目标:培养学生探究、观察、思考、判断的能力
情感目标:通过实验探究激发学生兴趣和热情,体验科学探究的乐趣。
【探究过程】:
实验目的:探究硫元素不同价态间的转化关系。
提供试剂:硫化钠,亚硫酸钠,浓硫酸,稀盐酸,氢硫酸,酸性高锰酸钾,氯水,酚酞,氢氧化钠溶液,氯化钡溶液。
理论依据:
探究过程:
归纳总结:1.综合以上实验结果,用图示的方法,表示不同价态硫元素之间的相互转化关系。
2.总结二氧化硫,浓硫酸的性质。
1、二氧化硫的性质
⑴物理性质:通常状况下,二氧化硫是一种色,味毒的气体,易溶于水(1:40),容易液化(沸点-10℃)密度比空气大。
⑵化学性质:
①酸性氧化物的通性:
与碱溶液(如氢氧化钠溶液)反应,化学方程式
与水反应化学方程式
②氧化性:如与H
2
S气体反应。
化学方程式
③还原性:如与氧气反应。
化学方程式
与新制氯水(溴水、碘水)化学方程式
④漂白性:能使品红溶液(该性质用来检验气体)
2.浓H
2SO
4
:
⑴物理性质:浓硫酸是色油状挥发(沸点338℃)液体,密度大(质量分数为98%的浓硫酸密度为1.84g/cm3),且质量分数越大其对应的密度也越大,易溶于水,溶于水时放出大量的热.。
稀释浓硫酸应把______沿______注入_______中,并___________以防_______________。
⑵化学性质:
①强氧化性:
与金属的反应:
与非金属的反应:
钝化:
②吸水性:
将浓H
2SO
4
放置在空气中,其质量会。
所以,用浓H
2
SO
4
做___________,
用来干燥、等气体
③脱水性:浓硫酸能按水(H2O)的组成比脱去有机物中的H、O元素,生成黑色的
C。
【针对练习】
1.下列不能用来区别SO
2和CO
2
气体的是()
A 石灰水
B KMnO
4
溶液 C 氯水 D 品红溶液
2.下列反应中SO
2
被氧化的是()
A、SO
2+2NaOH=Na
2
SO
3
+H
2
O B、2H
2
S+SO
2
=3S↓+2H
2
O
C、SO
2+H
2
O+Na
2
SO
3
=2NaHSO
3
D、Cl
2
+SO
2
+2H
2
O=H
2
SO
4
+2HCl
3.下列关于浓H
2SO
4
的叙述正确的是()
A、浓硫酸具有吸水性,因而能使蔗糖炭化
B、浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C、浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D、浓硫酸在常温下能够使铁、铝等金属钝化
【跟踪练习】
1、H2S和SO2 反应生成32g单质硫,则氧化产物和还原产物的质量之比()
A.1:2
B.2:1
C.1:1
D.1:3
2.Cl
2和SO
2
都有漂白作用,能使品红溶液褪色.若将等物质的量的Cl
2
和SO
2
混合
后,再通入品红与BaCl
2
的混合溶液,能观察到的现象是: ①溶液很快褪色;②溶液不褪色; ③出现沉淀; ④不出现沉淀()
A.①②B.①③C.②③D.②④
3.向50ml 18mol/L的硫酸溶液中加入足量的铜片并加热,充分反应后,被还原的硫酸的物质的量()
A.小于0.45mol
B. 等于0.45mol
C.在0.45和0.9mol之间
D.大于0.9mol 4.分别向盛有①紫色石蕊溶液②NaOH溶液③品红溶液④酸性KMnO4溶液的试管中通入SO2气体。
(1)试管①中现象:,发生反应的化学方程式为:
(2)试管②中发生反应的化学方程式为:
(3)试管③中现象:,如果将吸收SO2后的溶液加热,现象:。
(4)上述实验中,SO2表现出酸性氧化物性质的是(填标号,下同),SO2表现出漂白性的是,SO2表现出还原性的是。
5.试判断下列八种情况分别表现了硫酸的哪种性质?
(A)脱水性;(B)不挥发性;(C)强酸性;(D)二元酸;(E)氧化性;(F)吸水性
(1)铜和浓H2SO4加热,产生SO2气体( )
(2)在硫酸盐中有NaHSO4这样的酸式盐( )
(3)在烧杯中放入蔗糖,滴入浓H2SO4变黑( )
(4)在NaCl中加入浓H2SO4,加热,产生HCl气体( )
(5)在稀H2SO4中放入锌粒就产生H2( )
(6)用稀H2SO4清洗金属表面的氧化物( )
(7)浓H2SO4敞口久置会增重( )
(8)浓H2SO4不能用于干燥H2S气体( )
6.某亚硫酸钠已部分被氧化。
为确定它的纯度,要进行如下实验:
①称取样品W
1g;②将样品溶解;③给溶液加入稍过量盐酸酸化了的BaCl
2
溶液;
④过滤、洗涤、干燥沉淀,称其质量为W
2
g。
试回答:
(1)BaCl
2
要用盐酸酸化的原因是______________。
(2)BaCl
2
溶液要稍过量的原因是______________。
(3)判断操作③是否完成的方法是_____________。
