重庆大学大学化学Ⅱ期末考试试卷A
重庆大学大学化学习题答案

习题答案11.△f H m(298.15K)=44.01 kJ·mol-12mol时,△H(298.15K)=88.02kJ吸热Q p=△H=88.02kJ做功W=83.06 kJ2.νA= -3,νB= -1,νc= 2,△ξ(1)=0.5mol3.(1)△ξ(1)=4mol△r H m(298.15K)= -92.30kJ·mol-1△r H(298.15K)= -369.2kJ(2)△ξ(2)=2mol△r m(298.15K)= -184.6kJ·mol-1△r H (298.15K)= -369.2kJ4.△f m(298.15K)= -157kJ·mol-15.A.△r m(298.15K)分别为-2599kJ·mol-1,-890.3kJ·mol-1,-566.0kJ·mol-1B.△c H 分别为-1299.5kJ·mol-1,-890.3kJ·mol-1,-283.0kJ·mol-1 C.发热量排队C2H2>CH4>CO D.发热量排队CH4>C2H2>CO 6.(1)C,(2)B 7.(1)31.7kJ,(2)1.91×103kJ·mol-1 8.△= -626.6kJ·mol-110.△r m(298.15K)=173.14kJ·mol-1,有11. △f m(298.15K)= -1015kJ·mol-1 12.B13.T<1.24×103K,建议不可行,因为任何温度下,△r G(T)>0 14.D<A<C<B<E15.(1)△r m(298.15K)=689.94kJ·mol-1△r S m(298.15K)=0.360kJ·K-1·mol-1(2)△r m(298.15K)=582.2·mol-1,否(3)△r(1 000K)=329.0kJ·mol-1,否(4)T>1912K16.T<463.7K21. νA=0.5mol·dm-3·s-1,νB=0.5mol·dm-3·s-1,νC=0.5mol·dm-3·s-1,3. ν=kc2A c B三级反应4.9.36 5,75kJ·mol-1 6.k=3×1012s–17.Ea=1.0×105J·mol-1,A=1.1×1013s-18. k=1.2×10-2s–1 9.20% 10.4.69×106倍11. k=4.9×10-4s–112.k1(平均值)=2.15×10-4s–1,t1/2=3223.9s13.(1)v0(蔗糖)=6.43×10-5 mol·dm-3·s-1(2)n(葡萄糖)=n(果糖)=0.128mol(3)α(蔗糖)=0.3214.1.8×10-11 mol·dm-3·s-1 15.4600年31.p总=3.9×104pa2.n(O2)=2.0×10-2mol3.p(N2)=4.6×105pa,P(O2)=105pa5.K =2.0×10-106.K =2.3×10-29,K p=8.9×10-32pa7.(1)△r G(298K)=173.1kJ·mol-1,K =5.01×10-31(2)△r m(298K)=208.4kJ·mol-1,K =3.16×10-37(3)△r G m(298K)= -33.0kJ·mol-1,K =6.03×1058.(1)△r G(298K.15K)=37kJ·mol-1,K =3.3×10-7(2)K (800K)≈1.4×1039. K (500K)=1.47×101010.K2×104,△r G m(292K)= -27.2kJ·mol-111.△r m(298K)=86.55kJ·mol-1,K(298K)=6.8×10-16△r(1 573K)≈70.7kJ·mol-1,K(1 573K)≈4.5×10-312.(1)pH=5.15(2)pH=3.8814. pH= 4.7515. pH=9.25,α=9.0×10-516.(1)1.3×10-5mol·dm-3(2)1.8×10-10mol·dm-317.(1)无沉淀生成(2)c(Cl-)=8.9×10-3mol·dm-3(3)2.2%45.(Ni2+/Ni)= -0.257V6.(1)E,△r G m= -98.4kJ·mol-1,反应能自发。
重庆大学大学化学习题答案

成绩重庆大学大学化学(Ⅱ)期末考试试卷(B)学院___________ 专业___________姓名___________ 学号___________(请考生注意:本试卷共5页)大题一二三四成绩一、对的在题末括号内填“+”、错的填“-”。
(本大题分9小题, 每小题1分, 共9分)1、金属元素与非金属元素之间形成的化学键不一定都是离子键。
答()2、所有电子的电子云都有方向性。
答()3、微细的铝粉、麦面粉、煤粉等与乙醚、丙酮、苯等类似,也属于有火灾爆炸危险性的危险品。
答()4、 r H大,并不预示其反应速率快。
答:()5、由于共价键十分牢固,因而共价化合物的熔点均较高。
答()6、稀有气体固态时,在晶格结点上排列着原子,所以它们的晶体属于原子晶体。
答()7、同一元素的离子半径小于其原子半径。
答()8、碳原子只有两个未成对电子,故只能形成2 个共价键。
答()9、过渡元素在高氧化态时一般均可与活泼非金属形成离子化合物。
答()二、将一个或两个正确答案的代码填入题末的括号内。
若正确答案只有一个,多选时,该题为0分;若正确答案有两个,只选一个且正确,给1分,选两个且都正确给2分,但只要选错一个,该小题就为0分。
(本大题分11小题, 每小题2分, 共22分)1、下列各系统中,具有最大摩尔熵值的是答:()(1) 20 K 时的冰(2) 273.15 K 时的冰(3) 373.15 K 时的水蒸气(4) 400 K 时的水蒸气2、H2分子之间的作用力有答()(1) 氢键(2) 取向力(3) 诱导力(4) 色散力3、在一定条件下,由蔗糖水溶液、冰、水蒸气、氧气、氮气组成的系统中有答()(1) 三个相(2) 四个相(3) 三种组分(4) 四种组分(5) 五种组分4、确定多电子原子中,轨道的能量的是答()(1)n (2)n和l(3)n,l和m (4)n,l,m和m s5氢作为一种很有发展前途的能源,下列各项中尚需研究解决的有答()(1) H2是一种没有污染的能源(2) 用水制氢资源丰富(3) H2的运输方便、安全(4) H2的燃烧热值大(5) 价廉的制氢方法和技术6、下列有机高聚物中电绝缘性最好的是答:()(1) 酚醛树脂(2) 聚氯乙烯(3) 聚四氟乙烯(4) 聚酰胺7、下列有机高聚物中,最适宜作粘结剂,且使用范围最广的粘结剂是答:()(1) 聚碳酸酯(2) 聚甲基丙烯酸甲酯(3) 环氧树脂(4) 酚醛树脂8、在由气体A 与B 组成的混合气体中,组分A 的分压力与总压力之比等于答:()(1) A 组分的摩尔分数(2) A 组分的分体积与总体积之比(3) B 组分的分压力与总压力之比 (4) A 组分与 B 组分的分体积之比9、在一定温度和压力下,已知有一气态化合物分解只产生两种气态物质:单质磷蒸气和氢气。
2025届重庆大学城第一中学校化学高三第一学期期末监测试题含解析

2025届重庆大学城第一中学校化学高三第一学期期末监测试题请考生注意:1.请用2B铅笔将选择题答案涂填在答题纸相应位置上,请用0.5毫米及以上黑色字迹的钢笔或签字笔将主观题的答案写在答题纸相应的答题区内。
写在试题卷、草稿纸上均无效。
2.答题前,认真阅读答题纸上的《注意事项》,按规定答题。
一、选择题(共包括22个小题。
每小题均只有一个符合题意的选项)1、某有机物W的结构简式为下列有关W的说法错误的是A.是一种酯类有机物B.含苯环和羧基的同分异构体有3种C.所有碳原子可能在同一平面D.能发生取代、加成和氧化反应2、一氯甲烷等卤代烃跟苯的反应如图所示,(无机小分子产物略去)。
下列说法正确的是A.该反应属于化合反应B.b的二氯代物有6种结构C.1mol b加氢生成饱和烃需要6molH2D.C5H11Cl的结构有8种3、下列表示对应化学反应的离子方程式正确的是A.NO2溶于水:2NO2+H2O=2H++2NO3-B.向氨水溶液中通入过量SO2:2NH3·H2O+SO2=2NH4++SO32-+H2OC.酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2OD.明矾[KAl(SO4)2·12H2O]溶液中加入过量Ba(OH)2溶液:Al3++SO42-+Ba2++4OH−=AlO2-+BaSO4↓+2H2O4、常温下,下列各组离子在指定溶液中能大量共存的是()A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+B.水电离出的c(H+)=10-12mol/L的溶液中:Ca2+、K+、Cl-、HCO3-C.+-c(H)c(OH)=1012的水溶液中:NH4+、Al3+、NO3-、Cl-D.c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN-5、下列图示(加热装置省略,其序号与选项的序号对应)的实验操作,能实现相应实验目的的是A.探究乙醇的催化氧化B.实验室制取并收集少量纯净的氯气C.研究催化剂对过氧化氢分解速率的影响D.实验室制备少量NO6、短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层电子数是次外层的3倍,Y是迄今发现的非金属性最强的元素,在周期表中Z位于ⅠA族,W与X属于同一主族。
重庆大学化学期末考试试卷

违者按舞弊处理;不得自备草稿纸。
考生
承诺
本人知道考试违纪、作弊的严重性,将严格遵守考场纪律,如若违反则愿意接受学校按有关规定处分!
考生签名:
一、选择题:(每题2分,共30分)
得分
评阅人
1. 2分(0206)
当对某一试样进行平行测定时,若分析结果的精密度很好,但准确度不好,可能的原因是----------( )
(A)操作过程中溶液严重溅失(B)使用未校正过的容量仪器
(C)称样时某些记录有错误(D)试样不均匀
2. 2分(0227)
以下计算式答案x应为-------------------------------------------------------------------------------------------( )
(A) AlL和AlL2(B) Al3+和AlL (C) AlL2(D) AlL3
11. 2分(0803)
用EDTA直接滴定有色金属离子,终点所呈现的颜色是----------------------------------------------------( )
(A)指示剂-金属离子络合物的颜色
(A) (B)
(C) (D)
7. 2分(0305)
下列各组组分中不属于共轭酸碱对的是-------------------------------------------------------------------( )
(A) H2CO3和CO32-(B) NH3和NH2-
(C) HCl和Cl-(D) HSO4-和SO42-
—重庆大学考பைடு நூலகம்试卷—
大学化学实验_重庆大学中国大学mooc课后章节答案期末考试题库2023年

大学化学实验_重庆大学中国大学mooc课后章节答案期末考试题库2023年1.能相互反应产生有毒气体的废液,不得倒入同一收集桶中,应分类存放,并贴上标签。
答案:正确2.实验用过的仪器应及时清洁干净,放回指定位置,化学药品归还实验室,实验成品可自行带走。
答案:错误3.对强酸灼伤,应立即用水冲洗,再用20%-50%的碳酸钠或碳酸氢钠,肥皂水或淡石灰水冲洗,最后用水冲洗。
答案:错误4.倾注药剂或加热液体时,不要俯视容器,以防溅出。
试管加热时,切记不要使试管口向着自己或别人。
答案:正确5.酒精起火时,应立即用湿布或沙土等灭火,如火势较大,也可用泡沫灭火器灭火。
答案:正确6.对于无机酸类废液,实验室可以收集后进行如下处理:将废酸慢慢倒入过量的含碳酸钠或氢氧化钙的水溶液中(或用废碱)互相中和,再用大量水冲洗。
答案:正确7.含Pb等重金属的废液需要将重金属转化为难溶的氢氧化物,离子含量达标后方可排放。
答案:正确8.关于金属腐蚀,下列说法错误的是答案:发生吸氧腐蚀是由于金属表面氧气分布浓度不同而引起的_钢铁在大气中的腐蚀只有析氢腐蚀9.电镀结束后,对工件表面形状进行认真观察和仔细记录。
答案:正确10.下列关于试剂的取用描述正确的是答案:往试管中滴加试剂时,切勿使滴管伸入滴管中_所有取出的液体试剂和固体试剂都不能再倒入原试剂瓶中_从滴瓶中取用试剂时,需用滴瓶中的滴管11.下列关于学生实验守则描述正确的是答案:实验完毕,须清洗玻璃仪器,放回原位_随时保持实验台面的整洁_节约试剂,按规定用量取用12.采用EDTA滴定法测定水的硬度时,如何判断滴定的终点答案:溶液恰好由红色变成蓝色13.测定水的硬度时,采用EDTA进行配位滴定,所用指示剂为答案:铬黑T14.在进行电抛光前不需要的操作是答案:打磨工件15.在金属铜片上电镀镍时,下列操作正确的是答案:铜片做阴极,镍片做阳极16.在电抛光过程中,关于电化学除油操作的正确描述是答案:工件做阴极,钢板做阳极17.在进行减压过滤时,下列操作错误的是答案:抽滤前应用同一溶剂润湿滤纸18.影响反应速率常数的因素有答案:催化剂_反应温度_反应活化能19.用外推法确定∆T时,首先要在坐标纸上绘制反应温度随时间的变化曲线,坐标系的横轴是反应时间,纵轴是反应温度,单位是K。
重庆市主城区七校2023-2024学年高二下学期期末考试化学试题含答案

2023-2024学年(下)期末考试高2025届化学试题(答案在最后)考试说明:1.考试时间90分钟2.试题总分100分3.试卷页数8页可能用到的相对原子质量:H1C12N14O16F19Si28S32Ga70一、选择题:本题共16小题,每小题3分,共48分。
在每小题给出的四个选项中,只有一项是正确的。
1.2024年春节过后,健康塑形成为人们热议的话题。
以下说法正确的是A.对于需要减重的人群,应减少油脂摄入,油脂是一种高分子化合物B.要保证健康,应保证蛋白质的摄入,蛋白质将在人体内通过氧化反应转化成氨基酸C.糖类是重要的供能物质,糖类包含单糖、二糖、多糖等,二糖、多糖均属于非还原糖D.人的体型主要是由遗传决定的,核酸是生物体遗传信息的携带者【答案】D【解析】【详解】A.油脂是高级脂肪酸甘油酯,油脂不是高分子化合物,故A错误;B.蛋白质将在人体内水解为氨基酸,故B错误;C.二糖中麦芽糖属于还原糖,故C错误;D.核酸是生物体遗传信息的携带者,故D正确;选D。
2.下列关于N A的说法不正确的是A.0.1mol中σ键的数目为1.4N AB.标准状况下,22.4L水中含有氢键的数目为0.2N AC.1mol[Cu(NH3)4]2+中含有的配位键数目为4N AD.60gSiO2中含Si-O的数目为4N A【答案】B【解析】【详解】A .根据单键为σ键,双键中1个σ键和1个π键,所以0.1mol中σ键的数目为1.4N A ,A 正确;B .标准状况下,22.4LH 2O 不是1mol ,H 2O 在标准状况下不是气体,B 错误;C .NH 3与Cu 2+间为配位键,1mol[Cu(NH 3)4]2+中含有的配位键数目为4N A ,C 正确;D .60gSiO 2物质的量为1mol ,含Si-O 的数目为4N A ,D 正确;故选B 。
3.下列化学用语或图示表示不正确的是A.乙炔的比例模型:B.顺式聚异戊二烯的结构简式:C.1-戊烯的球棍模型:D.基态溴原子的简化电子排布式:[]25Ar 4s 4p 【答案】D【解析】【详解】A .乙炔为直线型分子,比例模型为,A 选项正确;B .顺式聚异戊二烯的结构中亚甲基位于碳碳双键同侧,结构简式,B 选项正确;C .1-戊烯的球棍模型为,C 选项正确;D .基态溴原子的简化电子排布式:[Ar]3d 104s 24p 5,D 选项错误;故答案选D 。
重庆理工大学有机化学试卷A及答案
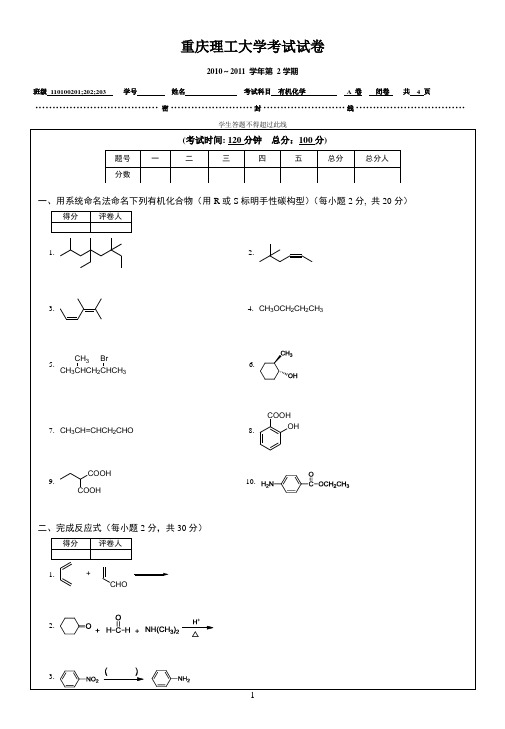
班级110100201;202;203 学号姓名考试科目有机化学 A 卷闭卷共 4 页····································密························封························线································班级110100201;202;203 学号姓名考试科目有机化学 A 卷闭卷共 4 页····································密························封························线································班级110100201;202;203 学号姓名考试科目有机化学 A 卷闭卷共 4 页····································密························封························线································班级110100201;202;203 学号姓名考试科目有机化学 A 卷闭卷共 4 页····································密························封························线································2. (CH3)3CCOOH(CH3)2C=CH2五、推测结构(本大题共18分)1. 化合物分子式为C9H10O其IR和1HNMR如下图,推断此化合物的结构式。
2025届重庆西南大学附中高二化学第二学期期末经典试题含解析

2025届重庆西南大学附中高二化学第二学期期末经典试题考生须知:1.全卷分选择题和非选择题两部分,全部在答题纸上作答。
选择题必须用2B铅笔填涂;非选择题的答案必须用黑色字迹的钢笔或答字笔写在“答题纸”相应位置上。
2.请用黑色字迹的钢笔或答字笔在“答题纸”上先填写姓名和准考证号。
3.保持卡面清洁,不要折叠,不要弄破、弄皱,在草稿纸、试题卷上答题无效。
一、选择题(共包括22个小题。
每小题均只有一个符合题意的选项)1、某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣、HCO3﹣等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是()A.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1B.ab段发生的离子反应为:Al3++3OH﹣=Al(OH)3↓,Mg2++2OH﹣=Mg(OH)2↓C.原溶液中含有的阳离子必定有H+、NH4+、Al3+但不能肯定Mg2+和Fe3+的中的哪一种D.d点溶液中含有的溶质只有Na2SO42、三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
下列叙述正确的是A.通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品C.负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成3、下列实验操作正确的是()A.用稀硫酸和锌粒制取H2时,加几滴Cu(NO3)2溶液以加快反应速率B.向Ca(ClO)2溶液中通入SO2气体,证明H2SO3的酸性强于HClOC.用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择甲基橙为指示剂D.将Cu与浓硫酸反应后的混合物先冷却,再向其中加入冷水以验证生成的Cu2+4、光化学烟雾是汽车尾气在紫外线作用下生成的有害浅蓝色烟雾,由氮的氧化物和烃类等一次污染物,与它们发生一系列光化学反应生成的臭氧、醛类、过氧乙酰硝酸酯(PAN)等二次污染物组成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
重庆大学大学化学Ⅱ期末考试试卷 A
试卷号:B070003
学院___________ 专业___________
姓名___________ 学号___________
(请考生注意:本试卷共 5 页)
大题一二三四
成绩
一、对的在题末括号内填“+”、错的填“-”。
(本大题分11小题, 每小题1分, 共11分)
1、室温时,在总压力为 200 Pa 的两种气体的混合物中,氯气的分压力为 100 Pa,这意味着 Cl2的物质的量是混合气体总的物质的量的一半。
答:()
2、反应 Fe + SnCl2 = FeCl2 + Sn 是氧化还原反应,而反应 2FeCl3 + SnCl2 =
SnCl4 +2FeCl2不是氧化还原反应。
答:()
3、由反应 Cu + 2Ag+=Cu2+ + 2Ag 组成原电池,当c(Cu2+ ) = c(Ag+ ) = 1.0 mol dm-3时,
E=E-E = E(Cu2+/Cu) -2E(Ag+/Ag)。
答:()
4、盐类水溶液电解产物的一般规律是:若阳极是惰性电极(如石墨),则首先是 OH -放电生成 O2,其次才是简单离子 S2-或 I-、Br-、Cl-等放电。
答()
5、升高反应温度,能使反应速率常数k和标准平衡常数K都增大。
答:()
6、由于 Cu+离子与 Na+离子的半径相近,离子所带电荷相同,故 NaOH 和 CuOH 碱性相近。
答()
7、将 50℃的一定量的水,置于密闭容器中,会自动冷却到室温(如20℃)。
此时密闭容器内水的熵值变小,即S < 0。
这说明在密闭容器中的自发过程,系统本身不一定要熵增加。
答()
8、铁原子失去 2 个电子成为 Fe2+,失去 3 个电子才成为 Fe3+,故在水溶液中 Fe2+比Fe3+更稳定。
答:()
9、
外层电子构型为 18 电子的离子都是位于 p 区或 ds 区元素的离子。
答()
10、弱电解质溶液的解离度和解离常数,可采用 pH 法或电导率法测
定。
答()
11、三氯化磷是以共价键结合的化合物,但将它加入到水中形成的溶液可以导电。
答:()。
