过渡金属氧化物催化理论精品PPT课件
合集下载
金属催化作用理论ppt课件.ppt

一、能带理论与催化 1、 能带理论 • 能带的形成
以Ni为例: Ni原子:1s22s22p63s23p64s23d84p
电子轨道没有任何相互作用
达到范德华(V.D.W)半径时,电 子轨道将要发生相互作用
RNi-Ni<R2×VDW时,Ni原子之间将 要发生电子轨道相互作用,出现 电子轨道重叠,形成金属键。
1. 暴露表面以低表面能的晶面为主 surfaces of low surface free energy will
be more stable. The most stable surfaces are those with : • a high surface atom density • surface atoms of high coordination number
• 具体内容有:
Ⅰ、与d电子轨道有关的电子因素,即能 量因素如何影响催化剂的吸附选择性、吸附力 的强弱、催化性能等,即催化的电子论
Ⅱ、晶体结构因素(也称;几何因素), 即(晶胞大小、晶面取向、晶粒大小、晶体表 面结构)与(吸附、催化)之间的关系,即催 化的几何论
§1、金属催化的电子论
能带理论、价键理论
1、晶胞 • 晶胞是晶体的最小重复单位,采用晶胞参数
来确定。
立方晶胞: a=b=c α=β=γ=900
四方晶胞:a=b≠c α=β=γ=900
三斜晶胞:a≠b≠c α≠β≠γ
2、晶面 晶面:是晶体在各个方向上的截面。相同
方向的截面,不仅具有相同的二维空间结构, 而且是相互平行的,晶面间距也相等,称晶面 距。
④、 金属间化合物催化剂,如Cu3Au、 CuAu3、 Ni29Al10、 Ni15Al
• 过渡金属催化剂有二大特点: Ⅰ、在反应气氛如H2、O2气下,过渡金
以Ni为例: Ni原子:1s22s22p63s23p64s23d84p
电子轨道没有任何相互作用
达到范德华(V.D.W)半径时,电 子轨道将要发生相互作用
RNi-Ni<R2×VDW时,Ni原子之间将 要发生电子轨道相互作用,出现 电子轨道重叠,形成金属键。
1. 暴露表面以低表面能的晶面为主 surfaces of low surface free energy will
be more stable. The most stable surfaces are those with : • a high surface atom density • surface atoms of high coordination number
• 具体内容有:
Ⅰ、与d电子轨道有关的电子因素,即能 量因素如何影响催化剂的吸附选择性、吸附力 的强弱、催化性能等,即催化的电子论
Ⅱ、晶体结构因素(也称;几何因素), 即(晶胞大小、晶面取向、晶粒大小、晶体表 面结构)与(吸附、催化)之间的关系,即催 化的几何论
§1、金属催化的电子论
能带理论、价键理论
1、晶胞 • 晶胞是晶体的最小重复单位,采用晶胞参数
来确定。
立方晶胞: a=b=c α=β=γ=900
四方晶胞:a=b≠c α=β=γ=900
三斜晶胞:a≠b≠c α≠β≠γ
2、晶面 晶面:是晶体在各个方向上的截面。相同
方向的截面,不仅具有相同的二维空间结构, 而且是相互平行的,晶面间距也相等,称晶面 距。
④、 金属间化合物催化剂,如Cu3Au、 CuAu3、 Ni29Al10、 Ni15Al
• 过渡金属催化剂有二大特点: Ⅰ、在反应气氛如H2、O2气下,过渡金
过渡金属合金催化剂氧还原ORR催化机理精品PPT课件

Pt-M合金催化剂活性提高机理
合金元素的添加改变了Pt原子外层的电子结构,增大了Pt 原子d轨道空穴数,增强了Pt原子dz2或两个相邻的Pt原子 dxz或dyz轨道与吸附的O2分子π轨道的作用,降低了O-O 键的键能,加快了O-O键断裂,促进了氧还原反应的发生。
通过改变d能带中心的位置可以控制合金问的耦合能,改 善合金催化剂的活性。当d能带中心上移(即d能带中心能 量变大),Pt-M与O2的相互作用增强,易于断O-O键。反 之,Pt-M上吸附的O原子易于和H结合生成OH。
氧还原反应机理
直接反应途径,直接发生4电子反应生成水。
连续反应途径,先2电子反应生成中间产物H2O2, H2O2 。 可能继续发生2电子反应还原生成H2O,也可能直接从溶 液中析出生成产物H2O2,中间产物不稳定,还可能发生 可逆反应分解为O2重新参加还原反应。
理想的燃料电池氧还原反应氧气充分还原,输出电压高, 为4电子反应途径,但是4电子反应的还原电位比2电子反 应高,并且O2中O-O键的解离能比H2O2中的大,因此此 催化活性不是很强时容易发生2电子反应或是2电子与4电 子的混合反应。2电子反应会产生H2O2 ,对催化剂及质子 交换膜造成损害,加速催化剂和质子交换膜的老化,因此 4电子反应是理想的氧还原途径。
氧还原反应机理
金属催化剂对物种的吸附强度与其表面原子d带中心值呈 线性关系。
催化剂的催化活性与金属的d带中心的位置呈火山关系。
氧还原反应机理
这是由于金属吸附O原子的能力太强,会造成催化剂活性 表面始终被O原子占据,不利于催化反应持续进行;相反, 如果金属对O原子的吸附能力太弱,则会导致O2无法吸附 在催化剂活性表面,不利于催化反应的发生。
氧还原反应机理
O2在过渡金属上的吸附模式大致分为Griftiths模式、Pauling 模式和Birdge模式
过渡金属氧化物材料PPT课件

zirconia pore wall surface ☺ Hydrothermally treating a surfactant-containing titania-zirconia
mesostructure to crystallize the titania component before calcination ☺ synthesizing mesostructures with walls thick enough to allow partial
Amorphous material Structure collapses
Hard templating :
Specific topological stability Veracity Predictability Controllability
6
Ferdi Schuth, Chem. Mater. 2001, 13, 3184 -3195
Schematic representation of CASH method
Ju1n2ko N. Kondo et al., Chem. Mater. 2008, 20(3): 835–847
Crystallization of mesoporous metal oxides (Cont.)
❖ Reinforcement of pore wall
Silica-coating
Seminar I (2008.5.27)
Research Progress of Ordered Mesoporous Transition-Metal Oxides Materials
指导教师:申文杰 研究员 研 究 生:郭小惠
Outline
Introduction Phylogeny & Property
mesostructure to crystallize the titania component before calcination ☺ synthesizing mesostructures with walls thick enough to allow partial
Amorphous material Structure collapses
Hard templating :
Specific topological stability Veracity Predictability Controllability
6
Ferdi Schuth, Chem. Mater. 2001, 13, 3184 -3195
Schematic representation of CASH method
Ju1n2ko N. Kondo et al., Chem. Mater. 2008, 20(3): 835–847
Crystallization of mesoporous metal oxides (Cont.)
❖ Reinforcement of pore wall
Silica-coating
Seminar I (2008.5.27)
Research Progress of Ordered Mesoporous Transition-Metal Oxides Materials
指导教师:申文杰 研究员 研 究 生:郭小惠
Outline
Introduction Phylogeny & Property
过渡金属氧化物催化理论

主要内容
1
2 3 4 5 6 半导体的形成与能带理论 氧化物催化剂的电子催化理论 半导体催化剂结构 氧化物催化剂的表面与催化性能 烃类的催化氧化理论 乙烯丙烯氧化及催化剂
6. 乙烯丙烯氧化及催化剂
Page 109
6. 乙烯丙烯氧化及催化剂
Page 110
6. 乙烯丙烯氧化及催化剂
Page 111
Page 81
四. 氧化物催化剂的表面与催化性能 小结:
Page 82
主要内容
1
2 3 4 5 6 半导体的形成与能带理论 氧化物催化剂的电子催化理论 半导体催化剂结构 氧化物催化剂的表面与催化性能 烃类的催化氧化理论 乙烯丙烯氧化及催化剂
Page 83
5. 烃类的催化氧化理论
Page 84
Page 75
四. 氧化物催化剂的表面与催化性能
Page 76
四. 氧化物催化剂的表面与催化性能
Page 77
四. 氧化物催化剂的表面与催化性能
Page 78
四. 氧化物催化剂的表面与催化性能
Page 79
四. 氧化物催化剂的表面与催化性能
Page 80
四. 氧化物催化剂的表面与催化性能
Page 43
Page 44
Page 45
Page 46
Page 47
Page 48
Page 49
Page 50
Page 51
Page 52
Page 53
Page 54
Page 55
Page 56
Page 57
主要内容
1
2 3
半导体的形成与能带理论
氧化物催化剂的电子催化理论 半导体催化剂结构 氧化物催化剂的表面与催化性能 烃类的催化氧化理论 乙烯丙烯氧化及催化剂
过渡金属氧化物催化剂及其催化作用141页PPT

过渡金属氧化物催化剂及其 催化作用
41、实际上,我们想要的不是针对犯 罪的法 律,而 是针对 疯狂的 法律。 ——马 克·吐温 42、法律的力量应当跟随着公民,就 像影子 跟随着 身体一 样。— —贝卡 利亚 43、法律和制度必须跟上人类思想进 步。— —杰弗 逊 44、人类受制于法律,法律受制于情 理。— —托·富 勒
拉ቤተ መጻሕፍቲ ባይዱ
60、生活的道路一旦选定,就要勇敢地 走到底 ,决不 回头。 ——左
45、法律的制定是为了保证每一个人 自由发 挥自己 的才能 ,而不 是为了 束缚他 的才能 。—— 罗伯斯 庇尔
56、书不仅是生活,而且是现在、过 去和未 来文化 生活的 源泉。 ——库 法耶夫 57、生命不可能有两次,但许多人连一 次也不 善于度 过。— —吕凯 特 58、问渠哪得清如许,为有源头活水来 。—— 朱熹 59、我的努力求学没有得到别的好处, 只不过 是愈来 愈发觉 自己的 无知。 ——笛 卡儿
41、实际上,我们想要的不是针对犯 罪的法 律,而 是针对 疯狂的 法律。 ——马 克·吐温 42、法律的力量应当跟随着公民,就 像影子 跟随着 身体一 样。— —贝卡 利亚 43、法律和制度必须跟上人类思想进 步。— —杰弗 逊 44、人类受制于法律,法律受制于情 理。— —托·富 勒
拉ቤተ መጻሕፍቲ ባይዱ
60、生活的道路一旦选定,就要勇敢地 走到底 ,决不 回头。 ——左
45、法律的制定是为了保证每一个人 自由发 挥自己 的才能 ,而不 是为了 束缚他 的才能 。—— 罗伯斯 庇尔
56、书不仅是生活,而且是现在、过 去和未 来文化 生活的 源泉。 ——库 法耶夫 57、生命不可能有两次,但许多人连一 次也不 善于度 过。— —吕凯 特 58、问渠哪得清如许,为有源头活水来 。—— 朱熹 59、我的努力求学没有得到别的好处, 只不过 是愈来 愈发觉 自己的 无知。 ——笛 卡儿
过渡金属配合物催化剂及其相关催化过程ppt课件

一、过渡金属配合物种的化学键
四类配体:
4)配体同时提供一个充满的成键轨道和一个空的反键 轨道,与金属的相应轨道作用。配体的成键轨道与金 属的空轨道作用,形成/ 键;配体空的反键轨道与 金属的充满轨道作用,形成键。如CO、烯烃、磷化
氢等。
一、过渡金属配合物种的化学键
一、过渡金属配合物种的化学键
插入反应:一个原子或分子插入两个初始键合的金
属-配体间。
烯烃向金属-烷基间的插入反应假定机理:
三、相关催化过程
烯烃加氢
能够活化氢的的金属配合物: RuCl63-;Co(CN)53-;RhCl(PPh3)3(即Wilkinson配合物, 对均相催化加氢非常有效)
三、相关催化过程
烯烃加氢
这类催化剂在加氢反应中 的作用为:
二、有机金属配合物的反应与催化反应
氧化加成:配体加成至金属原子并使价态升高的反
应(如H2对配合物的加成)。
氧化加成要求金属周围有两个空配位点,并且金属具 有差值为2 的两种氧化态,比如金属Rh。H2、HI和 CH3I等可以发生氧化加成反应。
二、有机金属配合物的反应与催化反应
插入反应:一个原子或分子插入两个初始键合的金
三、相关催化过程
乙烯氧化制乙醛——Wacker过程
4)在反应体系中直接加入乙醇,有乙醇转化为醛的速率要 比乙烯直接氧化得到醛的速率慢得多,这说明乙烯氧化为乙 醛不是以乙醇作为中间产物; 5)用重水所作的实验表明,所得乙醛分子中不含有D,说明 乙醛中的四个H全部来自乙烯内部; 6)动力学研究表明,插入反应是速控步,根据这一速控步 骤的机理可以导出总反应速率方程
C2H4 PdCl2 H2O CH3CHO Pd 2HCl
2)Pd(0)被氧化为Pd(II),Cu2+还原为Cu+:
过渡金属氧化物催化剂一半导体理论PPT课件
V4+ →V5+
Cu+→ Cu2+
负离子吸附
在高价金属
上
↘
负离子吸附 在高价金属
↘
上
施电子 气体 ( H2)
N型 ZnO
P型 NiO
1 / 2 H2→H +
Zn2+ →Zn+
↗ 正 离 子 气 体
吸附在低价 金属离子上
1 / 2 H2→H +
Ni3+→ Ni2+
↗ 正 离 子 气 体
吸附在低价 金属离子上
半导体导电性影响因素
➢温度升高,提高施主能级位置,增加施主杂质浓度可提 高n型半导体的导电性。
➢温度升高,降低受主能级位置或增加受主杂质浓度都可 以提高p型半导体的导电能力。
➢催化剂制备上措施:晶体缺陷,掺杂,通过杂质能级来 改善催化性能。
第6页/共22页
杂质对半导体催化剂的影响
➢1、对n型半导体 A)加入施主型杂质,EF↗Φ↘导电率↗ B)加入受主杂质, EF ↘ Φ ↗导电率↘ ➢2、对p型半导体 A)加入施主型杂质EF↗Φ↘导电率↘ B)加入受主型杂质EF ↘ Φ ↗导电率↗
第1页/共22页
第2页/共22页
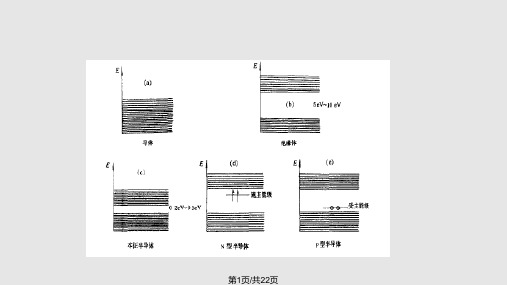
本征半导体、n型半导体、P型半导体
N型半导体和p型半导体的形成
➢当 金 属 氧 化 物 是 非 化 学 计 量 , 或 引 入 杂 质 离 子 或 原 子 可 产 生 n 型 、 p型半导体。
➢杂质是以原子、离子或集团分布在金属氧化物晶体中,存在于 晶格表面或晶格交界处。这些杂质可引起半导体禁带中出现杂 质能级。
φ
φ
EF
φ
EF
施主
受主
过渡金属配合物催化剂及其催化作用【共90张PPT】

2
+
A
+
B
ML □ n-2
2
MLn-2AB
(6 – 1) (6 – 2)
在一个过渡金属配合物MLn(L为配位体)所催化的一个分 子A和一个分子B的反应中,需要金属上存在两个空的配位点,式(6 -l)和(6-2)分别表示空配位点的生成和新配合物MLn-2AB的形成
(口代表空配位点),空配位点的生成通常由热引发
第八章
活化分子间的反应
✓ 有时基团也发生式(6-15)所示的反应,发生α– 消 除反应形成金属碳烯,这类反应在烯烃的歧化过程中 相当重要
✓把上面所讨论的催化过程连接起来建立一个催化循环 用来说明已知反应的机理或设计新的催化体系
第八章
活化分子间的反应
在建立过渡金属配合物催化循环中,根据具有抗磁性的d 轨道元素形成的均含有16或18个金属价电子配合物,而制订 的16、18电子规则相当重要
金属原子或离子以其部分充满的d轨道、相邻的较高一 层的s轨道或p轨道与配位体的轨道相互作用,形成金属 – 配位体化学键—配位键,成键情况如下:
①金属原于或离子的一个半充满轨道与配位体的一个半充 满轨道形成配位键
②金属原子或离子的一个空轨道与配位体的一个充满轨道形成 配位键
③金属原子或离子的一个充满轨道与配位体的一个空轨道 形成配位键
都由配位体提供,因此又称
为π– 给予体配位体
给予体π–成键作用
第八章
根据提供轨道的情况,配位体的分四类
④同时含有满轨道和空轨道的配位体,如 CO、烯烃和有机膦。这些配位体各不相同 ,但对金属有机物的催化作用起着重要作
用
表明一个CO配位体与一个 金属的相互作用,其中CO的
C原子具有一个满轨道的孤 对电子和一个空的反键π*–
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Page 12
Page 13
Page 14
Page 15
Page 16
Page 17
Page 18
Page 19
Page 20
Page 21
Page 22
Page 23
Page 24
Page 25
Page 26
Page 27
Page 28
Page 29
Page 30
Page 63
三、半导体催化剂的结构
2、钙钛矿型结构
▪ 这是一类化合物,其晶格结构类似于矿物CaTiO3,是可用通式 ABX3表示的氧化物,此处X是O=离子。A是一个大的阳离子, B是一个小的阳离子。
▪ 在高温下钙钛矿型结构的单位晶胞为正立方体,A位于晶胞的 中心,B位于正立方体顶点。此中A的配位数为12(O=),B的配 位数为6(O=)。
2、钙钛矿型结构
[1+5]=AIBVO3;[2+4]=AIIBIVO3;[3+3]= AIIIBIIIO3
பைடு நூலகம்
▪ ②A位和B位阳离子的特定组合与部分取代,会生成B位阳离子的 反常价态,也可能是阳离子空穴和/或O=空穴。
▪ 产生这种晶格缺陷后,会修饰氧化物的化学性质或者传递性质。 这种修饰会直接或间接地影响它们的催化性能。
Page 42
Page 43
Page 44
Page 45
Page 46
Page 47
Page 48
Page 49
Page 50
Page 51
Page 52
Page 53
Page 54
Page 55
Page 56
Page 57
主要内容
1 半导体的形成与能带理论 2 氧化物催化剂的电子催化理论 3 半导体催化剂结构 4 氧化物催化剂的表面与催化性能 5 烃类的催化氧化理论 6 乙烯丙烯氧化及催化剂
Page 64
三、半导体催化剂的结构
2、钙钛矿型结构
钙钛矿的晶体结构
三、半导体催化剂的结构
2、钙钛矿型结构
ABX3
▪ 基于电中性原理,阳离子的电荷之和应为+6,故其计量要求为:
[1+5]=AIBVO3;[2+4]=AIIBIVO3;[3+3]= AIIIBIIIO3 ▪ 具有这三种计量关系的钙钛矿型化合物有300多种,覆盖了很大范围。
有关钙钛矿型催化剂,原则如下:
▪ ①组分A无催化活性,组分B有催化活性。A和B的众多结合生成钙钛矿 型氧化物时,或A与B为别的离子部分取代时,不影响它基本晶格结构
▪ 故有A1-xA’xBO3型的,有AB1-xB’xO3型的,以及A1-xA’ xB1-yB’ yO3型的等
Page 66
三、半导体催化剂的结构
Page 59
三、半导体催化剂的结构
▪ 复合金属氧化物 需要满足3个方面的要求: ①控制化学计量关系的价态平衡; ②控制离子间大小相互取代的可能; ③修饰理想结构的配位情况变化,这种理想结构是基于假定离 子是刚性的,不可穿透的,非畸变的球体。实际复合金属氧化 物催化剂的结构,常是有晶格缺陷的,非化学计量的,且离子 是可变形的。
Page 58
三、半导体催化剂的结构
▪ 单组分金属氧化物 - M2O型氧化物,Cu2O晶体结构 - MO型氧化物,NaCl型、纤维锌矿型 - M2O3型氧化物,刚玉型、C-M2O3型(萤石) - MO2型氧化物,萤石CaF2、金红石和硅石三种 - M2O5型氧化物,V2O5(层状结构) - MO3 型氧化物, MoO3(层状结构)
个氧原子以正八面体配位。正常的尖晶石结构,A原子占据正四面体位,B 原子占据正八面体位。有一些尖晶石结构的化合物具有反常的结构,其中 B原子的一半占据正四面体位,另一半B与所有的A占据正八面体位。还有 A与B完全混乱分布的尖晶石型化合物。
Page 61
三、半导体催化剂的结构
1、尖晶石结构
尖晶石晶体结构
Page 60
三、半导体催化剂的结构
1、尖晶石结构
▪ 很多金属氧化物具有尖晶石结构,常用作氧化和脱氢过程的催化剂。 ▪ 其结构通式可写成AB2O4。其单位晶胞含有32个O=负离子,组成立方紧密
堆积,对应于式A8B16O32。 ▪ 正常晶格中,8个A原子各以4个氧原子以正四面体配位;16个B原子各以6
Page 1
主要内容
1 半导体的形成与能带理论 2 氧化物催化剂的电子催化理论 3 氧化物催化剂的表面与催化性能 4 烃类的催化氧化理论 5 乙烯丙烯氧化及催化剂
Page 2
Page 3
Page 4
Page 5
Page 6
Page 7
Page 8
Page 9
Page 10
Page 11
Page 62
三、半导体催化剂的结构
1、尖晶石结构
▪ 就AB2O4尖晶石型氧化物来说,8个负电荷可用3种不同方式的阳离子结 合的电价平衡:(A2++2B3+),(A4++2B2+)和(A6++2B+)。 - 4,2结合的尖晶石结构(A4++2B2+) ,约占15%;阴离子主要是O=或S=。 - 6,1结合的只有少数几种氧化物系(A6++2B+) ,如MoAg2O4,MoLi2O4 以及WLi2O4。 - 2,3结合的尖晶石结构占绝大多数(A2++2B3+) ,约为80%;阴离子除O= 外还可以是S=、Se=或Te=。A2+离子可以是Mg++、Ca++、Cr++、Mn++、 Fe++、Co++、Ni++、Cu++、Zn++、Cd++、Hg++或Sn++;B3+可以是Al3+、 Ga3+、In3+、Ti+、V3+、Cr3+、Mn3+、Fe3+、Co3+、Ni3+或Rh3+。
Page 67
三、半导体催化剂的结构
2、钙钛矿型结构
[1+5]=AIBVO3;[2+4]=AIIBIVO3;[3+3]= AIIIBIIIO3
▪ ③在ABO3型氧化物催化剂中,用体相性质或表面性质都可与催化 活性关联。因为组分A基本上无活性,活性B彼此相距较远,约
0.4nm;气态分子仅与单一活性位作用。但是在建立这种关联时
主要内容
1 半导体的形成与能带理论 2 氧化物催化剂的电子催化理论 3 氧化物催化剂的表面与催化性能 4 烃类的催化氧化理论 5 乙烯丙烯氧化及催化剂
Page 32
Page 33
Page 34
Page 35
Page 36
Page 37
Page 38
Page 39
Page 40
Page 41
