标准电极电势表
电极电势表
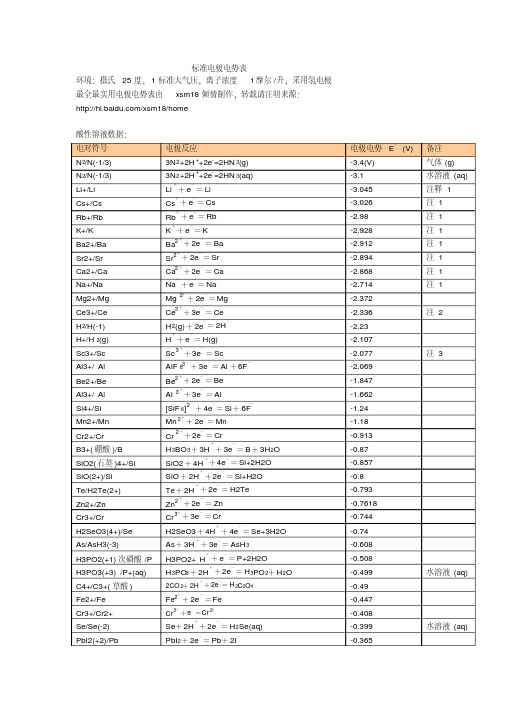
备注 气体 (g) 水溶液 (aq) 注释 1 注 1 注 1 注 1 注 1 注 1 注 1 注 1
+2+
+
+
-
+ 2e = Mg
- -
-
Ce3 + 3e = Ce H 2(g) + 2e = 2H H + e = H(g) Sc
3+
+ -
注 2
-2.23 -2.107 -2.077 注 3
- + - - - - + - + - -
-
0.2476 0.268 0.308 0.337 0.354 0.3572
HAsO 2 .H2O
SO42 + 8H + 6e = S+4H 2 O
2 Ag 2 CrO 4+ 2e = 2Ag + CrO 4
+ - -
0.447 0.449 0.4647 0.521 0.5355
2+
+ 2e = Cr
+ - + -
H 3BO 3+ 3H + 3e = B + 3H 2O SiO2 + 4H + 4e = Si+2H2O SiO + 2H + 2e = Si+H2O Te + 2H + 2e = H2Te Zn 2 + 2e = Zn Cr 3 + 3e = Cr H2SeO3 + 4H + 4e = Se+3H2O As + 3H + 3e = AsH 3 H3PO2+ H + e = P+2H2O H 3PO3 + 2H + 2e = H 3PO 2+ H 2O
3 Fe + 3e = Fe 2S Ag 2 S+ 2H + 2e = 2Ag +H
+ - + - - - + -
+
-
-0.12 -0.063 -0.0405 -0.037 -0.0366 0.00 气体 (g)
标准电极电势表
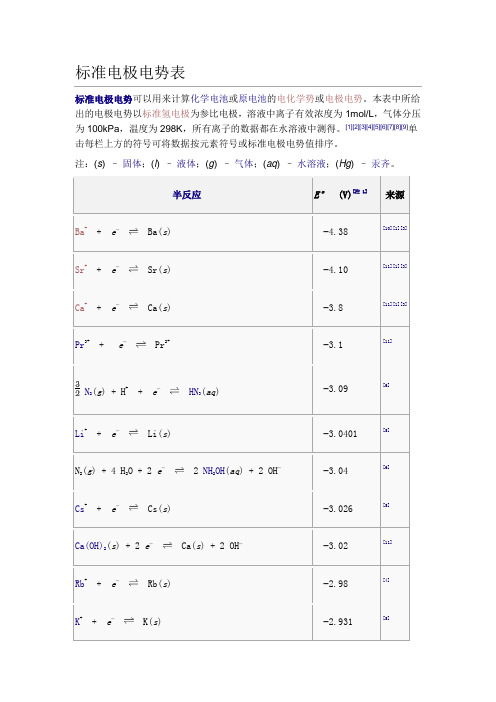
标准电极电势表标准电极电势可以用来计算化学电池或原电池的电化学势或电极电势。
本表中所给出的电极电势以标准氢电极为参比电极,溶液中离子有效浓度为1mol/L,气体分压为100kPa,温度为298K,所有离子的数据都在水溶液中测得。
[1][2][3][4][5][6][7][8][9]单击每栏上方的符号可将数据按元素符号或标准电极电势值排序。
注:(s) –固体;(l) –液体;(g) –气体;(aq) –水溶液;(Hg) –汞齐。
半反应E°(V)[注 1]来源Ba++ e−Ba(s) −4.38 [10][1][3]Sr++ e−Sr(s) −4.10 [11][1][3] Ca++ e−Ca(s) −3.8 [11][1][3]Pr3++ e−Pr2+−3.1 [11] N2(g) + H++ e−HN3(aq) −3.09 [6]Li++ e−Li(s) −3.0401 [5]N2(g) + 4 H2O + 2 e−2 NH2OH(aq) + 2 OH−−3.04 [6]Cs++ e−Cs(s) −3.026 [5]Ca(OH)2(s) + 2 e−Ca(s) + 2 OH−−3.02 [11]Rb++ e−Rb(s) −2.98 [4]K++ e−K(s) −2.931 [5]半反应E°(V)[注 1]来源Mg++ e−Mg(s) −2.93 [10] Ba2++ 2 e−Ba(s) −2.912 [5]La(OH)3(s) + 3 e−La(s) + 3OH−−2.90 [5]Fr++ e−Fr(s) −2.9 [11] Sr2++ 2 e−Sr(s) −2.899 [5]Sr(OH)2(s) + 2 e−Sr(s) + 2 OH−−2.88 [11] Ca2++ 2 e−Ca(s) −2.868 [5] Eu2++ 2 e−Eu(s) −2.812 [5] Ra2++ 2 e−Ra(s) −2.8 [5] Yb2++ 2 e−Yb(s) −2.76 [11][1] Na++ e−Na(s) −2.71 [5][9] Sm2++ 2 e−Sm(s) −2.68 [11][1] No2++ 2 e−No(s) −2.50 [11] HfO(OH)2(s) + H2O + 4 e−Hf(s) + 4 OH−−2.50 [11]半反应E°(V)[注 1]来源Th(OH)4(s) + 4 e−Th(s) + 4 OH−−2.48 [11] Md2++ 2 e−Md(s) −2.40 [11] La3++ 3 e−La(s) −2.379 [5]Y3++ 3 e−Y(s) −2.372 [5] Mg2++ 2 e−Mg(s) −2.372 [5] ZrO(OH)2(s) + H2O + 4 e−Zr(s) + 4OH−−2.36 [5]Pr3++ 3 e−Pr(s) −2.353 [11] Ce3++ 3 e−Ce(s) −2.336 [11] Er3++ 3 e−Er(s) −2.331 [11] Ho3++ 3 e−Ho(s) −2.33 [11]Al(OH)4−+ 3 e−Al(s) + 4 OH−−2.33Al(OH)3(s) + 3 e−Al(s) + 3OH−−2.31Tb3++ 3 e−Tb(s) −2.28半反应E°(V)[注 1]来源H2(g) + 2 e−2 H−−2.25Ac3++ 3 e−Ac(s) −2.20Be++ e−Be(s) −2.12 [10] Cf2++ 2 e−Cf(s) −2.12 [11] Am3++ 3 e−Am(s) −2.048 [11] Cf3++ 3 e−Cf(s) −1.94 [11] Am2++ 2 e−Am(s) −1.9 [11] Be2++ 2 e−Be(s) −1.85Rf4++ 4 e−Rf(s) −1.67 [12]U3++ 3 e−U(s) −1.66 [7]Al3++ 3 e−Al(s) −1.66 [9]Ti2++ 2 e−Ti(s) −1.63 [9]Bk2++ 2 e−Bk(s) −1.6 [11]半反应E°(V)[注 1]来源ZrO2(s) + 4 H++ 4 e−Zr(s) + 2 H2O −1.553 [5]Hf4++ 4 e−Hf(s) −1.55 [11]Zr4++ 4 e−Zr(s) −1.45 [5]Ti3++ 3 e−Ti(s) −1.37 [13] TiO(s) + 2 H++ 2 e−Ti(s) + H2O −1.31Ti2O3(s) + 2 H++ 2 e−2 TiO(s) + H2O −1.23Zn(OH)42−+ 2 e−Zn(s) + 4 OH−−1.199 [14] Mn2++ 2 e−Mn(s) −1.185 [14] Fe(CN)64−+ 6 H++ 2 e−Fe(s) + 4HCN(aq) −1.16 [15]V2++ 2 e−V(s) −1.175 [2]Te(s) + 2 e−Te2−−1.143 [2] Nb3++ 3 e−Nb(s) −1.099Sn(s) + 4 H++ 4 e−SnH4(g) −1.07半反应E°(V)[注 1]来源In(OH)3(s) + 3 e−In(s) + 3 OH−−0.99 [11] SiO2(s) + 4 H++ 4 e−Si(s) + 2 H2O −0.91B(OH)3(aq) + 3 H++ 3 e−B(s) + 3 H2O −0.89Fe(OH)2(s) + 2 e−Fe(s) + 2 OH−−0.89 [15] Fe2O3(s) + 3 H2O + 2 e−2Fe(OH)2(s) + 2 OH−−0.86 [15] TiO2++ 2 H++ 4 e−Ti(s) + H2O −0.862 H2O+ 2 e−H2(g) + 2 OH−−0.8277 [5]Bi(s) + 3 H++ 3 e−BiH3−0.8 [14] Zn2++ 2 e−Zn(Hg) −0.7628 [5]Zn2++ 2 e−Zn(s) −0.7618 [5]Ta2O5(s) + 10 H++ 10 e−2 Ta(s) + 5 H2O −0.75Cr3++ 3 e−Cr(s) −0.74[Au(CN)2]−+ e−Au(s) + 2 CN−−0.60半反应E°(V)[注 1]来源Ta3++ 3 e−Ta(s) −0.6PbO(s) + H2O + 2 e−Pb(s) + 2 OH−−0.582 TiO2(s) + 2 H++ 2 e−Ti2O3(s) + H2O −0.56Ga3++ 3 e−Ga(s) −0.53U4++ e−U3+−0.52 [7]H3PO2(aq) + H++ e−P(白磷[16]) + 2 H2O −0.508 [5]H3PO3(aq) + 2 H++ 2 e−H3PO2(aq) + H2O −0.499 [5]H3PO3(aq) + 3 H++ 3 e−P(红磷)[16]+ 3H2O −0.454 [5]Fe2++ 2 e−Fe(s) −0.44 [9]2 CO2(g) + 2 H++ 2 e−HOOCCOOH(aq) −0.43Cr3++ e−Cr2+−0.42Cd2++ 2 e−Cd(s) −0.40 [9] SeO32−+ 4e−+ 3H2O ⇌Se + 6OH−−0.37 [17]半反应E°(V)[注 1]来源GeO2(s) + 2 H++ 2 e−GeO(s) + H2O −0.37Cu2O(s) + H2O + 2 e−2 Cu(s) + 2 OH−−0.360 [5] PbSO4(s) + 2 e−Pb(s) + SO42−−0.3588 [5] PbSO4(s) + 2 e−Pb(Hg) + SO42−−0.3505 [5] Eu3++ e−Eu2+−0.35 [7]In3++ 3 e−In(s) −0.34 [2]Tl++ e−Tl(s) −0.34 [2] Ge(s) + 4 H++ 4 e−GeH4(g) −0.29Co2++ 2 e−Co(s) −0.28 [5]H3PO4(aq) + 2 H++ 2 e−H3PO3(aq) + H2O −0.276 [5]V3++ e−V2+−0.26 [9]Ni2++ 2 e−Ni(s) −0.25As(s) + 3 H++ 3 e−AsH3(g) −0.23 [2]半反应E°(V)[注 1]来源AgI(s) + e−Ag(s) + I−−0.15224 [14] MoO2(s) + 4 H++ 4 e−Mo(s) + 2 H2O −0.15Si(s) + 4 H++ 4 e−SiH4(g) −0.14Sn2++ 2 e−Sn(s) −0.13O2(g) + H++ e−HO2•(aq) −0.13Pb2++ 2 e−Pb(s) −0.13 [9] WO2(s) + 4 H++ 4 e−W(s) + 2 H2O −0.12P(红磷) + 3 H++ 3 e−PH3(g) −0.111 [5] CO2(g) + 2 H++ 2 e−HCOOH(aq) −0.11Se(s) + 2 H++ 2 e−H2Se(g) −0.11CO2(g) + 2 H++ 2 e−CO(g) + H2O −0.11SnO(s) + 2 H++ 2 e−Sn(s) + H2O −0.10半反应E°(V)[注 1]来源SnO2(s) + 2 H++ 2 e−SnO(s) + H2O −0.09WO3(aq) + 6 H++ 6 e−W(s) + 3 H2O −0.09 [2]P(白磷) + 3 H++ 3 e−PH3(g) −0.063 [5]Fe3++ 3 e−Fe(s) −0.04 [15] HCOOH(aq) + 2 H++ 2 e−HCHO(aq) + H2O −0.032 H++ 2 e−H2(g)0.00 ≡0 AgBr(s) + e−Ag(s) + Br−+0.07133 [14]S4O62−+ 2 e−2 S2O32−+0.08Fe3O4(s) + 8 H++ 8 e−3 Fe(s) + 4 H2O +0.085 [8]N2(g) + 2 H2O + 6H++ 6 e−2 NH4OH(aq) +0.092HgO(s) + H2O + 2 e−Hg(l) + 2 OH−+0.0977Cu(NH3)42++ e−Cu(NH3)2++ 2 NH3+0.10 [2]Ru(NH3)63++ e−Ru(NH3)62++0.10 [7]半反应E°(V)[注 1]来源N2H4(aq) + 4 H2O + 2 e−2 NH4++ 4 OH−+0.11 [6]H2MoO4(aq) + 6 H++ 6 e−Mo(s) + 4 H2O +0.11Ge4++ 4 e−Ge(s) +0.12C(s) + 4 H++ 4 e−CH4(g) +0.13 [2] HCHO(aq) + 2 H++ 2 e−CH3OH(aq) +0.13S(s) + 2 H++ 2 e−H2S(g) +0.14Sn4++ 2 e−Sn2++0.15Cu2++ e−Cu++0.159 [2] HSO4−+ 3 H++ 2 e−SO2(aq) + 2 H2O +0.16UO22++ e−UO2++0.163 [7] SO42−+ 4 H++ 2 e−SO2(aq) + 2 H2O +0.17TiO2++ 2 H++ e−Ti3++ H2O +0.19半反应E°(V)[注 1]来源Bi3++ 2e−Bi++0.2SbO++ 2 H++ 3 e−Sb(s) + H2O +0.20AgCl(s) + e−Ag(s) + Cl−+0.22233 [14]H3AsO3(aq) + 3 H++ 3 e−As(s) + 3 H2O +0.24GeO(s) + 2 H++ 2 e−Ge(s) + H2O +0.26UO2++ 4 H++ e−U4++ 2 H2O +0.273 [7]At2+ e−2 At-+0.3 [11] Re3++ 3 e−Re(s) +0.300Bi3++ 3 e−Bi(s) +0.32VO2++ 2 H++ e−V3++ H2O +0.34Cu2++ 2 e−Cu(s) +0.340 [2] [Fe(CN)6]3−+ e−[Fe(CN)6]4−+0.36半反应E°(V)[注 1]来源Tc2++ 2 e−Tc(s) +0.40 [11]O2(g) + 2 H2O + 4 e−4 OH−(aq) +0.40 [9]H2MoO4+ 6 H++ 3 e−Mo3++ 2 H2O +0.43Ru2++ 2 e−Ru(s) +0.455 [11]Bi++ e−Bi(s) +0.50CH3OH(aq) + 2 H++ 2 e−CH4(g) + H2O +0.50SO2(aq) + 4 H++ 4 e−S(s) + 2 H2O +0.50Cu++ e−Cu(s) +0.520 [2] CO(g) + 2 H++ 2 e−C(s) + H2O +0.52I3−+ 2 e−3 I−+0.53 [9]I2(s) + 2 e−2 I−+0.54 [9] [AuI4]−+ 3 e−Au(s) + 4 I−+0.56半反应E°(V)[注 1]来源H3AsO4(aq) + 2 H++ 2 e−H3AsO3(aq) + H2O +0.56[AuI2]−+ e−Au(s) + 2 I−+0.58MnO4−+ 2 H2O + 3 e−MnO2(s) + 4 OH−+0.59Rh++ e−Rh(s) +0.600 [11]S2O32 −+ 6 H++ 4 e−2 S(s) + 3 H2O +0.60Fc++ e−Fc(s) +0.641 [18]+0.643 [11]+ e−Ag + −H2MoO4(aq) + 2 H++ 2 e−MoO2(s) + 2 H2O +0.65+0.6992 [14] + 2 H++ 2 e−O2(g) + 2 H++ 2 e−H2O2(aq) +0.70Tl3++ 3 e−Tl(s) +0.72半反应E°(V)[注 1]来源PtCl62−+ 2 e−PtCl42−+ 2 Cl−+0.726 [7]H2SeO3(aq) + 4 H++ 4 e−Se(s) + 3 H2O +0.74Rh3++ 3 e−Rh(s) +0.758 [11] PtCl42−+ 2 e−Pt(s) + 4 Cl−+0.758 [7]Fe3++ e−Fe2++0.77Ag++ e−Ag(s) +0.7996 [5] Hg22++ 2 e−2 Hg(l) +0.80NO3−(aq) + 2 H++ e−NO2(g) + H2O +0.80FeO42−+ 5 H2O + 6 e−Fe2O3(s) + 10 OH−+0.81 [15]H2(g) + 2 OH−2 H2O + 2 e−+0.828 [19] [AuBr4]−+ 3 e−Au(s) + 4 Br−+0.85Hg2++ 2 e−Hg(l) +0.85半反应E°(V)[注 1]来源MnO4−+ H++ e−HMnO4−+0.902 Hg2++ 2 e−Hg22++0.91 [2] Pd2++ 2 e−Pd(s) +0.915 [7] [AuCl4]−+ 3 e−Au(s) + 4 Cl−+0.93MnO2(s) + 4 H++ e−Mn3++ 2 H2O +0.95[AuBr2]−+ e−Au(s) + 2 Br−+0.96[HXeO6]3−+ 2 H2O + 2 e−+ [HXeO4]−+ 4 OH−+0.99 [20] HNO2+ H++ e-= NO(g)+ H2O +0.996H6TeO6(aq) + 2 H++ 2 e−TeO2(s) + 4 H2O +1.02 [21] Br2(l) + 2 e−2 Br−+1.07Br2(aq) + 2 e−2 Br−+1.09 [9] NO2(g) + H++ e-= HNO2+1.093半反应E°(V)[注 1]来源IO3−+ 5 H++ 4 e−HIO(aq) + 2 H2O +1.13[AuCl2]−+ e−Au(s) + 2 Cl−+1.15HSeO4−+ 3 H++ 2 e−H2SeO3(aq) + H2O +1.15Ir3++ 3 e−Ir(s) +1.156 [11] Ag2O(s) + 2 H++ 2 e−2 Ag(s) + H2O +1.17ClO3−+ 2 H++ e−ClO2(g) + H2O +1.18[HXeO6]3−+ 5 H2O + 8 e−Xe(g) + 11 OH−+1.18 [20]Pt2++ 2 e−Pt(s) +1.188 [7] ClO2(g) + H++ e−HClO2(aq) +1.192 IO3−+ 12 H++ 10 e−I2(s) + 6 H2O +1.20ClO4−+ 2 H++ 2 e−ClO3−+ H2O +1.20O2(g) + 4 H++ 4 e−2 H2O+1.229 [9]半反应E°(V)[注 1]来源MnO2(s) + 4 H++ 2 e−Mn2++ 2H2O +1.23[HXeO4]−+ 3 H2O + 6 e−Xe(g) + 7 OH−+1.24 [20]Tl3++ 2 e−Tl++1.25Cr2O72 −+ 14 H++ 6 e−2 Cr3++ 7 H2O +1.33Cl2(g) + 2 e−2 Cl−+1.36 [9] CoO2(s) + 4 H++ e−Co3++ 2 H2O +1.422 NH3OH++ H++ 2 e−N2H5++ 2 H2O +1.42 [6]2 HIO(aq) + 2 H++ 2 e−I2(s) + 2 H2O +1.44Ce4++ e−Ce3++1.44BrO3−+ 5 H++ 4 e−HBrO(aq) + 2 H2O +1.45β-PbO2(s) + 4 H++ 2 e−Pb2++ 2 H2O +1.460 [2]α-PbO2(s) + 4 H++ 2 e−Pb2++ 2 H2O +1.468 [2]半反应E°(V)[注 1]来源2 BrO3−+ 12 H++ 10 e−Br2(l) + 6 H2O +1.482ClO3−+ 12 H++ 10 e−Cl2(g) + 6 H2O +1.49HO2+ H++ e−H2O2+1.495 [11] MnO4−+ 8 H++ 5 e−Mn2++ 4 H2O +1.51HO2•+ H++ e−H2O2(aq) +1.51Au3++ 3 e−Au(s) +1.52NiO2(s) + 4 H++ 2 e−Ni2++ 2 OH−+1.592 HClO(aq) + 2 H++ 2 e−Cl2(g) + 2 H2O +1.63Ag2O3(s) + 6 H++ 4 e−2 Ag++ 3 H2O +1.67HClO2(aq) + 2 H++ 2 e−HClO(aq) + H2O +1.67Pb4++ 2 e−Pb2++1.69 [2] MnO4−+ 4 H++ 3 e−MnO2(s) + 2 H2O +1.70半反应E°(V)[注 1]来源AgO(s) + 2 H++ e−Ag++ H2O +1.77 H2O2(aq) + 2 H++ 2 e−2 H2O +1.776Co3++ e−Co2++1.82Au++ e−Au(s) +1.83 [2] BrO4−+ 2 H++ 2 e−BrO3−+ H2O +1.85Ag2++ e−Ag++1.98 [2]S2O82−+ 2 e−2 SO42−+2.07O3(g) + 2 H++ 2 e−O2(g) + H2O +2.075 [7] HMnO4−+ 3 H++ 2 e−MnO2(s) + 2 H2O +2.09XeO3(aq) + 6 H++ 6 e−Xe(g) + 3 H2O +2.12 [20]H4XeO6(aq) + 8 H++ 8 e−Xe(g) + 6 H2O +2.18 [20] FeO42−+ 3 e−+ 8 H+Fe3++ 4 H2O +2.20 [22] XeF2(aq) + 2 H++ 2 e−Xe(g) + 2HF(aq) +2.32 [20]半反应E°(V)[注 1]来源H4XeO6(aq) + 2 H++ 2 e−XeO3(aq) + H2O +2.42 [20]F2(g) + 2 e−2 F−+2.87 [2][9] F2(g) + 2 H++ 2 e−2 HF(aq) +3.05 [2]Tb4++ e− Tb3++3.05 [11]。
标准电极电势表

标准电极电势表标准电极电势表,又称为标准还原电极电势表,是用于测量化学反应中电极对的电势的参考表。
它由国际电化学会(IUPAC)制定,用于比较不同电极对的电势大小。
标准电极电势是指在标准状态下,即温度为298K、气体为1标准大气压、物质浓度为1mol/L的情况下,电极对所具有的电势差。
标准电极电势表中,以氢电极为参考电极,将其电势定义为0V,其他电极对的电势相对于氢电极进行了测量。
标准电极电势表是按照电势从高到低排列的。
表中的电势值表示了不同物质的氧化还原能力,具有负值的电极对可以进行自发的氧化还原反应,而具有正值的电极对则不会进行自发的氧化还原反应。
标准电极电势表中常见的电极对包括:1. 氢电极(H^+ / H2):作为参考电极,其电势为0V。
2. 铂电极(Pt / Pt2+):作为惰性电极常常出现在其他电极对中。
3. 银电极(Ag+ / Ag):电势为0.7996V。
4. 铜电极(Cu2+ / Cu):电势为0.337V。
5. 铁电极(Fe2+ / Fe):电势为-0.440V。
6. 锌电极(Zn2+ / Zn):电势为-0.764V。
标准电极电势表可以用于计算化学反应的电动势。
根据标准电极电势表,当一个电极对的电势大于0时,反应是非自发的,需要提供外部电能才能进行。
当一个电极对的电势小于0时,反应是自发的,可以自发地进行。
标准电极电势表对于研究化学反应的方向性和电动势的计算非常重要。
它在化学工业生产、化学分析和电化学领域都有广泛的应用。
通过标准电极电势表,我们可以更好地了解化学反应的本质,并且对于电化学能量转化和储存等方面的研究也起到了重要的参考作用。
标准电极电势表

标准电极电势表1. 引言标准电极电势表是一种常用的参考工具,它用于比较不同化学电池或半电池的电势。
通过测量电池的电势,可以了解到其发生的化学反应过程以及反应的强弱。
标准电极电势表采用了一种标准电极作为参照,以确定其他电极的电势。
2. 标准电极标准电极是指在标准条件下,具有已知电势的电极。
根据国际电化学学会(IUPAC)的定义,标准电极是指与一个摩尔浓度为1的气体(气态物质)或摩尔浓度为1mol/L的溶液(溶解物质)接触的电极。
根据库仑定律,电势与物质浓度之间存在一定的关系。
通过实验测量得到的不同电极的电势与标准氢电极(SHE)的电势之间的差值,被称为标准电势。
标准电极电势表以标准氢电极为参照,给出了一系列常见电极的标准电势值。
3. 标准电势表的组成标准电极电势表由两列构成,分别为电极和标准电势。
电极列列出了不同电极的名称,而标准电势列则列出了对应电极的标准电势值。
常见的标准电极电势表包括了一系列重要的电极,如标准氢电极、标准铜电极、标准锌电极等。
下表为一个常见的标准电极电势表的示例:电极标准电势 (V)标准氢电极0标准锂电极-3.04标准铅电极-0.13标准铜电极+0.34标准银电极+0.80标准铂电极+0.99标准金电极+1.504. 应用与意义标准电极电势表在化学和电化学研究中具有重要的应用和意义。
它可以用于确定电池的电势以及反应的方向和驱动力。
根据标准电极电势表中的电势值,可以将不同电极的电势进行比较,从而判断反应的强弱。
当两个电极之间的标准电势差大于零时,表示反应是自发进行的,当电势差小于零时,则需要外加电势来推动反应。
此外,标准电极电势表还可以用于确定化学反应的电子转移过程。
电子转移是化学反应中常见的一种过程,通过标准电极电势表可以确定电子从高电势一侧转移到低电势一侧的方向。
5. 总结标准电极电势表是一种常用的参考工具,用于测量和比较不同电池或半电池的电势。
它以标准氢电极为参照,给出了一系列常见电极的标准电势值。
标准电极电势表 -回复

标准电极电势表 -回复标准电极电势表是一种记录不同金属电极电势的表格。
标准电极电势表采用了氢电极作为参照标准,将氢电极的电势定义为0V。
标准电极电势表中,数值为正的电极表示容易氧化,具有较强还原性;数值为负的电极表示容易被还原,具有较强氧化性。
在标准电极电势表中,银-银离子电极的电势为0.8V,表示银离子容易还原成银。
标准电极电势表中,铜-铜离子电极的电势为0.34V,表示铜离子容易还原成铜。
标准电极电势表中,锡-锡离子电极的电势为-0.14V,表示锡离子容易被还原成锡。
标准电极电势表中,镍-镍离子电极的电势为-0.25V,表示镍离子容易被还原成镍。
容易被还原成铁。
标准电极电势表中,钠-钠离子电极的电势为-2.71V,表示钠离子容易被还原成钠。
标准电极电势表中,氢-氢离子电极的电势为0V,即定义为标准电极。
标准电极电势表中,锌-锌离子电极的电势为-0.76V,表示锌离子容易被还原成锌。
标准电极电势表中,铝-铝离子电极的电势为-1.66V,表示铝离子容易被还原成铝。
标准电极电势表中,铂-铂离子电极的电势为0.00V,表示铂离子很稳定,不容易还原或氧化。
标准电极电势表中,钾-钾离子电极的电势为-2.93V,表示钾离子容易还原成钾。
标准电极电势表中,氯气-氯离子电极的电势为1.36V,表示氯离子容易还原成氯气。
子容易还原成溴气。
标准电极电势表中,碘气-碘离子电极的电势为0.53V,表示碘离子容易还原成碘气。
标准电极电势表中,溶解态氧气-氧离子电极的电势为1.23V,表示氧离子容易还原成溶解态氧气。
标准电极电势表中,溶解态氢气-氢离子电极的电势为0.00V,表示溶解态氢气很稳定,不容易还原或氧化。
标准电极电势表中,钏离子-钏金属电极的电势为-0.25V,表示钏离子容易还原成钏金属。
标准电极电势表中,镍离子-镍金属电极的电势为-0.25V,表示镍离子容易还原成镍金属。
标准电极电势表中,锰离子-锰金属电极的电势为-1.18V,表示锰离子容易还原成锰金属。
标准电势表

标准电势表是一种用于测量各种电极电势的工具,通常由铜、银、氯化银等材料制成。
它是一种精密的测量仪器,可以用于研究电解池的电极反应和电化学性质,也可以用于检测各种物质的电化学性质。
标准电势表的使用方法是将待测电极和标准电极插入同一电解液中,然后通过测量电路连接标准电极和待测电极。
当两电极之间的电位差达到稳定状态时,记录下待测电极的电位值,并与标准电极的电位值进行比较,即可得出待测电极的电极电势。
由于标准电势表是一种精密的测量仪器,因此在使用过程中需要注意以下几点:
1.使用前应先检查标准电势表的零点是否准确,如果不准确需要进行调整。
2.使用时应避免电极受到震动和碰撞,以免影响测量精度。
3.在测量过程中应保持电解液的温度恒定,以减小测量误差。
4.使用后应将标准电势表清洗干净,并妥善保管。
总之,标准电势表是一种重要的电化学测量仪器,可以用于研究电解池的电极反应和电化学性质,也可以用于检测各种物质的电化学性质。
在使用过程中需要注意精度和稳定性,以确保测量结果的准确性和可靠性。
标准电极电势表

标准电极电势表目录[隐藏]电极电势的产生—双电层理论定义公式电极电势内容标准电极电势表[编辑本段]电极电势的产生—双电层理论德国化学家能斯特(H.W.Nernst)提出了双电层理论(electron double lay er theory)解释电极电势的产生的原因。
当金属放入溶液中时,一方面金属晶体中处于热运动的金属离子在极性水分子的作用下,离开金属表面进入溶液。
金属性质越活泼,这种趋势就越大;另一方面溶液中的金属离子,由于受到金属表面电子的吸引,而在金属表面沉积,溶液中金属离子的浓度越大,这种趋势也越大。
在一定浓度的溶液中达到平衡后,在金属和溶液两相界面上形成了一个带相反电荷的双电层(electron double layer),双电层的厚度虽然很小(约为10-8厘米数量级), 但却在金属和溶液之间产生了电势差。
通常人们就把产生在金属和盐溶液之间的双电层间的电势差称为金属的电极电势(electrode potential),并以此描述电极得失电子能力的相对强弱。
电极电势以符号E Mn+/ M表示, 单位为V(伏)。
如锌的电极电势以EZn2+/ Zn 表示, 铜的电极电势以ECu2+/Cu 表示。
电极电势的大小主要取决于电极的本性,并受温度、介质和离子浓度等因素的影响。
[编辑本段]定义标准电极电势是可逆电极在标准状态及平衡态时的电势,也就是标准态时的电极电势.标准电极电势有很大的实用价值,可用来判断氧化剂与还原剂的相对强弱,判断氧化还原反应的进行方向,计算原电池的电动势、反应自由能、平衡常数,计算其他半反应的标准电极电势,等等。
将半反应按电极电势由低到高排序,可以得到标准电极电势表,可十分简明地判断氧还反应的方向.[编辑本段]公式任何温度下标准氢电极的标准电极电势值都为0,但其他电极电势值会受到温度影响。
以Ni/NiO电极为例,它可以用作高温伪参比电极,在0-400°C时的电极电势大致符合以下公式:E°(T)=-0.0003T+0.1414,T为温度[编辑本段]电极电势内容1 在酸性溶液中(298K)电对方程式Eq/VLi(I)-(0) Li++e-=Li -3.0401Cs(I)-(0) Cs++e-=Cs -3.026Rb(I)-(0) Rb++e-=Rb -2.98K(I)-(0) K++e-=K -2.931Ba(II)-(0) Ba2++2e-=Ba -2.912Sr(II)-(0) Sr2++2e-=Sr -2.89Ca(II)-(0) Ca2++2e-=Ca -2.868Na(I)-(0) Na++e-=Na -2.71La(III)-(0) La3++3e-=La -2.379Mg(II)-(0) Mg2++2e-=Mg -2.372Ce(III)-(0) Ce3++3e-=Ce -2.336H(0)-(-I) H2(g)+2e-=2H--2.23Al(III)-(0) AlF63-+3e-=Al+6F--2.069Th(IV)-(0) Th4++4e-=Th -1.899Be(II)-(0) Be2++2e-=Be -1.847U(III)-(0) U3++3e-=U -1.798Hf(IV)-(0) HfO2++2H++4e-=Hf+H2O -1.724Al(III)-(0) Al3++3e-=Al -1.662Ti(II)-(0) Ti2++2e-=Ti -1.630Zr(IV)-(0) ZrO2+4H++4e-=Zr+2H2O -1.553Si(IV)-(0) [SiF6]2-+4e-=Si+6F--1.24Mn(II)-(0) Mn2++2e-=Mn -1.185Cr(II)-(0) Cr2++2e-=Cr -0.913Ti(III)-(II) Ti3++e-=Ti2+-0.9B(III)-(0) H3BO3+3H++3e-=B+3H2O -0.8698*Ti(IV)-(0) TiO2+4H++4e-=Ti+2H2O -0.86Te(0)-(-II) Te+2H++2e-=H2Te -0.793Zn(II)-(0) Zn2++2e-=Zn -0.7618Ta(V)-(0) Ta2O5+10H++10e-=2Ta+5H2O -0.750Cr(III)-(0) Cr3++3e-=Cr -0.744Nb(V)-(0) Nb2O5+l0H++10e-=2Nb+5H2O -0.644 As(0)-(-III) As+3H++3e-=AsH3 -0.608U(IV)-(III) U4++e-=U3+-0.607Ga(III)-(0) Ga3++3e-=Ga -0.549P(I)-(0) H3PO2+H++e-=P+2H2O -0.508P(III)-(I) H3PO3+2H++2e-=H3PO2+H2O -0.499 *C(IV)-(III) 2CO2+2H++2e-=H2C2O4 -0.49Fe(II)-(0) Fe2++2e-=Fe -0.447Cr(III)-(II) Cr3++e-=Cr2+-0.407Cd(II)-(0) Cd2++2e-=Cd -0.4030Se(0)-(-II) Se+2H++2e-=H2Se(aq) -0.399Pb(II)-(0) PbI2+2e-=Pb+2I--0.365Eu(III)-(II) Eu3++e-=Eu2+-0.36Pb(II)-(0) PbSO4+2e-=Pb+SO42--0.3588In(III)-(0) In3++3e-=In -0.3382Tl(I)-(0) Tl++e-=Tl -0.336Co(II)-(0) Co2++2e-=Co -0.28P(V)-(III) H3PO4+2H++2e-=H3PO3+H2O -0.276 Pb(II)-(0) PbCl2+2e-=Pb+2Cl--0.2675Ni (II)-(0) Ni2++2e-=Ni -0.257V(III)-(II) V3++e-=V2+-0.255Ge(IV)-(0) H2GeO3+4H++4e-=Ge+3H2O -0.182 Ag(I)-(0) AgI+e-=Ag+I--0.15224Sn(II)-(0) Sn2++2e-=Sn -0.1375Pb(II)-(0) Pb2++2e-=Pb -0.1262*C(IV)-(II) CO2(g)+2H++2e-=CO+H2O -0.12P(0)-(-III) P(white)+3H++3e-=PH3(g) -0.063Hg(I)-(0) Hg2I2+2e-=2Hg+2I--0.0405Fe(III)-(0) Fe3++3e-=Fe -0.037H(I)-(0) 2H++2e-=H2 0.0000Ag(I)-(0) AgBr+e-=Ag+Br-0.07133S(II.V)-(II) S4O62-+2e-=2S2O32-0.08*Ti(IV)-(III) TiO2++2H++e-=Ti3++H2O 0.1S(0)-(-II) S+2H++2e-=H2S(aq) 0.142Sn(IV)-(II) Sn4++2e-=Sn2+0.151Sb(III)-(0) Sb2O3+6H++6e-=2Sb+3H2O 0.152Cu(II)-(I) Cu2++e-=Cu+0.153Bi(III)-(0) BiOCl+2H++3e-=Bi+Cl-+H2O 0.1583 S(VI)-(IV) SO42-+4H++2e-=H2SO3+H2O 0.172 Sb(III)-(0) SbO++2H++3e-=Sb+H2O 0.212Ag(I)-(0) AgCl+e-=Ag+Cl-0.22233As(III)-(0) HAsO2+3H++3e-=As+2H2O 0.248Hg(I)-(0) Hg2Cl2+2e-=2Hg+2Cl-(饱和KCl) 0.26808 Bi(III)-(0) BiO++2H++3e-=Bi+H2O 0.320U(VI)-(IV) UO22++4H++2e-=U4++2H2O 0.327C(IV)-(III) 2HCNO+2H++2e-=(CN)2+2H2O 0.330V(IV)-(III) VO2++2H++e-=V3++H2O 0.337Cu(II)-(0) Cu2++2e-=Cu 0.3419Re(VII)-(0) ReO4-+8H++7e-=Re+4H2O 0.368Ag(I)-(0) Ag2CrO4+2e-=2Ag+CrO42-0.4470S(IV)-(0) H2SO3+4H++4e-=S+3H2O 0.449Cu(I)-(0) Cu++e-=Cu 0.521I(0)-(-I) I2+2e-=2I-0.5355I(0)-(-I) I3-+2e-=3I-0.536As(V)-(III) H3AsO4+2H++2e-=HAsO2+2H2O 0.560 Sb(V)-(III) Sb2O5+6H++4e-=2SbO++3H2O 0.581 Te(IV)-(0) TeO2+4H++4e-=Te+2H2O 0.593U(V)-(IV) UO2++4H++e-=U4++2H2O 0.612**Hg(II)-(I) 2HgCl2+2e-=Hg2Cl2+2Cl-0.63Pt(IV)-(II) [PtCl6]2-+2e-=[PtCl4]2-+2Cl-0.68O(0)-(-I) O2+2H++2e-=H2O2 0.695Pt(II)-(0) [PtCl4]2-+2e-=Pt+4Cl-0.755*Se(IV)-(0) H2SeO3+4H++4e-=Se+3H2O 0.74Fe(III)-(II) Fe3++e-=Fe2+0.771Hg(I)-(0) Hg22++2e-=2Hg 0.7973Ag(I)-(0) Ag++e-=Ag 0.7996Os(VIII)-(0) OsO4+8H++8e-=Os+4H2O 0.8N(V)-(IV) 2NO3-+4H++2e-=N2O4+2H2O 0.803 Hg(II)-(0) Hg2++2e-=Hg 0.851Si(IV)-(0) (quartz)SiO2+4H++4e-=Si+2H2O 0.857 Cu(II)-(I) Cu2++I-+e-=CuI 0.86N(III)-(I) 2HNO2+4H++4e-=H2N2O2+2H2O 0.86 Hg(II)-(I) 2Hg2++2e-=Hg22+0.920N(V)-(III) NO3-+3H++2e-=HNO2+H2O 0.934Pd(II)-(0) Pd2++2e-=Pd 0.951N(V)-(II) NO3-+4H++3e-=NO+2H2O 0.957N(III)-(II) HNO2+H++e-=NO+H2O 0.983I(I)-(-I) HIO+H++2e-=I-+H2O 0.987V(V)-(IV) VO2++2H++e-=VO2++H2O 0.991V(V)-(IV) V(OH)4++2H++e-=VO2++3H2O 1.00Au(III)-(0) [AuCl4]-+3e-=Au+4Cl- 1.002Te(VI)-(IV) H6TeO6+2H++2e-=TeO2+4H2O 1.02N(IV)-(II) N2O4+4H++4e-=2NO+2H2O 1.035N(IV)-(III) N2O4+2H++2e-=2HNO2 1.065I(V)-(-I) IO3-+6H++6e-=I-+3H2O 1.085Br(0)-(-I) Br2(aq)+2e-=2Br- 1.0873Se(VI)-(IV) SeO42-+4H++2e-=H2SeO3+H2O 1.151 Cl(V)-(IV) ClO3-+2H++e-=ClO2+H2O 1.152Pt(II)-(0) Pt2++2e-=Pt 1.18Cl(VII)-(V) ClO4-+2H++2e-=ClO3-+H2O 1.189I(V)-(0) 2IO3-+12H++10e-=I2+6H2O 1.195Cl(V)-(III) ClO3-+3H++2e-=HClO2+H2O 1.214Mn(IV)-(II) MnO2+4H++2e-=Mn2++2H2O 1.224O(0)-(-II) O2+4H++4e-=2H2O 1.229Tl(III)-(I) T13++2e-=Tl+ 1.252Cl(IV)-(III) ClO2+H++e-=HClO2 1.277N(III)-(I) 2HNO2+4H++4e-=N2O+3H2O 1.297**Cr(VI)-(III) Cr2O72-+14H++6e-=2Cr3++7H2O 1.33 Br(I)-(-I) HBrO+H++2e-=Br-+H2O 1.331Cr(VI)-(III) HCrO4-+7H++3e-=Cr3++4H2O 1.350Cl(0)-(-I) Cl2(g)+2e-=2Cl- 1.35827Cl(VII)-(-I) ClO4-+8H++8e-=Cl-+4H2O 1.389Cl(VII)-(0) ClO4-+8H++7e-=1/2Cl2+4H2O 1.39Au(III)-(I) Au3++2e-=Au+ 1.401Br(V)-(-I) BrO3-+6H++6e-=Br-+3H2O 1.423I(I)-(0) 2HIO+2H++2e-=I2+2H2O 1.439Cl(V)-(-I) ClO3-+6H++6e-=Cl-+3H2O 1.451Pb(IV)-(II) PbO2+4H++2e-=Pb2++2H2O 1.455Cl(V)-(0) ClO3-+6H++5e-=1/2Cl2+3H2O 1.47Cl(I)-(-I) HClO+H++2e-=Cl-+H2O 1.482Br(V)-(0) BrO3-+6H++5e-=l/2Br2+3H2O 1.482Au(III)-(0) Au3++3e-=Au 1.498Mn(VII)-(II) MnO4-+8H++5e-=Mn2++4H2O 1.507Mn(III)-(II) Mn3++e-=Mn2+ 1.5415Cl(III)-(-I) HClO2+3H++4e-=Cl-+2H2O 1.570Br(I)-(0) HBrO+H++e-=l/2Br2(aq)+H2O 1.574N(II)-(I) 2NO+2H++2e-=N2O+H2O 1.591I(VII)-(V) H5IO6+H++2e-=IO3-+3H2O 1.601Cl(I)-(0) HClO+H++e-=1/2Cl2+H2O 1.611Cl(III)-(I) HClO2+2H++2e-=HClO+H2O 1.645Ni(IV)-(II) NiO2+4H++2e-=Ni2++2H2O 1.678Mn(VII)-(IV) MnO4-+4H++3e-=MnO2+2H2O 1.679Pb(IV)-(II) PbO2+SO42-+4H++2e-=PbSO4+2H2O 1.6913 Au(I)-(0) Au++e-=Au 1.692Ce(IV)-(III) Ce4++e-=Ce3+ 1.72N(I)-(0) N2O+2H++2e-=N2+H2O 1.766O(-I)-(-II) H2O2+2H++2e-=2H2O 1.776Co(III)-(II) Co3++e-=Co2+(2mol·L-1 H2SO4) 1.83Ag(II)-(I) Ag2++e-=Ag+ 1.980S(VII)-(VI) S2O82-+2e-=2SO42- 2.010O(0)-(-II) O3+2H++2e-=O2+H2O 2.076O(II)-(-II) F2O+2H++4e-=H2O+2F- 2.153Fe(VI)-(III) FeO42-+8H++3e-=Fe3++4H2O 2.20O(0)-(-II) O(g)+2H++2e-=H2O 2.421F(0)-(-I) F2+2e-=2F- 2.866F2+2H++2e-=2HF 3.0532 在碱性溶液中(298K)电对方程式Eq/VCa(II)-(0) Ca(OH)2+2e-=Ca+2OH--3.02Ba(II)-(0) Ba(OH)2+2e-=Ba+2OH--2.99La(III)-(0) La(OH)3+3e-=La+3OH--2.90Sr(II)-(0) Sr(OH)2·8H2O+2e-=Sr+2OH-+8H2O -2.88Mg(II)-(0) Mg(OH)2+2e-=Mg+2OH--2.690Be(II)-(0) Be2O32-+3H2O+4e-=2Be+6OH--2.63Hf(IV)-(0) HfO(OH)2+H2O+4e-=Hf+4OH--2.50Zr(IV)-(0) H2ZrO3+H2O+4e-=Zr+4OH--2.36Al(III)-(0) H2AlO3-+H2O+3e-=Al+OH--2.33P(I)-(0) H2PO2-+e-=P+2OH--1.82B(III)-(0) H2BO3-+H2O+3e-=B+4OH--1.79P(III)-(0) HPO32-+2H2O+3e-=P+5OH--1.71Si(IV)-(0) SiO32-+3H2O+4e-=Si+6OH--1.697P(III)-(I) HPO32-+2H2O+2e-=H2PO2-+3OH--1.65Mn(II)-(0) Mn(OH)2+2e-=Mn+2OH--1.56Cr(III)-(0) Cr(OH)3+3e-=Cr+3OH--1.48*Zn(II)-(0) [Zn(CN)4]2-+2e-=Zn+4CN--1.26Zn(II)-(0) Zn(OH)2+2e-=Zn+2OH--1.249Ga(III)-(0) H2GaO3-+H2O+2e-=Ga+4OH--1.219Zn(II)-(0) ZnO22-+2H2O+2e-=Zn+4OH--1.215Cr(III)-(0) CrO2-+2H2O+3e-=Cr+4OH--1.2Te(0)-(-I) Te+2e-=Te2--1.143P(V)-(III) PO43-+2H2O+2e-=HPO32-+3OH--1.05*Zn(II)-(0) [Zn(NH3)4]2++2e-=Zn+4NH3 -1.04*W(VI)-(0) WO42-+4H2O+6e-=W+8OH--1.01*Ge(IV)-(0) HGeO3-+2H2O+4e-=Ge+5OH--1.0Sn(IV)-(II) [Sn(OH)6]2-+2e-=HSnO2-+H2O+3OH--0.93 S(VI)-(IV) SO42-+H2O+2e-=SO32-+2OH--0.93Se(0)-(-II) Se+2e-=Se2--0.924Sn(II)-(0) HSnO2-+H2O+2e-=Sn+3OH--0.909P(0)-(-III) P+3H2O+3e-=PH3(g)+3OH--0.87N(V)-(IV) 2NO3-+2H2O+2e-=N2O4+4OH--0.85H(I)-(0) 2H2O+2e-=H2+2OH--0.8277Cd(II)-(0) Cd(OH)2+2e-=Cd(Hg)+2OH--0.809Co(II)-(0) Co(OH)2+2e-=Co+2OH--0.73Ni(II)-(0) Ni(OH)2+2e-=Ni+2OH--0.72As(V)-(III) AsO43-+2H2O+2e-=AsO2-+4OH--0.71Ag(I)-(0) Ag2S+2e-=2Ag+S2--0.691As(III)-(0) AsO2-+2H2O+3e-=As+4OH--0.68Sb(III)-(0) SbO2-+2H2O+3e-=Sb+4OH--0.66*Re(VII)-(IV) ReO4-+2H2O+3e-=ReO2+4OH--0.59*Sb(V)-(III) SbO3-+H2O+2e-=SbO2-+2OH--0.59Re(VII)-(0) ReO4-+4H2O+7e-=Re+8OH--0.584*S(IV)-(II) 2SO32-+3H2O+4e-=S2O32-+6OH--0.58Te(IV)-(0) TeO32-+3H2O+4e-=Te+6OH--0.57Fe(III)-(II) Fe(OH)3+e-=Fe(OH)2+OH--0.56S(0)-(-II) S+2e-=S2--0.47627Bi(III)-(0) Bi2O3+3H2O+6e-=2Bi+6OH--0.46N(III)-(II) NO2-+H2O+e-=NO+2OH--0.46*Co(II)-C(0) [Co(NH3)6]2++2e-=Co+6NH3 -0.422Se(IV)-(0) SeO32-+3H2O+4e-=Se+6OH--0.366Cu(I)-(0) Cu2O+H2O+2e-=2Cu+2OH--0.360Tl(I)-(0) Tl(OH)+e-=Tl+OH--0.34*Ag(I)-(0) [Ag(CN)2]-+e-=Ag+2CN--0.31Cu(II)-(0) Cu(OH)2+2e-=Cu+2OH--0.222Cr(VI)-(III) CrO42-+4H2O+3e-=Cr(OH)3+5OH--0.13 *Cu(I)-(0) [Cu(NH3)2]++e-=Cu+2NH3 -0.12O(0)-(-I) O2+H2O+2e-=HO2-+OH--0.076Ag(I)-(0) AgCN+e-=Ag+CN--0.017N(V)-(III) NO3-+H2O+2e-=NO2-+2OH-0.01Se(VI)-(IV) SeO42-+H2O+2e-=SeO32-+2OH-0.05 Pd(II)-(0) Pd(OH)2+2e-=Pd+2OH-0.07S(II,V)-(II) S4O62-+2e-=2S2O32-0.08Hg(II)-(0) HgO+H2O+2e-=Hg+2OH-0.0977Co(III)-(II) [Co(NH3)6]3++e-=[Co(NH3)6]2+0.108Pt(II)-(0) Pt(OH)2+2e-=Pt+2OH-0.14Co(III)-(II) Co(OH)3+e-=Co(OH)2+OH-0.17Pb(IV)-(II) PbO2+H2O+2e-=PbO+2OH-0.247I(V)-(-I) IO3-+3H2O+6e-=I-+6OH-0.26Cl(V)-(III) ClO3-+H2O+2e-=ClO2-+2OH-0.33Ag(I)-(0) Ag2O+H2O+2e-=2Ag+2OH-0.342Fe(III)-(II) [Fe(CN)6]3-+e-=[Fe(CN)6]4-0.358Cl(VII)-(V) ClO4-+H2O+2e-=ClO3-+2OH-0.36*Ag(I)-(0) [Ag(NH3)2]++e-=Ag+2NH3 0.373O(0)-(-II) O2+2H2O+4e-=4OH-0.401I(I)-(-I) IO-+H2O+2e-=I-+2OH-0.485*Ni(IV)-(II) NiO2+2H2O+2e-=Ni(OH)2+2OH-0.490Mn(VII)-(VI) MnO4-+e-=MnO42-0.558Mn(VII)-(IV) MnO4-+2H2O+3e-=MnO2+4OH-0.595 Mn(VI)-(IV) MnO42-+2H2O+2e-=MnO2+4OH-0.60Ag(II)-(I) 2AgO+H2O+2e-=Ag2O+2OH-0.607Br(V)-(-I) BrO3-+3H2O+6e-=Br-+6OH-0.61Cl(V)-(-I) ClO3-+3H2O+6e-=Cl-+6OH-0.62Cl(III)-(I) ClO2-+H2O+2e-=ClO-+2OH-0.66I(VII)-(V) H3IO62-+2e-=IO3-+3OH-0.7Cl(III)-(-I) ClO2-+2H2O+4e-=Cl-+4OH-0.76Br(I)-(-I) BrO-+H2O+2e-=Br-+2OH-0.761Cl(I)-(-I) ClO-+H2O+2e-=Cl-+2OH-0.841*Cl(IV)-(III) ClO2(g)+e-=ClO2-0.95O(0)-(-II) O3+H2O+2e-=O2+2OH- 1.24标准电极电势表半反应E°(V) 来源& -9Zz 9N N2(g) + H+ + e− HN3(aq) -3.09 [6]Li+ + e− Li(s) -3.0401 [5]N2(g) + 4H2O + 2e− 2N H2OH(aq) + 2OH− -3.04 [6] Cs+ + e− Cs(s) -3.026 [5]Rb+ + e− Rb(s) -2.98 [4]K+ + e− K(s) -2.931 [5]Ba2+ + 2e− Ba(s) -2.912 [5]La(OH)3(s) + 3e− La(s) + 3OH− -2.90 [5]Sr2+ + 2e−Sr(s) -2.899 [5]Ca2+ + 2e− Ca(s) -2.868 [5]Eu2+ + 2e− Eu(s) -2.812 [5]Ra2+ + 2e− Ra(s) -2.8 [5]Na+ + e− Na(s) -2.71 [5][9]La3+ + 3e− La(s) -2.379 [5]Y3+ + 3e− Y(s) -2.372 [5]Mg2+ + 2e− Mg(s) -2.372 [5]ZrO(OH)2(s) + H2O + 4e− Zr(s) + 4OH− -2.36 [5]Al(OH)4− + 3e− Al(s) + 4OH− -2.33Al(OH)3(s) + 3e− Al(s) + 3OH− -2.31H2(g) + 2e− 2H− -2.25Ac3+ + 3e− Ac(s) -2.20Be2+ + 2e− Be(s) -1.85U3+ + 3e− U(s) -1.66 [7]Al3+ + 3e− Al(s) -1.66 [9]Ti2+ + 2e− Ti(s) -1.63 [9]ZrO2(s) + 4H+ + 4e− Zr(s) + 2H2O -1.553 [5]Zr4+ + 4e− Zr(s) -1.45 [5]TiO(s) + 2H+ + 2e− Ti(s) + H2O -1.31Ti2O3(s) + 2H+ + 2e− 2T iO(s) + H2O -1.23Ti3+ + 3e− Ti(s) -1.21Te(s) + 2e− Te2− -1.143 [2]V2+ + 2e− V(s) -1.13 [2]Nb3+ + 3e− Nb(s) -1.099Sn(s) + 4H+ + 4e− SnH4(g) -1.07Mn2+ + 2e− Mn(s) -1.029 [9]SiO2(s) + 4H+ + 4e− Si(s) + 2H2O -0.91B(OH)3(aq) + 3H+ + 3e− B(s) + 3H2O -0.89TiO2+ + 2H+ + 4e− Ti(s) + H2O -0.86Bi(s) + 3H+ + 3e− BiH3 -0.8H2H2O + 2e− H2(g) + 2OH− -0.8277 [5]Zn2+ + 2e− Zn(Hg) -0.7628 [5]Zn2+ + 2e− Zn(s) -0.7618 [5]Ta2O5(s) + 10H+ + 10e− 2T a(s) + 5H2O -0.75Cr3+ + 3e− Cr(s) -0.74Au[Au(CN)2]− + e− Au(s) + 2C N− -0.60Ta3+ + 3e− Ta(s) -0.6PbO(s) + H2O + 2e− Pb(s) + 2OH− -0.58Ti2T iO2(s) + 2H+ + 2e− Ti2O3(s) + H2O -0.56Ga3+ + 3e− Ga(s) -0.53U4+ + e− U3+ -0.52 [7]P H3PO2(aq) + H+ + e− P(白磷[10]) + 2H2O -0.508 [5]P H3PO3(aq) + 2H+ + 2e− H3PO2(aq) + H2O -0.499 [5] P H3PO3(aq) + 3H+ + 3e− P(红磷)[10] + 3H2O -0.454 [5] Fe2+ + 2e− Fe(s) -0.44 [9]C2C O2(g) + 2H+ + 2e− HOOCCOOH(aq) -0.43Cr3+ + e− Cr2+ -0.42Cd2+ + 2e− Cd(s) -0.40 [9]GeO2(s) + 2H+ + 2e− GeO(s) + H2O -0.37Cu2O(s) + H2O + 2e− 2C u(s) + 2O H− -0.360 [5]PbSO4(s) + 2e− Pb(s) + SO42− -0.3588 [5]PbSO4(s) + 2e− Pb(Hg) + SO42− -0.3505 [5]Eu3+ + e− Eu2+ -0.35 [7]In3+ + 3e− In(s) 0.34 [2]Tl+ + e− Tl(s) -0.34 [2]Ge(s) + 4H+ + 4e− GeH4(g) -0.29Co2+ + 2e− Co(s) -0.28 [5]P H3PO4(aq) + 2H+ + 2e− H3PO3(aq) + H2O -0.276 [5] V3+ + e− V2+ 0.26 [9]Ni2+ + 2e− Ni(s) -0.25As(s) + 3H+ + 3e− AsH3(g) -0.23 [2]MoO2(s) + 4H+ + 4e− Mo(s) + 2H2O -0.15Si(s) + 4H+ + 4e− SiH4(g) -0.14Sn2+ + 2e− Sn(s) -0.13O2(g) + H+ + e− HO2•(aq) -0.13Pb2+ + 2e− Pb(s) -0.13 [9]WO2(s) + 4H+ + 4e− W(s) + 2H2O -0.12P(红磷) + 3H+ + 3e− PH3(g) -0.111 [5]C CO2(g) + 2H+ + 2e− HCOOH(aq) -0.11Se(s) + 2H+ + 2e− H2Se(g) -0.11C CO2(g) + 2H+ + 2e− CO(g) + H2O -0.11SnO(s) + 2H+ + 2e− Sn(s) + H2O -0.10SnO2(s) + 2H+ + 2e− SnO(s) + H2O -0.09WO3(aq) + 6H+ + 6e− W(s) + 3H2O -0.09 [2]P(白磷) + 3H+ + 3e− PH3(g) -0.063 [5]C HCOOH(aq) + 2H+ + 2e− HCHO(aq) + H2O -0.03 H 2H+ + 2e− H2(g) ≡ 0S4O62− + 2e− 2S2O32− +0.08Fe3O4(s) + 8H+ + 8e− 3F e(s) + 4H2O +0.085 [8]N2(g) + 2H2O + 6H+ + 6e− 2N H4OH(aq) +0.092 HgO(s) + H2O + 2e− H g(l) + 2O H− +0.0977Cu(NH3)42+ + e− Cu(NH3)2+ + 2N H3 +0.10 [2]Ru(NH3)63+ + e− Ru(NH3)62+ +0.10 [7]N2H4(aq) + 4H2O + 2e− 2N H4+ + 4O H− +0.11 [6] Mo H2MoO4(aq) + 6H+ + 6e− Mo(s) + 4H2O +0.11 Ge4+ + 4e− Ge(s) +0.12C(s) + 4H+ + 4e− CH4(g) +0.13 [2]C HCHO(aq) + 2H+ + 2e− CH3OH(aq) +0.13S(s) + 2H+ + 2e− H2S(g) +0.14Sn4+ + 2e− Sn2+ +0.15Cu2+ + e− Cu+ +0.159 [2]S HSO4− + 3H+ + 2e− SO2(aq) + 2H2O +0.16UO22+ + e− UO2+ +0.163 [7]S SO42− + 4H+ + 2e− SO2(aq) + 2H2O +0.17TiO2+ + 2H+ + e− Ti3+ + H2O +0.19Bi3+ + 2e− Bi+ +0.2SbO+ + 2H+ + 3e− Sb(s) + H2O +0.20As H3AsO3(aq) + 3H+ + 3e− As(s) + 3H2O +0.24 GeO(s) + 2H+ + 2e− Ge(s) + H2O +0.26UO2+ + 4H+ + e− U4+ + 2H2O +0.273 [7]Re3+ + 3e− Re(s) +0.300Bi3+ + 3e− Bi(s) +0.32VO2+ + 2H+ + e− V3+ + H2O +0.34Cu2+ + 2e− Cu(s) +0.340 [2]Fe [Fe(CN)6]3− + e− [Fe(CN)6]4− +0.36O2(g) + 2H2O + 4e− 4OH−(aq) +0.40 [9]Mo H2MoO4 + 6H+ + 3e− Mo3+ +2H2O +0.43Bi+ + e− Bi(s) +0.50C CH3OH(aq) + 2H+ + 2e− CH4(g) + H2O +0.50S SO2(aq) + 4H+ + 4e− S(s) + 2H2O +0.50Cu+ + e− Cu(s) +0.520 [2]C CO(g) + 2H+ + 2e− C(s) + H2O +0.52I2(s) + 2e− 2I− +0.54 [9]I3− + 2e− 3I− +0.53 [9]Au [AuI4]− + 3e− Au(s) + 4I− +0.56As H3AsO4(aq) + 2H+ + 2e− H3AsO3(aq) + H2O +0.56 Au [AuI2]− + e− Au(s) + 2I− +0.58MnO4− + 2H2O + 3e− MnO2(s) + 4O H− +0.59S2O32−+ 6H+ + 4e− 2S(s) + 3H2O +0.60Mo H2MoO4(aq) + 2H+ + 2e− MoO2(s) + 2H2O +0.65 O2(g) + 2H+ + 2e− H2O2(aq) +0.70Tl3+ + 3e− Tl(s) +0.72PtCl62− + 2e− PtCl42− + 2C l− +0.726 [7]Se H2SeO3(aq) + 4H+ + 4e− Se(s) + 3H2O +0.74PtCl42− + 2e− Pt(s) + 4C l− +0.758 [7]Fe3+ + e− Fe2+ +0.77Ag+ + e− Ag(s) +0.7996 [5]Hg22+ + 2e− 2H g(l) +0.80N NO3−(aq) + 2H+ + e− NO2(g) + H2O +0.80Au [AuBr4]− + 3e− Au(s) + 4B r− +0.85Hg2+ + 2e− Hg(l) +0.85MnO4− + H+ + e− HMnO4− +0.90Hg 2H g2+ + 2e− Hg22+ +0.91 [2]Pd2+ + 2e− Pd(s) +0.915 [7]Au [AuCl4]− + 3e− Au(s) + 4C l− +0.93MnO2(s) + 4H+ + e− Mn3+ + 2H2O +0.95Au [AuBr2]− + e− Au(s) + 2B r− +0.96Br2(l) + 2e− 2B r− +1.07Br2(aq) + 2e− 2B r− +1.09 [9]I IO3− + 5H+ + 4e− HIO(aq) + 2H2O +1.13Au [AuCl2]− + e− Au(s) + 2C l− +1.15Se HSeO4− + 3H+ + 2e− H2SeO3(aq) + H2O +1.15 Ag2O(s) + 2H+ + 2e− 2A g(s) + H2O +1.17ClO3− + 2H+ + e− ClO2(g) + H2O +1.18Pt2+ + 2e− Pt(s) +1.188 [7]ClO2(g) + H+ + e− HClO2(aq) +1.19I 2I O3− + 12H+ + 10e− I2(s) + 6H2O +1.20ClO4− + 2H+ + 2e− ClO3− + H2O +1.20O2(g) + 4H+ + 4e− 2H2O +1.23 [9]MnO2(s) + 4H+ + 2e− Mn2+ + 2H2O +1.23Tl3+ + 2e− Tl+ +1.25Cl2(g) + 2e− 2C l− +1.36 [9]Cr2O7−−+ 14H+ + 6e− 2C r3+ + 7H2O +1.33CoO2(s) + 4H+ + e− Co3+ + 2H2O +1.42N 2N H3OH+ + H+ + 2e− N2H5+ + 2H2O +1.42 [6]I 2H IO(aq) + 2H+ + 2e− I2(s) + 2H2O +1.44Ce4+ + e− Ce3+ +1.44BrO3− + 5H+ + 4e− HBrO(aq) + 2H2O +1.45PbO β-PbO2(s) + 4H+ + 2e− Pb2+ + 2H2O +1.460 [2] PbO α-PbO2(s) + 4H+ + 2e− Pb2+ + 2H2O +1.468 [2] Br 2B rO3− + 12H+ + 10e− Br2(l) + 6H2O +1.48Cl 2ClO3− + 12H+ + 10e− Cl2(g) + 6H2O +1.49MnO4− + 8H+ + 5e− Mn2+ + 4H2O +1.51O HO2• + H+ + e− H2O2(aq) +1.51Au3+ + 3e− Au(s) +1.52NiO2(s) + 4H+ + 2e− Ni2+ + 2OH− +1.59Cl 2H ClO(aq) + 2H+ + 2e− Cl2(g) + 2H2O +1.63Ag2O3(s) + 6H+ + 4e− 2A g+ + 3H2O +1.67Cl HClO2(aq) + 2H+ + 2e− HClO(aq) + H2O +1.67Pb4+ + 2e− Pb2+ +1.69 [2]MnO4− + 4H+ + 3e− MnO2(s) + 2H2O +1.70O H2O2(aq) + 2H+ + 2e− 2H2O +1.78AgO(s) + 2H+ + e− Ag+ + H2O +1.77Co3+ + e− Co2+ +1.82Au+ + e− Au(s) +1.83 [2]BrO4− + 2H+ + 2e− BrO3− + H2O +1.85Ag2+ + e− Ag+ +1.98 [2]S2O82− + 2e− 2SO42− +2.07O3(g) + 2H+ + 2e− O2(g) + H2O +2.075 [7]Mn HMnO4− + 3H+ + 2e− MnO2(s) + 2H2O +2.09 F2(g) + 2e− 2F− +2.87 [2][9]F2(g) + 2H+ + 2e− 2H F(aq) +3.05 [2]。
最新最全最实用电极电势表

标准电极电势表环境:摄氏25度,1标准大气压,离子浓度1摩尔/升,采用氢电极最全最实用电极电势表由xsm18倾情制作,转载请注明来源:/xsm18/homePbSO4(+2)/Pb PbSO4+2e-=Pb+SO42--0.3588PbBr2(+2)/Pb PbBr2+2e-=Pb+2Br--0.284Co2+/Co Co2++2e-=Co-0.28H3PO4/H3PO3H3PO4+2H++2e-=H3PO3+H2O-0.276PbCl2(+2)/Pb PbI2+2e-=Pb+2I--0.2675Ni2+/Ni Ni2++2e-=Ni-0.257CO2/HCOOH(甲酸)CO2(g)+2H++2e-=HCOOH(aq)-0.199CuI(+1)/Cu CuI+e-=Cu+I-0.1852AgI(+1)/Ag AgI+e-=Ag+I-0.15224Sn2+/Sn Sn2++2e-=Sn-0.1375Pb2+/Pb Pb2++2e-=Pb-0.1262C4+/C2+CO2(g)+2H++2e-=CO+H2O-0.12P/PH3P(白磷)+3H++3e-=PH3(g)-0.063气体(g)Hg2I2(+1)/Hg Hg2I2+2e-=2Hg+2I--0.0405Fe3+/Fe Fe3++3e-=Fe-0.037Ag2S(+1)/Ag Ag2S+2H++2e-=2Ag+H2S-0.0366H+/H22H++2e-=H20.00CuBr(+1)/Cu CuBr+e-=Cu+Br-0.033AgBr(+1)/Ag AgBr+e-=Ag+Br-0.07133Si/SiH4Si+4H++4e-=SiH40.102C(石墨)/CH4C+4H++4e-=CH40.1316CuCl(+1)/Cu CuCl+e-=Cu+Cl-0.137Hg2Br2(+1)/Hg Hg2Br2+2e-=2Hg+2Br-0.13923S/H2S(aq)S+2H++2e-=H2S(aq)0.142水溶液Sn4+/Sn2+Sn4++2e-=Sn2+0.151Cu2+/Cu+Cu2++e-=Cu+0.153S6+/S4+SO42-+4H++2e-=H2SO3+H2O0.172AgCl(+1)/Ag AgCl+e-=Ag+Cl-0.2223As3+/As(亚砷酸)HAsO2(aq)+3H++3e-=As+2H2O0.2476HAsO2.H2O Hg2Cl2/Hg Hg2Cl2+2e-=2Hg+2Cl-0.268Bi3+/Bi Bi3++3e-=Bi0.308Cu2+/Cu Cu2++2e-=Cu0.337AgIO3/Ag AgIO3+e-=Ag+IO3-0.354S6+/S SO42-+8H++6e-=S+4H2O0.3572Ag2CrO4/Ag Ag2CrO4+2e-=2Ag+CrO42-0.447铬酸银S4+/S H2SO3+4H++4e-=S+3H2O0.449Ag2C2O4/Ag Ag2C2O4+2e-=2Ag+C2O42-0.4647草酸银Cu+/Cu Cu++e-=Cu0.521I2/I-I2+2e-=2I-0.5355AgBrO3/Ag AgBrO3+e-=Ag+BrO3-0.546As5+/As3+H3AsO4(aq)+2H++2e-=HAsO2+2H2O0.56水溶液AgNO2/Ag AgNO2+e-=Ag+NO2-0.564Te4+/Te TeO2+4H++4e-=Te+2H2O0.593Hg2SO4/Hg Hg2SO4+2e-=2Hg+SO42-0.614Ag2SO4/Ag Ag2SO4+2e-=2Ag+SO42-0.654Pt4+(氯铂酸)/Pt2+[PtCl6]2-+2e-=[PtCl4]2-+2Cl-0.68O2/O-O2+2H++2e-=H2O20.695Pt2+/Pt(二氯化铂)[PtCl4]2-+2e-=Pt+4Cl-0.73Se4+/Se H2SeO3+4H++4e-=Se+3H2O0.74Fe3+/Fe2+Fe3++e-=Fe2+0.771AgF/Ag AgF+e-=Ag+F-0.779Hg+/Hg Hg22++2e-=2Hg0.788Ag+/Ag Ag++e-=Ag0.7991N5+/N4+(硝酸)2NO3-+4H++2e-=N2O4(g)+2H2O0.803气体(g) Hg2+/Hg Hg2++2e-=Hg(lq)0.853液态(水银) Si4+(石英)/Si SiO2+4H++4e-=Si+2H2O0.857Hg2+/Hg+2Hg2++2e-=Hg22+0.92N5+/N3+(亚硝酸)NO3-+3H++2e-=HNO2+H2O0.934Pd2+/Pd Pd2++2e-=Pd0.951N5+/N2+NO3-+4H++3e-=NO+2H2O0.957Au3+/Au(三溴化金)AuBr2-+e-=Au+2Br-0.959N3+/2+HNO2+H++e-=NO+H2O0.983Au3+/Au(三氯化金)[AuCl4]-+3e-=Au+4Cl- 1.002Te6+/Te4+H6TeO6+2H++2e-=TeO2+4H2O 1.02N4+/N2+N2O4+4H++4e-=2NO+2H2O 1.03Pt4+/Pt PtO2+4H++4e-=Pt+2H2O 1.045Br2(lq)/Br-Br2(lq)+2e-=2Br- 1.0652液溴(lq)N4+/N3+N2O4+2H++2e-=2HNO2 1.07Br2(aq)/Br-Br2(aq)+2e-=2Br- 1.087水溶液(aq) Se6+/Se4+SeO42-+4H++2e-=H2SeO3+H2O 1.151Cl5+/Cl4+ClO3-+2H++e-=ClO2+H2O 1.152O2/H2O(g)O2+4H++4e-=2H2O(g) 1.185水蒸汽(g) Pt2+/Pt Pt2++2e-=Pt 1.188Cl7+/Cl5+ClO4-+2H++2e-=ClO3-+H2O 1.189I5+/I22IO3-+12H++10e-=I2(s)+6H2O 1.195碘单质(s) Cl5+/Cl3+ClO3-+3H++2e-=HClO2+H2O 1.21Mn4+/Mn2+MnO2+4H++2e-=Mn2++2H2O 1.224O2/H2O(液态水)O2+4H++4e-=2H2O 1.229常温水S+(S2Cl2)/S S2Cl2+2e-=2S+2Cl- 1.23Fe3O4/Fe2+Fe3O4+8H++2e-=3Fe2++4H2O 1.23Tl3+/Tl+T13++2e-=Tl+ 1.25注4Cl4+/Cl3+ClO2+H++e-=HClO2 1.277N3+/N+2HNO2(aq)+4H++4e-=N2O(g)+3H2O 1.297Cr6+/Cr3+Cr2O72-+14H++6e-=2Cr3++7H2O 1.33重铬酸根Br+/Br-HBrO+H++2e-=Br-+H2O 1.331Cr6+/Cr3+HCrO4-+7H++3e-=Cr3++4H2O 1.35铬酸根Cl2/Cl-Cl2(g)+2e-=2Cl- 1.358(g)氯气Au2O3(+3)/Au Au2O3+6H++6e-=2Au+3H2O 1.36Cl7+/Cl-ClO4-+8H++8e-=Cl-+4H2O 1.388Cl7+/Cl2ClO4-+8H++7e-=1/2Cl2+4H2O 1.392Au3+/Au+Au3++2e-=Au+ 1.41Br5+/Br-BrO3-+6H++6e-=Br-+3H2O 1.424I+/I22HIO+2H++2e-=I2+2H2O 1.439Cl5+/Cl-ClO3-+6H++6e-=Cl-+3H2O 1.451Pb4+/Pb2+PbO2+4H++2e-=Pb2++2H2O 1.455Cl5+/Cl2ClO3-+6H++5e-=1/2Cl2+3H2O 1.47CrO2(+4)/Cr3+CrO2+4H++e-=Cr3++2H2O 1.48二氧化铬Cl+/Cl-HClO+H++2e-=Cl-+H2O 1.482Au3+/Au Au3++3e-=Au 1.498Mn7+/Mn2+MnO4-+8H++5e-=Mn2++4H2O 1.507Cl4+/Cl-ClO2+4H++5e-=Cl-+2H2O 1.511Br5+/Br2BrO3-+6H++5e-=l/2Br2+3H2O 1.52Mn3+/Mn2+Mn3++e-=Mn2+ 1.5415注5Cl3+/Cl-HClO2+3H++4e-=Cl-+2H2O 1.57N2+/N+2NO+2H++2e-=N2O+H2O 1.59Br+/Br2HBrO+H++e-=l/2Br2(aq)+H2O 1.595I7+/I5+H5IO6+H++2e-=IO3-+3H2O 1.603注6Cl+/Cl2HClO+H++e-=1/2Cl2+H2O 1.611Cl3+/Cl2HClO2+3H++2e-=1/2Cl2+2H2O 1.628Cl3+/Cl+HClO2+2H++2e-=HClO+H2O 1.645Ni4+/Ni2+NiO2+4H++2e-=Ni2++2H2O 1.678Mn7+/Mn4+MnO4-+4H++3e-=MnO2+2H2O 1.68注7Pb4+/Pb2+PbO2+SO42-+4H++2e-=PbSO4+2H2O 1.69Au+/Au Au++e-=Au 1.691Ce4+/Ce3+Ce4++e-=Ce3+ 1.74注8Br7+/Br5+BrO4-+2H++2e-=BrO3-+H2O 1.763注9N+/N2N2O+2H++2e-=N2+H2O 1.766O-(H2O2)/O2-(H2O)H2O2+2H++2e-=2H2O 1.776NiO42-/NiO2NiO42-+4H++2e-=NiO2+2H2O 1.8Co3+/Co2+Co3++e-=Co2+ 1.808Co3+/Co2+Co3++e-=Co2+ 1.83稀硫酸中Co3+/Co2+Co3++e-=Co2+ 1.92稀高氯酸Ag2+/Ag+Ag2++e-=Ag+ 1.93稀硝酸Ag2+/Ag+Ag2++e-=Ag+ 1.98稀硫酸Ag2+/Ag+Ag2++e-=Ag+ 2.0稀高氯酸S2O82-/SO42-S2O82-+2e-=2SO42- 2.01Bi5+/Bi3+BiO3-+2H++2e-=Bi3++H2O 2.03铋酸盐O3/O2-O3+2H++2e-=O2+H2O 2.076XeO3/Xe XeO3+6H++6e-=Xe+3H2O 2.1最全最实用电极电势表由xsm18倾情制作,转载请注明来源:/xsm18/home注释1:碱族和从钙开始的碱土元素均和水发生反应,其电极电势数值为理论计算值注释2:铈元素(Ce)属于镧系元素,有稳定的+3,+4价,+3价有很强的还原性,+4有很强的氧化性,该元素有很好的代表性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3十—
Al +3e =Al
AlF36+3e =Al+6F
CIO4+8H十+7e=1/2CI2+4冲0
AaO+61■十+6e—=2As+3HO
HAsO+3H++3e—=As+2H0
CIO4+8H++8e—=CI—+4H2O
HAsO+21■十+2e—=HAsO+2HO
CO+2e=Co
Au十+e—=Au
CcT+e一=C6+(2mol・L—1H2SO)
Au3++3 e—=Au
CQ+2H++2e—=HCOOH
AuCl4+3e=Au+ 4Cl
2+—
Cr+2e=Cr
Au3++2e—=Au+
3+—―2+
Cr+e=Cr
HBO+3H十+3e—=B+ 3f0
8
Cr3++3e—=Cr
HCIO+ H+2e=Cl+H2O
AgOO+2e=2Ag+C2o2
7
CIO2+H++e=HCIO
AgCl+e=Ag+Cl
HCIO+2H++2e一=HCIO+ HO
Ag CO3+2e「=2Ag+ CO2-
HCIQ+3H1+3e=1/2CI2+2H2O
AgCrO+2e=2Ag+ Cro2
0
HCIO+3H十+4e=Cl+2H2O
3N2+2H++2e「=2NH(aq)
Sb+3H++3e—=2SbH>
NO+2H++2e「=N2+ 冲0
SbO+6H++6e—=2Sb+3H2O
NO4+2e「=2NQ
SbQ+6H+4e=2SbO+3H2O
NO*+2H++2e「=2HNO
SbO丄+2H++3e—=Sb+ fO
丄—
NO+4H+4e=2NO^ 2WO
SO8+2H++2e—=2HSO
Mn。;+4H++3e「=MnO+2HO
2HSO+H++2e—=H2SO—+2f0
MnO4+8H++5e「=M(+4fO
fSO+4H++4e—=S+3HO
MO丄+3e「=MO
SO2-+4H++2e—=HSO+fO
N+2fO+ 6rf+6e「=2NHOH
2SO4+4H++2e—=SO;+2HO
La3++3e=La
Pt2++2e=Pt
Li丄+e=Li
1
RtT+e=Rb
z丄
Mg+2e=Mg
Re+3e=Re
MH丄+2e_=Mn
S+2H++2e—=HS(aq)
Mri丄+e"=Mn+
S2O6+4H丄+2e—=2H2SO
MnO+4J+2e「=m6丄+2fO
SO8+2e—=2SO4-
Mn04+e"=MnO-
PbI2+2e=Pb+2I
IO3+6H+6e=I+3H2O
PbO+4H++2e=戸~丄+2讯0
In+2e=In
PbO+SO2-+4H1+2e=PbSO+ 2H2O
3
In"丄+3e=In
2
PbSO+ 2e=Pb+SOT
8
Ir3++3e=Ir
PcT++2e—=Pd
£ +e=K
PdCl2-+2e=Pd+4Cl
AgF+e-=Ag+ F-
CIO3+2H'+e—=CIO2+H2O
Ag I+e=Ag+I
24
CIO3+3HT+2e=HCIO+HO
AgS+ 2H+2e=2Ag+fS
6
CIO3+6H'+5e=1/2CI2+3H2O
AgSCN- e-=Ag+SCN
51
CIO3+6H++6e—=CI—+3讯0
AgSO+2e=2Ag+ So;
2+ 一
Ba+2e=Ba
+—3+
CcO;+14H+6e=2Cr+7fO
B『+2e一=Ba(Hg)
HCrO—+71■十+3e—=Cr3++4fO
Be++2e=Be
Cu++e一=Cu
BiCl-4+3e—=Bi+4Cl—
cf+e=Cu+
Bi2O+4H++2e—=2BiO++2H2O
Cu+2e=Cu
9
BiO++2H++3e—=Bi+甩0
3+—
Sc+3e=Sc
2N6 2H++2e「=N2O+H2O
Se+2H++2e—=WSe(aq)
HNO+H++e「=NOH H2O
fSeO+4H++4e—=Se+ 3HO
2HNO丄4H"+4e「=N2O+3HO
2—丄一
SeO+4H+2e=fSeO+H2O
NC3+3H++2e「=HNO+ H2O
SiF2+4e—=Si+6F—
~3~
P(red)+3H++3e=Phl(g)
HgB「2+2e=2Hg+ 2Br
23
P(white)+3H+3e=PH(g)
HgCH 2e=2Hg+ 2Cl
08
HPO+H+e=P+2HO
Hg” 2e=2Hg+2I
5
HPO+2H+2e=H3PO+HO
HgSO+2e=2Hg+ SO2
5
fPO+3H1+3e=P+3HO
I2+2e=2I
5
HPO+2H+2e=H3PO+fO
I3-+2e一=31「
Pb2++2e—=Pb
2
H5IO6+H1+2e=IO3+3H2O
PbBr2+2e=Pb+2Br
2HIO+2H丄+2e= 2+2H0
PbCl2+2e=Pb+2Cl
5
HIO+H++2e=I+H2O
PbF2+2e=Pb+2F
4
2I03+12H'+10e=I2+6H2O
附录八 标准电极电势
()
1.在酸性溶液中
电极反应
E/V
电极反应
E /V
Ag"+e-=Ag
-6~
Cd,++2e=Cd(Hg)
Ag+e=Ag
Ce+3e=Ce
AgAc+e=Ag+Ac
Cl2(g)+2e=2Cl
AgBr+e=Ag+Br
33
HCIO+ H+e=1/2C12+fO
AgBrO+e=2Ag+ BrO
CcT+2e一=Cd
H(g)+2e一=2H
CdSO十2e=Cd+SO:
HQ+H++e一=I4Q
电极反应
E/V
电极反应
E /V
HO2=2htO
Hg+2e=Hg
O(g)+2H丄+2e=HO
2Hg21+2e=Hg2+
O+2H,+2e=O+HO
Hg2++2e=2Hg
CuCI+e=Cu+ Cl
BiOCl+2H++3e一=Bi+Cl—+fO
3
F2+2H++2e一=2HF
B「2(aq)+2e=2Br
