圆二色光谱分析小结
生物分析 圆二色光谱

圆二色光谱分析法引言五十年代初,生物学研究从宏观领域深入到微观领域,开创了分子生物学的新时代。
随着研究的不断深入和发展,生物学已发展成最活跃的学科之一。
手性(Chirality)是物质结构中的重要特征.即具有不能重叠的三维镜像对映异构体,它们的分子式完全相同,但其中原子或原子基团在空间的配置不同,互为镜像。
凡手性分子都具有光学活性,即可使偏振光的振动面发生旋转。
生物基础分子一般都具有手性,也都具有光学活性。
在自然界中,氨基酸有L型和D型两种对映异构体,组成蛋白质的20种氨基酸,除最简单的甘氨酸不具有手性外,其余都是L型的[1]。
手性分子都具有光学活性。
当单色左旋与右旋的圆偏振光通过某一种手性样品时,该样品对左、右旋圆偏振光的吸收不同,这叫做圆二色性(Circular Dichroism)。
其差值△A=△A L-△A R称为圆二色值,按波长扫描就得到了圆二色谱(CD谱)。
CD谱是特殊的吸收谱,它比一般的吸收谱弱几个量级,但由于它对分子结构十分敏感,因此近十几年来,CD已成为研究分子构型(象)和分子间相互作用的最重要的光谱实验之一。
利用CD研究生物大分子和药物分子,具有重要的科学意义和实用价值[2,3]。
一、蛋白质的圆二色性蛋白质是由氨基酸通过肽键连接而成的具有特定结构的生物大分子。
蛋白质一般有一级结构、二级结构、超二级结构、结构域、三级结构和四级结构几个结构层次[4-6]。
在蛋白质或多肽中,主要的光活性基团是肽链骨架中的肽键、芳香氨基酸残基及二硫桥键。
当平面圆偏振光通过这些光活性的生色基团时,光活性中心对平面圆偏振光中的左、右圆偏振光的吸收不相同,产生的吸收差值,由于这种吸收差的存在,造成了偏振光矢量的振幅差,圆偏振光变成了椭圆偏振光,这就是蛋白质的圆二色性。
圆二色性的大小常用摩尔消光系数差△ (M-1 ·cm-1 )来度量。
蛋白质的CD光谱一般分为两个波长范围,即178—250 nm为远紫外区CD光谱,250—320 nm为近紫外区CD光谱, 具有不同二级结构的蛋白质或多肽所产生CD谱带的位置、吸收的强弱都不相同。
圆二色谱测试:红外光谱分析的得力助手

圆二色谱测试:红外光谱分析的得力助手在生物制药领域,药物的质量控制是至关重要的。
为了确保药物的纯度和有效性,科学家们需要使用各种分析技术来进行药物的表征和分析。
其中,圆二色谱测试作为一种重要的分析方法,被广泛应用于生物药物的研究和开发过程中。
本文将详细介绍圆二色谱测试的原理、应用和优势,帮助读者更好地了解这一分析技术。
一、圆二色谱测试的原理圆二色谱测试是一种基于红外光谱的分析方法,通过测量样品对不同偏振方向的圆偏振光的吸收情况,来获取样品的结构和构象信息。
圆二色谱测试主要依赖于分子中手性中心的存在,手性分子对圆偏振光的吸收会导致光的旋光现象,从而产生圆二色信号。
通过测量样品对左旋和右旋圆偏振光的吸收差异,可以得到样品的圆二色谱图。
图1。
二、圆二色谱测试的应用圆二色谱测试在生物制药领域有着广泛的应用。
首先,它可以用于药物的纯度检验。
不同的药物分子具有不同的手性结构,通过圆二色谱测试可以确定药物样品中手性分子的含量和纯度,确保药物的质量。
其次,圆二色谱测试还可以用于药物的结构分析。
药物的结构对其活性和稳定性有着重要影响,通过圆二色谱测试可以获取药物分子的构象信息,帮助科学家们了解药物的结构特征,从而指导药物的设计和改进。
此外,圆二色谱测试还可以用于蛋白质的研究和分析,帮助科学家们揭示蛋白质的结构和功能。
三、圆二色谱测试的优势相比于其他分析方法,圆二色谱测试具有一些独特的优势。
首先,圆二色谱测试是一种非破坏性的分析方法,可以在不破坏样品的情况下获取样品的结构信息。
这对于药物的研究和开发非常重要,可以避免样品的浪费和损坏。
其次,圆二色谱测试具有高灵敏度和高分辨率的特点,可以检测到极小浓度的手性分子,并且可以区分不同手性分子的结构差异。
这使得圆二色谱测试在药物分析中具有很大的优势。
此外,圆二色谱测试还可以进行在线监测,实时监测药物的质量和稳定性,提高生产过程的控制和效率。
圆二色谱测试作为一种重要的分析方法,在生物制药领域发挥着重要的作用。
紫外圆二色谱分析蛋白结构

紫外圆二色谱分析蛋白结构根据电子跃迁能级能量的大小,蛋白质的CD光谱分为三个波长范围:(1) 250nm以下的远紫外光谱区,圆二色性主要由肽键的电子跃迁引起;(2) 250~300nm的近紫外光谱区,主要由侧链芳香基团的电子跃迁引起;(3) 300~700nm的紫外-可见光光谱区,主要由蛋白质辅基等外在生色基团引起。
相应地,远紫外CD主要用于蛋白质二级结构的解析,近紫外CD主要揭示蛋白质的三级结构信息,紫外-可见光CD主要用于辅基的偶合分析。
远紫外CD谱:在蛋白质或多肽的规则二级结构中,肽键是高度有规律排列的,二级结构不同的蛋白质或多肽,所产生CD谱带的位置、峰的强弱都不同。
因此,根据所测得蛋白质或多肽的远紫外CD谱,能反映出蛋白质或多肽链二级结构的信息。
紫外区段(190-240nm),α-螺旋的CD谱在192nm附近有一正峰,在208nm、222nm处呈两个负的特征肩峰;β-折叠在216-218nm有一负峰,在185-200nm有一强的正峰;β-转角则在206nm附近有一正峰;无规则卷曲构象的CD谱在198nm附近有一负峰,在220nm附近有一小而宽的正峰。
近紫外CD光谱:蛋白质中芳香氨基酸残基,如色氨酸(Trp)、酪氨酸(Tyr)、苯丙氨酸(Phe)及二硫键处于不对称微环境时,在近紫外区250~320nm表现出CD峰。
研究表明:色氨酸在290及305nm处有精细的特征峰;酪氨酸在275及282nm有峰;苯丙氨酸在255、260及270 nm有弱的但比较尖锐的峰带;另外芳香氨基酸残基在远紫外光谱区也有CD信号;二硫键于195-200nm和250-260处有谱峰?。
总的来说,在250~280nm之间,由于芳香氨酸残基的侧链的谱峰常因微区特征的不同而改变,不同谱峰之间可能产生重叠。
蛋白浓度与使用的光径厚度和测量区域有一定关系,测量远紫外区氨基酸残基微环境的蛋白,浓度范围在0.1~1.0mg/ml,则光径可选择在0.1~0.2cm之间,溶液体积则在200~500ul。
圆二色谱总结

圆二色谱实验总结圆二色谱是用来表征蛋白的二级结构和三级结构的常用方法,在界面课题组主要用来表征肽自组装体的二级结构;通常对于三级结构不予考虑。
这一方法的实验操作容易,与一般的光谱测量相同,但是形成的机制比较复杂。
在此只能说我自己理解了的部分,对于不理解的部分还需要继续查文献进行了解。
1圆二色谱的原理名称中虽有“色谱”两字,但是这一测量方法实际上是一光谱法,光谱法对应的即为电子的跃迁行为。
同时,光谱法中必然存在的定量关系就是朗伯-比尔定律,圆二色谱的方法就是建立在这一光吸收过程上的光谱方法。
1.1预备知识需要推演圆二色谱的原理用到的工具有数学工具和物理知识两个方面,分别叙述如下。
1.1.1 数学工具在推演圆二色谱的数学表达形式时,需要用到一些数学知识,主要有圆的普通方程及参数方程、椭圆的普通方程及参数方程,相关的三角函数知识,这些数学知识基本都在高中阶段学过。
首先说明圆的普通方程和参数方程:圆的普通方程即为仅对圆上点的坐标关系进行描述的方程。
圆上点的特点是对固定点(即圆心)的距离相等,设圆心的坐标为(x0, y0)半径为r,则圆的普通方程为√(x−x0)2+(y−y0)2=r通常用的是化简的形式,为讨论方便,将圆心设为原点,即得到x2+y2=r2利用同角三角函数关系,即sin²θ+cos²θ=1可将上述方程参数化,得到圆的参数方程{y=r sinθx=r cosθ使用同样的思路,可以得到椭圆的参数方程,即{y=b sinθx=a cosθ消去参数后,得到椭圆的标准方程,即x2 a2+y2b2=1上述有关于椭圆的方程中均有a≠b。
1.2 物理预备知识关于物理的预备知识是最基本的波动光学的观点。
按照波动光学的观点,光是在空间中交替传播的电磁场,电场强度的方向与磁感应强度的方向垂直。
从能量分布的角度来说,光的能量被认为主要以电场的形式传播,因而通常也将光的电场强度矢量方向定义为光矢量方向。
CD(圆二色)光谱的理论和实验

2 12 2 , 0 V12 r12 1 2 , 0 2 , , r12
N. Berova and K. Nakanishi, Circular Dichroism: Principles and Applications, Wiley-VCH, New York, 2nd ed., 2000 Exciton Chirality: Fundamentals and Frontiers, Monatsh. Chem., 2005, 136(3)
d 不含发色团的手性配体与在UVvis区有d 或 f 型跃迁的金属离子 络合,产生ICD活性。
S. Allenmark, Chirality, 2003, 15, 409-422 G. Ascoli, E. Domenici, C. Bertucci, Chirality, 2006, 18, 667-679 L. Di Bari, G. Pescitelli and P. Salvadori, Chem.–Eur. J., 2004, 10, 1205–1214
Ⅳ 超分子体系诱导CD(ICD)
a 手性客体分子与含发色团的非手性主体
O. Mcconnell, A. Bach, C. Balibar, et al., Chirality, 2007, 19,658 - 682
Ⅳ 超分子体系诱导CD(ICD)
b 带发色团的非手性小分子键合手 性生物高聚物主体中,如蛋白质, 多肽,寡核苷酸,低聚糖(环糊 精)。 c 几个客体分子同时结合在主体大 分子的不同活性位。
摩尔椭圆率
平均残基椭圆率
OR旋光现象
R
L
L R 在 旋 光 介 质 中
在 非 旋 光 介 质 中
圆二色谱报告

圆二色谱报告一、实验目的1. 圆二色性;2. 圆二色光谱的原理与应用;3. 圆二色光谱的相关拓展知识;4. 圆二色光谱的实验技术与操作。
二、实验原理圆二色性是手性分子在光学上表现的一种特性。
光可视为振动方向与传播方向垂直的电磁横波。
当光波的电矢量方向以一个固定的角速度以传播方向为轴心匀速旋转时,称之为圆偏振光。
根据圆偏振光电矢量旋转方向的不同,可以将其区分为左圆偏振光和右圆偏振光。
一束平面偏振光可以看成是由两个振幅和速度相同而螺旋前进方向相反的圆偏振光叠加而成(图1)。
两圆偏振光彼此对映,互为镜像。
当手性物质在偏振光的波长范围内存在吸收的时候,其对左右圆偏振光的吸收程度,也就是摩尔吸光系数,是不同的。
此时不但偏振光的偏振平面将被旋转,构成该偏振光的左右圆偏振光的振幅也将不再相等。
组成出射光的左右圆偏振光的电矢量和将沿一个椭圆轨迹移动,此时的出射光就是椭圆偏振光(图2)。
这种光学现象就称为手性物质所具有的圆二色性。
对于纯手性物质,其椭圆偏振光的椭圆度θ在特定溶剂、浓度、温度和光程下,在特定波长处为定值。
同时,在特定波长处的椭圆度θ与在该波长处对左右圆偏振光的摩尔吸光系数之差(Δε)成正比。
将θ或Δε对波长作图,即得到圆二色光谱。
图1 右圆偏振光(a)、左圆偏振光(b)及平面偏振光示意图,水平箭头表示光的传播方向。
图2 (a) 平面偏振光的圆组分;(b) 平面偏振光的旋转与圆组分;(c) 椭圆偏振光的旋转与圆组分被吸收的情况。
其中,OB与OC分别表示右、左圆偏振光被吸收后的振幅,OD表示OB与OC的矢量和,θ表示椭圆偏振光的椭圆率角,tanθ= OE/OA″≈θ。
圆二色光谱的英文名称为Circular Dichroism,简称CD光谱。
其光谱仪的基本测试原理是——通过入射圆偏振光的波长变化,测定手性样品的左圆偏振光和右圆偏振光摩尔消光系数之差Δε。
由于CD光谱反映了光和分子间的能量交换,因而只能在有最大能量交换的共振波长范围内测。
实验4 圆二色光谱

实验二圆二色光谱一、实验目的1.学习和了解圆二色光谱的原理2.掌握圆二色光谱的的操作和分析二、实验原理1.圆偏振光振幅保持不变,而方向随前进方向随周期性变化,电场矢量绕绕传播方向螺旋前进2.圆二色性当光通过光学活性的物质时,介质对左右旋的圆偏振光的吸收率不同,二者的差值称为该物质的圆二色性(circular dichroism,简称CD)3.圆二色谱图光学活性物质对左右圆偏振光的吸收率之差为Δε=εL-εR是随入射偏振光的波长变化而变化的以Δε或有关量为纵坐标,波长为横坐标得到的谱图称为圆二色谱图,由于Δε绝对值很小,常用摩尔椭圆[θ]度来代替,二者的关系是[θ] =3300Δε当光学活性物质对光没有特性吸收时,在谱图中仅为一条近似的直线,当光学活性物质对光存在特征性吸收时通常有两种情况:当εL>εR得到一个正的圆二色谱图,当εL<εR得到一个负的圆二色谱图三、实验内容1.实验仪器及构造圆二色谱仪的基本构造:2.圆二色谱的应用蛋白质的圆二色性(1)由氨基酸通过肽键连接而成;(2)光学活性基团:肽键、芳香氨基酸残基、二硫桥键;(3)蛋白质有多个结构层次,相同的氨基酸序列,因蛋白质的折叠结构不同,基团的光学活性受到影响。
蛋白质的圆二色特征(1)光学活性基团及折叠结构;(2)250nm以下的光谱区,肽键的电子跃迁引起;(3)250~300nm光谱区,侧链芳香基团的电子跃迁引起;(4)300~700nm光谱区,蛋白质辅基等外在生色基团引起。
3.实验内容分别测定左旋和右旋苯丙氨酸的圆二色光谱三、实验结论可以通过圆二色光谱来分析化合物的手性结构。
从图中可知,左旋异构体对右旋的圆偏振光的吸收要比左旋圆偏振光大;同理,右旋异构体对左旋圆偏振光的吸收要比右旋圆偏振光要大。
故在分析位置样品时,若谱线峰值大于零,则为左旋,反之,则为左旋。
圆二色谱分析结果怎么看?
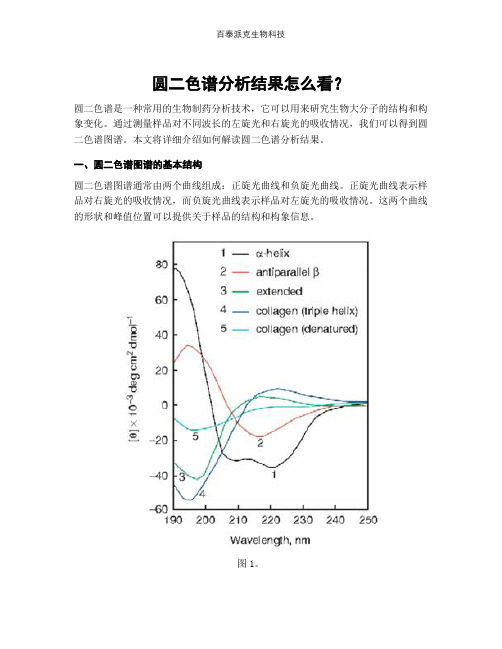
圆二色谱分析结果怎么看?圆二色谱是一种常用的生物制药分析技术,它可以用来研究生物大分子的结构和构象变化。
通过测量样品对不同波长的左旋光和右旋光的吸收情况,我们可以得到圆二色谱图谱。
本文将详细介绍如何解读圆二色谱分析结果。
一、圆二色谱图谱的基本结构圆二色谱图谱通常由两个曲线组成:正旋光曲线和负旋光曲线。
正旋光曲线表示样品对右旋光的吸收情况,而负旋光曲线表示样品对左旋光的吸收情况。
这两个曲线的形状和峰值位置可以提供关于样品的结构和构象信息。
图1。
二、峰值位置的解读圆二色谱图谱中的峰值位置可以告诉我们样品的二级结构信息。
一般来说,α-螺旋结构在190-200 nm处会出现负峰,而β-折叠结构在210-220 nm处会出现正峰。
通过观察峰值位置的变化,我们可以推断样品的二级结构变化。
三、峰值强度的解读除了峰值位置,圆二色谱图谱中的峰值强度也是解读样品结构的重要指标。
峰值强度反映了样品对旋光的吸收程度,强度越高表示吸收越强。
通过比较不同样品的峰值强度,我们可以判断它们的结构差异。
四、色谱图形的解读除了峰值位置和峰值强度,圆二色谱图谱的整体形状也提供了有关样品结构的信息。
例如,如果图谱呈现出对称的双峰形状,那么可能存在一种手性结构。
而如果图谱呈现出单峰形状,那么样品可能是非手性的。
五、结构变化的解读通过比较不同条件下的圆二色谱图谱,我们可以观察到样品结构的变化。
例如,当样品在不同温度下进行测量时,我们可以观察到峰值位置的变化,从而推断样品的热稳定性。
类似地,通过比较不同pH值下的圆二色谱图谱,我们可以了解样品的酸碱稳定性。
圆二色谱分析结果的解读需要考虑峰值位置、峰值强度、峰形、色谱图形和对比分析等因素。
通过综合分析这些指标,我们可以得出关于样品结构特征、纯度和质量变化情况的重要信息。
圆二色谱作为一种重要的分析技术,在生物制药领域具有广泛的应用前景。
百泰派克生物科技——生物制品表征,多组学生物质谱检测优质服务商。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.3.9圆二色性(Circular dichroic,CD)测定
1%(w/w)的蛋清溶液调节到pH 4.0,6.0,10.0,在85oC加热不同时间,离心,取上清液,然后稀释至100~200μg/mL溶液。
对照组为天然蛋清样品。
用Jasco J-715光度计测定样品的CD谱。
测定条件设定:测定波长范围190~250 nm,25oC,比色皿光径1 mm,分辨率0.2 nm,扫描速率100 nm/min,扫描5次。
使用Jasco SSE软件确定样品的二级结构百分含量。
3.4.6蛋白质的二级结构对DH的影响
蛋白酶的水解反应还受到蛋白质的结构的影响,一般结构紧密的蛋白质提供的酶切位点少于结构松散的蛋白质。
因此有必要研究蛋白质结构对DH的影响。
蛋白质的热处理可能引起二级、三级和四级结构的变化。
从二级结构看,α-螺旋结构表现蛋白质分子的有序性,而其结构如β-折叠、β-转角、无规卷曲等反映了蛋白质分子的松散性[26]。
蛋白质分子的有序性差,越有利于蛋白酶的水解。
目前,研究蛋白质构象最好的方法是x-射线衍射,但对结构复杂、柔性的生物大分子蛋白质来说,制备蛋白质单晶较为困难。
二维、多维核磁共振技术能测出溶液状态下蛋白质分子的构象,可是对分子量较大的蛋白质的计算处理非常复杂。
相比之下圆二色性是研究稀溶液中蛋白质分子构象的一种快速、简单、较准确的方法。
圆二色性在紫外区段(190~240 nm),主要生色团是肽链,这一波长范围的CD谱包含着生物大分子主链构象的信息。
在一般情况下,实验中得到的CD谱线是α-螺旋、β-折叠和无规卷曲构象的CD 谱的线性迭加[27]。
图3-7显示天然蛋清的CD谱线a在222 nm处和208 nm处呈负峰,在190 nm附近有一正峰,这是存在部分α-螺旋构象的特征。
谱线b、c、d、e在221 nm处的负谱带减弱,意味着α-螺旋的百分比减小。
谱线b、c、d、e向短波长方向移动,即发生蓝移。
由于发色团吸收光谱发生位移主要取决于它的微环境更加亲水或疏水的结果[28],因此谱线b、c、d、e蓝移的发生说明体系的亲水性降低,即疏水性增加。
表3.3列出了天然蛋清和热处理蛋清的α-螺旋、β-折叠、β-转角和无规卷曲构象所占的比例。
从表中可以看出,通过热处理,天然蛋清的α-螺旋比例下降,而β-折叠和无规卷曲的比例增加,说明蛋清蛋白分子结构的有序性降低,形成了以β-折叠和无规卷曲为主的二级结构。
图3-7天然和热处理的蛋清的CD光谱
a-天然蛋清;b-pH4,85oC加热36 min蛋清;c-pH6,85oC加热36 min蛋清;d-pH10,85oC 加热30 min蛋清;e-pH10,85oC加热60 min蛋清。
4.19圆二色谱分析动态超高压微射流均质对卵清蛋白二级结构的影晌
圆二色光谱(简称CD)是目前应用最为广泛的测定蛋白质二级结构的方法,是研究稀溶液中蛋白质构象的一种快速、简单、较准确的方法。
它可以在溶液状态下测定,较接近其生理状态。
而且测定方法快速简便,对构象变化灵敏,所以它是目前研究蛋白质二级结构的主要手段之一,并已广泛应用于蛋白质的构象研究中186]。
蛋白质是由氨基酸通过肤键连接而成的具有特定结构的生物大分子。
在蛋白质中,氨基酸的a一碳原子是不对称碳原子,具有光学活性,蛋白质的肤链走向也是不对称的结构,也具有光学活性,当平面圆偏振光通过这些光活性的生色基团时,光活性中心对平面圆偏振光中的左、右圆偏振光的吸收不相同,产生了吸收差值,由于这种吸收差的存在,造成了偏振光矢量的振幅差,圆偏振光变成了椭圆偏振光,这就是蛋白质的圆二色性。
通过测定蛋白质溶液的圆二色性,可以研究蛋白质的二级结构及其变化信息[87一l。
一般蛋白质的圆二色光谱分为两段,波长范围在185一245Inn 称为远紫外区,245一320nln称近紫外区。
具有不同二级结构的蛋白质或多肤所产生的CD 谱带的位置、吸收的强弱都不相同。
a一螺旋结构在靠近192Inn有一正的谱带,在222和208nm处表现出两个负的特征肩峰谱带;p一折叠的CD谱在216nm有一负谱带,在185一Zoonln有一正谱带;p一转角在206lun附近有一正CD谱带。
远紫外区是蛋白质肤链的吸收峰,反映了主链的构象。
因此,可利用这一区域的CD光谱推算蛋白质分子中的a一螺旋、p一折叠、p一转角以及无规卷曲的含量191]。
本实验利用圆二色光谱分析经动态超高压微射流均质处理后的卵清蛋白的二级结构变化情况。
下图分别为经不同均质压力处理后的卵清蛋白的圆二色谱图。
图4.24未处理的卵清蛋白的CD色谱
图4.2540MPa卵清蛋白的CD色谱
图4.2680MPa的卵清蛋白的CD色谱
图4.27120MPa的卵清蛋白的CD色谱
图4.28160MPa的卵清蛋白的CD色谱
图4.24一图4.28分别为不同压力处理的卵清蛋白与对照组的CD谱。
可以看出,不同压力对卵清蛋白CD谱的影响程度不同。
与未处理的样品相比,经不同压力处理后卵清蛋白CD 谱曲线,谱峰峰位和峰高均发生了不同程度的变化。
由图4.22中可知,未处理的卵清蛋白样品的CD谱在208nm和222nm附近处有两个宽负峰谱带;在190一202lun有一正谱带。
从各谱峰位及峰形来看,说明卵清蛋白以多种构象共存,并以a一螺旋结构为主。
经不同压力处理后,在192run出现明显的正峰谱带,并且在192tun和222nm处峰强有所提高,而在190nm处,峰强减小,这说明经高压均质处理后卵清蛋白的a一螺旋的含量有所增加(这与红外光谱的结果相一致),p一折叠有所减少。
将CD图谱与、认ng氏参照CD光谱拟合后估算出卵清蛋白二级结构中a一螺旋,p一折叠,p一转角和无规卷曲所占的比率。
.圆二色谱的结果表明,动态超高压微射流均质使卵清蛋白的二级结构发生了变化。
a一螺旋含量增加,既a一螺旋结构有所展开,并发生去折叠现象。
且过高的压力使卵清蛋白的a一螺旋和p一转角又向p一折叠转化。
(10)圆二色谱分析
用JASCOJ一810旋光仪旧本JASCO公司)测定卵清蛋白的远紫外圆二色谱变化170]。
旋光仪与电脑连接以Jasco软件操作。
将经过处理后卵清蛋白溶液注入0.Icm厚的椭圆形比色皿中,在25℃和连续充氮的条件下,进行远紫外区域190一250nm)扫描,速度为50nln/min,光谱间隔0.Inln,3次累积。
由仪器提供的、认ng氏参照CD光谱估算卵清蛋白二级结构中a螺旋,p折叠,p转角和无规卷曲所占的比率。
