人教版化学必修一4.4《氨 硝酸 硫酸-氨气制取、喷泉及性质综合实验》说课稿课件最新课件
人教版化学必修一4.4《氨 硝酸 硫酸(浓硫酸)》课件教学课件

(2)脱水性
(将有机物中的H、O元素按2:1的比例 即水的组成脱去)
现象:蔗糖变黑,体积膨胀呈疏松海绵状,有刺
激性气味的气体生成,放出大量的热。
有机物
浓硫酸 将H、O按H2O组
成比脱去
炭 化
(含C、H、O等)
C12H22O11 浓硫酸 蔗糖
脱水
12C + 11H2O
蔗糖脱水后为何变得疏松多孔?
(3)强氧化性
H2 O2 N2 CO CO2 CH4 SO2 HCl Cl2 浓硫酸不能干燥:
H2S HBr HI NH3
区别 浓硫酸特性:
吸水性:吸收物质中本来就有的自由水或 结晶水(如CuSO4•5H2O)。
脱水性:将化合物(主要指有机物)分子中 H、O两种元素以水的比例脱去。
强氧化性:由S(+6)表现出来的,
♣ (一)物理性质:
颜 色:无 色 状 态 : 油状液体
密 度 : 1.84g/cm3 沸 点 : 高沸点(338˚C) 挥发性: 难挥发 溶解度: 易溶与水
思考:稀释浓硫酸时应该如何操作?
l
正确操作: 将浓硫酸缓慢地沿玻璃
棒倒入盛有蒸馏水的烧杯内,并用玻棒不
断搅拌。
—— 三大特性
(1) 吸水性 — 吸收物质或空气中本来就
浓硫酸
以存 分在 子为 态主
H2SO4
自身特性
稀释 稀硫酸
完 全 电 离
H2SO4= 2H++SO42-
酸的通性
稀硫酸:酸的通性:H2SO4 = 2H+ + SO42-
1)与指示剂作用 2)与活泼金属反应 3)与碱性氧化物反应 4)与碱反应 5)与某些盐反应
人教版高中化学必修一:4.4氨硝酸硫酸(学案1)(第1课时氨)

第四节 氨 硝酸 硫酸第一课时 氨[课标要求]1.了解氨的性质及应用。
2.理解喷泉实验的原理。
3.掌握氨气的实验室制法。
4.了解铵盐的性质及NH +4的检验。
1.氮的固定2.氨的性质(1)物理性质(2)化学性质 1.两种物质的性质(1)氨的性质:氨气极易溶于水,能与水反应生成NH 3·H 2O ,与酸反应生成铵盐,能催化氧化制备硝酸。
(2)铵盐的性质:铵盐易溶于水,加热易分解,能与碱反应产生氨气。
2.检验氨气的两种方法(1)使湿润的红色石蕊试纸变蓝。
(2)用蘸有浓盐酸的玻璃棒靠近时会有白烟生成。
氮的固定 氨的性质及用途①与水反应:NH 3+H 2O NH 3·H 2O 。
②与盐酸反应:NH 3+HCl===NH 4Cl氨气与氯化氢气体相遇时产生白烟。
③催化氧化反应:4NH 3+5O 2=====催化剂△4NO +6H 2O 生成的NO 进而氧化生成NO 2,用来制造硝酸。
3.氨水的性质 (1)弱碱性,电离方程式:NH 3·H 2O NH +4+OH -,能使红色石蕊试纸变蓝。
(2)不稳定性,受热分解:NH 3·H 2O =====△NH 3↑+H 2O 。
4.氨的用途(1)氨是氮肥工业、有机合成工业及制造硝酸、铵盐和纯碱的原料。
(2)氨易液化,可用作制冷剂。
在干燥的圆底烧瓶中充满氨气,用带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶口,倒置烧瓶,使玻璃管插入盛有水(含酚酞)的烧杯中,轻轻挤压滴管的胶头,使少量水进入烧瓶,装置如图。
[问题思考]1.挤压滴管的胶头后,立即形成红色喷泉,该实验能说明氨气的哪些性质?提示:能说明氨气极易溶于水;氨气与水反应生成的氨水呈碱性。
2.该喷泉实验中,引发喷泉的实验操作是什么?提示:打开止水夹,挤压胶头滴管的胶头。
3.该喷泉实验成功的关键是什么?提示:①装置气密性良好。
②圆底烧瓶要干燥。
③装置内气体的纯度要高。
形成喷泉的条件使容器内外产生较大压强差的两类情况(1)容器内气体极易溶于水或容器内气体易与溶液中的溶质发生化学反应。
氨的催化氧化制硝酸和喷泉实验
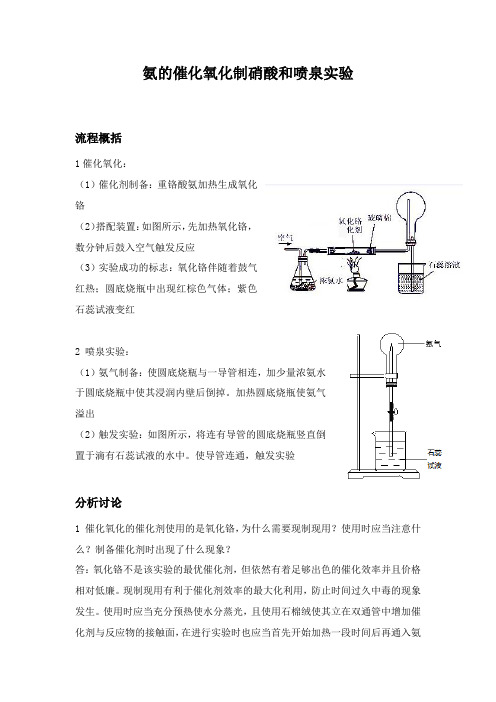
氨的催化氧化制硝酸和喷泉实验流程概括1催化氧化:(1)催化剂制备:重铬酸氨加热生成氧化铬(2)搭配装置:如图所示,先加热氧化铬,数分钟后鼓入空气触发反应(3)实验成功的标志:氧化铬伴随着鼓气红热;圆底烧瓶中出现红棕色气体;紫色石蕊试液变红2 喷泉实验:(1)氨气制备:使圆底烧瓶与一导管相连,加少量浓氨水于圆底烧瓶中使其浸润内壁后倒掉。
加热圆底烧瓶使氨气溢出(2)触发实验:如图所示,将连有导管的圆底烧瓶竖直倒置于滴有石蕊试液的水中。
使导管连通,触发实验分析讨论1 催化氧化的催化剂使用的是氧化铬,为什么需要现制现用?使用时应当注意什么?制备催化剂时出现了什么现象?答:氧化铬不是该实验的最优催化剂,但依然有着足够出色的催化效率并且价格相对低廉。
现制现用有利于催化剂效率的最大化利用,防止时间过久中毒的现象发生。
使用时应当充分预热使水分蒸光,且使用石棉绒使其立在双通管中增加催化剂与反应物的接触面,在进行实验时也应当首先开始加热一段时间后再通入氨气。
制备氧化铬时使用重铬酸氨分解的方法:(NH4)2Cr2O7= Cr2O3+N2↑+4H2O,红色的重铬酸铵分解生成的固体残渣随生成的气体喷出,产生绿色蓬松状固体,并伴随着火星飞溅。
2 本实验中的喷泉实验没有使用胶头滴管触发反应即可成功,为什么?答:胶头滴管触发是因为少量水使烧瓶中的氨气溶解,造成烧瓶内气压低于大气压从而使得滴有石蕊试液的水进入烧瓶触发实验。
而本实验中,因使用浓氨水,事先加热烧瓶壁使得氨气溢出,在导管中亦有氨气存在,水直接接触导管中的氨气,氨气大量溶解,直接引发实验,方法简单易操作。
3 氧化铬伴随着反应的进行会出现红热现象,为什么?答:氨气催化氧化为放热反应,热量的大量产生以及反应中本来就在进行的加热使得氧化铬到达熔点,从而出现红热现象。
4 实验过程中圆底烧瓶出现白雾或者白烟现象,如何避免?答:白烟现象可能反应产生的硝酸与氨气产生的硝酸氨的颗粒,可能是由于通入气体过快,气体流动速度太快导致的,减缓通入气体的速度就可以避免这样的问题;白雾现象可能是氨气催化氧化会产生水分,水蒸气在圆底烧瓶内出现冷凝并与NO2反应产生硝酸酸雾。
人教版高中化学必修一4.4《氨硝酸硫酸(喷泉实验)》说课课件

教材分析 教法分析 学法分析 教学过程 课后反思 2、喷泉实验原理 实验进行中……
➢学生分组实验,探究喷泉实验的原理 。 (课堂实录)
教材分析 教法分析 学法分析 教学过程 课后反思
2、喷泉实验原理
实验操作:
实验后总结
塞紧双孔塞,先打开止水夹,再挤压盛水的 胶头滴管
第四章第四节 氨 硝酸 硫酸 喷泉实验
说课内容
教材分析 教法分析 学法分析 教学过程 课后反思
教材分析 教法分析 学法分析 教学过程 课后反思 教材内容、地位及作用
所处位置
学习基础
主要内容
联系及作用
在教材中的地位及作用
“的喷良氨实泉好本教 通“喷的验方节材过泉性探法实是是 本实质究的验实在 节验” 之 探 设验介 的”中 后 究 计探绍 学的 引 。 和究是了 习实入课人二 使验此,教氧学。课评主版化生题价要高硫掌。归内中溶握纳容化于喷能包学水泉力括必和实。喷修用验泉1水的第实吸 原四验收 理章原二 ,第理氧 并四、化 建节引氮 立中发
探究提问:是否只有氨气才能产生喷泉,产生喷泉的气
体要符合哪些条件?
教材分析 教法分析 学法分析 教学过程 课后反思
4、课堂小结
提问:这节课我们学到了什么? 学情:学生了解了喷泉实验的原理、操作;
教师主导下的学生自主探究合作学习 学情:学生了解了喷泉实验的原理、操作; 提问:利用喷泉实验的原理,如何引发该实验装置?请描述实验操作和实验现象
3、引发喷泉的方法探究 的方法探究 教学目标
合作讨论、启发式点拨、实验探究等
通过本节的学习使学生掌握喷泉实验的原理,并建立良好的实验设计和实验评价归纳能力。
必修一4.4氨硝酸硫酸喷泉实验

第三节喷泉实验喷泉实验是中学化学中的重要实验,也是中学化学的常考内容,常见喷泉的形成主要有以下两类:(1)极易溶于水的气体(NH3、HCl、SO2等)与水可形成喷泉。
(2)酸性气体(HCl、SO2、NO2、CO2、H2S等)与NaOH(aq)也能形成喷泉。
典型例题1:如图所示的装置中,烧瓶中充满了干燥气体A将滴管中的液体b 挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。
A(干燥气体)NO2b(液体)A NO2水B CO24mol/LnaOH溶液C Cl2饱和NaCl溶液D NH31mol/L盐酸(1)选项_____________(填A、B、C、D)为何不满足要求_____________.(2)能形成图示喷泉实验的气体和液体甚多,它们需满足的条件是①____________;②____________________。
例如________气体和________液体。
解析:形成喷泉最根本的原因是瓶内外存在压强差。
当烧瓶内气体溶于液体并与之反应时,瓶内气体大量减少,压强降低,外界的大气压将液体压入烧瓶内。
如此持续,最后液体将充满烧瓶。
B和D正确.NO2气体虽也易溶于水,但同时产生NO气体:3NO2+H2O =2HNO3+NO,即使会出现“喷泉”现象,但烧杯内的水只会部分进入烧瓶内,不会几乎充满烧瓶。
饱和氯化钠溶液不能吸收氯气,所以选项A 和C 错误。
从以上分析我们可知;当气体极易溶于液体或气体与液体反应(一般无新气体产生)即可形成“喷泉”,例如:Cl 2和NaOH 溶液等。
答案:(1)A 、C ;前者与水反应后生成NO ,溶液不能充满整个烧瓶.后者气体不溶于液体.(2)①气体易溶于液体②气体与液体反应(无新气体产生);Cl 2和NaOH 溶液。
思维点拨:本题对喷泉实验的概括,体现了对开放性,创造性的能力要求。
喷泉实验是中学化学中的重要实验,也是中学化学的常考内容,常见喷泉的形成主要有以下两类:(1)极易溶于水的气体(NH 3、HCl 、SO 2等)与水可形成喷泉。
人教版化学必修一4.4《氨 硝酸 硫酸-氨气制取、喷泉及性质综合实验》说课稿课件教学课件

2)喷泉实验
实验成功的关键:
① 装置的气密性良好; ② 烧瓶要干燥; ③ 烧瓶充满气体。
常见能形成喷泉的物质组合
气体 NH3
可吸收多余的氨气,防止污染空气。
➢实验室中还可以用哪些方法快速制氨气:
①加热浓氨水法 (装置与实验室制氯气的发生装置 相同)
②浓氨水加碱石灰法 (碱石灰吸水、溶解时放热)
浓氨水
CaO
3) 喷泉实验改进装置
峡江中学
Xia Jiang Middle School
氨气制取、喷泉及 性质综合实验
峡江中学
Xia Jiang Middle School
目录
一、教材分析
二、教学目标
三、教学重难点
四、教法与学法
五、教学过程
六、归纳总结
氨气的喷泉实验说课过程
一、教材分析:
本节课是人教版高中化学必修一第四章,第 四节的内容,是高一化学非金属及其化合物中学 习的;
他因为攻克氨的合成这
一世界难题,将无数人 从饥饿的死亡线上拯救
哈伯(F.Haber 1868—1934)
出来;他也因发明大量 化学武器并用于战争, 使无数人伤残致死;他 是诺贝尔化学奖得主受 人尊敬,他也是战争魔 鬼遭人唾骂。
氨气的喷泉实验说课过程
2、新课学习
氨气的泄漏事件
2007年1月25日下午1点10分左右, 大兴区正大大发熟食厂冷冻车间 的氨气管道突然泄漏,外泄的液 态氨瞬间挥发成白色气柱冲出来。 空气中弥漫着一股浓烈的刺激性 气味,进入厂区呼吸都感到困难. 厂区内寒气逼人。 …
人教版高中化学必修一:4.4氨硝酸硫酸(学案1)(第1课时氨)

第四节氨硝酸硫酸第一课时氨1.了解氨的性质及应用。
2.理解喷泉实验的原理。
3.掌握氨气的实验室制法。
4.了解铵盐的性质及NH错误!的检验。
1.氮的固定2.氨的性质1物理性质颜色气味密度溶解性沸点无色刺激性气味g/L,比空气的密度小极易溶于水,1体积水能溶解700体积NH3-℃易液化2化学性质1.两种物质的性质1氨的性质:氨气极易溶于水,能与水反应生成NH3·H2O,与酸反应生成铵盐,能催化氧化制备硝酸。
2铵盐的性质:铵盐易溶于水,加热易分解,能与碱反应产生氨气。
2.检验氨气的两种方法1使湿润的红色石蕊试纸变蓝。
2用蘸有浓盐酸的玻璃棒靠近时会有白烟生成。
错误!①与水反应:NH3+H2O NH3·H2O。
②与盐酸反应:NH3+HCl===NH4Cl氨气与氯化氢气体相遇时产生白烟。
③催化氧化反应:4NH3+5O2错误!错误!错误!错误!错误!错误!ol N2有6 mol电子转移解析:选C此反应存在元素化合价的变化,为氧化还原反应,氧化还原反应不可能为复分解反应,C错误;Cl2在此反应中作氧化剂,体现强氧化性,B正确;反应生成的HCl遇到挥发出来的NH3生成白烟NH4Cl,A正确;2NH3错误!ol N2将有6 mol电子转移,D正确。
9.已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使湿润红色石蕊试纸变蓝的气体,它们之间能发生如下反应:①A+H2O―→B+C②C +F―→D③D+NaOH错误!错误!错误!错误!错误!错误!ol·L-1。
解析:1装置A是制备氨气的发生装置,浓氨水滴入固体碱石灰或氧化钙或固体氢氧化钠都可以生成氨气,浓硫酸和氨气发生反应,氨气易溶于烧碱溶液,不能选择浓硫酸、氢氧化钠溶液制备氨气,所以A装置中试剂为:a碱石灰,b生石灰;B装置中的碱石灰是吸收水蒸气,干燥氨气。
2连接好装置并检验装置的气密性后,装入试剂,打开旋塞逐滴向圆底烧瓶中加入氨水发生反应生成氨气。
人教版化学必修一第四章第四节氨 硝酸 硫酸(一)优秀课件PPT

①湿润红色石蕊试纸 ②浓HCl
三、NH3的实验室制法
尾气处理:水/稀硫酸(防倒吸)
‘棉花’的作用: 干燥:减缓NH3与空气对流的作用 有水/稀硫酸:还可吸收多余的NH3
【实验4-8】喷泉实验
现象
烧杯中溶液由玻璃管进入烧瓶, 形成喷泉,瓶内液体呈现红色
结论 NH3极易溶于水,水溶液呈碱性
一、氨气(NH3)
(2)化学性质
①与H2O
• NH3+H20 ≒ NH3·H2O
一水合氨、氨水
氨水
NH3·H2O 的性质
①弱碱性:NH3·H2O ≒ NH4++OH②不稳定性:NH3·H2O =△= NH3↑+H2O
小结
①氨的3性:极易溶于水,催化氧化,氨水的 弱碱性
②NH3的制备:1原理,3检验 ③2个特性: • 盐类不一定含有金属离子 如:铵盐 • 铵盐受热都易分解,但不一定产生NH3
用微笑告诉别人,今天的我,比昨天更强。瀑布跨过险峻陡壁时,才显得格外雄伟壮观。勤奋可以弥补聪明的不足,但聪明无法弥补懒惰的缺陷。孤独是 每个强者必须经历的坎。有时候,坚持了你最不想干的事情之后,会得到你最想要的东西。生命太过短暂,今天放弃了明天不一定能得到。只有经历人生 的种种磨难,才能悟出人生的价值。没有比人更高的山,没有比脚更长的路学会坚强,做一只沙漠中永不哭泣的骆驼!一个人没有钱并不一定就穷,但没 有梦想那就穷定了。困难像弹簧,你强它就弱,你弱它就强。炫丽的彩虹,永远都在雨过天晴后。没有人能令你失望,除了你自己人生舞台的大幕随时都 可能拉开,关键是你愿意表演,还是选择躲避。能把在面前行走的机会抓住的人,十有八九都会成功。再长的路,一步步也能走完,再短的路,不迈开双 脚也无法到达。有志者自有千计万计,无志者只感千难万难。我成功因为我志在成功!再冷的石头,坐上三年也会暖。平凡的脚步也可以走完伟大的行程。 有福之人是那些抱有美好的企盼从而灵魂得到真正满足的人。如果我们都去做自己能力做得到的事,我们真会叫自己大吃一惊。只有不断找寻机会的人才 会及时把握机会。人之所以平凡,在于无法超越自己。无论才能知识多么卓著,如果缺乏热情,则无异纸上画饼充饥,无补于事。你可以选择这样的“三 心二意”:信心恒心决心;创意乐意。驾驭命运的舵是奋斗。不抱有一丝幻想,不放弃一点机会,不停止一日努力。如果一个人不知道他要驶向哪个码头, 那么任何风都不会是顺风。行动是理想最高贵的表达。你既然认准一条道路,何必去打听要走多久。勇气是控制恐惧心理,而不是心里毫无恐惧。不举步, 越不过栅栏;不迈腿,登不上高山。不知道明天干什么的人是不幸的!智者的梦再美,也不如愚人实干的脚印不要让安逸盗取我们的生命力。别人只能给 你指路,而不能帮你走路,自己的人生路,还需要自己走。勤奋可以弥补聪明的不足,但聪明无法弥补懒惰的缺陷。后悔是一种耗费精神的情绪,后悔是 比损失更大的损失,比错误更大的错误,所以,不要后悔!复杂的事情要简单做,简单的事情要认真做,认真的事情要重复做,重复的事情要创造性地做。 只有那些能耐心把简单事做得完美的人,才能获得做好困难事的本领。生活就像在飙车,越快越刺激,相反,越慢越枯燥无味。人生的含义是什么,是奋 斗。奋斗的动力是什么,是成功。决不能放弃,世界上没有失败,只有放弃。未跌过未识做人,不会哭未算幸运。人生就像赛跑,不在乎你是否第一个到 达终点,而在乎你有没有跑完全程。累了,就要休息,休息好了之后,把所的都忘掉,重新开始!人生苦短,行走在人生路上,总会有许多得失和起落。 人生离不开选择,少不了抉择,但选是累人的,择是费人的。坦然接受生活给你的馈赠吧,不管是好的还是坏的。现在很痛苦,等过阵子回头看看,会发 现其实那都不算事。要先把手放开,才抓得住精彩旳未来。可以爱,可以恨,不可以漫不经心。我比别人知道得多,不过是我知道自己的无知。你若不想 做,会找一个或无数个借口;你若想做,会想一个或无数个办法。见时间的离开,我在某年某月醒过来,飞过一片时间海,我们也常在爱情里受伤害。1、 只有在开水里,茶叶才能展开生命浓郁的香气。人生就像奔腾的江水,没有岛屿与暗礁,就难以激起美丽的浪花。别人能做到的事,我一定也能做到。不 要浪费你的生命,在你一定会后悔的地方上。逆境中,力挽狂澜使强者更强,随波逐流使弱者更弱。凉风把枫叶吹红,冷言让强者成熟。努力不不一定成 功,不努力一定不成功。永远不抱怨,一切靠自己。人生最大的改变就是去做自己害怕的事情。每一个成功者都有一个开始。勇于开始,才能找到成功的 路。社会上要想分出层次,只有一个办法,那就是竞争,你必须努力,否则结局就是被压在社会的底层。后悔是一种耗费精神的情绪后悔是比损失更大的 损失,比错误更大的错误所以不要后悔。每个人都有潜在的能量,只是很容易:被习惯所掩盖,被时间所迷离,被惰性所消磨。与其临渊羡鱼,不如退而结网。 生命之灯因热情而点燃,生命之舟因拼搏而前行。世界会向那些有目标和远见的人让路。不积跬步,无以至千里;不积小流,无以成江海。骐骥一跃,不 能十步;驽马十驾,功在不舍。锲而舍之,朽木不折;锲而不舍,金石可镂。若不给自己设限,则人生中就没有限制你发挥的藩篱。赚钱之道很多,但是 找不到赚钱的种子,便成不了事业家。最有效的资本是我们的信誉,它小时不停为我们工作。销售世界上第一号的产品——不是汽车,而是自己。在你成
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
他因为攻克氨的合成这
一世界难题,将无数人 从饥饿的死亡线上拯救
哈伯(F.Haber 1868—1934)
出来;他也因发明大量 化学武器并用于战争, 使无数人伤残致死;他 是诺贝尔化学奖得主受 人尊敬,他也是战争魔 鬼遭人唾骂。
氨气的喷泉实验说课过程
2、新课学习
氨气的泄漏事件
2007年1月25日下午1点10分左右, 大兴区正大大发熟食厂冷冻车间 的氨气管道突然泄漏,外泄的液 态氨瞬间挥发成白色气柱冲出来。 空气中弥漫着一股浓烈的刺激性 气味,进入厂区呼吸都感到困难. 厂区内寒气逼人。 …
氨气是中学阶段唯一的碱性气体,是重要的 氢化物代表,在教学要求上属于理解应用层次;
本节可通过实验演示、讨论、展示、计算, 不仅要了解易溶于水的气体,由于压强变化形成 美丽的喷泉的定性认识,要掌握气体与溶液,或 者气体与气体只要压强变化都能形成这一实验现 象的本质。
氨气的喷泉实验说课过程
二、教学目标:
可吸收多余的氨气,防止污染空气。
➢实验室中还可以用哪些方法快速制氨气:
①加热浓氨水法 (装置与实验室制氯气的发生装置 相同)
②浓氨水加碱石灰法 (碱石灰吸水、溶解时放热)
浓氨水
CaO
3) 喷泉实验改进装置
通过参与实验探究,进而形成科学探究的思维和热爱科 学、热爱生活的态度。
氨气的喷泉实验说课过程
三、教学重难点:
教学重点:氨气的物理、化学性质
氨气的制取及检验方法 喷泉实验的操作和原理
教学难点:氨水的成分分析
氨水物质的量浓度的计算
氨气的喷泉实验说课过程
四、教法 学法
我主要采取学生活动的教学方法,让学生真正的参与活 动,充分调动起学生参与活动的积极性,激发学生对解决实 际问题的渴望,并且要培养学生以理论联系实际的能力,从 而达到最佳的教学效果。
在介绍氨的物理性质的时候,我会展示一则液氨泄漏的 图片,通过这一组图片让学生总结出氨的物理性质,再如在 介绍氨的化学性质的时候,我用了一组喷泉图片,导入本节 的一个重点,即氨的喷泉实验。利用图片和演示实验等手段 进行直观展示和演示,激发学生的学习兴趣,活跃课堂气氛 ,促进学生对知识物理性质和化学性质的掌握。
刺鼻的味道也弥漫到了附近 的林校路上。…消防员利用 喷雾水枪稀释空气中的氨, 地上的水流已经结成了厚厚 的一层冰。…
氨气的喷泉实验说课过程
氨气
1) 物理性质 •无色、有刺激性气味的气体 •很容易液化(-33.5℃) •密度比空气小 •极易溶于水(1:700)
氨溶于水的喷泉实验
2)喷泉实验
2)喷泉实验
NH3
如图,在干燥的圆底烧瓶内充满氨气,
用带有玻璃管和滴管(滴管里预先吸入
水)的塞子塞紧瓶口,倒置烧瓶,使玻
璃管插入盛有水的烧杯(预先在水里滴
入少量酚酞溶液)。轻轻挤压滴管,使
少量水进入烧瓶。观察并描述现象。
烧瓶内压强减小
水往上流产生喷泉 溶液变红 酚酞溶液 氨气极易溶于水 溶液显碱性
2)喷泉实验
氨气的喷泉实验说课过程
五、教学过程
情
新
境
课
创
学
设
习
物理性质
归 喷泉实验 纳
改进装置
总 结
化学性质
创设情景启发式教学,引入教学内容。 设计实验探究式教学,发展学生思维。
氨气的喷泉实验说课过程
1、情境创设
我将会展示一张哈伯的图片,请同学们大胆猜测图片上 的人是谁,从而将同学们的注意力转入课堂。
天才还是魔鬼?
HCl
SO2、 NO2与
CO2
O2
吸收 水或 水或氢氧 浓氢氧化 剂 盐酸 化钠溶液 钠溶液
水
3) 喷泉实验改进装置
分析喷泉实验存在的缺陷
采用现行教材中的方法进行实验,喷泉实验效 果不理想。例如,喷泉实验对氨气和收集氨气的装 置的干燥程度要求很高,湿度大的氨气容易造成实 验不理想或者失败。预先收集好的氨气在进行仪器 组装中容易发生泄漏,导致实验效果不理想,甚至 失败,而且氨气泄漏会造成环境污染,不环保。
峡江中学
Xia Jiang Middle School
氨气制取、喷泉及 性质综合实验
峡江中学
Xia Jiang Middle School
目录
一、教材分析
二、教学目标
三、教学重难点
四、教法与学法
五、教学过程
六、归纳总结
氨气的喷泉实验说课过程
一、教材分析:
本节课是人教版高中化学必修一第四章,第 四节的内容,是高一化学非金属及其化合物中学 习的;
(常见气体中唯一的一种碱性气体)
(2)蘸有浓盐酸的玻璃棒放在容器口
6)干燥方法:
(试管口产生白烟)
①CaO、碱石灰等碱性干燥剂
②无水CaCl2不能用来干燥NH3(形成CaCl2·8NH3) 将气体通过干燥管或U型管干燥。
氨气的实验室制法
7)吸收方法: 用浸湿的棉花团 作用: 防止氨气与空气对流,使所制氨气不纯;
针对以上情况,对实验装置加以创新和改进。 本人通过设计出将NH3的制备、干燥和NH3的喷泉 实验、氨气的检验及性质结合在一起的实验装置, 现象明显,无环境污染。
氨气的实验室制法
1)原料:NH4Cl(s)、Ca(OH)2(s) 为什么不用NaOH固体呢?
2)原理:铵盐与碱共热产△生NH3 2NH4Cl+ Ca(OH)2=== Cபைடு நூலகம்Cl2 + 2NH3↑+2H2O
原理:当气体接触外部水或溶液时,由于气体大 量溶解或与溶液中的溶质发生化学反应,从而使容器 内气压迅速降低,在外界大气压作用下,外部液体迅 速进入容器,通过尖嘴导管喷出,形成喷泉。
2)喷泉实验
实验成功的关键:
① 装置的气密性良好; ② 烧瓶要干燥; ③ 烧瓶充满气体。
常见能形成喷泉的物质组合
气体 NH3
1、知识与技能
本节课的教学目标定位:
①了解氨气喷泉实验形成的原理和实验成功的关键因素
②掌握喷泉实验后形成溶液的溶质物质的量浓度的计算
③掌握氨气的物理、化学性质及氨气的制取和检验方法
2、过程与方法
通过喷泉成因的探究来认识NH3的性质,同时形成实验 观察能力、问题分析能力、理性思维能力
3、情感态度和价值观
制 取 NH3 可 用 NH4Cl 或 (NH4)2SO4 等 , 但 不 能 用 NH4HCO3 或 NH4NO3 , 因 为 NH4HCO3 、 NH4NO3受热分解产生杂质气体
3)装置特点:
△
固+固
气体
氨气的实验室制法
4)收集方法:向下排空气法
5)验满方法:
(1)湿润的红色石蕊试纸放在容器口
