硫酸硫酸盐和硫酸的工业制法
硫酸的工业制法

1 .什么是环境?
大气、土地、水、矿产、森林、生物以 及风景游览区、自然保护区、生活居住 区等构成了人类生存的环境
2 .环境污染包括哪些?
环境污染主要包括大气污染、水污染、土壤 污染、食品污染等,此外还包括固体废弃物, 放射性噪声等污染。
返回
3.SO2排放到大气中有哪些危害?
• ①人吸入SO2会发生呼吸道疾病,浓度高达一定程 度时,会使人死亡。 • ②如果SO2与空气中的飘尘接触,或跟氮的氧化物 接触,会部分被氧化为SO3,危害跟严重,这些硫 的氧化物能直接伤害植物叶片,浓度高时,会使 植物枯死。 • ③降水时,硫的氧化物以及所形成的硫酸和硫酸 盐随雨雪降到地面,即所谓的“酸雨”。酸雨可 使湖泊水质酸化,毒害鱼类和其它水生生物;使 土壤酸化、破坏农田、损害农作物、森林;酸雨 还会腐蚀建筑物、金属制品、名胜古迹等。
返回
6.什么是热交换过程? 6. 什么是热交换过程?
通过热交换器把反应时生 成的热,传递给进入接触 室的需要预热的混合气体, 并冷却反应后生成的气体, 像这样传递热量的过程就 是化学工业上常用的热交 换过程。
返回
7.吸收SO3为什么不直接用水或 稀硫酸,而是用98.3%的浓硫酸?
因为用水或稀硫酸作吸收 剂时,容易形成酸雾,吸 收速度慢且吸收不充分, 而 用 98.3% 的 浓 硫 酸 作 吸 收剂,则在吸收过程中不 形成酸雾,吸收速度快且 吸收充分,有利于SO3的吸 收。
关于多步反应变一步的计算
步骤: 1.写出多步反应的化学方程式; 2.找出主要原料和最终产物之间的物质的 量的对应关系。即找出主要原料和最终产 物中所含关键原子个数关系。 3.列出关系式,解出答案。
守恒原则
•计算中可以按照守恒、累积、转化的三原则处 理有关过程及数据以化难为易。 •1.守恒原则:如黄铁矿制硫酸中 S 原子守恒,具 体表现形式为 •FeS2——2H2SO4 或 S——H2SO4
硫酸的工业制法

S+O2 点燃 SO2
4FeS2+11O2 高温 2Fe2O3+8SO2
催化剂
2SO2+O2
2SO3
③三氧化硫的吸收
SO3 +H2O → H2SO4
硫酸的工业生产 硫酸工业生产流程动画
沸腾炉
接触室
吸收塔
净 化
冷却
沸腾炉
沸 腾 炉
照片
接触室
接 触 室
照片
吸收塔
吸
收
塔
沸腾炉照片
炉气净化主要除去砷、硒等化合物 和矿尘;
炉气的净化
炉气的成分:二氧化硫、氧气、氮气、 水蒸气、矿尘、砷硒化合物等
净化的目的: 防止催化剂中毒和设备腐蚀
方法:除尘(除矿尘) 洗涤(除去砷、硒等化合物) 干燥(除水蒸气)
• 净化设备: • 1、旋风分离器 • 2、文丘里除尘 • 3、水洗塔
二、接触氧化
硫黄 65%
黄铁矿 16%
其他 19%
• 2.煅烧黄铁矿 将硫黄或经过粉碎的黄铁矿,分别放在
专门设计的燃烧炉中,利用空气中的氧气使 其燃烧,就可以得到SO2。
煅烧黄铁矿在沸腾炉中进行。 造气阶段的反应原理:
• S(s)+O2(g)=SO2(g);△H= -297kJ/mol
• 或者FeS2(s)+O2(g)=Fe2O3(s)+2SO2(g);△H= 853kJ/mol
• 1.反应原理 SO2跟O2是在催化剂(如V2O5)表面
上接触时发生反应的,所以,这种生产 硫酸的方法叫做接触法。
从沸腾炉出来的气体主要有:SO2、 O2、N2,它们进入接触室,发生氧化反 应:
SO2、O2
温度较高的气体
硫酸的工业制法三个方程式

硫酸的工业制法三个方程式
硫酸是一种重要的化工原料,在工业上有几种制备方法。
其中最常见的三种制法分别为铁硫矿氧化法、硫三氧化二硫催化剂法和硫酸盐矿石法。
首先是铁硫矿氧化法,其化学方程式为,2FeS2 + 7O2 + 2H2O → 2FeSO4 + 2H2SO4。
这个过程中,铁硫矿(黄铁矿)被氧化成硫酸铁和硫酸。
其次是硫三氧化二硫催化剂法,其化学方程式为,2SO2 + O2 → 2SO3。
这个过程中,二氧化硫被氧化成三氧化硫,而后者溶于水形成硫酸。
最后是硫酸盐矿石法,其化学方程式为,CaSO4 + 2C + O2 → 2CO2 + 2CO + 2SO2 + CaS。
这个过程中,硫酸盐矿石(石膏)经过还原反应生成二氧化硫,再经过催化氧化反应生成硫三氧化二硫,最终形成硫酸。
这三种工业制法分别从硫化物、二氧化硫和硫酸盐矿石出发,通过不同的化学反应途径最终制得硫酸。
这些方程式展示了硫酸的
工业制备过程,每个方程式都代表着不同的反应路径和条件。
希望这些信息能够满足你的需求。
(Ⅱ)二氧化硫、硫酸、硫酸盐、硫酸的工业...

SO2 某些有机色素 △
无色的物质
经SO2漂白的物质长时间光照或受热后, 会恢复原来的颜色,因此,其漂白作用不持久。 漂白本质:SO2与有色物质的化合作用。 浸有浓溴水的滤纸悬在SO2的集气瓶中,滤纸 的红棕色褪去,SO2表现_____性。 还原 SO2通入蓝色石蕊溶液的现象: ___________________________。 蓝色溶液变紫色后又变红色
化学性质
1、具有酸的通性(强酸) H2SO4=2H++SO42Cu(OH)2 CuO ZnO BaCl2 CuSO4 +2H2O CuSO4 +H2O ZnSO4 +H2↑ BaSO4+2HCl
H2SO4
FeS+H2SO4 =FeSO4+H2S↑
紫色石蕊试液 变红
2、难挥发性 实验室制HCl(HF)、HNO3利用了硫酸的难挥发性。 ∆ 2NaCl+H2SO4(浓)==Na2SO4+2HCl↑ 微热 NaNO3+H2SO4(浓)=====NaHSO4+HNO3↑
工业制硫酸反应方程式

工业制硫酸反应方程式引言硫酸是一种广泛应用于工业生产和实验室的重要化学品。
它是一种无色、无臭的液体,具有强酸性。
硫酸的制备方法有很多种,其中工业制硫酸反应方程式是最常用的一种方法之一。
本文将详细介绍工业制硫酸反应方程式的原理、条件和具体步骤。
工业制硫酸反应方程式的原理工业制硫酸的反应方程式是一种氧化还原反应。
具体来说,硫酸的制备是通过将硫磺或硫化物氧化为二氧化硫,然后再将二氧化硫进一步氧化为三氧化硫,最后与水反应生成硫酸的过程。
反应方程式如下所示:2 SO2 + O2 → 2 SO3SO3 + H2O → H2SO4在这个反应过程中,二氧化硫和氧气首先反应生成三氧化硫。
然后,三氧化硫与水反应生成硫酸。
整个过程是一个连续的反应链,需要适当的温度、压力和催化剂的存在。
工业制硫酸反应方程式的条件工业制硫酸的反应条件如下: - 温度:反应温度通常在400-500°C之间,这是为了保证反应速率和产率的最优化。
- 压力:反应压力通常在1-2 atm之间,这是为了保持反应体系的稳定性和安全性。
- 催化剂:反应需要催化剂的存在,常用的催化剂有铁、钒等金属催化剂。
工业制硫酸反应方程式的步骤工业制硫酸的反应步骤如下: 1. 原料准备:将硫磺或硫化物作为反应的原料,将其加入反应釜中。
2. 氧化反应:加热反应釜,使硫磺或硫化物与氧气反应生成二氧化硫。
这个过程需要控制温度和压力。
3. 催化反应:将二氧化硫和氧气进一步反应,生成三氧化硫。
催化剂的存在可以加速这个反应。
4. 吸收反应:将三氧化硫与水反应,生成硫酸。
这个过程需要控制温度和压力,并且需要适当的吸收剂来吸收生成的硫酸。
5. 分离与纯化:将反应产物进行分离和纯化,得到高纯度的硫酸。
工业制硫酸反应方程式的应用工业制硫酸的反应方程式是制备硫酸的重要方法,硫酸在工业生产中有广泛的应用,包括但不限于以下几个方面: - 化肥生产:硫酸是制造化肥的重要原料,可以用于制造磷酸二氢铵、硫酸铵等化肥。
硫酸的工业制法
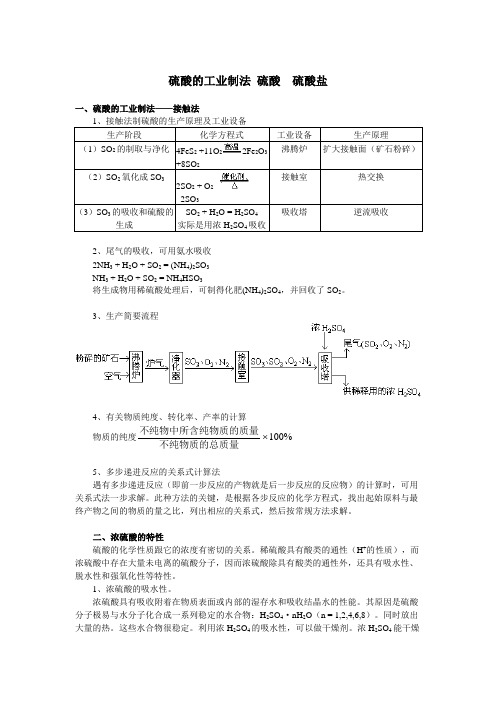
硫酸的工业制法硫酸硫酸盐一、硫酸的工业制法——接触法1、接触法制硫酸的生产原理及工业设备生产阶段化学方程式工业设备生产原理(1)SO2的制取与净化4FeS2+11O22Fe2O3+8SO2沸腾炉扩大接触面(矿石粉碎)(2)SO2氧化成SO32SO2 + O22SO3接触室热交换(3)SO3的吸收和硫酸的生成SO2 + H2O = H2SO4实际是用浓H2SO4吸收吸收塔逆流吸收2、尾气的吸收,可用氨水吸收2NH3 + H2O + SO2 = (NH4)2SO3NH3 + H2O + SO2 = NH4HSO3将生成物用稀硫酸处理后,可制得化肥(NH4)2SO4,并回收了SO2。
3、生产简要流程4、有关物质纯度、转化率、产率的计算物质的纯度不纯物中所含纯物质的质量不纯物质的总质量100%5、多步递进反应的关系式计算法遇有多步递进反应(即前一步反应的产物就是后一步反应的反应物)的计算时,可用关系式法一步求解。
此种方法的关键,是根据各步反应的化学方程式,找出起始原料与最终产物之间的物质的量之比,列出相应的关系式,然后按常规方法求解。
二、浓硫酸的特性硫酸的化学性质跟它的浓度有密切的关系。
稀硫酸具有酸类的通性(H+的性质),而浓硫酸中存在大量未电离的硫酸分子,因而浓硫酸除具有酸类的通性外,还具有吸水性、脱水性和强氧化性等特性。
1、浓硫酸的吸水性。
浓硫酸具有吸收附着在物质表面或内部的湿存水和吸收结晶水的性能。
其原因是硫酸分子极易与水分子化合成一系列稳定的水合物:H2SO4·nH2O(n = 1,2,4,6,8)。
同时放出大量的热。
这些水合物很稳定。
利用浓H2SO4的吸水性,可以做干燥剂。
浓H2SO4能干燥H 2、O 2、CO 等中性气体,也能干燥SO 2、Cl 2、CO 2、HCl 、HF 等酸性气体;但不能干燥NH 3等碱性气体,也不能干燥HBr 、HI 、H 2S 等有强还原性的气体。
2、浓硫酸的脱水性。
硫酸的工业制法
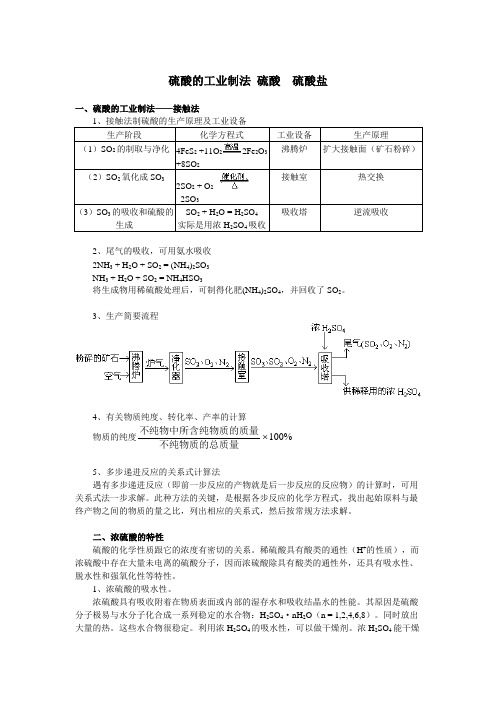
硫酸的工业制法硫酸硫酸盐一、硫酸的工业制法——接触法1、接触法制硫酸的生产原理及工业设备生产阶段化学方程式工业设备生产原理(1)SO2的制取与净化4FeS2+11O22Fe2O3+8SO2沸腾炉扩大接触面(矿石粉碎)(2)SO2氧化成SO32SO2 + O22SO3接触室热交换(3)SO3的吸收和硫酸的生成SO2 + H2O = H2SO4实际是用浓H2SO4吸收吸收塔逆流吸收2、尾气的吸收,可用氨水吸收2NH3 + H2O + SO2 = (NH4)2SO3NH3 + H2O + SO2 = NH4HSO3将生成物用稀硫酸处理后,可制得化肥(NH4)2SO4,并回收了SO2。
3、生产简要流程4、有关物质纯度、转化率、产率的计算物质的纯度不纯物中所含纯物质的质量不纯物质的总质量100%5、多步递进反应的关系式计算法遇有多步递进反应(即前一步反应的产物就是后一步反应的反应物)的计算时,可用关系式法一步求解。
此种方法的关键,是根据各步反应的化学方程式,找出起始原料与最终产物之间的物质的量之比,列出相应的关系式,然后按常规方法求解。
二、浓硫酸的特性硫酸的化学性质跟它的浓度有密切的关系。
稀硫酸具有酸类的通性(H+的性质),而浓硫酸中存在大量未电离的硫酸分子,因而浓硫酸除具有酸类的通性外,还具有吸水性、脱水性和强氧化性等特性。
1、浓硫酸的吸水性。
浓硫酸具有吸收附着在物质表面或内部的湿存水和吸收结晶水的性能。
其原因是硫酸分子极易与水分子化合成一系列稳定的水合物:H2SO4·nH2O(n = 1,2,4,6,8)。
同时放出大量的热。
这些水合物很稳定。
利用浓H2SO4的吸水性,可以做干燥剂。
浓H2SO4能干燥H 2、O 2、CO 等中性气体,也能干燥SO 2、Cl 2、CO 2、HCl 、HF 等酸性气体;但不能干燥NH 3等碱性气体,也不能干燥HBr 、HI 、H 2S 等有强还原性的气体。
2、浓硫酸的脱水性。
【高中化学】硫酸的工业制法PPT课件

原理一、提高原料转化率原理
1、增大反应物的浓度。根据勒夏特列原理,对于达到平衡后的可逆
反应,在其他条件不变时,增大一种反应物的浓度,可使平衡向正反 应方向移动,从而可以提高另一种反应物的转化率。在实际生产中,
常使反应中原料较易得到、价钱比较便宜的反应物的浓度超过反应所
需要的量,从而能提高较贵重原料的利用率。如煅烧黄铁矿制硫酸时, 采用通入过量空气的方法使黄铁矿充分燃烧。 2、逆流吸收原理。用98.3%的浓硫酸吸收时,液体和气体的流向是 相反的,液体自上而下,气体自下而上,使吸收更完全。在热交换中, 冷的和热的气体(或液体),都是采用逆流的方法进行热量交换的。
原理四、经济效益最高原理
LOGO
1、热能充分利用原理。硫酸生产过程中三个主要反应都是放
热的,可在制硫酸的工厂设置锅炉来加热水,用生成的水蒸气
发电。在接触氧化时用放出的热量来预热未起反应的空气。
2、循环原理。许多化学反应是可逆的,为了提高原料的利用
率,化学工业上一般把未起反应的原料分离出来再循环使用,
1、脱水性:可被浓硫酸脱水的物质一般为含 氢、氧元素的有机物,其中蔗糖、木屑、纸 屑和棉花等物质中的有机物,被脱水后生成 了黑色的炭(炭化)。 如C12H22O11===12C + 11H2O
2.吸水性: 就硫酸而言,吸水性有很多用处,比如 很多的气体都可以用浓硫酸来干燥。它是 良好的干燥剂。 这个与脱水性有很大的不 同:脱水性一般反应前没有水,而是H、O 元素以个数比2:1的形式形成水,从有机 物中出来。 除此之外浓硫酸还具有难挥发性(高沸点 )、酸性和稳定性。
如用接触法制取中把未反应的(不能排放到空气中)加以回收
再通入接触室中继续参加反应,以保证原料的充分利用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硫酸 硫酸盐和硫酸的工业制法
一、硫酸的工业制法——接触法
22、尾气的吸收,可用氨水吸收
2NH 3 + H 2O + SO 2 = (NH 4)2SO 3 NH 3 + H 2O + SO 2 = NH 4HSO 3
将生成物用稀硫酸处理后,可制得化肥(NH 4)2SO 4,并回收了SO 2。
3、生产简要流程
4、有关物质纯度、转化率、产率的计算
物质的纯度
不纯物中所含纯物质的质量
不纯物质的总质量
⨯100%
5、多步递进反应的关系式计算法
遇有多步递进反应(即前一步反应的产物就是后一步反应的反应物)的计算时,可用关系式法一步求解。
此种方法的关键,是根据各步反应的化学方程式,找出起始原料与最终产物之间的物质的量之比,列出相应的关系式,然后按常规方法求解。
二、浓硫酸的特性
硫酸的化学性质跟它的浓度有密切的关系。
稀硫酸具有酸类的通性(H +的性质),而浓硫酸中存在大量未电离的硫酸分子,因而浓硫酸除具有酸类的通性外,还具有吸水性、脱水性和强氧化性等特性。
1、浓硫酸的吸水性
浓硫酸具有吸收附着在物质表面或内部的湿存水和吸收结晶水的性能。
其原因是硫酸分子极易与水分子化合成一系列稳定的水合物:H 2SO 4·nH 2O (n = 1,2,4,6,8)。
同时放出大量的热。
这些水合物很稳定。
利用浓H 2SO 4的吸水性,可以做干燥剂。
浓H 2SO 4能干燥H 2、O 2、CO 等中性气体,也能干燥SO 2、Cl 2、CO 2、HCl 、HF 等酸性气体;但不能干燥NH 3等碱性气体,也不能干燥HBr 、HI 、H 2S 等有强还原性的气体。
2、浓硫酸的脱水性
浓硫酸能把纸张、木材、蔗糖等有机物中的氢、氧元素,按水分子里的氢、氧原子个数比(2∶ 1)脱出,使其碳化。
如: C 12H 22O 11 浓
H SO 24−→−−− 12C + 11H 2O (蔗糖)
3、浓硫酸的氧化性
硫酸分子中S 6
+有较强的得电子能力,故浓硫酸有较强的氧化性,加热时其氧化性增强。
(1)与金属的反应:在加热的条件下,绝大部分金属(除Pt 、Au 外)能被浓H 2SO 4氧化到高价态,同时H 2SO 4被还原成SO 2(一般情况下),反应中没有氢气生成。
Cu + 2H2SO4 (浓) CuSO4 + SO2↑ + 2H2O Hg + 2H2SO4 (浓) HgSO4 + SO2↑ + 2H2O
Zn + 2H2SO4 (浓) ZnSO4 + SO2↑ + 2H2O
(2)常温时浓H2SO4使铁、铝钝化。
加热时铁、铝可与浓硫酸剧烈反应。
2Fe + 6H2SO4 (浓) Fe2 (SO4)3 + 3SO2↑ + 6H2O 2Al + 6H2SO4 (浓) Al2(SO4)3 + 3SO2↑ + 6H2O (3)与非金属的反应
C + 2H2SO4 ( 浓) 2SO2↑ + CO2↑+ 2H2O S + 2H2SO4 (浓) 3SO2↑ + 2H2O
2P + 5H2SO4(浓) 2H3PO4 + 5SO2↑ + 2H2O
(4)与具有还原性的化合物反应
H2S + H2SO4 (浓) = S + SO2↑ + 2H2O 2HBr + H2SO4 (浓) = Br2↑ + SO2 ↑ + 2H2O
8HI + H2SO4(浓) = 4I2 + H2S ↑ + 4H2O
5、硫酸的性质与作用的联系
(1)硫酸的酸性实际上就是硫酸中H+的性质
Zn + H2SO4 (稀) = ZnSO4 + H2↑CuO + H2SO4 = CuSO4 + H2O 2NaOH + H2SO4 = Na2SO4 + H2O (2)硫酸可与弱酸盐反应,表现出硫酸的强酸性
FeS + H2SO4 (稀) = FeSO4 +H2S ↑Ca3(PO4)2 + 3H2SO4(浓) 3CaSO4↓ + 2H3PO4
2CH3COONa + H2SO4(浓) = Na2SO4 + 2CH3COOH
(3)硫酸的难挥发性(或称高沸点性)可以用硫酸与易挥发酸的盐反应来制取易挥发的酸,或者说可以用硫酸与低沸点酸的盐反应来制取低沸点的酸。
NaCl (固) + H2SO4 (浓) NaHSO4 + HCl ↑2NaCl(固) + H2SO4 (浓) Na2SO4 + 2HCl↑
NaNO3(固) + H2SO4 (浓) NaHSO4 + HNO3↑
在这些反应中是硫酸的难挥发性(即高沸点性)与酸性的共同表现。
(4)硫酸的稳定性:硫酸对热的稳定性强,可以用硫酸与不稳定酸的盐反应来制取不稳定酸。
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑Na2SO3 + H2SO4 = Na2SO4 + H2O + SO2↑
不稳定酸分解后可得到相应的气体。
(5)浓H2SO4的吸水性:在实验室用浓H2SO4做干燥剂;或把少量研细的胆矾放入浓H2SO4中,胆矾会逐渐变为白色。
这些都是浓H2SO4吸水性的表现。
(6)浓H2SO4的脱水性:浓H2SO4使蔗糖、纤维素等碳化,是浓H2SO4脱水性的表现。
(7)浓H2SO4与C、S、H2S、HBr、HI等反应时,只表现出氧化性。
(8)浓H2SO4与Cu、Ag等金属反应,或与NaBr、FeS等还原性化合物反应时,是浓H2SO4的氧化性与酸性的共同体现。
2NaBr + 3H2SO4 (浓) = 2NaHSO4 + Br2↑ + SO2↑ + 2H2O
2FeS + 6H2SO4(浓) = Fe2(SO4)3 + 2S ↓ + 3SO2↑ + 6H2O
三、硫酸根离子的检验
1、所用试剂:BaCl2溶液(或Ba(NO3)2溶液)和稀盐酸。
2、原理:Ba2+与SO42-结合生成的BaSO4,即不溶于水也不溶于稀HCl或稀HNO3。
3、操作方法:取样→加试剂→观察与描述现象→根据现象得出结论。
4、加入试剂的顺序,为了防止溶液中可能存在的Ag+、SO32-、CO32-等离子的干扰,应在待检液中先加入足量稀HCl,若无沉淀和气泡时,再加入BaCl2溶液,此时若出现白色沉淀,则可肯定原试液中必
定含有SO42-。
