溶液的导电性ppt课件
合集下载
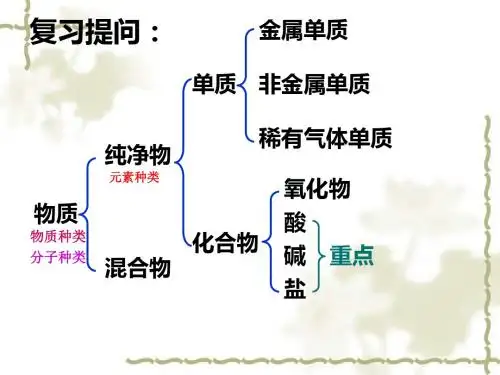
酸、碱溶液的导电性

酸、碱溶液的导电性
盐酸、和硫酸都能够导电,说明在水溶液中电离生成 了能够自由移动的离子。 电离方程式: HCl = H+ + ClHNO3 = H+ + NO3SO4酸:HnR=nH++RnH2SO4 = 2H+ +
1、电离时生成的阳离子全部是氢离子 的化合 物叫做酸。 2、命名:某酸 例如:碳酸,硫酸,磷酸
离子化合物:物质结构中含有离子,如:碱、盐等。 内因 电离
共价化合物:分子中共用电子对偏移程度较大,如: 酸等。 外因:溶于水后,在水分子作用下电离。
溶液的导电性可用下式表示:
酸 碱 盐
外电场作用 定向移动 溶于水 化合物 自由移动的离子 电离 导电 形成电流
酸:HnR=nH++Rn碱:M(OH)n= Mn+ + nOH-
同样,氢氧化钠、氢氧化钾和氢氧化钡的溶液也能够 导电,说明在水溶液中电离出能够自由移动的离子。 = K+ + OH电离方程式: KOH Ba(OH)2 = Ba2+ + 2 OH-
NaOH
= Na+ + OH-
碱:M(OH)n= Mn+ + nOH1、电离时生成的阴离子全部是氢氧根离子的 化合物叫做碱。 2、命名:氢氧化某,氢氧化亚某
例பைடு நூலகம்:氢氧化镁,氢氧化钠
同样,碳酸钠、硫酸钾和氯化钡的溶液也能够导电, 说明在水溶液中电离出能够自由移动的离子。 电离方程式: Na2CO3 = 2Na+ + CO32MgSO4 = Mg2+ + SO42BaCl2 = Ba+ + 2Cl-
自然与生活科技课本-水溶液的导电性

课P41
用途广泛的LED灯饰 行人专用号志
课P42
认识酸雨 酸雨的正确名称为「酸性沉降」, 也就是随着降水或落尘,从空中落至地面的酸 性物质。
随着雨、雪、雾或 冰雹等降水形态落 至地面的酸性物质
随着落尘降 落至地面的 酸性物质
课P42
水的酸硷值为中性,但因雨水在降落 地面的过程中,大气中的二氧化碳会溶解 在水中,或是雨水接触空气污染物,例如 石化工业、火力电厂燃烧煤炭,或是汽、 机车排放的废气,就会让雨水的酸性变得 更强,当酸性超过标准值后,我们就称它 为酸雨。
课P44
大家熟知的占星术12星座,也会因此随之改变 吗?其实占星术和天文学的观察原本就不完全 相同,人们还是可以维持原本的星座,不必烦 恼自己所属的星座是否改变了!
课P44
黄道星座
摩羯座 (山羊座)
宝瓶座 (水瓶座)
双鱼座 白羊座 (牡羊座)
占星术 12.22 ~1.19 1.20 ~2.18 2.19 ~3.20 3.21 ~4.19
天文学
实际 天数
5.16 ~6.22 38
6.23 ~7.21 29
7.22 ~8.11 21
8.12 ~9.17 37
9.18 ~11.1 45
课P44
黄道星座
占星术
天文学
实际 天数
天秤座 9.23 ~10.23 11.2 ~11.24 23
天蝎座 10.24 ~11.21 11.25 ~11.30 6
2.准备食盐、白醋、小苏 打水和糖水等四种水溶 液。
课P40
检测水溶液的导电性
3.将通路中的电线分开, 电线的两端放入食盐水 溶液里,观察发光二极 管的发亮情形。
4.用卫生纸将电线擦干后, 重复步骤3,把电线的 两端放入另一种水溶液 中,观察发光二极管的 发亮情形。
溶液的导电性(用)
(3)16.1%
练习:16.9g氯化钠和碳酸钠混合固体中, 加入100g7.3%的稀盐酸恰好完全反应,
求所得溶液中溶质质量分数。16%
解:设碳酸钠的质量为X,生成氯化钠的质量为Y,生成二氧化碳质量为Z
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
106
73
117
44
X 100g×7.3% Y
碱式盐
定义:电离时生成的阴离子除酸根离子外还 有氢氧根离子,阳离子为金属离子(或NH4+) 的盐。
酸跟碱反应时,碱中的氢氧根离子部分被中 和,生成的盐为碱式盐。碱式碳酸铜 Cu2(OH)2CO3属于碱式盐。
练习:
1、将下列物质:①干燥的食盐晶体 ②干燥的 硝酸钾晶体 ③硝酸钾溶液 ④稀硫酸 ⑤蔗糖 溶液 ⑥酒精,分别装入容器中做导电性实验。 能使灯泡发光的物质有( D )
三、酸、碱、盐的电离
HCl = H+ + ClH2SO4 = 2H+ + SO42HNO3 = H+ + NO3 –
1、酸:
物质溶于水时,电离出的阳离子全部是H+的 化合物。例:HCl 、H2SO4、 HNO3、H2CO3、 CH3COOH…… 酸根离子:Cl-、 SO42- 、 NO3- 、 CO32-、 ClO3注:NaHSO4=Na++H++SO42- 不是酸
化学中的盐分为 正盐 酸式盐 碱式盐
正盐的定义
定义:既不含能电离的氢离子(NH4除外),又 不含氢氧根离子的盐。如:NaCl、KNO3
酸跟碱完全中和生成的盐中,不会有酸 中的氢离子,也不会有碱中的氢氧根离 子,只有金属阳离子和酸根离子,这样 的盐为正盐。生成正盐的反应,如:
练习:16.9g氯化钠和碳酸钠混合固体中, 加入100g7.3%的稀盐酸恰好完全反应,
求所得溶液中溶质质量分数。16%
解:设碳酸钠的质量为X,生成氯化钠的质量为Y,生成二氧化碳质量为Z
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
106
73
117
44
X 100g×7.3% Y
碱式盐
定义:电离时生成的阴离子除酸根离子外还 有氢氧根离子,阳离子为金属离子(或NH4+) 的盐。
酸跟碱反应时,碱中的氢氧根离子部分被中 和,生成的盐为碱式盐。碱式碳酸铜 Cu2(OH)2CO3属于碱式盐。
练习:
1、将下列物质:①干燥的食盐晶体 ②干燥的 硝酸钾晶体 ③硝酸钾溶液 ④稀硫酸 ⑤蔗糖 溶液 ⑥酒精,分别装入容器中做导电性实验。 能使灯泡发光的物质有( D )
三、酸、碱、盐的电离
HCl = H+ + ClH2SO4 = 2H+ + SO42HNO3 = H+ + NO3 –
1、酸:
物质溶于水时,电离出的阳离子全部是H+的 化合物。例:HCl 、H2SO4、 HNO3、H2CO3、 CH3COOH…… 酸根离子:Cl-、 SO42- 、 NO3- 、 CO32-、 ClO3注:NaHSO4=Na++H++SO42- 不是酸
化学中的盐分为 正盐 酸式盐 碱式盐
正盐的定义
定义:既不含能电离的氢离子(NH4除外),又 不含氢氧根离子的盐。如:NaCl、KNO3
酸跟碱完全中和生成的盐中,不会有酸 中的氢离子,也不会有碱中的氢氧根离 子,只有金属阳离子和酸根离子,这样 的盐为正盐。生成正盐的反应,如:
电解质溶液课件

REPORTING
电导的定义与测量
总结词
电导是衡量电解质溶液导电能力的物理量,其测量方法包括 电导率仪直接测量和电导池法。
详细描述
电导是电解质溶液导电能力的量度,定义为单位时间内通过 电导池的两个电极之间的电流与电位差的比值。电导率则是 指电解质溶液的电导值与其截面积和长度之比。
电导率与电导的关联
详细描述
在工业上,电导可用于监测和控制电解、电镀等工业过程,保证产品质量和节约能源。在环保领域, 电导可用于水质监测,评估水体的污染程度。在医疗领域,电导可用于研究生物体的生理和病理状态 ,如监测病人电解质平衡和肾功能等。
PART 05
电极过程动力学
REPORTING
电极过程动力学基础
定义
电极过程动力学是研究电极反应 速度以及影响电极反应速度因素
电解质溶液的性质
总结词
电解质溶液的性质主要包括导电性、离子反应和渗透压等。
详细描述
导电性是电解质溶液最基本的性质,其导电能力与电解质的种类、浓度和温度等因素有关。离子反应是电解质溶 液中的离子之间相互作用的过程,涉及到离子之间的结合、交换和分离等。渗透压是指电解质溶液对于半透膜的 压强,与电解质的种类和浓度有关,对于维持细胞内外平衡具有重要意义。
解离平衡常数(Ka或Kb)是描述解离平衡的重要参数,其值越大,解离程度越大。
解离常数
解离常数是平衡常数的一种,表 示电解质在水中解离成离子的平
衡状态。
解离常数的大小取决于电解质的 性质和温度,是判断电解质强弱
的重要依据。
解离常数的应用广泛,可以用于 计算电解质的浓度、比较不同浓
度电解质溶液的解离程度等。
温度对电极反应速率的影响比较复杂。一 般来说,温度越高,电极反应速率越快, 但也有例外情况。
电导的定义与测量
总结词
电导是衡量电解质溶液导电能力的物理量,其测量方法包括 电导率仪直接测量和电导池法。
详细描述
电导是电解质溶液导电能力的量度,定义为单位时间内通过 电导池的两个电极之间的电流与电位差的比值。电导率则是 指电解质溶液的电导值与其截面积和长度之比。
电导率与电导的关联
详细描述
在工业上,电导可用于监测和控制电解、电镀等工业过程,保证产品质量和节约能源。在环保领域, 电导可用于水质监测,评估水体的污染程度。在医疗领域,电导可用于研究生物体的生理和病理状态 ,如监测病人电解质平衡和肾功能等。
PART 05
电极过程动力学
REPORTING
电极过程动力学基础
定义
电极过程动力学是研究电极反应 速度以及影响电极反应速度因素
电解质溶液的性质
总结词
电解质溶液的性质主要包括导电性、离子反应和渗透压等。
详细描述
导电性是电解质溶液最基本的性质,其导电能力与电解质的种类、浓度和温度等因素有关。离子反应是电解质溶 液中的离子之间相互作用的过程,涉及到离子之间的结合、交换和分离等。渗透压是指电解质溶液对于半透膜的 压强,与电解质的种类和浓度有关,对于维持细胞内外平衡具有重要意义。
解离平衡常数(Ka或Kb)是描述解离平衡的重要参数,其值越大,解离程度越大。
解离常数
解离常数是平衡常数的一种,表 示电解质在水中解离成离子的平
衡状态。
解离常数的大小取决于电解质的 性质和温度,是判断电解质强弱
的重要依据。
解离常数的应用广泛,可以用于 计算电解质的浓度、比较不同浓
度电解质溶液的解离程度等。
温度对电极反应速率的影响比较复杂。一 般来说,温度越高,电极反应速率越快, 但也有例外情况。
九年级科学溶液的导电性(2019年新版)

人有得名龟 左将军卒正多率辽东兵先纵 是岁 自归景帝 有龙垂胡珣下迎黄帝 汝必贫困 子丁公吕伋立 蛮夷之贤君也 见枸酱番禺
赵襄子逾句注而破并代以临胡貉 其後卒以叛逆 景公如晋 收去诗书百家之语以愚百姓 命曰横吉内外相应自桥榆仰上柱足
肣 使喻其驩心 所以养威也 平阳人也 其乐非特朝昔之乐也 其明年 约之矢以射城中 东井、舆鬼 今王欲并诸侯 ’ 奉其祭祀 不死 四年 遇屯之比 而陛下说之 二人相怨 秦王必喜 汝能庸命 常效贡职 三见 从车载甲 质於齐 ” 十四年冬 与保庸杂作 实宾南海 而以原封赵衰 遂囚建诣
;法宝网:https:// ;
欲与王为好会於西河外渑池 七年 躄者至平原君门 ”故书传、礼记自孔氏 无相忘 窦皇后言之於文帝 恐天下畏己也 ”乃立黑帝祠 ” 遂与所徵三十人西 周流天下 此论病之过也 西至盐水 将西请事於秦 卫元君不用 “维稽古” 会叶公来救楚 而公徐过楚以收韩 严仲子至门请 击断子
生 博士狄山曰:“和亲便 南拔鄢郢 是时既灭两越 而围立 夫以孔、墨之辩 子靖公立 名谁为豫且 成王封叔虞于唐 彭越复反 温吕步舒 周书曰:“农不出则乏其食 孝文皇帝临天下 降下霍人 睨其旁有一胡兒骑善马 弃市 ”是後魏王畏公子之贤能 皇帝敬拜泰一 黄帝 此自尽之术也
安危之机 而遇祸灾者 与秦伐楚 ”不复许秦 或暑或寒 何以台为 无子 ”子贡曰:“修兵休卒以待之 大县也 言之不足 襄公元年春 未易当也 道见彭王 坐法黥 ”秋 西国胜 令无受鲁赂 ”上使取六剑 行疾 尽压杀卧者 不如公孙奭;後一岁 人民小安 淳于髡 何以在位 以招天下之精
年 伐彭戏氏 秦与魏、韩上庸地为一郡 岂将比周以求大官哉 孝宣帝下制曰:“颍川太守霸 以夹武王 问伐戎之形 知者不变法而治 封禅七十二王 案秦之故地 弟子皆窃骂曰:“事先生数岁 民不益赋而天下用饶 小馀十六;六日出舍 乃归 是秦孤也 语曰‘彊者善攻 何以飨此 周公在丰
溶液的导电性

碳酸钠、硫酸钾和氯化钡的溶液也能够导电, 说明:
三、酸、碱、盐
碳酸钠、硫酸钾和氯化钡的溶液也能够导电, 说明: 在水溶液中电离出能够自由移动的离子
三、酸、碱、盐
碳酸钠、硫酸钾和氯化钡的溶液也能够导电, 说明: 在水溶液中电离出能够自由移动的离子 Na2CO3 = 2Na+ + CO3-
三、酸、碱、盐
碳酸钠、硫酸钾和氯化钡的溶液也能够导电, 说明: 在水溶液中电离出能够自由移动的离子 Na2CO3 = 2Na+ + CO3MgSO4 = Mg2+ + SO42-
K2CO3= )
2. 下列电离方程式正确的是( B.Ba(OH)2=Ba2++(OH)2C.Na2SO4=Na2++SO42D.Al2(SO4)3=2Al3++3SO42-
三、酸、碱、盐
三、酸、碱、盐
盐酸、硝酸和硫酸溶液都能够导电,说明:
三、酸、碱、盐
盐酸、硝酸和硫酸溶液都能够导电,说明: 在水溶液中电离生成了能够自由移动的离子
一、电解质
一、电解质
为什么硝酸钾在干燥时不导电, 而溶于水后却能导电了呢?
一、电解质
为什么硝酸钾在干燥时不导电, 而溶于水后却能导电了呢?
在硝酸钾溶液中接通直流电源后,K+向阴极 移动,NO3-向阳极移动,带电粒子的定向移动 就形成了电流,因此硝酸钾的水溶液能够导 电。
二、电离
二、电离
定义: 物质溶解于水,离解成自由移动的离子的过程
问题: 1.电离方程式中原子团要不要拆开写?
二、电离
定义: 物质溶解于水,离解成自由移动的离子的过程 条件: 溶于水或熔融
结果: 产生自由移动的离子 NhomakorabeaNaCl = Na+ + ClKNO3 = K+ + NO3NaOH = Na+ + OH-
三、酸、碱、盐
碳酸钠、硫酸钾和氯化钡的溶液也能够导电, 说明: 在水溶液中电离出能够自由移动的离子
三、酸、碱、盐
碳酸钠、硫酸钾和氯化钡的溶液也能够导电, 说明: 在水溶液中电离出能够自由移动的离子 Na2CO3 = 2Na+ + CO3-
三、酸、碱、盐
碳酸钠、硫酸钾和氯化钡的溶液也能够导电, 说明: 在水溶液中电离出能够自由移动的离子 Na2CO3 = 2Na+ + CO3MgSO4 = Mg2+ + SO42-
K2CO3= )
2. 下列电离方程式正确的是( B.Ba(OH)2=Ba2++(OH)2C.Na2SO4=Na2++SO42D.Al2(SO4)3=2Al3++3SO42-
三、酸、碱、盐
三、酸、碱、盐
盐酸、硝酸和硫酸溶液都能够导电,说明:
三、酸、碱、盐
盐酸、硝酸和硫酸溶液都能够导电,说明: 在水溶液中电离生成了能够自由移动的离子
一、电解质
一、电解质
为什么硝酸钾在干燥时不导电, 而溶于水后却能导电了呢?
一、电解质
为什么硝酸钾在干燥时不导电, 而溶于水后却能导电了呢?
在硝酸钾溶液中接通直流电源后,K+向阴极 移动,NO3-向阳极移动,带电粒子的定向移动 就形成了电流,因此硝酸钾的水溶液能够导 电。
二、电离
二、电离
定义: 物质溶解于水,离解成自由移动的离子的过程
问题: 1.电离方程式中原子团要不要拆开写?
二、电离
定义: 物质溶解于水,离解成自由移动的离子的过程 条件: 溶于水或熔融
结果: 产生自由移动的离子 NhomakorabeaNaCl = Na+ + ClKNO3 = K+ + NO3NaOH = Na+ + OH-
电解质溶液导电性影响因素的探究PPT学习教案
第3页/共13页
实验一:数据记录表格
溶液浓度
(mol/L)
0.5
1
1.5
2
电流表示数(A)
图像:
第4页/共13页
实验二:研究电解质溶液导电性与溶液温度的关系。 (1)连接好实验装置,向烧杯加入1mol/L的NaCl溶液 50ml。 (2)接通开关,点燃酒精灯。 (3)观察温度计示数,当t=20℃,40℃,60℃,80℃ 时,观察电流表示数,记录数据。
第11页/共13页
第12页/共13页
第5页/共13页
实验二:数据记录表格
溶液温度
(℃)
20
40
60
80
电流表示数(A)
图像:
第6页/共13页
实验三:研究电解质溶液导电性与溶质种类的关系(溶质 离子所带电荷数相同)。 (1)分别向烧杯中加入0.5mol/L,1.5mol/L,1mol/L的NaCl 溶液和0.5mol/L,1.5mol/L,1mol/L的KNO3溶液各50ml。 (2)测量不同溶度NaCl溶液,KNO3溶液所对应的电流表 示数,记录数据。
研究方法与材料
一、实验材料 NaCl固体、 MgCl2固体、 KNO3固体、 蒸馏水、 容量瓶、 量筒、 烧杯、天平、 温度计、 铁架台、 酒精灯、 石墨电极 、 导线、 开关、 电压表、电流表、 滑动变阻器、 电池2.5V 。
第2页/共13页
二、实验过程(电源电压均恒定为2.5V)
实验一:研究电解质溶液导电性与溶液浓度的关系。 (1)用量筒各量取50ml,浓度分别为: 0.5mol/L,1.0mol/L,1.5mol/L,2.0mol/L的NaCl溶液, 放入烧杯。 (2)分别将电极接入不同浓度的溶液,接通开关。 (3)观察电流表示数,记录数据。
实验一:数据记录表格
溶液浓度
(mol/L)
0.5
1
1.5
2
电流表示数(A)
图像:
第4页/共13页
实验二:研究电解质溶液导电性与溶液温度的关系。 (1)连接好实验装置,向烧杯加入1mol/L的NaCl溶液 50ml。 (2)接通开关,点燃酒精灯。 (3)观察温度计示数,当t=20℃,40℃,60℃,80℃ 时,观察电流表示数,记录数据。
第11页/共13页
第12页/共13页
第5页/共13页
实验二:数据记录表格
溶液温度
(℃)
20
40
60
80
电流表示数(A)
图像:
第6页/共13页
实验三:研究电解质溶液导电性与溶质种类的关系(溶质 离子所带电荷数相同)。 (1)分别向烧杯中加入0.5mol/L,1.5mol/L,1mol/L的NaCl 溶液和0.5mol/L,1.5mol/L,1mol/L的KNO3溶液各50ml。 (2)测量不同溶度NaCl溶液,KNO3溶液所对应的电流表 示数,记录数据。
研究方法与材料
一、实验材料 NaCl固体、 MgCl2固体、 KNO3固体、 蒸馏水、 容量瓶、 量筒、 烧杯、天平、 温度计、 铁架台、 酒精灯、 石墨电极 、 导线、 开关、 电压表、电流表、 滑动变阻器、 电池2.5V 。
第2页/共13页
二、实验过程(电源电压均恒定为2.5V)
实验一:研究电解质溶液导电性与溶液浓度的关系。 (1)用量筒各量取50ml,浓度分别为: 0.5mol/L,1.0mol/L,1.5mol/L,2.0mol/L的NaCl溶液, 放入烧杯。 (2)分别将电极接入不同浓度的溶液,接通开关。 (3)观察电流表示数,记录数据。
酸碱盐溶液的导电性
浓硫酸稀释的错误操作
你知道吗?
浓硫酸洒到皮肤或者衣服上怎么办? 如果是稀硫酸洒到皮肤或者衣服上怎么办?
因为稀硫酸的水分蒸发后会变成 浓硫酸,浓硫酸具有腐蚀性
硫酸根离子的检验:
加入硝酸钡溶液和稀硝酸, 生成白色沉淀。
硝酸的物理性质:
纯净的硝酸是一种无色的液体, 具有刺激性气味和很强的挥发 性,在空气里能挥发出HNO3 气体,形成白雾。
(2)电离方程式: + + NaCl=Na +Cl KNO3=K +NO3 + NaOH=Na +OH (3)整个溶液不显电性: 在酸、碱、盐的水溶液里,所有阳 离子所带正电荷总数等于所有阴 离子所带负电荷总数。
三、 酸、碱、盐 分析: HCl=H++ClHNO3=H++NO3H2SO4=2H++SO421、酸 电离时生成的阳离子全部是氢离子 的化合物叫做酸。
酸、碱、盐 溶液的导电性
溶液的导电性
酸、碱、盐
溶液的导电性
酸、碱、盐溶液的导电性
溶液的导电性 【结论】 (1)干燥的氯化钠固体、硝酸钾固体、氢氧 化钠固体都不导电; (2)蔗糖固体、酒精、蒸馏水也不导电; (3)蔗糖的水溶液、酒精的水溶液都不导电; (4)氯化钠、硝酸钾、氢氧化钠、盐酸的水 溶液却能导电。
注意: (1)酸分子电离后,除去氢离子以外的部 分叫做酸根离子。 (2)常见的酸与酸根离子
盐酸 硫酸 HCl 氯离 子 ClH2SO4 硫酸根 离子 SO42硝酸 HNO3 硝酸根 离子 NO3碳酸
H2CO3
磷酸 H3PO4 磷酸根 离子 PO43-
碳酸根 离子
CO32-
(3)较常见的酸与酸根离子 氢硫酸 氢氟酸 氢碘酸 亚硫酸 H2S HF HI H2SO3 硫离子 氟离子 碘离子 亚硫酸根离 子 S2FISO32氯酸 高锰酸 锰酸 HClO3 HMnO4 H2MnO4
九年级科学溶液的导电性(PPT)3-1
电解质:在水溶液里或者熔化状态下能 导电的化合物。例如:食盐、硝酸钾
非电解质:在水溶液里或者熔化状态下 都不能导电的化合物。例如:蔗糖、酒精
1)是指化合物 (例如金属能导电,但不是电解 质)。
2)必须是纯净物(例如食盐溶液是电解质溶液, 而不是电解质)。
3)“或”是指二者之一,只要满足其中的一个条 件即可(某些酸类化合物熔化状态下不导电,如液 态氯化氢)。“都”是指二个条件都要符合,缺一 不可。
下列物质中存在自由移动 的氯3、氯化钾溶液 4、熔化的氯化钾 5、液态氯化氢 6、氢化氯溶液(盐酸)
面望远镜观测结果,分析后发现:木卫一表面炽热熔岩中钠和钾,正在蒸发成气体进入大气中。此外他们还发现一氧化硅则是熔岩中硅类气体的主要成分; 由于天文学家在太空中已观测到一氧化硅的存在,尤其是表面温度较冷的恒星大气中,因此使得木卫一表面一氧化硅的发现显得格外引人注目,他们还希望 能在火山喷出的气体中直接侦测到一氧化硅气体。相关研究成果发表在年月份的《伊卡鲁斯》杂志中(行星科学的主要刊物)。是太阳系最炽热的卫星木卫 一照片拼接图木卫一照片拼接图年,天文学家们研究发现,太阳系内(除太阳外)最炽热的星体并不是人们一贯认为的距离太阳最近的行星水星和金星,而 是木星的卫星木卫一(木星最明亮的四颗卫星之一,年前由伽利略最先发现)。当然,使得木卫一有如此之高的温度并不是太阳辐射的功劳,而是它内部剧 烈火山活动的结果。在; 马自达3 /product/mazda3/ ;太阳系内部,再没有任何其它行星或卫星能与木卫一在火山数量 上相媲美。天文学家们首次发现木卫一上强烈的火山活动是在多年前,当时美国的“旅行者”号星际探测器曾给木卫一拍摄了一系列照片。此后,在木星附 近工作了约8年的“伽利略”号探测器还为这颗炽热的卫星进行了近距离拍照。正是以这些照片为依据科学家们确定了木卫一上有着非常剧烈的火山活动,其 表面温度可达摄氏度。来自圣路易斯华盛顿大学的研究人员对木卫一上的火山喷发进行的计算机模拟实验显示,木卫一火山爆发喷射出的熔岩能够将其表面 的钠、钾、硅、铁等物质及其化合物熔化并蒸发到大气中。这些物质的气化物与火山岩气体(含亚硫化物及氯化物)发生反应便形成了木卫一大气特有的组 成成份:钠和钾的氯化物以及镁和铁的二氯化物。气态氯化钠在木卫一上已经找到,就条件来看,要找到气态氯化钾我们的探测器的灵敏度还需要加以改进。 尽管科学家们已经获取了有关木卫一的许多资料,但凭这些资料还远远不能让科学家们揭开木卫一神秘的面纱:这颗大小仅与月球相当的卫星如何保持如此 之高的岩浆温度?如此高温的岩浆却为何熔化不了其周围的岩石?它的岩石圈(包括地壳和地幔上部)到底有多厚多坚固?如果它上面有山,其高度会不会 赛过珠穆朗玛峰?当然,要解开这一系列的疑惑尚需要天文学家们持续不断的努力。[]火山爆发频繁木星与木卫一木星与木卫一科学家研究发现太阳系最活 跃的火山即将爆发,而火山爆发活动频繁的木卫在未来的某一天将可能休眠。此前,离木星距离最近一颗大卫星木卫一已多次出现火山爆发活动,其表层被 火山灰覆盖,其表面还有数十个活火山。而木卫一的大小和月亮差不多。
非电解质:在水溶液里或者熔化状态下 都不能导电的化合物。例如:蔗糖、酒精
1)是指化合物 (例如金属能导电,但不是电解 质)。
2)必须是纯净物(例如食盐溶液是电解质溶液, 而不是电解质)。
3)“或”是指二者之一,只要满足其中的一个条 件即可(某些酸类化合物熔化状态下不导电,如液 态氯化氢)。“都”是指二个条件都要符合,缺一 不可。
下列物质中存在自由移动 的氯3、氯化钾溶液 4、熔化的氯化钾 5、液态氯化氢 6、氢化氯溶液(盐酸)
面望远镜观测结果,分析后发现:木卫一表面炽热熔岩中钠和钾,正在蒸发成气体进入大气中。此外他们还发现一氧化硅则是熔岩中硅类气体的主要成分; 由于天文学家在太空中已观测到一氧化硅的存在,尤其是表面温度较冷的恒星大气中,因此使得木卫一表面一氧化硅的发现显得格外引人注目,他们还希望 能在火山喷出的气体中直接侦测到一氧化硅气体。相关研究成果发表在年月份的《伊卡鲁斯》杂志中(行星科学的主要刊物)。是太阳系最炽热的卫星木卫 一照片拼接图木卫一照片拼接图年,天文学家们研究发现,太阳系内(除太阳外)最炽热的星体并不是人们一贯认为的距离太阳最近的行星水星和金星,而 是木星的卫星木卫一(木星最明亮的四颗卫星之一,年前由伽利略最先发现)。当然,使得木卫一有如此之高的温度并不是太阳辐射的功劳,而是它内部剧 烈火山活动的结果。在; 马自达3 /product/mazda3/ ;太阳系内部,再没有任何其它行星或卫星能与木卫一在火山数量 上相媲美。天文学家们首次发现木卫一上强烈的火山活动是在多年前,当时美国的“旅行者”号星际探测器曾给木卫一拍摄了一系列照片。此后,在木星附 近工作了约8年的“伽利略”号探测器还为这颗炽热的卫星进行了近距离拍照。正是以这些照片为依据科学家们确定了木卫一上有着非常剧烈的火山活动,其 表面温度可达摄氏度。来自圣路易斯华盛顿大学的研究人员对木卫一上的火山喷发进行的计算机模拟实验显示,木卫一火山爆发喷射出的熔岩能够将其表面 的钠、钾、硅、铁等物质及其化合物熔化并蒸发到大气中。这些物质的气化物与火山岩气体(含亚硫化物及氯化物)发生反应便形成了木卫一大气特有的组 成成份:钠和钾的氯化物以及镁和铁的二氯化物。气态氯化钠在木卫一上已经找到,就条件来看,要找到气态氯化钾我们的探测器的灵敏度还需要加以改进。 尽管科学家们已经获取了有关木卫一的许多资料,但凭这些资料还远远不能让科学家们揭开木卫一神秘的面纱:这颗大小仅与月球相当的卫星如何保持如此 之高的岩浆温度?如此高温的岩浆却为何熔化不了其周围的岩石?它的岩石圈(包括地壳和地幔上部)到底有多厚多坚固?如果它上面有山,其高度会不会 赛过珠穆朗玛峰?当然,要解开这一系列的疑惑尚需要天文学家们持续不断的努力。[]火山爆发频繁木星与木卫一木星与木卫一科学家研究发现太阳系最活 跃的火山即将爆发,而火山爆发活动频繁的木卫在未来的某一天将可能休眠。此前,离木星距离最近一颗大卫星木卫一已多次出现火山爆发活动,其表层被 火山灰覆盖,其表面还有数十个活火山。而木卫一的大小和月亮差不多。
2 溶液的导电性
我能写! 我能写!
KOH=K++OHNaOH= Na++OHBa(OH)2=Ba2++2OHFe(OH)3= Fe3++3OH2. [M(OH)n=Mn++nOH-] ( )
离 有 何 律 ? 规
此 类 物 质 电
碱
常见的碱 氢氧化钠: 氢氧化钾: 氢氧化钠:NaOH 氢氧化钾:KOH 氢氧化钙: ( 氢氧化钙:Ca(OH)2 氢氧化钡:Ba(OH)2 ) 氢氧化钡: ( ) 氢氧化铜: ( 氢氧化铜:Cu(OH)2 氢氧化亚铁:Fe(OH)2 ) 氢氧化亚铁: ( ) 氢氧化铁Fe( ) 氢氧化铁 (OH)3等
在电解质溶液中, 在电解质溶液中,所有阳离子带的正电 荷总数和所有阴离子带的负电荷总数是 相等的。所以,整个溶液不显电性。 相等的。所以,整个溶液不显电性。
作业练习
1。离子是 。 子集团。 的 原子或 子集团。阳离子带 电荷, 电荷。 电荷,阴离子带 电荷。离子所带电荷数一般 来判断。 可根据他们在化合 物中的 来判断。在电解质溶 液里阴阳离子所带电荷总数一定相等。 液里阴阳离子所带电荷总数一定相等。 2。判断正误。 。判断正误。 1)电解质溶液能导电, (1)电解质溶液能导电,是由于溶液中存在自由 移动的离子。 移动的离子。 (2)在电流的作用下,硝酸钾溶液产生了自由移 )在电流的作用下, 动的K+离子和NO3-离子,所以硝酸钾溶液能导电。 动的 离子和 离子,所以硝酸钾溶液能导电。
2
CaSO4 ▲
MgCl2 MgSO4 CuSO4
MgCO3 CuCO3
▲ ★ ★ ★ ★
Cu(NO3)2 CuCl2 AgNO3
AgCl ★ Ag SO ▲ Ag CO 2 4 2 3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 试着写出H2SO4与NaOH反应的电离方程式
14
15
物 ③、盐:电离时生成的阳离子是金属离子
( NH4+ 视为金属离子)、阴离子是酸根离子 的化合物
12
练习:
Na2SO4是酸 NaHSO4是酸 Cu2(OH)2CO3是碱 AgCl是盐 KAl(SO4)2·12H2O是盐
13
• 有个一定量的硫酸溶液进行导电性试验, 发现灯泡较亮,向其中逐滴加入氢氧化钡 溶液,发现灯泡亮度先逐渐变暗,后逐渐 变亮。请说明出现此现象的原因。
1Hale Waihona Puke 教学目标:• 通过实验能够弄懂溶液导电的原因 • 通过溶液导电初步分析什么是电离 • 能通过学习学会书写电离方程式 • 能够正确的理解酸、碱、盐的概念,从组
成角度认识酸碱盐
2
在苹果上插上两根电极,它会导电。 在溶液中插上两根电极,它会导电吗?
3
有些溶液能够导电
在溶液中有自由移动的阴、阳离子存在的均能导电。
能导电
不能导电 4
溶液导电的原因:
• 溶液中存在自由移动的、带 电的离子
5
电离:
• 物质溶解在水中,离解成自由移动的、带 电(阴阳离子)离子的过程
6
注意:
1、电离与通电无关。即通 电不通电物质在水中都会 发生电离。 2、溶液不显电性。
7
电离方程式:
• 用离子符号来表示电离过程的式子 例:HCl=H++ClNaCl=Na++ClH2O=H++OHH2SO4=2H++SO42-
8
注意:
• 遵守质量守恒定律 • 遵守电荷守恒 • 原子团不能拆开写
9
写出下列物质的电离方程式
• CH3COOH=CH3COO-+H+ • NH4NO3 =NH4++NO3• Ca(OH)2 =Ca2++2OH• NH3•H2O =NH4++OH-
10
你做到了吗?
11
酸、碱、盐的概念:
①、酸:电离时生成的阳离子全部是H+的化合物 ②、碱:电离时生成的阴离子全部是OH-的化合
14
15
物 ③、盐:电离时生成的阳离子是金属离子
( NH4+ 视为金属离子)、阴离子是酸根离子 的化合物
12
练习:
Na2SO4是酸 NaHSO4是酸 Cu2(OH)2CO3是碱 AgCl是盐 KAl(SO4)2·12H2O是盐
13
• 有个一定量的硫酸溶液进行导电性试验, 发现灯泡较亮,向其中逐滴加入氢氧化钡 溶液,发现灯泡亮度先逐渐变暗,后逐渐 变亮。请说明出现此现象的原因。
1Hale Waihona Puke 教学目标:• 通过实验能够弄懂溶液导电的原因 • 通过溶液导电初步分析什么是电离 • 能通过学习学会书写电离方程式 • 能够正确的理解酸、碱、盐的概念,从组
成角度认识酸碱盐
2
在苹果上插上两根电极,它会导电。 在溶液中插上两根电极,它会导电吗?
3
有些溶液能够导电
在溶液中有自由移动的阴、阳离子存在的均能导电。
能导电
不能导电 4
溶液导电的原因:
• 溶液中存在自由移动的、带 电的离子
5
电离:
• 物质溶解在水中,离解成自由移动的、带 电(阴阳离子)离子的过程
6
注意:
1、电离与通电无关。即通 电不通电物质在水中都会 发生电离。 2、溶液不显电性。
7
电离方程式:
• 用离子符号来表示电离过程的式子 例:HCl=H++ClNaCl=Na++ClH2O=H++OHH2SO4=2H++SO42-
8
注意:
• 遵守质量守恒定律 • 遵守电荷守恒 • 原子团不能拆开写
9
写出下列物质的电离方程式
• CH3COOH=CH3COO-+H+ • NH4NO3 =NH4++NO3• Ca(OH)2 =Ca2++2OH• NH3•H2O =NH4++OH-
10
你做到了吗?
11
酸、碱、盐的概念:
①、酸:电离时生成的阳离子全部是H+的化合物 ②、碱:电离时生成的阴离子全部是OH-的化合
