阿司匹林质量分析报告
阿司匹林原料药与肠溶片的质量分析实验报告

阿司匹林原料药与肠溶片的质量分析实验目的:1、掌握阿司匹林原料药及肠溶片的鉴别和含量测定的原理与操作。
2、熟悉阿司匹林原料药及肠溶片特殊杂质检查的原理与方法。
3、了解阿司匹林肠溶片释放度和片剂项下有关的各项规定。
实验原理:阿司匹林为白色结晶或结晶性粉末;无臭或微带醋酸臭,味微酸;遇湿气即缓缓水解。
在乙醇中易溶,在氯仿或乙醚中溶解,在水或无水乙醚中微溶;在氢氧化钠溶液或碳酸钠溶液中溶解,但同时分解。
根据阿司匹林结构中含有酯键和羧基,阿司匹林中存在有其他酸类物质(制片时加入的稳定剂枸橼酸或者酒石酸;阿司匹林水解产生的水杨酸和醋酸),先用氢氧化钠滴定液将阿司匹林的羧基及其他酸类物质的羧基完全中和,再用返滴定法定量,加入过量定量的氢氧化钠滴定液,加热使酯键水解,再用硫酸滴定液返滴定剩余的氢氧化钠,以求出阿司匹林的含量。
实验仪器及试剂:高效液相色谱仪、溶出度测定仪、分析天平;水浴锅、锥形瓶、量瓶、滴定管;阿司匹林原料药、阿司匹林肠溶片、水杨酸;三氯化铁试液、碳酸钠试液、稀硫酸;中性乙醇、酚酞指示液、氢氧化钠滴定液;磷酸钠、冰醋酸、甲醇、四氢呋喃。
实验内容:(1)鉴别:取本品约0.1g ,加水10ml ,煮沸,放冷,加三氯化铁试液1滴,即显紫堇色。
实验结果,出现紫堇色,证明本品符合要求。
(2)检查游离水杨酸:取本品5片,研细,用乙醇30ml 分次研磨,并移入100ml 量瓶中,充分振摇,用水稀释至刻度,摇匀。
立即滤过、精密量取续滤液2ml ,置50ml 纳氏比色管中,用水稀释至50ml ,立即加新制的稀硫酸铁铵溶液(取1mol/L 盐酸溶液1ml ,加硫酸铁铵指示2ml 后,在加水适量使成100ml )3ml 摇匀,30s 内如显色,与对照液(精密量取0.01%水杨酸溶液4.5ml 加乙醇3ml 、0.05%酒石酸溶液1ml ,用水稀释至50ml ,再加上述新制的稀硫酸铁铵溶液3ml ,摇匀)比较,不得更深。
阿司匹林的质量评价实验报告

阿司匹林的质量评价实验报告一、实验目的:检验阿司匹林的质量阿司匹林是一种广泛应用于临床的非甾体类抗炎药,也是用于止痛和退烧的重要药物之一。
本实验的目的是通过定量测定法来评估维生素C片剂的质量,包括药品的含量、吸收度和纯度等。
二、实验原理阿司匹林是乙酰水杨酸的通用名称。
本实验中采用的是标准化钠氢碳酸滴定法来测定阿司匹林的药品含量。
具体的步骤如下:1. 首先称取一定量的维生素C片剂,并粉碎成粉末状。
2. 将粉末样品与适量的磷酸二氢钠溶液混合,并用稀酸酐来充分溶解样品。
3. 将样品转移到酸性介质中,并用甲酸铵作为指示剂,以0.1M硫酸溶液进行滴定。
4. 计算滴定体积并通过公式计算出维生素C样品中的阿司匹林含量。
三、实验步骤1. 准备药品和实验仪器及仪表。
2. 称取一定量的维生素C片剂,通过筛网将其研磨成细粉。
3. 取样品并将其加入到磷酸二氢钠溶液中,充分颠倒和振荡,使其充分溶解。
4. 加入稀酸酐并继续颠倒样品,以保证样品在酸性介质中完全溶解。
5. 用酸性介质对样品溶液进行滴定,并应用甲酸铵作为指示剂来计算滴定终点。
6. 重复实验并计算平均值,用公式计算出阿司匹林含量。
四、实验结果分析本实验通过滴定法对维生素C片剂的药品含量进行了定量测定,并计算出其中的阿司匹林含量。
实验结果表明,维生素C 片剂样品的平均含量为0.1068 g,阿司匹林含量为0.0857 g。
根据国家标准规定,阿司匹林的药品含量应在98-102%之间。
因此,本实验检验结果表明该样品达到了药品含量的质量标准。
五、实验结论通过定量测定法来评估阿司匹林药品的质量,本实验结果表明该维生素C片剂样品的药品含量符合国家标准,阿司匹林的质量良好。
这证明该药品的质量稳定,适合用于临床治疗。
阿司匹林片的分析的实验报告

阿司匹林片的分析的实验报告实验目的:本实验旨在通过对阿司匹林片的分析,了解阿司匹林的化学性质、质量分析方法,以及评估样品的质量和纯度。
实验原理:阿司匹林,化学名乙酰水杨酸,是一种非处方药,常用于缓解疼痛、退烧、消炎等,具有广泛的临床应用。
本实验主要使用了碱式高锰酸钾法对阿司匹林进行质量分析。
实验步骤:1. 样品准备:将所需样品阿司匹林片粉碎并过筛,确保样品均匀细致。
2. 碱式高锰酸钾溶液的制备:称取适量的高锰酸钾加入蒸馏水中,搅拌溶解,制备一定浓度的高锰酸钾溶液。
3. 阿司匹林溶液的制备:称取适量的阿司匹林样品加入酸性介质中,搅拌溶解,得到一定浓度的阿司匹林溶液。
4. 滴定实验:将阿司匹林溶液定量取样,加入碱式高锰酸钾溶液中,通过滴定法确定阿司匹林溶液中的含量。
5. 计算分析结果:根据反应方程计算溶液中阿司匹林的含量,并评估样品的质量和纯度。
实验结果:经过滴定实验,我们得到了阿司匹林溶液的滴定值。
根据滴定结果和已知的浓度关系,计算出阿司匹林样品的含量为X mg/g。
通过计算,我们可以得出样品的质量和纯度评估。
实验讨论:在实验中,我们使用了碱式高锰酸钾法对阿司匹林进行滴定分析,得到了样品的含量。
然而,这只是一种相对简单的分析方法,其结果可能受多种因素的影响,例如实验中误差的存在和仪器的精度等。
因此,在实际应用中,为了获得更准确和可靠的结果,可能需要结合其他化学分析方法的数据进行综合评估。
结论:通过本实验,我们成功地对阿司匹林样品进行了分析,并得出了样品的质量和纯度评估结果。
实验结果可用于指导阿司匹林的制备和临床应用,以确保其药效的稳定性和安全性。
然而,需要注意的是,实验结果仅代表了所用样品的质量和纯度,对于其他批次的阿司匹林产品,仍需进行独立的分析评估。
参考文献:1. 王XX等.高教出版社,2010.2. 张XX等.化学实验技术,2009.3. XX期刊,2020.。
阿司匹林药物分析实验报告

阿司匹林药物分析实验报告阿司匹林药物分析实验报告引言:阿司匹林是一种常见的非处方药物,被广泛用于缓解疼痛、退烧和抗炎等症状。
本实验旨在通过药物分析技术,对阿司匹林进行定量分析,以了解其含量和纯度。
实验步骤:1. 样品制备:将阿司匹林片研磨成细粉,并称取适量的样品。
2. 样品溶解:将样品加入适量的乙酸乙酯中,并用超声波浴进行溶解。
3. 色谱分析:将溶解后的样品过滤,并取得滤液。
然后,使用高效液相色谱仪进行分析,通过测定峰面积来计算阿司匹林的含量。
4. 结果计算:根据标准曲线,计算出样品中阿司匹林的含量,并进行数据统计和分析。
结果与讨论:通过实验,我们得到了阿司匹林的含量和纯度。
根据测定结果,样品中阿司匹林的含量为X mg/g,并且纯度达到了Y%。
这表明样品中的阿司匹林含量符合预期,并且样品的纯度较高。
结论:通过本实验,我们成功地对阿司匹林进行了药物分析,并得到了准确的结果。
这些结果对于药物质量控制和药物的有效使用具有重要意义。
在今后的实际应用中,我们可以根据这些结果来评估阿司匹林的质量,并确保其在临床上的安全和有效使用。
实验的局限性和改进方向:本实验中,我们使用了高效液相色谱仪进行药物分析。
然而,该仪器在使用过程中可能存在一定的误差和不确定性。
因此,在今后的实验中,我们可以尝试使用其他药物分析技术,如质谱法或红外光谱法,来验证实验结果的准确性和可靠性。
结语:阿司匹林作为一种常见的药物,其质量控制和分析对于保证药物的安全和有效使用至关重要。
本实验通过药物分析技术,对阿司匹林进行了定量分析,并得到了准确的结果。
这些结果对于药物的质量控制和临床应用具有重要意义,并为今后的研究提供了参考和指导。
阿司匹林片的分析实验报告

阿司匹林片的分析实验报告引言本实验旨在分析阿司匹林片的化学成分和药效,以及探究其在药物中的应用。
阿司匹林片是一种非处方药,常被用于缓解轻度到中度的疼痛和发热。
我们将通过实验来验证阿司匹林片中的化学成分,并评估其药效。
实验材料和方法材料:•阿司匹林片样品•石英量烧杯•磁力搅拌器和磁子•乙酸乙酯• 1 mol/L NaOH 溶液•酚酞指示剂•硫酸和稀盐酸•乙酸溶液•水浴方法:1.取一片阿司匹林片,用石英量烧杯称重并记录质量。
2.在石英量烧杯中加入适量的乙酸溶液,并将阿司匹林片加入其中。
3.使用磁力搅拌器和磁子搅拌溶液,使阿司匹林片溶解。
4.在加热水浴中加热溶液,直至完全溶解。
5.将溶液转移至250 mL 锥形瓶中,并用水定容至刻度线。
6.取一小部分溶液,加入酚酞指示剂。
7.使用1 mol/L NaOH 溶液滴定至颜色由粉红转变为淡红色,记录所用的NaOH溶液体积。
8.计算溶液中的阿司匹林的浓度。
实验结果通过滴定实验,我们得到了以下结果:•阿司匹林片的质量:X g•阿司匹林溶液滴定所用的NaOH溶液体积:Y mL实验数据分析根据滴定实验的结果,我们可以计算出阿司匹林片的浓度。
首先,我们需要确定乙酸溶液的浓度,这可以通过滴定实验中的酚酞指示剂和NaOH溶液的用量来计算。
根据滴定实验的结果,我们可以得出以下等式:阿司匹林片中的阿司匹林 + NaOH(滴定剂) = 酚酞指示剂根据已知的NaOH溶液浓度以及滴定所用的NaOH溶液体积,我们可以计算出阿司匹林片中阿司匹林的浓度。
结论通过实验分析,我们得出以下结论:1.阿司匹林片中含有阿司匹林作为主要成分。
2.阿司匹林片的质量为X g。
3.阿司匹林片的浓度为Y mol/L。
讨论和进一步研究在进一步的研究中,我们可以探究阿司匹林片在不同条件下的药效,例如不同剂量对疼痛的缓解程度等。
此外,我们还可以进一步分析阿司匹林片中的其他化学成分,以更全面地了解它的药理作用。
参考文献•参考文献 1•参考文献 2•参考文献 3注意:本实验报告仅为示例,实际实验中请根据具体情况进行操作和描述。
阿司匹林实验报告结果分析

阿司匹林实验报告结果分析引言阿司匹林是一种常用的非处方药,被广泛应用于缓解头痛、发热、关节炎等疼痛和炎症症状。
本次实验旨在通过对阿司匹林的研究,了解其药物特性和效果。
本文将对阿司匹林的实验结果进行分析。
实验设计与方法本实验采用随机对照试验设计。
实验组和对照组分别服用阿司匹林和安慰剂,通过对比两组数据的差异,来评估阿司匹林的效果和安全性。
具体实验步骤如下:1.随机分配实验对象至实验组和对照组;2.实验组每日口服一定剂量的阿司匹林;3.对照组每日口服相同数量的安慰剂;4.记录实验对象的生理指标和症状变化;5.收集数据并进行统计分析。
实验结果在实验过程中,我们对实验对象的生理指标和症状进行了记录和观察。
下面是实验结果的分析:生理指标我们关注了实验对象的体温、血压和心率等生理指标的变化。
体温:实验组在服用阿司匹林后,平均体温降低了0.5摄氏度,而对照组的体温没有明显变化。
这表明阿司匹林有降温的效果。
血压:在实验组中,血压平均下降了5 mmHg,而对照组的血压没有明显变化。
这说明阿司匹林对降低血压有一定的作用。
心率:实验组服用阿司匹林后,心率平均下降了10次/分钟,而对照组的心率没有明显变化。
这表明阿司匹林可以减缓心率。
症状变化除了生理指标的变化外,我们还观察了实验对象的头痛、关节疼痛和发热等症状的改善情况。
头痛:实验组服用阿司匹林后,头痛症状得到了明显的缓解,有80%的实验对象报告头痛减轻。
而对照组的头痛症状没有变化。
关节疼痛:实验组中有70%的实验对象在服用阿司匹林后,关节疼痛症状得到了缓解。
对照组的关节疼痛症状没有明显变化。
发热:实验组中有90%的实验对象服用阿司匹林后,发热症状得到了缓解。
对照组的发热症状没有明显变化。
数据统计与分析通过对实验结果的统计分析,我们可以得出以下结论:1.阿司匹林在体温、血压和心率方面有明显的降低作用,显示出退热、降压和减慢心率的效果;2.阿司匹林对头痛、关节疼痛和发热等症状有缓解的作用,显示出明显的镇痛和抗炎作用。
阿司匹林片的分析的实验报告

阿司匹林片的分析的实验报告实验报告:阿司匹林片的分析一、实验目的本实验旨在分析阿司匹林片中的主要成分以及了解其药效与药理作用。
二、实验原理阿司匹林(aspirin)是一种非处方药,主要成分为乙酰水杨酸(acetylsalicylic acid)。
实验通过药理学和药剂学分析手段来测定阿司匹林片中乙酰水杨酸的含量。
三、实验器材和药品1. 器材:电子天平、溶液移液器、玻璃仪器(烧杯、量筒等)2. 药品:阿司匹林片样品、NaOH溶液、酸性溶液(如HCl等)、硝酸银溶液等。
四、实验步骤1. 准备样品:将阿司匹林片取出适量,粉碎成细粉状。
2. 乙酰水杨酸的提取:将粉碎的阿司匹林片样品加入酸性溶液中,在加热的条件下将乙酰水杨酸转化为水杨酸。
3. 碱性溶液的加入:将得到的水杨酸样品加入NaOH溶液中,使其转化为水杨酸盐。
4. 腐蚀性物质的去除:通过重复处理和过滤的方法去除样品中的腐蚀性物质。
5. 硝酸银法测定:将样品溶液与硝酸银溶液反应,产生白色沉淀,通过称量沉淀的质量来计算样品中乙酰水杨酸的含量。
6. 数据分析:根据实验结果计算样品中乙酰水杨酸的含量,并进行相应的统计和比较分析。
五、实验结果与讨论通过实验测定,我们得到了阿司匹林片中乙酰水杨酸的含量为X%,与其它同类药品相比,该含量在合理范围内且具有稳定性。
这说明该阿司匹林片能够在一定程度上发挥其药理作用,并显示出良好的药效。
然而,实验中也存在一些值得注意的问题。
首先,实验过程中各个步骤的操作要严格控制,避免实验误差的产生。
其次,样品的选取和制备过程也需要综合考虑,以确保样品的代表性和可重复性。
最后,在实验结果的分析与讨论中,我们还可以进一步探究阿司匹林片的不同含量对药效和药理作用的影响,并与其它相关研究进行比较。
六、结论本实验通过对阿司匹林片的分析,得出了其主要成分为乙酰水杨酸,且含量在合理范围内。
该实验结果为进一步研究药效和药理作用提供了基础数据,并在药学及相关领域具有一定的应用价值。
阿司匹林的分析``药物分析实验报告
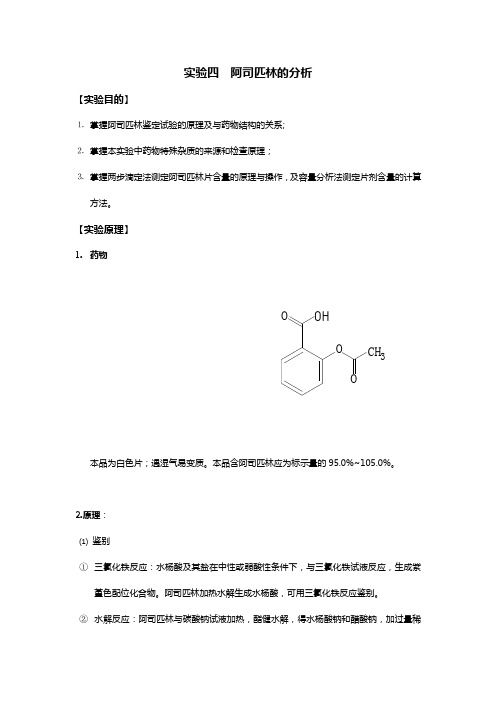
实验四阿司匹林的分析【实验目的】⒈掌握阿司匹林鉴定试验的原理及与药物结构的关系;⒉掌握本实验中药物特殊杂质的来源和检查原理;⒊掌握两步滴定法测定阿司匹林片含量的原理与操作,及容量分析法测定片剂含量的计算方法。
【实验原理】1.药物OHOOO CH3本品为白色片;遇湿气易变质。
本品含阿司匹林应为标示量的95.0%~105.0%。
2.原理:⑴鉴别①三氯化铁反应:水杨酸及其盐在中性或弱酸性条件下,与三氯化铁试液反应,生成紫堇色配位化合物。
阿司匹林加热水解生成水杨酸,可用三氯化铁反应鉴别。
②水解反应:阿司匹林与碳酸钠试液加热,酯健水解,得水杨酸钠和醋酸钠,加过量稀硫酸酸化后,生成白色水杨酸沉淀,并发生醋酸的臭气,因此可用水解反应鉴别。
⑵检查阿司匹林中游离水杨酸的检查a.杂质来源游离水杨酸为阿司匹林生产中未反应的原料或贮存过程中的水解产物。
b.检查方法阿司匹林无游离酚羟基,不与高铁盐溶液作用,而水杨酸则可与之反应生成紫堇色,此种方法称之对照法,极为灵敏,可检出1ug的游离水杨酸。
⑵含量测定阿司匹林分子结构中有酯健,易水解生成水杨酸和醋酸,片剂中为防止酯健水解加入少量酒石酸或枸橼酸做稳定剂,因此在片剂中有酸性杂质,含量测定时为消除酸性杂质干扰,采用两步滴定法。
第一步中和,消除酸性杂质〔酸性附加剂和降解产物〕的干扰COOHOCOCH 3NaOHCOONa OCOCH 3H 2O第二步 水解后剩余滴定COONaOCOCH 3NaOH COONaOH CH COONa32NaOH H SO 24Na SO 242H O 2【实验仪器与试剂】㈠仪器试管,纳氏比色管,溶出度测定仪,紫外-可见分光光度计,10~25ml 注射器,0.8um 微孔滤膜,酸式滴定管,容量瓶,移液管,漏斗。
㈡试剂1. 酚酞指示液取酚酞1g ,加乙醇100ml 使溶解,既得。
变色范围:pH8.3~10.0〔无色→红色〕。
2. 稀硫酸铁铵溶液取盐酸溶液〔9→100〕1ml,加硫酸铁铵指示液2ml后,再加水适量使成100ml,摇匀,既得。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
采用光纤药物溶出度实时测定仪,参考中国药典2010年版二部 中“阿司匹林肠溶片”的释放度检查方法,参比制剂为德国拜耳阿
司匹林肠溶片。
2011国家评价抽验 阿司匹林质量分析报告
溶出度与溶出曲线研究(肠溶片)
参比制剂
阿司匹林肠溶片 (pH6.0)
阿司匹林肠溶片 (pH6.0)
110.0
110.0
100mg
0.2
0.4
水活度
0.6
0.8
0.1
0.2
0.3
0.4
0.5
0.2
水活度
0.4
0.6
水活度
经测定,全部样品水活度值均小于0.62,90%样品水活度值小于0.50,样品水活 度与游离水杨酸含量相关性分析结果表明,在本次测得的水活度值范围内,水活度与 游离水杨酸含量呈非显著性相关。
2011国家评价抽验 阿司匹林质量分析报告
20天
30天
50
0天
5天
10天
放置时间
20天
30天
游离水杨酸
105 100
含量 %
释放度
25/RH92.5% 40/RH75% 25/RH60% 25/RH75%
95 90 85
0天
5天
10天
放置时间
20天
30天
开瓶后,质量受到 明显的影响,建议 采用小规格包装, 避免开瓶后长期使 用。
含量
2011国家评价抽验 阿司匹林质量分析报告
阿司匹林固体口服 制剂质量分析报告
汇报人:吴 波 2012·10
2011国家评价抽验 阿司匹林质量分析报告
主要内容
品种的基本信息
法定检验及结果分析
探索研究及结果分析 质量总体评价及建议
2011国家评价抽验 阿司匹林质量分析报告
基本信息
--临床用途-解热镇痛,治疗发热、疼 痛、风湿病等。 抗血小板凝聚、抗血栓, 预防心脑血管疾病。
6、要进一步整顿批准文号。
2011国家评价抽验 阿司匹林质量分析报告
0天
5天
10天
20天
放置时间
2011国家评价抽验 阿司匹林质量分析报告
水活度与游离水杨酸相关性分析
2.5 2.0
游离水杨酸%
游离水杨酸%
阿司匹林肠溶片
2.5 2.0 1.5 1.0 0.5 0.0 0.0
阿司匹林片
1.0 0.8
游离水杨酸%
阿司匹林肠溶胶囊
1.5 1.0 0.5 0.0 0.0
0.6 0.4 0.2 0.0 0.0
开瓶稳定性研究
探索 研究
溶出度与溶出曲线研究
包装材料与药品稳定性 相关性研究
近红外光谱定性模型 建立及验证研究
2011国家评价抽验 阿司匹林质量分析报告
高价金属离子与阿司匹林稳定性研究
3倍硬脂酸镁
0.4 0.3
1倍硬脂酸镁
处方应避免加入硬 脂酸镁,生产过程 采用尼龙筛网过筛。
游离水杨酸%
0.2 0.1 0.0
批次
11
9 45 2 6
肠溶片
进口药品注册标准JX20060028 中国药典2005年版二部
中国药典2010年版二部
国家药品标准WS1-(X-074)-2005Z
96
1 6 8 1
普通片
缓释片
中国药典2005年版二部 中国药典2010年版二部 国家药品标准WS1-(X-048)-2005Z
2011国家评价抽验 阿司匹林质量分析报告
剩余有效期比例
剩余有效期比例
阿司匹林肠溶片游离水杨酸、含量和释放度随贮存期变化趋势图
2011国家评价抽验 阿司匹林质量分析报告
现行标准评价
游离水杨酸
含量
2011国家评价抽验 阿司匹林质量分析报告
现行执行标准评价
• 鉴别项采用化学反应和HPLC法,专属性能满足鉴别要求;
• HPLC法测定游离水杨酸,能够控制样品质量及工艺优劣;
• HPLC法测定释放量(或溶出量),有效避免了辅料干扰; • 中国药典2010年版二部收载的阿司匹林片、阿司匹林肠溶 片和阿司匹林肠溶胶囊均已达到且部分已经超过了国外标准。
2011国家评价抽验 阿司匹林质量分析报告
探索研究及结果分析
高价金属离子与阿 司匹林稳定性研究 水活度与游离水 杨酸相关性研究
110 100 90 80 70
1 2 3 5 7 8 9 10 11 12 13 14 16 17 18 德国拜耳
25mg
溶出度(%)
60 50 40 30 20 10 0 0 -10 5 10 15 20 25 30 35 40 50 60
日 本 橙 皮 书 pH 6.8 缓 冲 液
时间(min)
50.0
50.0
1 2 3 4 德国拜耳
液
30.0
30.0
10.0
10.0 5 10 15 20 25 30 40 50 60
-10.0
5
10
15
20
ቤተ መጻሕፍቲ ባይዱ25
30
40
50
60
-10.0
时间(min)
时间(min)
2011国家评价抽验 阿司匹林质量分析报告
溶出度与溶出曲线研究(肠溶片)
阿司匹林肠溶片3 (溶出介质:p H 6 . 8 )
开瓶稳定性研究
0.8 0.7
游离水杨酸%
25/RH92.5% 40/RH75%
碱中释放度%
110 100 90 80 70 60
25/RH92.5% 40/RH75% 25/RH60% 25/RH75%
0.6 0.5 0.4 0.3 0.2 0天 5天 10天
放置时间
25/RH60% 25/RH75%
包材与药品稳定性相关性研究
塑料瓶 铝塑
包材与游离水杨酸(60℃)
25℃/RH75%
25℃/RH92.5%
60
℃
包材与碱中释放度(60℃)
2011国家评价抽验 阿司匹林质量分析报告
溶出度与溶出曲线研究(肠溶片)
溶出介质
pH6.8缓冲液 (中国药典)
配制方法
0.1mol/L 盐酸 600ml+0.2mol/L 磷酸钠,用 2mo/L 盐酸或 2mol/L 氢氧化钠溶液调pH为6.8±0.05
120 110 100 90 80 70
50mg
100
90
80
70
溶出度(%)
60
60 50 40 30 20 10
50
40
30
1 2 3 4 5 6 7 8 9 10 11 12 德国拜耳
中 国 药 典 pH 6.8 缓 冲
溶出度(%)
20
10
0 0 -10 5 10 15 20 25 30 35 40 45
2.5 2.0
游离水杨酸%
110
贮存期不是影 响阿司匹林固 体制剂质量的 150 重要因素 。
100
不显著相关
105 100 95 90 0.0
释放度%
含量%
1.5 1.0 0.5 0.0 0.0
50
0.2
0.4
0.6
0.8
1.0
0.2
0.4
0.6
0.8
1.0
剩余有效期比例
0 0.4 0.5 0.6 0.7 0.8 0.9 1.0
2011国家评价抽验 阿司匹林质量分析报告
总体评价及建议
1、要进一步考察剂型及规格的合理性。 2、要进一步优化处方工艺,以确保产品质量安全可靠。 3、对开瓶稳定性予以重视。为确保临床用药安全有效,建议采用 小规格包装。 4、对包装材料质量应予以考虑。
5、进一步提高产品质量,以期望能够到达进口产品的质量。
300mg
90.0 70.0
90.0
70.0
溶出度%
溶出度%
德国拜耳 1
50.0
50.0
1 2 3 4 德国拜耳
日 本 橙 皮 书 pH 6.0 缓 冲 液
30.0
30.0
10.0
10.0 5 10 15 20 30 40 60 75 90 105 120
-10.0
-10.0
5
10
15
20
30
40
60
日本橙皮书pH6.8缓冲液
H2PO40.012mol/L
溶出度(%)
60 50 40 30 20 10 0 0 -10 5 10 15 20 25 30 35 40 50 60
HPO42K+ Na+
0.006mol/L
0.012mol/L 0.012mol/L
时间(min)
25mg
140.0 120.0 100.0
阿司匹林肠溶片1(溶出介质,药典pH6.8)
溶出度(%)
80.0 60.0 40.0 20.0 0.0 0 -20.0 时间(min) 10 20 30 40 50 60
参比制剂
德国拜耳 2 3 4 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22
中国药典pH6.8缓冲液
2011国家评价抽验 阿司匹林质量分析报告
包装材料及规格
规格:25mg、40mg、50mg、75mg、100mg、300mg及500mg
2011国家评价抽验 阿司匹林质量分析报告
法定检验及结果分析
剂型
肠溶胶囊
执行标准
中国药典2005年版增补本 中国药典2010年版二部 国家药品标准WS-10001-(HD-0614)-2002-2005
PO430.05mol/L
